Что такое k2co3 в химии
Карбонат калия: способы получения и химические свойства
Карбонат калия K2CO3 — соль щелочного металла калия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается. Очень хорошо растворяется в воде.
Относительная молекулярная масса Mr = 138,20; относительная плотность для тв. и ж. состояния d = 2,428; tпл = 891º C;
Способ получения
1. Карбонат калия можно получить путем взаимодействия при комнатной температуре пероксида калия и влажного углекислого газа. В результате реакции образуется карбонат калия и кислород:
2. В результате взаимодействия пероксида калия и угарного газа при 50º С образуется карбонат калия и кислород:
3. При взаимодействии концентрированного гидроксида калия и углекислого газа образуется карбонат калия и вода:
4. Взаимодействуя с углеродом (графитом) при 30º С надпероксид калия карбонат калия и углекислый газ:
5. Разлагаясь при температуре 100 — 400 ºС гидрокарбонат калия образует карбонат калия, углекислый газ и воду:
6. В результате реакции между гидрокарбонатом калия и гидроксидом калия образуется карбонат калия и вода:
Качественная реакция
Качественная реакция на карбонат калия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат калия образует хлорид калия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат калия образует углекислый газ и воду, а также сульфат калия:
Химические свойства
1. Карбонат калия может реагировать с простыми веществами :
С хлором, бромом и йодом концентрированный и горячий раствор карбоната калия реагирует с образованием хлорида, бромида или йодида калия, хлората, бромата или йодата калия и углекислого газа:
2. Карбонат калия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат калия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната калия:
2.2. Карбонат калия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида калия и осадка карбоната кальция:
2.3. Карбонат калия способен реагировать с кислотами :
2.3.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат калия образует хлорид калия, углекислый газ и воду:
2.3.2. В результате реакции между насыщенным карбонатом калия и концентрированной и холодной хлорной кислотой образуется осадок хлорат калия, вода и газ углекислый газ:
2.3.3. Взаимодействуя с разбавленной фосфорной кислотой концентрированный раствор карбоната калия образует фосфат калия, воду и углекислый газ:
а если кислота концентрированная, то образуется гидрофторид калия, вода и углекислый газ:
ПОТАШ
Поташ стал известен людям много позднее соды. Минералов состава K2CО3 в природе нет, карбонат калия в виде примеси обычно сопровождает соду. Слово «поташ», видимо, произошло от немецких слов «потт» – горшок и «аш» – зола.
В России производили поташ, начиная с 16 в. В старых книгах сообщалось, что на поташных производствах боярина Морозова в 1672 было выработано 770 тонн поташа – это очень большое количество, по тогдашним меркам. Главные потребители поташа – мыловарение, красильное дело и стекольное производство. Когда в 1660 появилась угроза вторжения татар, Морозов написал в вотчины, чтобы поташ прятали и закапывали в ямы, «где б вода не была, на высоких местах», иначе хорошо растворимая соль уйдет в почву и будет потеряна.
Поташ в 17 в. изготавливали в России следующим способом: в деревянных корытах обрабатывали горячей водой древесную золу и полученным раствором поливали горящие в кирпичном очаге дрова – так, чтобы не потушить костер. При этом раствор упаривался, и на дне очага плотным слоем кристаллизовался поташ. Затем его выламывали ломами и закупоривали в бочки. Процесс сжигания дров и их полива требовал особых приемов, от умения рабочих-«поливачей» зависели выход поташа и его качество. Поэтому крестьянских детей отдавали в долгое обучение мастерству к «поливачам» еще подростками.
Для получения поташа жгли древесину только определенных пород – сосну, клен, березу, в которых содержание карбоната калия наибольшее. Из одного кубометра такой древесины получали около полукилограмма поташа. В те времена для получения поташа выжигали большие лесные площади, превращая эти места в пустоши и луга.
В наше время карбонат калия получают взаимодействием раствора гидроксида калия KOH с диоксидом углерода CO2:
Зола растений, по-арабски «аль-кали», дала и название элемента «калий». И действительно, первым источником соединений этого элемента была древесная зола, содержащая карбонат калия – поташ. Интересно, что латинское и немецкое названия элемента «калиум» не совпадают с французским и английским «потассиум», образованным от слова «поташ».
Применяется K2CO3 в тех же областях, что карбонат натрия (производство стекла, моющих средств и т.д.). Однако, карбонат калия дороже, поэтому его используют, когда нужны те свойства, которых нет у карбоната натрия. Например, поташ служит сырьем для выработки оптического стекла,
Как обезвоживающий реагент, он лучше соды, поглощает из газовых смесей
сероводород. А гидрокарбонат калия служит компонентом жидких моющих средств.
Карапетьянц М.Х., Дракин С.И.. Общая и неорганическая химия. М., «Химия», 1992
Химические свойства неорганических веществ. – Учеб.пособие для вузов. М., «Химия», 1996
Карбонат калия
| Карбонат калия | |
|---|---|
 | |
 | |
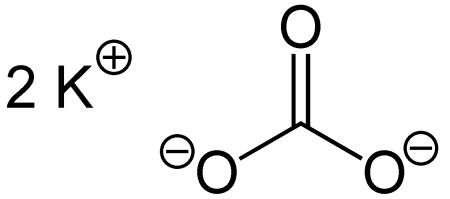
| Систематическое наименование | Карбонат калия |
| Традиционные названия | поташ |
| Хим. формула | CK₂O₃ |
| Состояние | кристаллическое |
| Молярная масса | 138,205 г/моль |
| Плотность | 2,44 г/см³ |
| Т. плав. | 891 °C |
| Растворимость в воде | 110,5 г/100мл (20 °C) |
| ГОСТ | ГОСТ 4221-76 ГОСТ 10690-73 |
| Рег. номер CAS | 584-08-7 |
| PubChem | 11430 |
| Рег. номер EINECS | 209-529-3 |
| SMILES | |
| Кодекс Алиментариус | E501(i) |
| RTECS | TS7750000 |
| ChEBI | 131526 |
| ChemSpider | 10949 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Карбонат калия, углекислый калий, арх. поташ K2CO3 — средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде. Малотоксичен, относится к III классу опасности.
Содержание
История
Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но, в основном, в России и Северной Америке, — то есть именно там, где за несколько тысяч лет до н. э. находились языки отходящих в сторону северного полюса вместе с глобальным потеплением ледников (как правило, в тех местностях, где вода предельно жёсткая).
На производство поташа ещё Петр I в 1721 году установил монополию: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу». С целью сбережения леса, поскольку вводил технологию производства поташа из «худых бочек, сучьев и прочих обрезков» то есть вторичная переработка.
Физические и химические свойства
Образует несколько различных гидратов с 5, 1,5 и 0,5 молекулами воды, гидрат с 1,5·H2O образуется при кристаллизации из водных растворов и хранении безводной формы на воздухе. Все перечисленные гидраты полностью обезвоживаются при 150—160 °C.
Водные растворы карбоната калия присоединяют углекислый газ с образованием гидрокарбоната калия. С двуокисью серы водные растворы реагируют с образованием гидросульфита калия и двуокиси углерода.
Получение
Карбонат калия получают:
Для использования в качестве удобрения, поташ получают из щёлока при выщелачивании водой золы из злаков или водорослей, так как именно карбоната калия больше всего в растворимой части растительных остатков (белая «зола» от костра — в основном поташ). Принцип добычи: в глиняный обожжённый сосуд с небольшим отверстием на дне насыпали золу и слегка утрамбовывали. Потом его заливали определённым количеством воды. Воду, прошедшую через сосуд, тщательно собирали и ею заливали следующую партию. И так до тех пор, пока жидкость не приобретала сиропообразную консистенцию. После лишнюю жидкость выпаривали в металлической посуде и получали поташ.
Применение
Карбонат калия применяют:
Карбонат калия (K2CO3): строение, свойства, применение, производство
Содержание:
Он хорошо растворяется в воде, образуя щелочные растворы, богатые ионами ОН. – и, следовательно, с высоким значением pH. Его водные растворы, будучи щелочными, используются в различных промышленных процессах для поглощения кислых газов, таких как диоксид углерода CO.2 и сероводород H2Да, легко их нейтрализует.
K2CO3 Он используется для приготовления мыла, чистящих средств, стиральных порошков и смесей для мытья посуды. Он также используется при обработке некоторых текстильных волокон, таких как шерсть.
Он широко используется в химических лабораториях, например, для поглощения воды из других соединений или для подщелачивания смесей химических реакций, а также в химическом анализе.
Его также добавляют в некоторые продукты, например, для устранения горького вкуса какао-бобов во время производства шоколада.
Состав
Номенклатура
— Калиевая соль угольной кислоты.
Свойства
Физическое состояние
Кристаллическое твердое вещество от бесцветного до белого цвета.
Молекулярный вес
Температура плавления
Точка кипения
Плотность
Растворимость
Хорошо растворим в воде: 111 г / 100 г воды при 25 ° C. Нерастворим в этаноле и ацетоне.
pH
Водный раствор может иметь pH 11,6, то есть он достаточно щелочной.
Химические свойства
Карбонат калия расплывается или гигроскопичен, то есть поглощает влагу из окружающей среды. Имеет стабильный гидрат K2CO3.2H2ИЛИ.
K2CO3 в водном растворе он гидролизуется, то есть реагирует с водой с выделением групп ОН – которые придают растворам щелочность:
Получение
Его можно получить из золы, оставшейся при сжигании растений. Также карбонизацией гидроксида калия KOH, то есть добавлением избытка диоксида углерода CO2 кому: КОН:
Гидратированная двойная соль Энгельса выпадает в осадок и отфильтровывается из раствора. Затем он нагревается и образуется карбонат калия К.2CO3 что при добавлении воды растворяется, а карбонат магния MgCO3 он остается нерастворимым и удаляется фильтрацией.
Приложения
При абсорбции CO2 в промышленных процессах
Удаление CO2 происходит по следующей реакции:
Этот метод используется, например, для обработки природного газа. Также на электростанциях, чтобы избежать выбросов CO.2 в атмосферу и при производстве сухого льда.
Решение К.2CO3 его можно регенерировать термически, то есть путем нагревания до температуры около 100 ° C.
Чтобы раствор карбоната калия мог поглощать CO2 с хорошей скоростью, для ускорения процесса добавляются промоторы, такие как диэтаноламин (DEA).
При удалении H2S определенных процессов
Растворы карбоната калия также используются для удаления сероводорода H.2S для технологических потоков. Иногда добавляют калий К трифосфат3PO4 для ускорения процесса.
В химических лабораториях
K2CO3 Это позволяет проводить органический синтез, например, в реакциях конденсации и нейтрализации. Он используется для удаления воды из органических жидкостей в качестве обезвоживающего агента или осушителя в лаборатории.
Он также используется в реакциях аналитической химии и для подщелачивания в фармацевтической промышленности.
В индустрии чистящих средств
K2CO3 Из него делают мыло, формулы для чистки, средства для стирки и мытья посуды, а также для приготовления шампуня и других средств личной гигиены.
В пищевой промышленности
Карбонат калия добавляют в различные продукты для различных целей.
Например, его добавляют в какао-бобы, чтобы устранить их горький вкус и использовать их в производстве шоколада. Его добавляют в виноград в процессе сушки для получения изюма.
В кондитерских изделиях он используется как разрыхлитель (который действует как дрожжи) для муки для приготовления выпечки.
В удобрениях
K2CO3 используется для удобрения кислых почв, так как карбонат-ион CO3 2- при контакте с водой производит ионы ОН – которые повышают pH почвы. Плюс калий К + это питательное вещество для растений.
Карбонат калия также использовался для изготовления удобрений с медленным высвобождением.
Удобрение с медленным высвобождением высвобождает или высвобождает питательные вещества медленно, чтобы они не растворялись и не смывались водой. Благодаря этому они смогут уделять корням растения больше времени.
В различных приложениях
Карбонат калия К2CO3 он также используется для:
— Процессы окрашивания, отбеливания и очистки сырой шерсти и другие виды деятельности текстильной промышленности
— Получение других органических и неорганических солей калия, таких как цианид калия KCN.
— Действовать как регулятор кислотности в различных процессах.
— Производство керамики и гончарных изделий.
— Процессы гравировки и литографии.
— Дубление и отделка кож.
— Подготовить краски для печати, пигменты.
— Производство очков специально для телевидения, т.к.2CO3 более совместим, чем карбонат натрия Na2CO3 с оксидами свинца, бария и стронция, содержащимися в этих стеклах.
— Торможение возгорания (в виде водных растворов).
— Препятствует коррозии и как противообрастающий агент в технологическом оборудовании.
Карбонат калия: описание, применение, польза и вред, реакции
Карбонат калия – это достаточно известная в современной промышленности пищевая добавка, которую указывают в составе продуктов питания под индексом Е501. Внешне она представляет собой порошок из мелких кристаллов белого цвета, напоминающий поваренную соль.
Для обозначения карбоната калия, как правило, используют более короткое слово поташ. Вещество великолепно растворяется в обычной воде, обладает низкой токсичностью, что позволяет не бояться его присутствия в составе продуктов питания. Поташ относится к III классу опасности: то есть, к умеренно опасным соединениям, летальная доза которых варьируется от 150 до 50 тыс.мг на 1 килограмм веса.
Карбонат калия – это не что-то новое в мире пищевых технологий: его используют не сотни и даже не десятки лет. Однако, современный поташ отличается от того, который использовали люди в древности – он обладал длинным перечнем примесей, поэтому был не чисто белого, а бурого цвета. Вплоть до начала 20 столетия карбонат калия играл очень важную роль в химической промышленности и использовался в качестве реагента во многих процессах. Производили его тогда на основе растительной золы, которую впоследствии очищали до требуемого для той или иной цели уровня. Самые крупные производства располагались в лесистой местности: преимущественно, в России, Северной Америке и некоторых европейских странах.
В России производство карбоната калия началось во время правительства Петра I: наладить его экспорт он не пытался, а напротив под страхом смертной казни запретил продавать поташ за границу. Из соображений сохранения леса поташ производили из старых бочек и опавших ветвей.
Что такое карбонат калия: его особенности
Карбонат калия, или другими словами поташ – это соль щелочного металла калия и угольной кислоты. Внешне пищевая добавка представляет собой белый порошок. Он обладает свойством плавиться при повышении температуры, не разлагаясь при этом. Поташ прекрасно растворяется и в холодной, и в теплой воде. А вот в спиртовой среде рассматриваемое вещество остается неизменным.
При растворении в воде поташ высвобождает тепло. Причем чем выше температура порошка, тем сильнее проявляются его щелочные свойства.
Поташ легко вступает в реакции с оксидом углерода серы, по завершению которой образуются кристаллогидраты. Данное взаимодействие возможно только в солевом растворе.
Формула карбоната калия и его свойства
Формула карбоната калия: K2CO3
Растворимость карбоната калия в воде
| Температура воды, ˚С | Растворимость, г/100 г воды |
| 0 | 107 |
| 10 | 109,2 |
| 20 | 111 |
| 25 | 112,3 |
| 30 | 113,7 |
| 40 | 116,9 |
| 60 | 125,7 |
| 80 | 139,2 |
| 100 | 155,8 |
| 200 | 274 |
Молекула карбоната калия
При нагревании вещества до 1200 градусов и выше оно разлагается на две составляющие – оксид калия и углекислый газ. Вещество прекрасно реагирует с кислотами-неокислителями, основаниями, углеродом (в условиях высокой температуры) и с оксидом серы.
Получение карбоната калия
Существует несколько способов получения карбоната калия. Среди них наибольшей популярностью пользуются следующие: смешивание пероксида калия с углекислым газом или угарным газом, соединение углерода с надпероксидом, разложение гидрокарбоната калия при температуре в диапазоне от 100 до 400 градусов, смешивание гидрокарбоната и гидроксида калия.
Рассмотрим все вышеперечисленные реакции подробнее:
Смешивание перекиси калия с влажным углекислым газом при температуре в диапазоне от 20 до 26 градусов. По завершению реакции образуется поташ и выделяется кислород:
Смешивание пероксида калия с моноксидом углерода при температуре на отметке 50 градусов. В результате образуются два соединения – поташ и кислород:
Смешивание высококонцентрированного гидроксида калия с моноксидом углерода. В итоге можно получить искомый карбонат калия и обычную воду:
Смешивание углерода с надпероксидом калия при температуре 30 градусов. По завершению реакции образуются поташ и моноксид углерода:
Получить поташ можно и без смешиваний реактивов: достаточно разогреть гидрокарбонат калия до отметки в 100 и выше градусов и наблюдать за реакцией. В итоге вы получите карбонат калия, моноксид углерода и воду:
Соединение гидрокарбоната калия и его гидроксида с образованием карбоната калия и обычной воды:
Интересно знать
Жители древних Рима и Греции получали поташ из обычной золы. Полученное вещество они применяли для бытовых нужд, а именно – для стирки: карбонат калия прекрасно убирал с ткани жиры. В приготовлении пищи поташ не применяли.
На просторах Руси карбонат калия также получали на основе золы травянистых растений. Ее заливали родниковой водой, а затем выливали получившуюся смесь на костер. Пепелище упаривалось, а на дне со временем образовался толстый слой карбоната калия. Корку разбивали камнями.
В наши дни основными производителями карбоната калия считаются Китай, Германия, Франция и Корея.
Реакции с карбонатом калия
Взаимодействие с хлороводордной кислотой с образованием трех составляющих: хлорид калия, вода и моноксид углерода:
Взаимодействие с серной кислотой с образованием моноксида углерода, воды и сульфата натрия:
Вещество легко вступает в реакцию с простыми веществами, среди которых стоит отметить хлор, бром и йод:
Поташ не ограничивается взаимодействиями с простыми металлами – он также реагирует со сложными соединениями, например, с водой и углекислым газом:
С гидроксидом кальция:
Гидроксид калия реагирует с соединениями, принадлежащими к классу кислот, например, с хлороводородной кислотой:
С хлорной кислотой:
С фосфорной кислотой:
С плавиковой кислотой:
Карбонат калия, разведенный водой, взаимодействует с оксидом серы:
Допустимые нормы употребления карбоната калия
Конкретных ограничений относительно употребления карбоната калия не существует, однако существуют определенные нормы, регулирующие использование пищевой добавки.
Несмотря на это, специалисты не рекомендуют употреблять более 50 мэкв карбоната калия в сутки.
При употреблении слишком большого количества карбоната калия может возникать мышечная слабость, помутнение сознания, тошнота и нарушения работы ЖКТ.
Сферы применения карбоната калия
Карбонат калия пользуется популярностью во многих отраслях. Так, без него трудно представить себе работу химической отрасли и предприятий по производству стекла, а также сельскохозяйственных предприятий, легкой промышленности, фотодела и других сфер.
Так, к числу процессов, в которых поташ принимает активное участие, относятся:
Благодаря своим свойствам поташ способен выступать в качестве стабилизатора, регулятора кислотности, разрыхлителя и осушителя. Данное вещество применяют также для получения однородной смеси из компонентов, которые в нормальных условиях не соединяются между собой: например, из воды, масла и жира.
Животноводство
Не меньшей популярностью поташ пользуется в сфере животноводства: его применяют для приготовления лекарственных препаратов – мазей, растворов и т.д.
Пищевая промышленность
В производстве продуктов питания добавку применяют в качестве эмульгатора, который добавляет хлебобулочным изделиям пышности: благодаря ему хлеб и булочки становятся более воздушными, приобретают пористую структуру. Встретить поташ можно также в составе алкогольных напитков, в древности добавку вводили в состав пряников. Из-за такого активного использования в производстве продуктов питания специалисты вели активные споры о том, насколько безопасен поташ для человека.
Медицина
В медицине карбонат калия необходим для усиления эффекта от употребления лекарственных препаратов, именно поэтому его часто вводят в состав мазей и кремов. Кроме того, поташ помогает избавиться от паразитов: он эффективен в избавлении от вшей и чесоточных клещей.
Сельское хозяйство
В сельскохозяйственной сфере карбонат калия применяют для удобрения почвы и повышения урожайности высаженных культур.
Наиболее часто карбонат калия применяют для обработки подзолистых почв.
Строительство
Поташ применяется и в сфере строительства. Он, в первую очередь, необходим для гидратации цемента, которая значительно замедляется при понижении температуры. Впрочем, добавление карбоната калия в состав строительного раствора имеет свои недостатки – работать с ним можно только при низкой температуре, как только начинает теплеть цемент теряет свои свойства.
Бетонные смеси. В состав которых входит поташ, наиболее часто применяют для устройства скользящей опалубки внутренних стен в зданиях средней этажности и многоэтажных постройках.
Впрочем, существуют определенные ограничения в использовании карбоната калия. Так, например, запрещено:
Карбонат калия в различных сферах
| Сфера применения | Применение карбоната калия |
| Животноводство | Приготовление лекарственных препаратов, действие которых направлено на борьбу с паразитами |
| Сельское хозяйство | Обработка почвы, защита растений от вредителей |
| Пищевая промышленность | Эмульгатор, стабилизатор. Можно встретить в составе алкогольных напитков и хлебобулочных изделий |
| Медицина | Усиление действия лекарственных препаратов, борьба с паразитами |
| Строительство | Приготовление строительных смесей для работы при пониженной температуре |
Воздействие карбоната калия на организм человека
Поташ важен для правильной работы многих систем организма. Более того, данное вещество содержится в организме человека и имеет свойство вымываться, дабы предотвратить дефицит поташа в организме, важно ввести его в свой рацион в достаточном количестве.
Вещество усваивается в стенках ЖКТ, а его излишек выводится вместе с продуктами жизнедеятельности.
Впрочем, злоупотреблять карбонатом калия не стоит: переизбыток добавки в организме может привести к развитию гиперкалиемии – состояния, при котором почки не способны вывести избыток калия из организма. Так что основной вред от неправильного употребления поташа испытывают почки.
В чистом виде употреблять поташ не стоит – он небезопасен, как и любая друга щелочь. При контакте с кожей вещество вызывает химический ожог, которому сопутствуют покраснения, раздражения и зуд. Дабы минимизировать негативные последствия необходимо промыть пораженный участок кожи.
Полезные свойства карбоната калия и показания к его употреблению
Калий крайне важен для правильной работы организма, а карбонат калия способен восполнять дефицит этого элемента. Рассматриваемое вещество необходимо для поддержания правильной работы пищеварительного тракта.
Так, поташ показан при:
Вред карбоната калия и противопоказания к его употреблению
При чрезмерном употреблении поташа возможно развитие гиперкалиемии – состоянии, при котором почки не способны вывести избыток карбоната калия из организма, вследствие чего начинают хуже работать.
Чистый карбонат калия небезопасен, поэтому употреблять его можно только в составе лекарственных препаратов.
Где можно приобрести карбонат калия и сколько он стоит
Для индивидуального использования рекомендуется отдавать предпочтение не чистому поташу, а специальным препаратам: Блемарену и Гевискону Форте, стоимость которых изменяется в диапазоне от 200 до 350 рублей.
Чистый карбонат калия можно приобрести в режиме онлайн, обойдется он вам примерно в 300 рублей за килограмм добавки.
Заключение
Карбонат калия – это вещество, широко применяемое в разных отраслях промышленности. Внешне оно представляет собой белый однородный порошок, состоящий из мелких гранул.
Наиболее широко поташ применяется в сфере производства пищи, сельском хозяйстве, животноводстве, фармакологии и строительстве. В производстве продуктов питания его используют в качестве стабилизатора и эмульгатора, встретить который можно в составе алкогольной продукции и хлебобулочных изделий. В составе его указывают под индексом Е501.
В фармакологии поташ необходим для усиления действия лекарственных препаратов, в частности тех, действие которых направлено на борьбу с паразитами. Данное соединение применяют также для обработки почвы: понижения ее кислотности, защиты растений от вредителей и повышения урожайности.
Использование поташа началось давно – вещество пользовалось большой популярностью еще во времена Киевской Руси: тогда вещество производили из золы и применяли в качестве порошка для удаления жирных пятен и в качестве удобрения.
Карбонат калия принадлежит к III классу опасности. Вещество важно для поддержания правильной работы желудочно-кишечного тракта, но злоупотреблять им не рекомендуется – избыток поташа в организме может привести к нарушению работы почек.





