Что такое k2cr2o7 в химии
Дихромат калия
| Дихромат калия | |
|---|---|
 | |
| Систематическое наименование | Дихромат калия |
| Традиционные названия | Бихромат калия, двухромовокислый калий, хромпик |
| Хим. формула | K2Cr2O7 |
| Состояние | оранжевые кристаллы |
| Молярная масса | 294,19 г/моль |
| Плотность | 2,676 г/см³ |
| Т. плав. | 396 °C |
| Т. кип. | 500 °C |
| Т. разл. | 500 °C |
| Энтальпия образования | −2033 кДж/моль |
| Растворимость в воде | 4,9 г/100 мл |
| Координационная геометрия | Тетраэдральная |
| Кристаллическая структура | Триклинная |
| ГОСТ | ГОСТ 2652-78 |
| Рег. номер CAS | 7778-50-9 |
| PubChem | 24502 |
| Рег. номер EINECS | 231-906-6 |
| SMILES | |
| Рег. номер EC | 231-906-6 |
| RTECS | HX7680000 |
| ChEBI | 53444 |
| ChemSpider | 22910 |
| ЛД50 | 25 мг/кг (крысы, орально) |
| Токсичность | высокотоксичен, канцероген, мутаген, аллерген, сильный окислитель |
| Пиктограммы СГС |      |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Дихромат калия (двухромовокислый калий, бихромат калия, техн. хромпик) — неорганическое соединение, калиевая соль дихромовой кислоты с химической формулой K2Cr2O7, имеет вид оранжевых кристаллов. Обладает сильными окислительными свойствами, в связи с чем широко применяется в химии, фотографии, пиротехнике и различных областях промышленности. Высокотоксичен и канцерогенен.
Иногда хромпиком также называют дихромат натрия (Na2Cr2O7).
Содержание
Физические и химические свойства
Оранжевые кристаллы с температурой плавления 396 °C. Разлагается при нагреве выше 500 °C. Растворим в воде (г / 100 г): 4,6 (0 °C), 15,1 (25 °C), 37,7 (50 °C), незначительно растворим в этаноле. Сильный окислитель.
В кислой среде восстанавливается до солей хрома (III). Например, он окисляет галогенид-ионы галогенводородных кислот до свободных галогенов:
Также в кислой среде при pH 3,0—3,5 обладает способностью окислять металлическое серебро:
6Ag + Cr2O7 2− + 14H + ⟶ 6Ag + + 2Cr 3 + + 7H2O
Кристаллический дихромат калия при нагревании с серой и углеродом восстанавливается до оксида хрома (III):
Водные растворы дихромата калия обладают дубящими свойствами, в частности, задубливают желатину.
Получение
Получают действием хлорида калия на дихромат натрия:
2KCl + Na2Cr2O7 ⟶ K2Cr2O7 + 2NaCl
Применение
Применяется при производстве красителей, при дублении кож и овчин, как окислитель в спичечной промышленности, пиротехнике, фотографии, живописи. Раствор хромпика в серной кислоте (т. н. хромовую смесь) применяют для мытья стеклянной посуды в лабораториях. В лабораторной практике используется в качестве окислителя, в том числе в аналитической химии (хроматометрия).
В чёрно-белой фотографии применяется в качестве отбеливателя для удаления металлического серебра из эмульсии. Не применяется в цветной фотографии, так как для отбеливания требует кислой среды, а при pH ⩽ 4 красители, образовавшиеся в эмульсии при цветном проявлении, обесцвечиваются. Вместо этого в цветной фотографии для отбеливания используются составы на основе гексацианоферрата III калия и железной соли трилона Б.
Безопасность
Высокотоксичен, канцерогенен, аллерген, брызги его раствора разрушают кожные покровы, дыхательные пути и хрящевые ткани. Среди соединений шестивалентного хрома наиболее токсичен. ПДК составляет 0,01 мг/м³ (в пересчёте на CrO3). При работе с дихроматом калия необходимо применять защиту органов дыхания и кожи.
Бихромат калия
Бихромат калия
| Дихромат калия | |
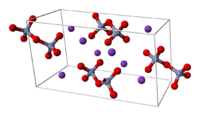 | |
| Общие | |
|---|---|
| Систематическое наименование | Дихромат калия (VI) |
| Традиционные названия | Двухромовокислый калий, калиевый хромпик |
| Химическая формула | K2Cr2O7 |
| Молярная масса | 294.19 г/моль |
| Физические свойства | |
| Плотность вещества | 2.676 г/см³ |
| Термические свойства | |
| Температура плавления | 398 °C |
| Температура кипения | 500 °C |
| Энтальпия (ст. усл.) | -2033 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 4.9 г/100 мл |
| Структура | |
| Координационная геометрия | Тетраэдральная |
| Кристаллическая структура | Триклинная |
| Классификация | |
| номер CAS | 7778-50-9 |
| Номер UN | 3288 |
| Регистрационный номер EC | 231-906-6 |
| RTECS | HX7680000 |
Дихрома́т ка́лия (двухромовокислый калий, ка́лиевый хро́мпик) — K2Cr2O7.
Хорошо растворим в воде. Применяется при производстве красителей, при дублении кож и овчин, как окислитель в спичечной промышленности, пиротехнике, фотографии, живописи. Раствор хромпика в серной кислоте — хромовую смесь, применяют для мытья стеклянной посуды в лабораториях.
Высокотоксичен, канцерогенен, брызги его раствора разрушают кожные покровы, дыхательные пути и хрящевые ткани. ПДК 0,01мг/м³ (В пересчете на CrO3). При работе с хромпиком необходимо применять защиту органов дыхания и кожи.
Полезное
Смотреть что такое «Бихромат калия» в других словарях:
бихромат калия — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN potassium dichromate … Справочник технического переводчика
бихромат калия — двухромовокислый калий, хромпик … Cловарь химических синонимов I
Бихромат серебра — Общие Систематическое наименование Бихромат серебра Традиционные названия Хромовокислое серебро Химическая формула Ag2Cr2O7 Физические свойства … Википедия
Калия бихромат — калия дихромат, двухромовокислый калий, K2Cr2O7, см. Дихроматы … Большая советская энциклопедия
Калия дихромат — калия бихромат, двухромовокислый калий, K2Cr2O7, см. Дихроматы … Большая советская энциклопедия
Бихромат аммония — Эту страницу предлагается переименовать в Дихромат аммония. Пояснение причин и обсуждение на странице Википедия:К переименованию/25 декабря 2012. Возможно, её текущее название не соответствует нормам современного русского языка и/или… … Википедия
Калия бихромат — Дихромат калия Общие Систематическое наименование Дихромат калия (VI) Традиционные названия Двухромовокислый калий, калиевый хромпик Химическая формула K2Cr2O … Википедия
Калия дихромат — Дихромат калия Общие Систематическое наименование Дихромат калия (VI) Традиционные названия Двухромовокислый калий, калиевый хромпик Химическая формула K2Cr2O … Википедия
Бихромат — Хроматы соли хромовой кислоты H2CrO4. Содержание 1 Получение 2 Химические свойства 3 Применение 4 … Википедия
Хромат калия — Хромат калия … Википедия
Калий двухромовокислый — токсичный, но важный реагент
Калий двухромовокислый — неорганическое 
Получить реактив можно:
• взаимодействием дихромата натрия Na2Cr2O7 с хлористым калием KCl;
• воздействием серной кислотой H2SO4 на хромат калия K2CrO4.
Для промышленности хромпик производят обработкой хромитной руды соединениями калия или электролизом.
Свойства
Дихромат калия представляет собой кристаллический порошок ярко-оранжевого цвета. Водорастворимый, малорастворим в этиловом спирте, не растворим в аммиаке. Разлагается при нагревании с выделением кислорода. Не горит. Обладает дубящими свойствами. Не слеживается при длительном хранении. Очень ядовит, канцероген.
В химических реакциях проявляет себя как сильный окислитель. Взаимодействует с кислотами с образованием солей хрома (III). Реагирует с серебром, серой, углеродом, сернистым газом SO2, этанолом C2H5OH, фтороводородом, галогенпроизводными и многими другими веществами.
 |  |  |
| Калий двухромовокислый «ХЧ» | Калий двухромовокислый «Ч» | Калий двухромовокислый «чда» (калий бихромат, калий дихромат, калиевый хромпик) |
Меры предосторожности
Калиевый хромпик — высокотоксичное соединение, относится к первому классу опасности для человека. Его раствор вызывает химические ожоги, разрушает кожу, хрящи, слизистые оболочки глаз, органов дыхания, ЖКТ (при проглатывании). Вещество оказывает канцерогенное и мутагенное воздействие, опасно для беременных, проникает через плацентарный барьер; вызывает аллергические реакции. Не горит, но пожаро- и взрывоопасен, т. к. при нагревании выделяет кислород, поддерживающий горение. Калий двухромовокислый опасен для окружающей среды, особенно для водных организмов и экосистем.
На производствах при работе с ним персоналу следует использовать защитную одежду и обувь, резиновые перчатки, очки, респираторы или маски. Должен быть организован контроль за ПДК дихромата калия в воздухе рабочей зоны. Рабочее помещение должно быть оснащено приточно-вытяжной системой вентиляции.
В лабораториях работы с реактивом проводят в вытяжном шкафу. Хранят вещество в стеклянных или пластиковых, плотно укупориваемых сосудах, вдали от источников тепла.
Использованную одноразовую упаковку после реактива следует утилизировать как опасные отходы; не допускать слива реагента или растворов с ним в окружающую среду.
Соединение хранят на крытых, сухих, хорошо проветриваемых складах, в герметичных, водонепроницаемых мешках или контейнерах (полиэтиленовые или многослойные бумажные мешки, стальные барабаны и т. п.), отдельно от горючих материалов.
Применение
• В химпроме — в орг. синтезе; для изготовления органических и неорганических красителей и пигментов; катализаторов; сырье для получения хромокалиевых квасцов.
• Для дубления и окрашивания овчин и кож в кожевенном деле.
• На предприятиях, выпускающих автомобили и велосипеды, перед окрашиванием поверхности продукцию протравливают хромпиком для защиты от коррозии.
• Водные растворы реактива применяют для защиты древесины и деревянных конструкций от гниения и повреждения насекомыми.
• Для обеззараживания семян в сельском хозяйстве.
• В пиротехнике, спичечном производстве, живописи, в черно-белой фотографии.
• В лабораторной практике — в хроматографии; в качестве реактива.
• Для приготовления хромовой смеси для мытья в лабораториях посуды и принадлежностей из стекла.
• Для изготовления сухих источников питания (батарей).
• В специализированных учебных заведениях для демонстрации зрелищных опытов («Извержение вулкана», «Фараонова змея», выращивание красивых красно-оранжевых кристаллов).
Дихромат калия — формула, свойства и особенности применения вещества
Дихромат калия – название неорганического соединения, представляющего собой калиевую соль дихромовой кислоты. Давайте поговорим о данном веществе и узнаем много интересного.
Характеристика, формула и физические свойства
Химическая формула — K2Cr2O7. Другие наименования — бихромат калия или двухромовокислый калий. Cr в данном соединении обладает максимальной степенью окисления, равной +6.
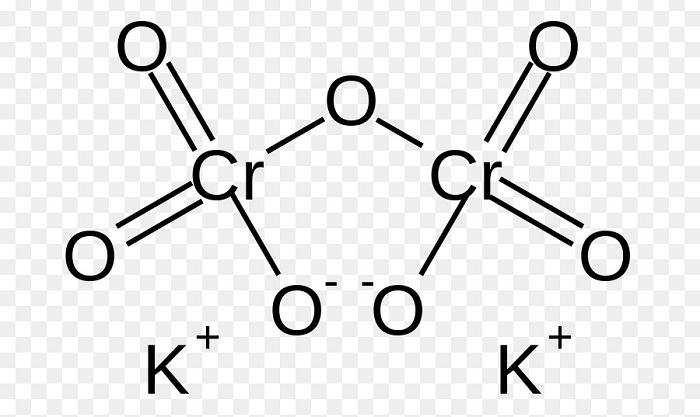
Структурная формула дихромата калия
Молекулярная (молярная) масса вещества — 294,19 грамм/моль.
Одной из особенностей дихромата калия является его ярко-оранжевый цвет и кристаллообразная структура.
Температура плавления соединения равна 396 0 C, а температура кипения и разложения — 500 0 C.
Ярко выражены окислительные свойства дихромата калия, по этой причине вещество широко применяется в фотографии, химии и промышленности.
Является канцерогеном, аллергеном, сильнейшим окислителем и токсичным веществом.
Химические свойства
Имеет высокую растворимость в воде (4,9 г/100 мл) и небольшую при взаимодействии с этиловым спиртом. В кислой среде происходит восстановление до солей хрома (III).
В качестве примера можно привести то, что он может окислять галогенид-ионы до свободных галогенов:
K2Cr2O7 + 14HCl => 2CrCl3 +3Cl2 + 2KCl + 7H2O.
Если среда имеет pH от 3 до 3.5, двухромовокислый калий реагирует на металлическое серебро – окисляет его:
6Ag + Cr2O7 2- + 14H + => 6Ag + + 2Cr 3- + 7H2O.
При нагревании кристаллического бихромата калия с углеродом С и серой S происходит восстановление вещества до оксида хрома:
2K2Cr2O7 + 3C => 2Cr2O3 + 2K2CO3 + CO2;
K2Cr2O7
+ S => Cr2O3 + K2SO4.
При электролитической диссоциации дихромат калия распадается на ионы калия и дихромат-ион:
Получение дихромата калия
В основе получения соединения лежит следующая химическая реакция:
Токсичность
Вещество относится к первому классу опасности. Это значит, что оно наиболее токсично и может нанести большой вред организму, поэтому при работе с ним требуется соблюдать меры безопасности.
Раствор бихромата калия повреждает органы дыхания и кожные покровы, нарушает хрящевую ткань и вызывает сильнейшие отравления при попадании в организм. Работая с данным соединением необходимо защищать кожу и дыхательные пути.
Применение калия двухромовокислого
Имеет широкий спектр применения, например:
для дубления, так как раствор двухромовокислого калия с водой имеет все свойства для этого;
применяется для мытья лабораторной посуды;
при обработке черно-белых фотографий бихромат калия используется в качестве отбеливающего реагента;
так как окислительные свойства соединения крайне высоки, то оно выступает окислителем при обработке фотографий и занятиях живописью, а также в спичечной промышленности и пиротехнике.
Дихромат калия – название неорганического соединения, представляющего собой калиевую соль дихромовой кислоты. Давайте поговорим о данном веществе и узнаем много интересного.
Характеристика, формула и физические свойства
Структурная формула дихромата калия
Одной из особенностей дихромата калия является его ярко-оранжевый цвет и кристаллообразная структура.
Температура плавления соединения равна 396 0 C, а температура кипения и разложения — 500 0 C.
Ярко выражены окислительные свойства дихромата калия, по этой причине вещество широко применяется в фотографии, химии и промышленности.
Является канцерогеном, аллергеном, сильнейшим окислителем и токсичным веществом.
Химические свойства
Имеет высокую растворимость в воде (4,9 г/100 мл) и небольшую при взаимодействии с этиловым спиртом. В кислой среде происходит восстановление до солей хрома (III).
В качестве примера можно привести то, что он может окислять галогенид-ионы до свободных галогенов:
Если среда имеет pH от 3 до 3.5, двухромовокислый калий реагирует на металлическое серебро – окисляет его:
6Ag + Cr2O7 2- + 14H + => 6Ag + + 2Cr 3- + 7H2O.
При нагревании кристаллического бихромата калия с углеродом С и серой S происходит восстановление вещества до оксида хрома:
При электролитической диссоциации дихромат калия распадается на ионы калия и дихромат-ион:
Получение дихромата калия
В основе получения соединения лежит следующая химическая реакция:
Токсичность
Вещество относится к первому классу опасности. Это значит, что оно наиболее токсично и может нанести большой вред организму, поэтому при работе с ним требуется соблюдать меры безопасности.
Раствор бихромата калия повреждает органы дыхания и кожные покровы, нарушает хрящевую ткань и вызывает сильнейшие отравления при попадании в организм. Работая с данным соединением необходимо защищать кожу и дыхательные пути.
Применение калия двухромовокислого
Имеет широкий спектр применения, например:
для дубления, так как раствор двухромовокислого калия с водой имеет все свойства для этого;
применяется для мытья лабораторной посуды;
при обработке черно-белых фотографий бихромат калия используется в качестве отбеливающего реагента;
так как окислительные свойства соединения крайне высоки, то оно выступает окислителем при обработке фотографий и занятиях живописью, а также в спичечной промышленности и пиротехнике.