Что такое crispr технологии
CRISPR «для чайников»: краткий путеводитель по главной биотехнологии
CRISPR — одна из самых перспективных технологий последних лет, и в ближайшие годы ее роль будет только расти. Однако далеко не все понимают, как именно работает генное редактирование. Издание Vox представило простой справочник, который поможет разобраться в CRISPR даже человеку, далекому от биологии.
Говоря вкратце, CRISPR — точнее, CRISPR/Cas9 — мощный инструмент редактирования геномов. Он основан на элементе защитной системы бактерий, который биологи приспособили для внесения изменений в ДНК растений, животных и даже людей. Технология позволяет внести поправки всего за несколько дней, а не недель или месяцев. Никогда прежде у человечества не было столь точного орудия для манипуляции генами.
История CRISPR началась в 1987 году, когда японские ученые, изучавшие кишечную палочку Escherichia coli, обнаружили в ее ДНК необычные повторяющиеся последовательности. Их биологическое значение выяснить не удалось, однако вскоре аналогичные фрагменты были найдены в геноме других бактерий и архей. Последовательности получили название CRISPR — короткие палиндромные повторы, регулярно расположенные группами (Clustered Regular Interspaced Short Palindromic Repeats).
Их функция оставалась загадкой до 2007 года, когда специалисты по бактерии Streptococcus, которая используется для приготовления кисломолочных продуктов, определили: эти фрагменты — часть иммунной системы бактерий.
Некоторое время это открытие было интересно только микробиологам. Однако все изменилось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье решили точнее изучить механизм CRISPR. Они обнаружили, что белок Cas9 можно обмануть, дав ему искусственную РНК. Белок, несущий такую РНК, будет искать генетические фрагменты, совпадающие с тем, что он несет на себе. Обнаружив соответствие с чужой ДНК, он начнет измельчать ее, независимо от того, кому она принадлежит — вирусу, растению или животному. Как отметили в статье 2012 года Дудна и Шарпантье, этот механизм можно использовать для разрезания любого генома в нужном месте.
В феврале 2013 года было доказано, что CRISPR/Cas9 можно использовать для редактирования ДНК в культуре клеток мышей и человека. Более того. выяснилось, что технология позволяет не только удалять ненужные гены, но и вставлять на их место другие. Для этого достаточно добавить ферменты, восстанавливающие ДНК.
Ученые быстро поняли огромные перспективы CRISPR. Если в 2011 году было опубликовано всего 100 работ о ней, то к 2017 году эта цифра достигла более 14 000.
Помимо прочего, в них описывались аналоги белков Cas9. Например, Cas13 может редактировать не ДНК, а РНК.
Существует почти бесконечное множество потенциальных применений технологии. Во-первых, CRISPR позволяет ученым выяснить функцию различных генов. Достаточно просто вырезать изучаемый ген из ДНК и увидеть, какие функции организма оказались затронуты. Однако общественность намного сильнее интересуют практические применения. Их можно разделить на несколько пунктов:
1) Изменения в сельском хозяйстве
CRISPR позволяет сделать сельскохозяйственные культуры более питательными, более вкусными и устойчивыми к жаре и стрессу. Можно придать растениям и другие свойства: например, вырезать из арахиса ген аллергена, а в бананы внедрить устойчивость к смертельному грибку. Технологию можно применить и для редактирования генома домашних животных — например, коров.
2) Борьба с наследственными заболеваниями
Ученые намерены использовать CRISPR, чтобы вырезать из человеческого генома мутации, ответственные за целый ряд заболеваний, например, серповидноклеточную анемию. Технология также позволят вырезать гены хореи Хантингтона или мутаций BRCA-1 и 2, связанных с раком молочной железы и яичников. Теоретически CRISPR-атака даже может остановить развитие ВИЧ.
Однако специалистам предстоит убедиться в безопасности методики, прежде чем ее начнут применять в больницах. Ферменты Cas9 иногда ошибаются и редактируют ДНК в неожиданных местах, что может вызвать серьезные последствия для здоровья.
3) Новые антибиотики и противовирусные препараты
Бактерии развивают устойчивость к антибиотикам, а разрабатывать новые дорого и сложно. Технология CRISPR дает возможность с высокой точностью уничтожать опредленные виды бактерий, хотя конкретную методику еще предстоит разработать. Ряд исследователей также работает над CRISPR-системами, нацеленными на вирусы.
4) Генетический драйв
С помощью CRISPR можно изменить не просто геном отдельного животного и растения, но и генофонд целого вида. Эта концепция известна как «генетический драйв». Обычно любой организм передает потомству половину своих генов. Однако использование CRISPR позволяет повысить вероятность передачи генов по наследству почти до 100%. Это позволит нужному признаку быстро распространиться по всей популяции.
Используя эту технологию, можно, например, модифицировать комаров так, чтобы в их популяции рождались только самки. Через какое-то время популяция исчезнет.
5) Создание «дизайнерских младенцев»
Этот пункт привлекает больше всего общественного внимания. Однако, по словам ученых, пока наши технологические возможности не позволяют создавать детей с заданными качествами. Например, за уровень интеллекта отвечают тысячи генов, и скорректировать их всех пока невозможно. Возможно, в будущем технологии достигнут нужного уровня, но пока беспокоиться не о чем.
Не все ученые считают CRISPR безопасной технологией. Например, согласно недавним исследованиям, генное редактирование может вызвать обширные нецелевые мутации. Авторы другой работы отмечают, что CRISPR ошибается в 15% случаев.
CRISPR/CAS9: что значит для человечества переход от чтения генома к его редактированию?
Технология CRISPR / Cas9, позволяющая вносить изменения в геном высших организмов (в том числе человека) стала в последние годы одной из самых обсуждаемых — не только молекулярными биологами, но и биотех-инвесторами, медиками, социологами — тем. Все дело в том, что CRISPR/Cas9 потенциально имеет перспективы применения для борьбы с многими тяжелыми заболеваниями, среди которых рак, наследственные болезни, ВИЧ. Если раньше генетические технологии применялись в первую очередь для диагностики, то теперь мы впервые подошли к новому рубежу — у нас есть инструмент редактирования ДНК, который, возможно, получит все больше внедрений в клиническую практику и программы лечения. Хотя ранее попытки редактирования генома уже были (например, для больных лейкемией) именно CRISPR/Cas9, как более универсальный инструмент, претендует на создание инструментов для все более активных внедрений. Старт дан: в Китае уже делают первые шаги в клинических испытаниях технологий, основанных на CRISPR/Cas9. Растущие возможности генной терапии ставят перед нами все больше вопросов, связанных с этикой. Чего ждать?
CRISPR/ Cas 9 — «ножницы» вместо «ножа» для ДНК
Способы редактирования генов в геномах живых существ изучаются с начала XX века – еще с открытия механизма индуцированного мутагенеза (то есть вызванного воздействием каких-нибудь внешних агентов – например, радиоактивного излучения или химических веществ). И если для бактерий механизмы достаточно точного модифицирования генов разработаны еще в середине XX века, то для более сложных организмов, в частности, человека, подходы появились лишь в конце прошлого века. Например, целое семейство вирусов, называемое ретровирусами (к которым относится и ВИЧ, вызывающий СПИД у человека), от природы получило механизм, согласно которому для функционирования вируса требуется встраивание его генома в геном организма-хозяина. Путем введения модификаций в геном ретровируса, то есть вставки измененных человеческих генов, можно добиться внедрения в геном хозяина таких квазичеловеческих элементов – вот и готовый механизм геномного редактирования. Существенным его недостатком является отсутствие специфичности встраивания, то есть вирусный геном может попасть в любой участок генома хозяина, а может и вообще не попасть. Для научных изысканий это нестрашно – всегда можно повторить эксперимент. Но для целей лечения конкретных пациентов подход с «повторить», как правило, не работает.
Другие способы модификаций генома связаны с технологиями ZFN и TALEN, активно обсуждаемые начиная с 2000-х годов. Идея этих подходов основана также на природных свойствах определенных белков, называемых нуклеазами. Эти активные белки (ферменты) умеют проводить специфическое, неслучайное вырезание участка исходного генома и встраивание в место разреза привнесенного с собой кусочка исправленной ДНК. Такой способ позволяет проводить целевую, гораздо более точную, чем просто ретровирусная, модификацию «сломанных» генов. Отличие ZFN и TALEN заключается в использовании разных видов ферментов, но итог их работы примерно одинаков.
В 2015 году технологию ZFN удалось успешно применить для терапии ВИЧ: в стволовых клетках донора был отредактирован участок, отвечающий за восприимчивость ВИЧ, затем они были трансплантированы пациенту. Стоит отметить, что примерно у каждого тысячного европейца имеется такой генотип, который гарантирует невозможность внедрения вириона (активной вирусной частицы, которая осуществляет заражение) внутрь клеток организма-хозяина, то есть невозможность инфицирования.
Но ZFN и TALEN оказались далеки от массового применения в медицине. Ученые пытались научить их узнавать специфическую, в идеале — любую заданную последовательность ДНК для «кусания». Иногда это работало, но для каждой последовательности приходилось создавать свой отдельный белок, а это кропотливая и долгая работа.
Пока неочевидно, какие технологии геномного редактирования будут наиболее активно применяться в медицине уже через 10 лет. Возможно, это будет CRISPR/ Cas 9 или текущие аналоги, а может быть, будет открыта новая технология, которая возникнет так же неожиданно и ярко, как CRISPR/ Cas 9.
А пока между двумя научными группами, которые в 2012 году одновременно нашли способ применения CRISPR/Cas9 для точечного редактирования геномов сложных организмов, идет патентная война. Группа в Калифорнийском университете в Беркли и группа из MIT и Broad Institute (институт MIT и Гарварда), подавшие заявки на патент в разное время в 2013 году, тратят десятки миллионов долларов на юристов и вряд ли остановятся — на кону миллиарды долларов, которые может принести технология. По прогнозам, патентный офис примет решение в 2017 году.
Применение и этические вопросы
Среди потенциальных применений новой технологии — лечение наследственных заболеваний (гемофилия, бета-талассемия, мышечная дистрофия), терапия онкологии и вирусных инфекций, включая ВИЧ.
Но есть и более экзотические потенциальные применения. Например, борьба с мультифакторными заболеваниями (диабет, шизофрения и др.) или редактирование эмбрионов при искусственном оплодотворении для подбора определенной внешности у детей. Именно здесь возникает множество этических вопросов, которые начали обсуждаться, но пока так и не получили консенсусного решения у мирового сообщества. Когда же можно, а когда нельзя применять редактирование генома? Пока, в отсутствие у человечества единой позиции, каждая из стран решает это по-своему.
Например, мир потрясли уже два исследования китайских ученых. В 2015 году группа китайских ученых применила геномное редактирование на 86 человеческих эмбрионах для того, чтобы изменить мутации, вызывающие тяжелую наследственную патологию бета-талассемию. Это тяжелая наследственная патология, которая связана с нарушением синтеза гемоглобина и разрушением эритроцитов, средняя продолжительность жизни носителей мутации — 17 лет. Несмотря на серьезную научную значимость исследования китайских ученых, два главных научных журнала Nature (Великобритания) и Science (США) отказались публиковать результаты, в частности из-за этических вопросов. Также это исследование показало неидеальность технологии CRISPR/Cas9, по крайней мере на данный момент. Из 86 эмбрионов точно поменять желаемый участок ДНК получилось только у 28. Процент ошибки оказался больше, чем ожидали исследователи исходя из опытов над эмбрионами животных. Какой участок ДНК нужно редактировать, определяется при помощи синтетической последовательности РНК (так называемый «гид»). Она комплементарна нужному участку ДНК. Но может оказаться, что в другой части генома также есть аналогичная последовательность нуклеотидов.
Исследование вызвало множество дискуссий. Должны ли западные страны очень аккуратно относиться к этическим вопросам при применении новых технологий геномного редактирования, либо же это приведет только к отставанию от Китая? По всей видимости, пока Запад рассматривает возможность терпимее относиться к генетическим модификациям — менее чем через полгода после скандальной публикации китайских исследователей в Великобритании были официально разрешены первые опыты по геномному редактированию эмбрионов человека, в Лондоне новые группы ученых уже ведут работу над дизайном новых экспериментов.
А в середине ноября группа китайских ученых анонсировала применение генной модификации клеток при помощи CRISPR/Cas9 для лечения пациента с агрессивным раком легкого. В журнале Nature эта статья анонсирована с подзаголовком: «Шаг китайских ученых может разжечь борьбу между Китаем и США в сфере биомедицины». Мир ждет результатов второго исследования китайских ученых.
Однако в будущем этических вопросов, связанных с новыми технологиями в области генетики и репродукции, будет еще больше. Биоэтика становится все более важной дисциплиной.
Например, у некоторых европейцев есть мутации в гене CCR5 — ее носители практически невосприимчивы к ВИЧ. В рамках генетического тестирования эти мутации могут быть исследованы. Но этично, корректно ли рассказывать человеку о наличии такой мутации? Мы, как компания, которая занимается генетическими тестами, решили, что нет.
Другие проблемы связаны с тем, что возможности генетического редактирования меняют само понятие семьи. С появлением искусственного оплодотворения и суррогатного материнства в принципе понимание института семьи усложнилось. Теперь у некоторых детей помимо отца могут быть две матери: суррогатная и «юридическая». А если для зачатия используются яйцеклетка и сперматозоид пары, которые затем переносятся в суррогатную мать, у ребенка тоже две матери — генетическая и суррогатная. Теоретически возможны ситуации, когда юридическая, генетическая и суррогатная мать — это три разных человека.
Юридические нюансы, возникающие в подобных случаях, уже получают оценки. Например, « Baby M Case »: у Элизабет Стерн был рассеянный склероз, который несет много рисков при беременности, поэтому семья Стерн обратилась в один из медицинских центров в Нью-Йорке для суррогатного материнства. Использовался генетический материал отца. Между сторонами был подписан договор, что юридическими родителями будут Стерны. Но вскоре после рождения суррогатная мать Мэри Бет Вайтхед под угрозой суицида потребовала вернуть ей ребенка. В дело включились полиция и суд. В итоге суд признал Стернов официальными родителями ребенка, но дал суррогатной матери возможность посещения ребенка. Интересно, что основной мотивацией суда было преследование «лучших интересов ребенка». В другой схожей истории, тоже произошедшей в Нью-Йорке, суд рассудил иначе: двое родителей лучше трех, решил суд, отказав в правах посещения ребенка суррогатной матери. Есть деталь: во втором случае пара использовала собственные яйцеклетку и сперму, которые были перенесены в суррогатную мать.
«Офшоры» для геномного редактирования
Недавно мир потрясло рождение ребенка от трех генетических родителей: в апреле 2016 года появился на свет ребенок, зачатие которого происходило с использованием митохондриальной ДНК третьего человека. Такая процедура была необходима, так как у матери ребенка есть патогенные мутации в митохондриях (органеллы внутри клеток человека, отвечающие за обеспечение клеток энергией, обладают собственным небольшим геномом, передаются ребенку от матери), которые могли привести к появлению у ребенка синдрома Лея, наследственному заболеванию, связанному с поражением ЦНС и энцефалопатией. Два первых ребенка матери погибли от синдрома Лея. Американский врач Джон Чанг, из клиники в Нью-Йорке вместе с родителями из Иордании прибыли в Мексику. И в Иордании, и в США подобные модификации генетического материала были запрещены.
Получается, в современном мире появляются «биомедицинские офшоры». Люди едут в страны с лояльным законодательством для осуществления процедур, неоднозначных с точки зрения этики и допустимости законодательством той или иной страны. Генная терапия уже становится в центре подобных «спорных» случаев. Например, американка Лиз Пэрриш утверждает, что прошла в Колумбии процедуру по редактированию специальных участков ДНК-теломер при помощи вируса. Длина теломер коррелирует со старением. Пэрриш стала первым человеком, решившимся на генетическую терапию для борьбы со старением, до нее эксперименты проводились только на животных. Научное сообщество отнеслось к самовольным клиническим испытаниям Пэрриш неоднозначно, многие подвергли ее действия критике.
В целом на данный момент мировое сообщество с очень большой осторожностью относится к редактированию генома, когда оно не связано напрямую с лечением тяжелых заболеваний, которые нельзя вылечить иным способом. Дело в том, что технологии еще несовершенны и не максимально специфичны. Так, в уже упомянутом эксперименте китайских ученых над эмбрионами в ДНК многих эмбрионов изменились не только участки, которые планировали изменить ученые, но и другие, случайные. Или, например, когда во Франции генную терапию решили применить для лечения врожденного X-сцепленного иммунодефицита, в ходе клинического испытания неожиданно в качестве побочного эффекта у больного развилась лейкемия.
Ребенок на заказ
В целом медицинское и научное сообщество сейчас более лояльно к генной терапии, которая будет влиять только на генетический материал самого человека. Генные модификации, которые передавались бы детям, все еще изучены недостаточно и остаются в «серой зоне». Но в определенной степени выбор определенных черт ребенка с помощью генетических технологий доступен уже сейчас.
В ходе искусственного оплодотворения можно пройти процедуру преимплантационной генетической диагностики или преимплантационного генетического скрининга. При ЭКО (искусственном оплодотворении, вне тела матери, с последующим переносом 2-5-дневного эмбриона в полость матки) на сегодняшний день оплодотворяется несколько яйцеклеток. Можно исследовать геном каждой из них и выбрать наиболее «подходящие» эмбрионы. Такая процедура уже довольно активно используется для профилактики тяжелых наследственных патологий у семей с соответствующими рисками. Однако данная технология, очевидно, может быть применена для выбора черт, не связанных со здоровьем — например, цвета глаз или волос. Это, безусловно, несколько пугающая ситуация, заставляет задуматься о способах применения новых генетических технологий для евгеники, для других манипуляций, описанных фантастами в антиутопиях. Разные страны уже вырабатывают позицию по влиянию родителей на генетические данные своих детей.
В Китае, например, запрещено использование преимплантационной генетической диагностики для выбора пола будущего ребенка. Но такая процедура не запрещена в Штатах. Но волнуют китайцев этические вопросы или для подобного законодательного регулирования важнее демографические причины — большой вопрос.
Но важно, чтобы свои взгляды на границы генетических вмешательств сформировали не только правительства, но и обычные люди. Иначе мы рискуем оказаться в ситуации неосведомленности населения о базовых принципах генетических технологий и распространения предрассудков. Недавняя волна заявлений об опасности ГМО для человека — яркое тому подтверждение. Один из опросов в Казани, например, показал, что почти половина респондентов считают, что «любые пищевые продукты, содержащие гены», должны быть изъяты из продажи и не должны импортироваться или производиться в стране. Очевидно, что гены есть в любом живом организме, так что такие результаты исследования просто плачевны. Впрочем, 15% опрошенных честно признались, что не представляют себе, что такое ГМО. Ученым, биомедикам и просто тем, кто верит в то, что технологии делают нашу жизнь лучше, теперь нужно сделать все, чтобы генетическое редактирование человека не столкнулось с той же волной необоснованной паники, а стало действительно эффективным инструментом в борьбе с болезнями.
Разнообразие и эволюция систем CRISPR/Cas
Пространственные структуры эффекторных комплексов CRISPR/Cas-систем классов 1 и 2
Автор
Редактор
Системы CRISPR/Cas вот уже несколько лет триумфально шествуют по лабораториям мира, и неудивительно: эта простая, дешевая и быстрая технология редактирования генома нашла самое широкое применение в генетической инженерии. Однако биология систем CRISPR/Cas, а именно их функционирование в качестве противовирусных иммунных агентов бактерий и архей, не менее интересна и увлекательна: разнообразие молекулярных механизмов и в то же время их фундаментальное сходство и простота общей идеи поражают воображение. Наш обзор посвящен разнообразию естественных систем CRISPR/Cas.
В общем случае при первом столкновении прокариотической клетки с вирусом из его ДНК белки Cas вырезают небольшой фрагмент (его еще называют протоспейсером) и обеспечивают его интеграцию в локус CRISPR в качестве нового спейсера. При следующей встрече с тем же вирусом с соответствующего спейсера считывается РНК (ее обозначают CRISPR-РНК, или, сокращенно, crРНК), комплементарная участку его генома, которая взаимодействует с вирусом и привлекает к его ДНК другие белки Cas, разрезающие вирусный геном на кусочки, тем самым инактивируя его. Эта базовая идея лежит в основе работы всех систем CRISPR/Cas, однако детали у разных типов и подтипов различаются.
В большинстве систем CRISPR/Cas за этап адаптации, то есть встраивания в CRISPR нового спейсера, отвечают белки Cas1 и Cas2. Они формируют комплекс, где Cas1 функционирует как эндонуклеаза (задействованная и в вырезании фрагмента из вирусной ДНК, и во внесении разрывов в локус CRISPR) и интеграза (которая встраивает новый спейсер в бактериальный геном), а Cas2 обычно формирует структурную опору (рис. 1). Во многих системах CRISPR/Cas в адаптации принимают участие и другие белки Cas (Cas3, Cas4 или Cas9), а если фрагмент вырезается из генома РНК-вируса, то и обратная транскриптаза, причем нередко перечисленные белки сливаются с Cas1 или Cas2 и синтезируются в виде единой молекулы. Разнообразие систем CRISPR/Cas связано преимущественно с эффекторными белками, которые обеспечивают уничтожение чужеродной ДНК [3].
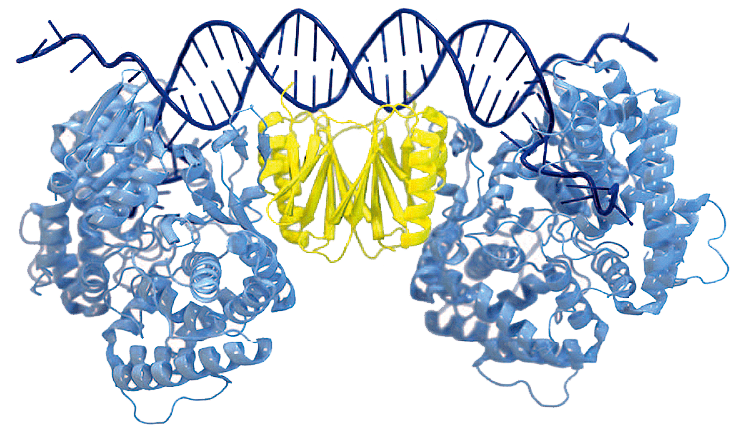
Рисунок 1. Кристаллическая структура комплекса Cas1—Cas2, связанного с ДНК. Cas1 показан голубым цветом, Cas2 — желтым.
Классификация
На основе устройства эффекторных белковых комплексов системы CRISPR/Cas разделяют на два класса. В системах класса 1 эффекторный комплекс образован множеством субъединиц, в том числе несколькими белками Cas, а в системах класса 2 эффектором является один большой многодоменный белок. К сожалению, белки Cas, и даже белок Cas1 — самый эволюционно консервативный из белков Cas, — в силу разнообразия аминокислотных последовательностей и независимой эволюции не могут быть использованы для воссоздания филогении систем CRISPR/Cas [3].
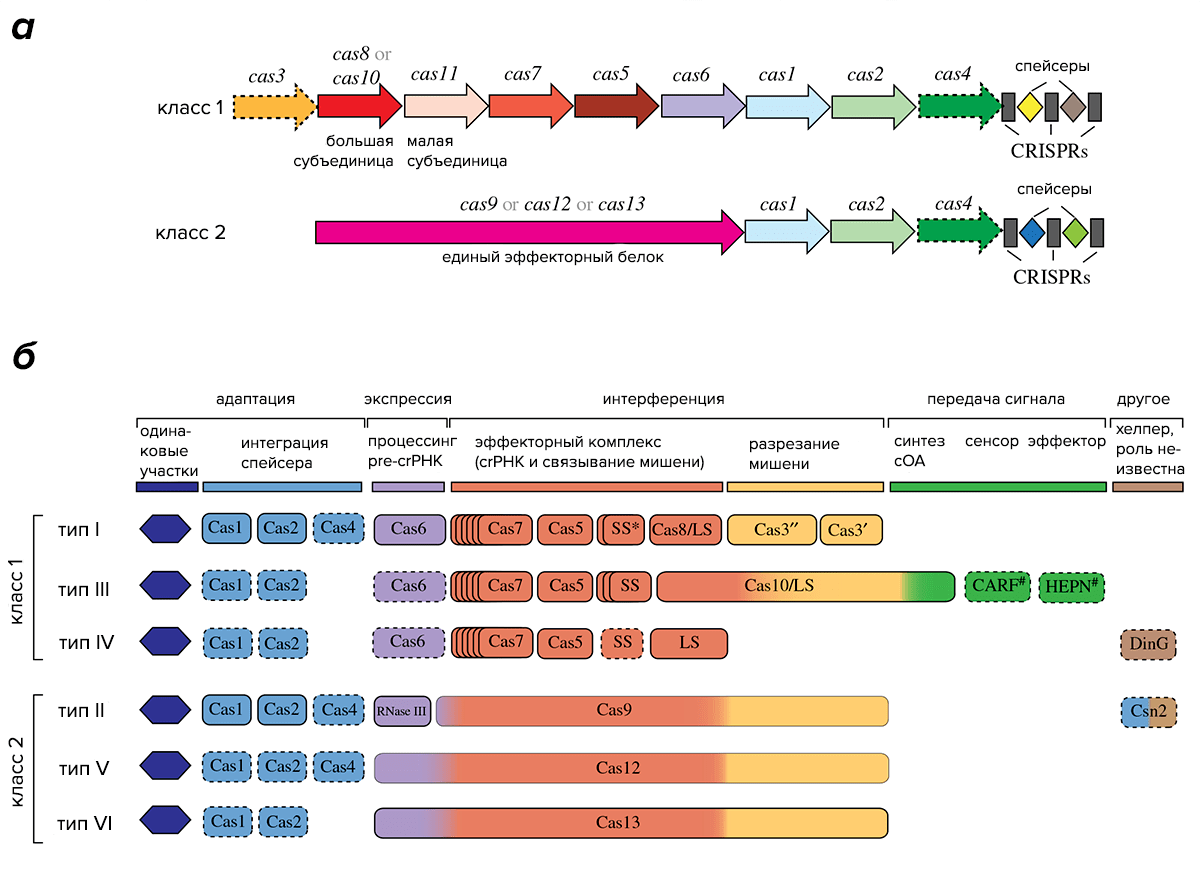
Классы систем CRISPR/Cas подразделяются на несколько типов. К классу 1 относятся типы I, III и IV, а к классу 2 — типы II, V и VI. Деление на типы основано на устройстве эффекторных комплексов, причем в системах одного и того же типа, как правило, в состав комплекса входит особый сигнатурный белок, уникальный для систем этого типа. Типы, в свою очередь, делятся на подтипы, различающиеся особенностями строения локуса CRISPR и, в некоторых случаях, наличием уникальных белков Cas (рис. 2) [3].
Рисунок 2. Разнообразие систем CRISPR/Cas. а — Общая схема устройства систем классов 1 и 2. б — Схема отдельных типов систем.
В системах класса 1 созревание (процессинг) crРНК катализирует сложный комплекс из белков Cas, известный как Cascade (от англ. CRISPR-associated complex for antiviral defence). Он связывается с транскриптом-предшественником crРНК (пре-crРНК) и привлекает дополнительный белок Cas6 (реже Cas5) — нуклеазу, осуществляющую процессинг [3].
В наиболее изученных представителях класса 2 — системах типа II — процессинг катализирует фермент, не имеющий отношения к системе CRISPR/Cas, — бактериальная РНКаза III — при участии дополнительных РНК — транс-действующих CRISPR-РНК (tracrРНК от trans-acting). tracrРНК описаны также в системах типа V класса 2. Однако в системах этого типа и типа VI пока еще не охарактеризована нуклеаза, которая осуществляет процессинг предшественника crРНК. Но известно, что она также входит в состав эффекторного комплекса, разрушающего чужеродную ДНК [3].
Различия между системами классов 1 и 2 становятся особенно очевидны на этапе интерференции, когда crРНК распознает свою мишень и связывается с ней. В системах типа I, относящихся к классу 1, белковый комплекс, содержащий зрелую crРНК, распознает комплементарную ей последовательность в мишени и привлекает дополнительный белок Cas — Cas3, — который обладает хеликазной активностью, благодаря чему расплетает двойную спираль ДНК-мишени, а также имеет нуклеазный домен, который разрезает мишень. В системах типа III класса 1 нуклеаза, которая разрушает молекулу-мишень, входит в состав процессирующего комплекса, причем для деградации чужеродной ДНК ей не требуется дополнительной хеликазной активности. Кроме того, в ходе работы систем типа III специальная РНКаза, ассоциированная с локусами CRISPR, разрушает еще и транскрипты, считанные с генома-мишени. В системах же класса 2 за разрушение мишени отвечают различные домены одного и того же большого эффекторного белка [3].
Подробнее о системах анти-CRISPR читайте в статье «Анти-CRISPR: ответ вирусов» [4].
В случае многих типов систем CRISPR/Cas эволюция защитных функций приводила к их вовлечению в другие процессы, не связанные с адаптивным иммунитетом [3]. «Биомолекула» уже писала о нескольких любопытных примерах участия систем CRISPR/Cas в процессах, не связанных с защитой от вирусов и мобильных генетических элементов [5].
Происхождение адаптационного модуля
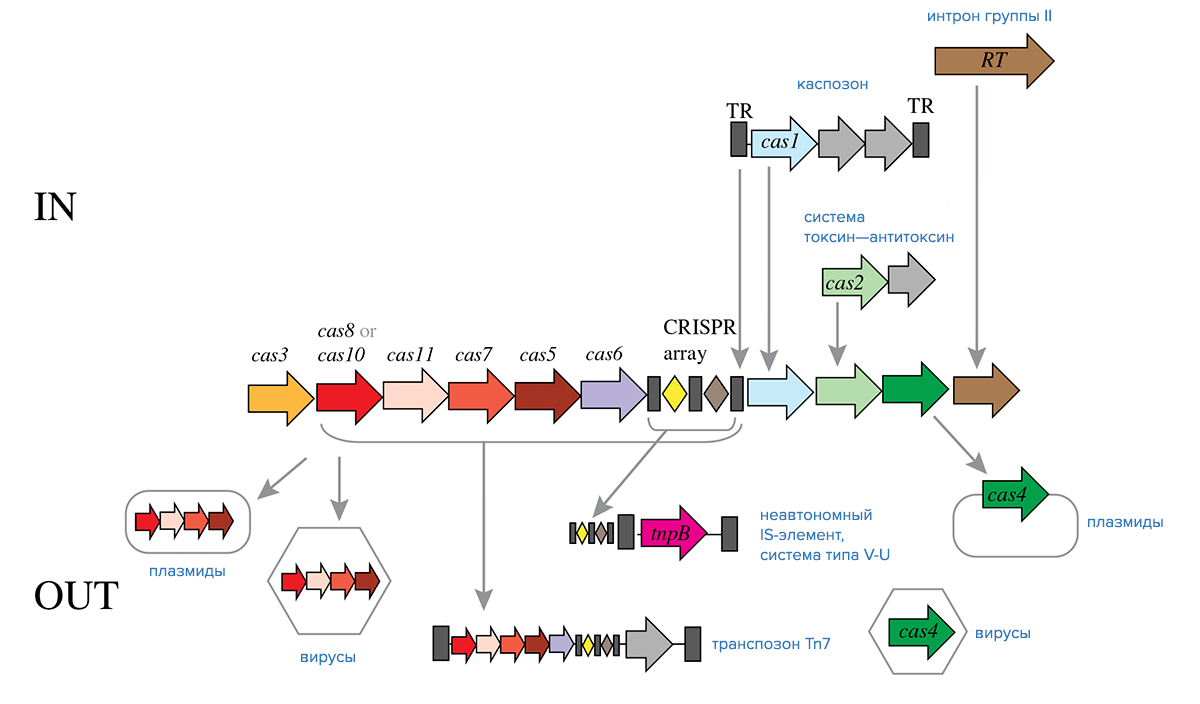
Дальнейшее изучение каспозонов показало, что они гораздо больше распространены среди архей, чем среди бактерий. Пока что перемещение каспозонов не удалось продемонстрировать экспериментально, однако геномный анализ нескольких штаммов археи Methanosarcina mazei позволил найти следы их недавних перемещений, так что по крайней мере некоторые из каспозонов действительно являются активными транспозонами [3].
Предполагают, что адаптационный модуль систем CRISPR/Cas произошел от предкового каспозона (рис. 4), который, кроме того, мог содержать дополнительные гены cas. Хотя идентифицированные на данный момент каспозоны не кодируют Cas2, некоторые из них кодируют нуклеазы, гомологичные Cas4, и ряд дополнительных нуклеаз. Возможно, в процессе формирования адаптационного модуля CRISPR/Cas произошла иммобилизация каспозона, при этом часть его генов — в том числе ген ДНК-полимеразы — были утеряны [3].
Происхождение систем класса 1
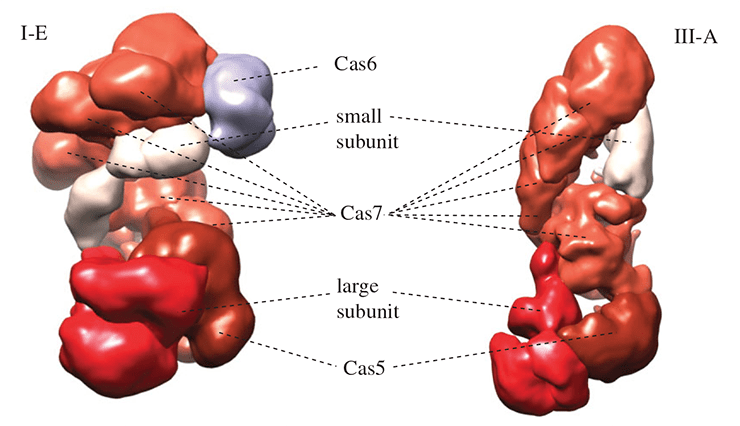
Хотя аминокислотные последовательности эффекторных белков типов I и III класса 1 мало похожи, можно не сомневаться, что эффекторные комплексы этих систем имеют общее происхождение. Их пространственные структуры поразительно похожи, и в обоих случаях структурная основа эффекторного комплекса образована несколькими копиями белка Cas7 (рис. 3). Также комплексы содержат белок Cas5, приходящийся дальним родственником белку Cas7, и так называемые малую и большую субъединицы. Малые субъединицы очень близки структурно и сходны с C-концевым доменом белка Cas10. В системах I типа роль большой субъединицы исполняет белок Cas8, аминокислотная последовательность которого высоко вариабельна даже в пределах систем различных подтипов типа I. В системах III типа большая субъединица представлена белком Cas10, который содержит два РНК-связывающих домена, причем один из них очень похож на домен-«ладонь», имеющийся у многих РНК- и ДНК-полимераз. Отметим, что Cas8 структурно лишь отдаленно напоминает белок Cas10, однако общность структурной организации и наличие опорного элемента из белков Cas5 и Cas7 почти не оставляет сомнений, что системы I и III типов класса 1 произошли от одного предка. Любопытно, что на долю этих типов приходится около 90% всех идентифицированных систем CRISPR/Cas и почти 100% этих систем у архей [3].
Рисунок 3. Сравнение строения эффекторных комплексов систем I и III типов класса 1
Стоит отметить, что распознавание мишени системами III типа запускает полимеразную активность белка Cas10, который начинает производить циклические олиго-(А)-нуклеотиды (cOA). Большинство систем CRISPR/Cas III типа включает ряд белков, которые не относятся к числу белков Cas, но необходимы для функционирования системы. Таковыми являются, в частности, белки Csm6 и Csx1. Csm6 связывает cOA, за счет чего активируется его РНКазный домен, который разрушает и РНК-мишень (напомним, многие системы CRISPR/Cas III типа действуют на РНК, а не на ДНК), и другие молекулы РНК, «подвернувшиеся под руку». Следствием такого массового неспецифического разрушения РНК является или переход клетки в состояние покоя, или ее программируемая гибель. Оба этих варианта предотвращают дальнейшее распространение вируса по бактериальной колонии и массовую гибель других бактериальных клеток [3].
Так как последствием активации пути Cas10—cOA может стать программируемая клеточная гибель, существует предположение, что эффекторные комплексы некоторых систем CRISPR/Cas произошли от систем ответа на стресс, которые запускали гибель клетки. Ген возможного белка, который дал эволюционное начало сигнальной системе с защитной функцией, удалось идентифицировать в геномах нескольких бактерий. Этот белок содержит единственный домен-«ладонь», гомологичный полимеразно-циклазному домену Cas10. Этот факт служит еще одним подтверждением предположения, что адаптивный иммунитет прокариот, то есть системы CRISPR/Cas, произошли от древних форм защиты бактериальных сообществ, запускавших гибель клетки или переводящих ее в состояние покоя. Системы III типа с двойной функцией — разрушение чужеродной ДНК и запуск состояния покоя или программируемой гибели клетки — считаются одними из самых сложных систем CRISPR/Cas [3].
Системы IV типа встречаются в основном в составе плазмид и профагов (рис. 4) и подробнее рассматриваются ниже. На данный момент достоверных сведений об их происхождении нет.
Рисунок 4. Обмен компонентами между системами CRISPR-Cas класса 1 и мобильными генетическими элементами в ходе эволюции. Условные обозначения: RT — обратная транскриптаза, TR — концевые повторы.
Происхождение систем класса 2
Эффекторная компонента систем класса 2 радикальным образом отличается от таковой у систем класса 1. Все эффекторные функции выполняет не сложный многобелковый комплекс, а один большой белок со многими доменами. Удивительно, но все белки-эффекторы систем класса 2 гомологичны нуклеазам, которые кодируются разнообразными мобильными генетическими элементами. Эффекторные белки систем типов II и V — Cas9 и Cas12 соответственно — имеют общий домен с эндонуклеазами семейства RuvC (RuvC-подобный домен). Собственно, этот домен — единственное, что объединяет Cas9 и Cas12: их аминокислотные последовательности совершенно различны, и эти белки, по-видимому, не гомологичны друг другу [3].
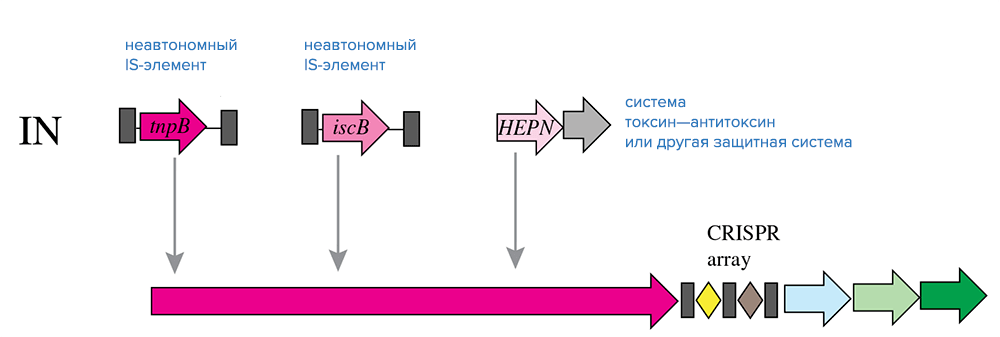
Если не брать в расчет белки Cas, ближайшие родственники белков Cas9 и Cas12 — это белки TnpB, также содержащие домен RuvC и принадлежащие IS-элементам семейства IS605 и их родственникам (рис. 5). Интересно, что гены tnpB — одни из самых многочисленных генов в геномах бактерий и архей. Судя по всему, Cas9, Cas12 и TnpB имеют общее эволюционное происхождение. Системы CRISPR/Cas подтипа V-U вообще не имеют генов адаптационного модуля и содержат, помимо локуса CRISPR, только несколько генов белков, гомологичных TnpB, которые, вероятнее всего, и являются эффекторными. Предполагают, что подтип V-U появился совсем недавно по эволюционным меркам и представляет собой модель предковой формы систем типов II и V [3].
Рисунок 5. Обмен компонентами между системами CRISPR-Cas класса 2 и мобильными генетическими элементами в ходе эволюции. Условные обозначения: HEPN — РНКаза.
Появление систем II и V типов связывают со случайной вставкой TnpB-содержащих IS-элементов рядом с локусом CRISPR (рис. 5). Дальнейший ход эволюции сопровождался независимым преобразованием белков TnpB в эффекторные белки путем получения дополнительных доменов (правда, не совсем понятно, откуда: возможно, источниками дополнительных доменов стали внутренние акты дупликации и рекомбинации) [3].
Помимо разнообразных мобильных элементов, важную роль в эволюции систем CRISPR/Cas, по-видимому, сыграли системы токсин—антитоксин: показано, что многие белки-токсины из этих семейств родственны некоторым белкам Cas (а именно Cas2) [3].
Системы типа VI, подробно рассматриваемые в следующем разделе, отличаются тем, что распознают исключительно РНК-мишени. Системы этого типа почти наверняка связаны с системами токсин—антитоксин, поскольку в их белках Cas часто обнаруживают домен HEPN, имеющийся у многих белков-токсинов, действующих как РНКазы (рис. 5) [3].
Системы CRISPR/Cas, распознающие РНК
Недавно открытые системы VI типа класса 2 с эффекторным белком Cas13 действуют исключительно на РНК-мишени. Белок Cas13 представляет собой РНК-направляемую РНКазу и эффективно защищает, например, кишечную палочку Escherichia coli от бактериофага MS2, чей геном представлен РНК [8]. Интересной особенностью, ранее не описанной для систем CRISPR/Cas, обладает эффекторный белок подтипа VI-B (Cas13b): его активность может повышаться или понижаться под действием вспомогательных белков Cas.
Когда Cas13 активируется РНК-мишенью, он становится неспецифичной РНКазой, которая режет все РНК, до которых сможет «дотянуться». Разумеется, такое действие токсично для клетки и приводит либо к ее программируемой смерти, либо переводит клетку в покоящееся состояние. Как мы уже отмечали, подобное действие на клетку оказывает активированный белок Cas10 систем III типа класса 1. Поскольку РНК-содержащие бактерифаги весьма немногочисленны, вероятнее всего, системы VI типа разрушают транскрипты, считанные с вирусных ДНК-геномов, и запускают гибель клетки или переводят ее в состояние покоя в ответ на интенсивную экспрессию вирусных генов [9].
Минималистичные варианты систем CRISPR/Cas
Наряду с возникновением сложно организованных систем CRISPR/Cas, в состав которых входят разнообразные белки и РНК, есть и обратный «тренд» — появление минималистичных систем CRISPR/Cas с уменьшенными возможностями по адаптации или интерференции. Часто такие «урезанные» варианты CRISPR/Cas переносятся транспозонами и плазмидами. Так, у Tn7-подобных транспозонов имеется уменьшенный вариант системы I-F или I-B (рис. 4). Показано, что систему I-F транспозоны «подхватили» один раз, а вот приобретение ими системы I-B происходило дважды. В этих системах отсутствует адаптационный модуль и белок Cas3, необходимый для разрушения мишени, поэтому они неспособны ни к адаптации, ни к интерференции. Однако они содержат все компоненты, необходимые для процессинга пре-crРНК, поэтому теоретически могут образовывать crРНК и распознавать ДНК-мишень. Экспериментально эти системы еще не изучены, однако предполагают, что они могут способствовать вставке транспозонов за счет образования в сайтах-мишенях R-петель (участков ДНК, на которых цепи разъединены, при чем одна образует комплементарный гибрид с РНК, а вторая остается свободной) [3].
Еще один пример минималистичных систем CRISPR/Cas — системы IV типа класса 1. Как правило, они содержатся в плазмидах или профагах в геномах различных бактерий. За редкими исключениями, в системах IV типа нет адаптационного модуля, но есть гены cas5, cas7, cas8 и, в редких случаях, cas6 (рис. 4). Самих локусов CRISPR в системах IV типа, как правило, нет. Поскольку эти системы встречаются почти исключительно на плазмидах, они могут каким-то образом обеспечивать их мобильность и стабильность [3].
Систематический скрининг прокариотических геномов позволил найти вариант системы подтипа I-E, лишенный гена cas3 и потому неспособный разрушать мишень, однако, судя по входящим в его состав генам, он может быть задействован в сигнальных путях, в частности, приводящих к запуску программируемой клеточной гибели [3].
Заключение
Общая тема, то и дело возникающая при обсуждении эволюции и происхождения систем CRISPR/Cas, — это взаимодействие с мобильными генетическими элементами (рис. 4 и 5). Напомним, по меньшей мере четыре их группы внесли вклад в эволюцию систем CRISPR/Cas. В числе таких элементов:
Во всех этих случаях мобильные элементы встраивались по соседству с локусами CRISPR/Cas и постепенно вовлекались в работу защитных систем [3].
Еще один «тренд» в эволюции систем CRISPR/Cas — утрата тех или иных компонентов, необходимых для полноценного функционирования системы. Во многих случаях такие «урезанные» системы стали принимать участие в совершенно других процессах [3]. Что стало причиной такого «переключения» пока, опять же, остается неясным. Будем надеяться, что дальнейший прогресс в геномике прокариот позволит ответить на эти вопросы о системах CRISPR/Cas.