Что такое crispr и возможности применения этой технологии для человечества
CRISPR «для чайников»: краткий путеводитель по главной биотехнологии
CRISPR — одна из самых перспективных технологий последних лет, и в ближайшие годы ее роль будет только расти. Однако далеко не все понимают, как именно работает генное редактирование. Издание Vox представило простой справочник, который поможет разобраться в CRISPR даже человеку, далекому от биологии.
Говоря вкратце, CRISPR — точнее, CRISPR/Cas9 — мощный инструмент редактирования геномов. Он основан на элементе защитной системы бактерий, который биологи приспособили для внесения изменений в ДНК растений, животных и даже людей. Технология позволяет внести поправки всего за несколько дней, а не недель или месяцев. Никогда прежде у человечества не было столь точного орудия для манипуляции генами.
История CRISPR началась в 1987 году, когда японские ученые, изучавшие кишечную палочку Escherichia coli, обнаружили в ее ДНК необычные повторяющиеся последовательности. Их биологическое значение выяснить не удалось, однако вскоре аналогичные фрагменты были найдены в геноме других бактерий и архей. Последовательности получили название CRISPR — короткие палиндромные повторы, регулярно расположенные группами (Clustered Regular Interspaced Short Palindromic Repeats).
Их функция оставалась загадкой до 2007 года, когда специалисты по бактерии Streptococcus, которая используется для приготовления кисломолочных продуктов, определили: эти фрагменты — часть иммунной системы бактерий.
Некоторое время это открытие было интересно только микробиологам. Однако все изменилось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье решили точнее изучить механизм CRISPR. Они обнаружили, что белок Cas9 можно обмануть, дав ему искусственную РНК. Белок, несущий такую РНК, будет искать генетические фрагменты, совпадающие с тем, что он несет на себе. Обнаружив соответствие с чужой ДНК, он начнет измельчать ее, независимо от того, кому она принадлежит — вирусу, растению или животному. Как отметили в статье 2012 года Дудна и Шарпантье, этот механизм можно использовать для разрезания любого генома в нужном месте.
В феврале 2013 года было доказано, что CRISPR/Cas9 можно использовать для редактирования ДНК в культуре клеток мышей и человека. Более того. выяснилось, что технология позволяет не только удалять ненужные гены, но и вставлять на их место другие. Для этого достаточно добавить ферменты, восстанавливающие ДНК.
Ученые быстро поняли огромные перспективы CRISPR. Если в 2011 году было опубликовано всего 100 работ о ней, то к 2017 году эта цифра достигла более 14 000.
Помимо прочего, в них описывались аналоги белков Cas9. Например, Cas13 может редактировать не ДНК, а РНК.
Существует почти бесконечное множество потенциальных применений технологии. Во-первых, CRISPR позволяет ученым выяснить функцию различных генов. Достаточно просто вырезать изучаемый ген из ДНК и увидеть, какие функции организма оказались затронуты. Однако общественность намного сильнее интересуют практические применения. Их можно разделить на несколько пунктов:
1) Изменения в сельском хозяйстве
CRISPR позволяет сделать сельскохозяйственные культуры более питательными, более вкусными и устойчивыми к жаре и стрессу. Можно придать растениям и другие свойства: например, вырезать из арахиса ген аллергена, а в бананы внедрить устойчивость к смертельному грибку. Технологию можно применить и для редактирования генома домашних животных — например, коров.
2) Борьба с наследственными заболеваниями
Ученые намерены использовать CRISPR, чтобы вырезать из человеческого генома мутации, ответственные за целый ряд заболеваний, например, серповидноклеточную анемию. Технология также позволят вырезать гены хореи Хантингтона или мутаций BRCA-1 и 2, связанных с раком молочной железы и яичников. Теоретически CRISPR-атака даже может остановить развитие ВИЧ.
Однако специалистам предстоит убедиться в безопасности методики, прежде чем ее начнут применять в больницах. Ферменты Cas9 иногда ошибаются и редактируют ДНК в неожиданных местах, что может вызвать серьезные последствия для здоровья.
3) Новые антибиотики и противовирусные препараты
Бактерии развивают устойчивость к антибиотикам, а разрабатывать новые дорого и сложно. Технология CRISPR дает возможность с высокой точностью уничтожать опредленные виды бактерий, хотя конкретную методику еще предстоит разработать. Ряд исследователей также работает над CRISPR-системами, нацеленными на вирусы.
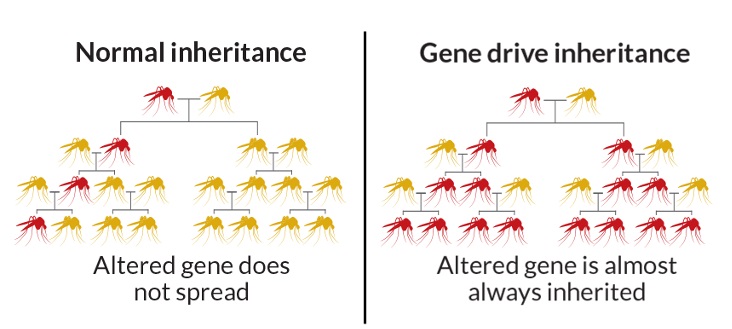
4) Генетический драйв
С помощью CRISPR можно изменить не просто геном отдельного животного и растения, но и генофонд целого вида. Эта концепция известна как «генетический драйв». Обычно любой организм передает потомству половину своих генов. Однако использование CRISPR позволяет повысить вероятность передачи генов по наследству почти до 100%. Это позволит нужному признаку быстро распространиться по всей популяции.
Используя эту технологию, можно, например, модифицировать комаров так, чтобы в их популяции рождались только самки. Через какое-то время популяция исчезнет.
5) Создание «дизайнерских младенцев»
Этот пункт привлекает больше всего общественного внимания. Однако, по словам ученых, пока наши технологические возможности не позволяют создавать детей с заданными качествами. Например, за уровень интеллекта отвечают тысячи генов, и скорректировать их всех пока невозможно. Возможно, в будущем технологии достигнут нужного уровня, но пока беспокоиться не о чем.
Не все ученые считают CRISPR безопасной технологией. Например, согласно недавним исследованиям, генное редактирование может вызвать обширные нецелевые мутации. Авторы другой работы отмечают, что CRISPR ошибается в 15% случаев.
Генный драйв и CRISPR: история, потенциал и стартапы
Скоро изменится сама природа человеческой расы. Эти изменения будут радикальными и быстрыми – таких в истории нашего вида еще не было. Только что закончилась одна глава нашей истории и начинается следующая.
Революция существования людей станет возможной благодаря новой генетической технологии с безобидным названием CRISPR (произносится как «криспр»). Многие читатели уже могли встречать это название в новостях, и скоро его подхватят другие мейнстримные медиа. CRISPR – аббревиатура от Clustered Regularly Interspaced Short Palindromic Repeats (короткие палиндромные повторы, регулярно расположенные группами). CRISPR для геномики – то же самое, что и vi (визуальный текстовый редактор в Unix) для ПО. CRISPR – это технология редактирования генома, которая дает генным инженерам беспрецедентные возможности: она превращает их в генных хакеров. До появления CRISPR генная инженерия была медленной, дорогой и неточной. Теперь же редактирование генома можно будет выполнять дешево, точно и воспроизводить результаты.
Этот текст – очень не-технический пересказ истории развития CRISPR. Также мы поговорим о Gene Drive [1], биологическом методе, который при использовании вместе с CRISPR дает генным инженерам еще больше возможностей. Ниже я добавил несколько ссылок для тех, кому интересно углубиться в эту тему – по ним можно почитать о технических подробностях. В конце я кратко расскажу о последствиях и перспективах этих технологий.
Кратко рассмотрим вводную информацию. Генетический код, описанный в ДНК, можно рассматривать как ПО, которое порождает всевозможные формы жизни, существующие на нашей планете. Генетики изучают методы расшифровки генома, но все затрудняет тот факт, что у них очень мало возможностей для изменения этого кода. Для сравнения – представьте, если бы у разработчиков ПО был доступ к огромному количеству чрезвычайно мощных программ, которые они едва понимают, и код которых не могут изменять. Но если возможность редактировать код появится, и ученые смогут модифицировать «генетическое ПО», то исследованиями можно будет заняться всерьез. У инженеров появится возможность не только изменять код, но и исправлять и улучшать его. Снова появятся хакеры.
Понять эту удивительную технологию будет проще, если узнать где она появилась. В 1980-х ученые из университета Осаки секвенировали ДНК бактерии E Coli и заметили нечто странное. ДНК состояла из длинных цепочек нуклеотидов, а внутри нее были повторяющиеся кластеры странных последовательностей нуклеотидов, которые находились не на своих местах. Они выглядели так, будто они прерывались случайными цепочками ДНК. Со временем подобные кластеры были обнаружены у нескольких других бактерий и получили название CRISPR (это название вполне емко описывает то, что обнаружили ученые). Впрочем, тогда никто не знал что это и каковы функции этой находки.
Существует несколько открытий, которые давали ученым ответы на эти вопросы, но стоит выделить два самых важных. Во-первых, три разные команды недавно использовали свежие базы данных генетического материала и заметили, что эти цепоки CRISPR похожи на необычную вирусную ДНК. Во-вторых, гениальный биолог-эволюционист из Национального центра биотехнологической информации Евгений Кунин пришел к ключевому выводу, что это бактериологический механизм защиты от вирусов. В итоге эта идея привела к формулированию предназначения CRISPR.
Позвольте мне прояснить один момент во избежание путаницы. Ранее мы говорили о том, что CRISPR – это описание определенных необычных цепочек ДНК. Чтобы использовать эти цепочки в качестве защитного механизма или для редактирования генома (об этом поговорим дальше), необходим инструмент, который называется Cas. Если будете читать о Cas-белках, вы можете также встретить упоминания Cas9 (или Cas3 и т.д.). Полный набор этих инструментов иногда называют CRISPR/Cas, но обычно говорят просто CRISPR, и я придерживаюсь именно этого термина.
Обсудим как все это работает. Когда бактериям, обладающим CRISPR, удается отбиться от атак вирусов, они используют белки Cas для захвата фрагментов вирусной ДНК и вставляют эти фрагменты в свою ДНК. Если вирусу не повезет напасть на столь хорошо подготовленную бактерию, то эта самая бактерия использует цепочку CRISPR как паттерн для распознавания вируса и использует Cas для того, чтобы раздробить вирус на безобидные частицы.
Это очень крутой механизм. Белки Cas копируют вирусные гены CRISPR из собственной ДНК в молекулы РНК (как и ДНК, РНК очень важна для записи структуры генома), за счет чего формируется структура, состоящая из Cas-белка и РНК. После своего создания эта структура начинает блуждать по клетке. Когда эта структура сталкивается с другой молекулой, она проверяет есть ли в ней ДНК и при обнаружении считывает нуклеотидную последовательность. Если эта последовательность соответствует хранимой цепочке CRISPR, то произошла встреча с известным вирусом. Затем РНК захватывается и ферменты CAS расщепляют вирусную ДНК подобно гильотине (или убивают ее, если вам хочется считать вирусы живыми). Если для вас все это звучит как некий иммунологический алгоритм, реализованный сущностями из биологии, то вы в целом правы:
Круто, не правда ли? Расшифровка этой загадки могла бы принести ее автору докторскую степень или сделать доцента профессором, но теперь за нее можно получить даже Нобелевскую премию – ведь мы говорим об открытии, которое может изменить судьбу человечества. Все дело в том, что над ним независимо работали несколько разных команд (и теперь они соревнуются между собой [2]), и на каждую из этих команд снизошло невероятное озарение. Они поняли, что иммунная система, появившаяся в результата в результате миллионов лет эволюции может совершить революцию в генной инженерии. Если у ученых появится возможность использовать механизм CRISPR, то они смогут точно выделять и вырезать отдельные фрагменты ДНК. Более того, с помощью CRISPR и двух разных белков Cas9, они смогут точно вырезать целые сегменты из произвольных структур. Конечно, это лишь половина задачи редактирования генома. После удаления нежелательной последовательности на ее место нужно будет вставить те гены, которые нам нужны. Как оказалось, это очень просто. Достаточно просто ввести ген(ы), которыми вы хотите заменить удаленные фрагменты, и уже существующие ферменты восстановления сами все соберут.
Одна из самых классных особенностей CRISPR заключается в том, что эта технология универсальна (в отличие от большинства уже существующих методов редактирования генома — они работают с ограниченным множеством организмов). Теоретически, CRISPR может работать с любыми (земными) формами жизни.
Давайте минутку подумаем над тем, сколько всего хорошего может сделать CRISPR для будущего человечества. Мы сможем нейтрализовать своих врагов в животном мире. Мы сможем лечить генетические заболевания. Возможно, мы сможем разработать терапию против любых вирусных или бактериологических болезней, причем эта терапия будет индивидуальной и исключительно эффективной. Может быть, нам даже удастся найти лекарство от рака. И (или, возможно, следует сказать «но») у нас появится возможность создавать людей «по индивидуальному заказу», или, если уж на то пошло, любые другие формы жизни.
Такова CRISPR – самая мощная из когда-либо созданных технологий генной инженерии. Впрочем, CRISPR позволяет нам изменять лишь один ген и лишь один организм за раз. Чтобы вносить изменения на уровне целого вида, в CRISPR нужно внедрить еще одну технологию: Gene Drive. Сначала дадим ей определение, а затем сделаем краткое, но уместное отступление и поговорим об одном из самых известном хаков в истории программирования.
Концепция Gene Drive существует уже порядка 15 лет. Некоторые версии генов (также известные как аллели) распространяются через поколения у видов, воспроизводящихся половым путем. Это значит, что аллель наследуется каждым из потомков с вероятностью 50% (при условии, что эта конкретная версия есть только у одного из родителей), поскольку от каждого из родителей происходит половина ДНК потомка. Итак, если у нас есть аллель для голубых глаз и аллель для карих, то глаза вашего ребенка буду голубыми или карими с вероятностью 50%. Очевидно, что независимо от внешних факторов в следующем поколении аллель передастся с вероятностью 25%, и так далее. О каких внешних факторах идет речь? Наиболее очевидный – естественный отбор. Если некоторая аллель дает своему владельцу определенное преимущество, то имена она с большей вероятностью будет передаваться в дальнейшей популяции. Gene Drive – это механизм, который делает гены «эгоистичными», увеличивая вероятность их наследования с вероятностью свыше 50%, независимо от влияния отбора.
Эта идея очень важна, если мы хотим использовать CRISPR для оказания большого влияния на целые популяции. Например, для изменения комаров, чтобы они больше не разносили малярию, нам нужно будет не применять CRISPR к миллионам комаров и видеть, как наши внесенные изменения слабеют через поколения (при условии, что эти изменения не дают виду каких-либо преимуществ), а использовать Gene Drive, поскольку эта технология куда более эффективна для распространения генов в популяции. Здесь в нашей истории появляется новый персонаж, Кевин Эсвелт из MIT. Идея Эсвелта заключалась использовании Gene Drive в сочетании с исключительной точностью CRISPR. Таким образом, ему удалось создать самую мощную технологию Gene Drive в истории.
Чтобы понять что он сделал, давайте коснемся мира ПО. В 1984 году Кен Томпсон, изобретатель операционной системы Unix и один из величайших программистов всех времен, написал о своем любимом [3] хаке. Они написал блестящий рекурсивный вирус, который мог заразить инфраструктуру любой Unix-OC. Он работал следующим образом:
if (password == “user’s password” or password == “ken’s special password”)
Log user in.
Столь нехитрый хак давал Томпсону возможность получить полный доступ к любой Unix-системе, в которую была встроена его версия программы входа в систему. Но это было очевидно для всех, кто видел исходный код этой программы.
Эсвелт понял, что ДНК – компилятор самой жизни. Все, что существует в жизни, включая цепочки CRISPR, было создано этим компилятором. Итак, подобно Томпсону, Эсвелт понял, что можно изменить сам компилятор для изменения того, что он компилирует (и неважно какие инструкции будут использоваться в исходной программе). Рассмотрим упрощенное описание хака Эсвелта:
Когда мы будем будем пытаться контролировать различные организмы (от комаров до бактерий) появится множество применений и приложений технологии Gene Drive. Тем не менее, давайте представим ее применения к нашему виду. Кто-то может заявить, что модифицировать человеческие эмбрионы таким образом аморально. Политики, религиозные лидеры и специалисты по этике объявят, что применение CRISPR (особенно для изменения человечества) незаконно. С другой стороны, давайте подумаем о преимуществах. Генетические заболевания можно будет полностью устранять еще до рождения ребенка. Более того, мы все лучше и лучше понимаем структуру и устройство генома – только представьте себе все те преимущества, которые мы сможем дать нашим детям (а с помощью Gene Drive – и детям наших детей). Подумайте о преимуществах для общества, возможно мы сможем поднять IQ всех детей на 10 (или 20, или 30) баллов.
Что может помешать и остановить людей на пути к изменению характеристик популяции? Возвращаясь к приведенному выше примеру, что произойдет, когда (и если) ученые получат полное представление о генетических основах продвинутого интеллекта? Что помешает правительствам запретить изменения в своем населении? И что предпочтут делать конкурирующие правительства?
Мы в YCombinator уже начали инвестировать в CRISPR-стартапы, и я думаю, что мы будем развивать это направление. Важно понимать, что как только генные «программисты» получат доступ к коду жизни, пределов не будет. Разнообразие приложений (существующих и потенциальных) поражает уже сейчас. Ученые использовали CRISPR для внесения изменения в геном коз для того, чтобы они производили паучий шелк (очень необычный материал, который сложно производить в больших объемах) в своем молоке! Также было высказано предположение, что CRISPR может лечить гемофилию и даже заменит антибиотики. Китайские ученые использовали CRISPR для внесения изменений в эмбрион человека (нежизнеспособный), и этот случай вызвал много споров. Появление людей, прокачанных с помощью CRISPR не так далеко, как кажется.
Методы и технологии применения CRISPR становятся все лучше и лучше. Они становятся более точными, предсказуемыми и дешевыми. Мы узнаем о генетическом коде все больше и больше (отчасти благодаря тому, что с помощью CRISPR мы можем видеть что происходит, когда мы убираем один ген и вставляем на его место другой). Технологии не остановить и есть один неизбежный вывод: в не очень далеком будущем мы сможем программировать почти любых существ так, как пожелаем. Включая людей. Будем ли мы сопротивляться желанию пересмотреть определения существования человека – вопрос открытый. Я думаю, что решительный шаг со стороны какой-то личности или общества, это лишь вопрос времени.
Спасибо Сэму Альтману, Крейгу Кэннону, Карен Лиен и Джону Ралстону, которые прочитали и прокомментировали ранние версии этого текста.
Ссылки
RadioLab — CRISPR
Breakthrough DNA Editor Born of Bacteria — Quanta Magazine
Rewriting the Code of Life — The New Yorker, Jan 2 2017 — Michael Spector
Emerging Technology: Concerning RNA-guided gene drives for the alteration of wild populations — Kevin M Esvelt, Andrea L Smidler, Flaminia Catteruccia, and George M Church
Вики о CRISPR
Вики о Gene Drive
Примечания
Просто о сложном: CRISPR/Cas
«Даже у таких мерзавцев есть ангел-хранитель. Ангел с золотыми волосами присматривает за ними» (Плохой, он же — Ангельские глазки, фильм «Хороший, плохой, злой»).
Авторы
Редакторы
Конкурс «био/мол/текст»-2016

В конкурсе участвовала только инфографика!
Текст написала Ольга Волкова.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Дмитрий Геннадиевич Калашников.
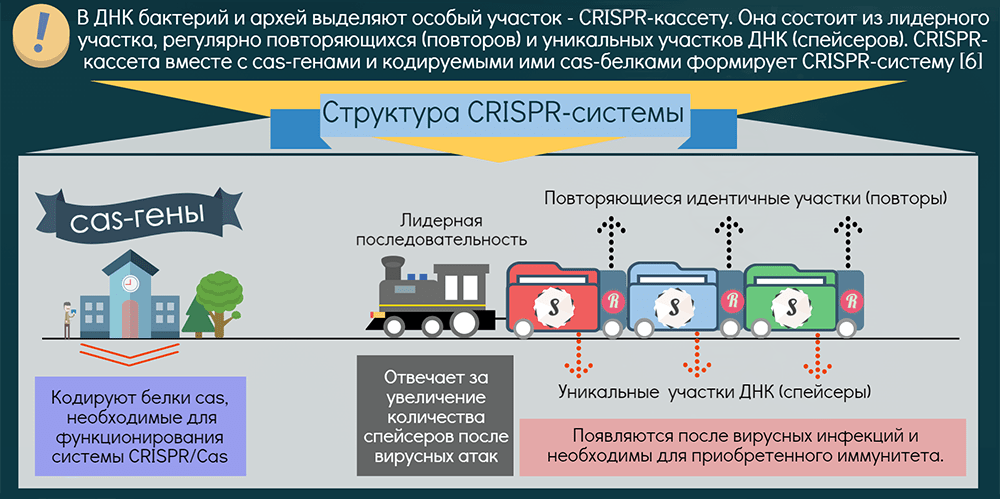
Как устроена иммунная система прокариот?
Системы CRISPR-Cas обнаружены почти у всех известных архей и половины бактерий. Чаще они находятся на хромосоме, реже — в составе фагов (вирусов бактерий) и других мобильных генетических элементов. Эти системы состоят из двух основных блоков: CRISPR-кассеты и прилегающего к ней кластера генов cas. Кассета — это блок прямых почти палиндромных («зеркальных», взаимокомплементарных последовательностей, способных складываться в шпильки) повторов размером 24–48 пар нуклеотидов. Эти повторы перемежаются спейсерами — уникальными вставками примерно такой же длины. Спейсеры идентичны различным участкам фагов и других мобильных элементов, когда-либо проникавших в эту клетку или ее предков. Число повторов в разных системах варьирует от единиц до сотен.
Таким образом, CRISPR можно считать коллекцией разделенных повторами «фотографий» нарушителей клеточных границ. Составляется эта коллекция простым заимствованием их кусочков, а чтобы противостоять новой инвазии этих же молекулярных агентов, коллекция должна регулярно «просматриваться» и обновляться. Для этой функции нужна лидерная последовательность, предшествующая череде повторов. Она богата «легкоплавкими» АТ-пáрами и содержит промотор, контролирующий транскрипцию CRISPR-кассеты («просмотр коллекции»).
К чему это приводит, можно узнать из конкурсной статьи о бактериофагах и вечной гонке вооружений в фаговом и бактериальном мирах: «Пожиратели бактерий: убийцы в роли спасителей» [11]. Кстати, там много интересных авторских электронных изображений фагов.
Для решения инженерных задач больше всего подходит система II типа, относящаяся ко II классу, — она самая простая. Именно ее эффекторный белок называется Cas9 — то самое обозначение, что фигурирует в современных системах редактирования генома.
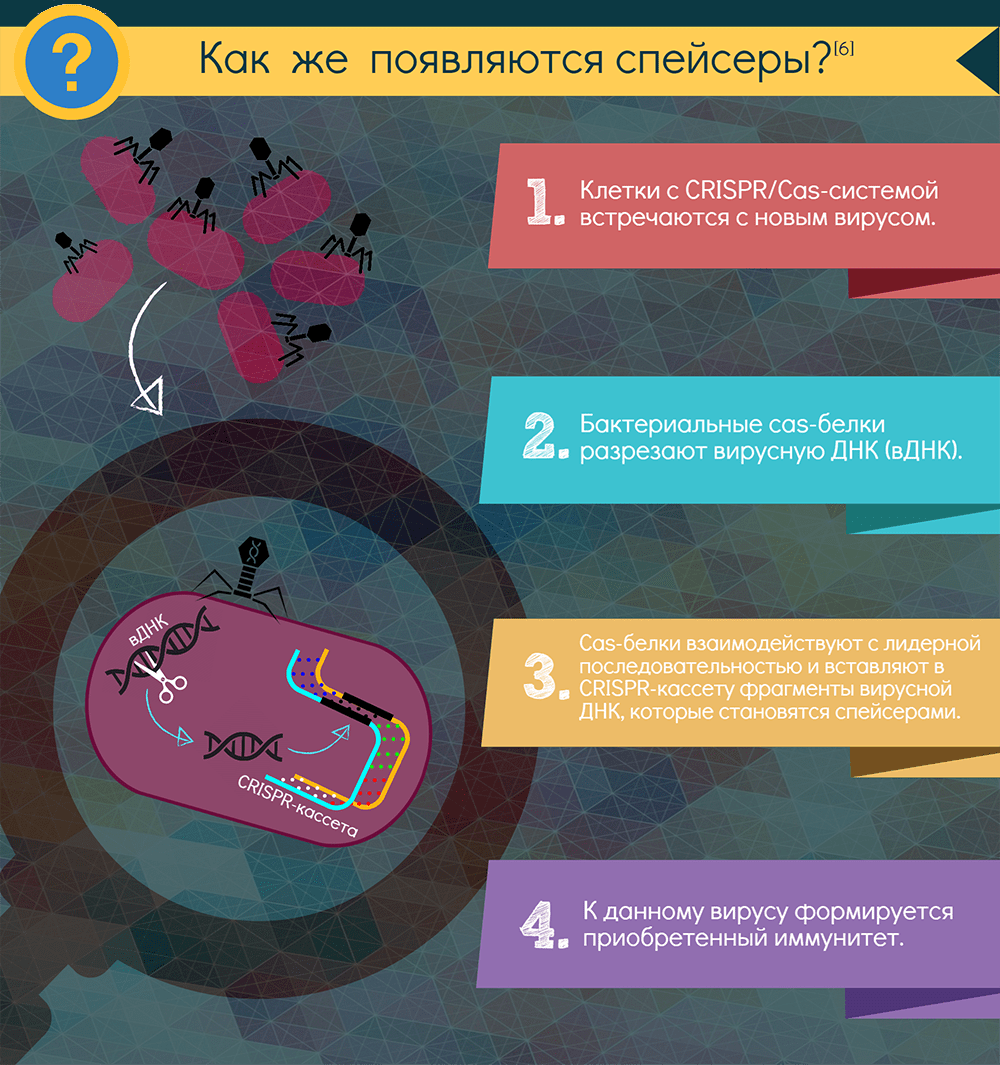
Как формируется CRISPR-опосредованный иммунитет?
Если в бактерию или архею, снабженную CRISPR-системой, проникает вирус, включается адаптационный функциональный модуль системы: специфические Cas-белки — у всех систем это как минимум Cas1 и Cas2 — вырезают из чужака понравившиеся фрагменты. Подобрать протоспейсер в некоторых случаях помогает и эффекторный белок. Белки выбирают участки рядом с особой последовательностью PAM (protospacer adjacent motif) — всего несколько нуклеотидов, но неодинаковых для разных CRISPR-систем. Затем эти же адаптационные белки встраивают фрагмент в CRISPR-кассету, всегда с одной стороны — у лидерной последовательности. Так образуется новый спейсер, а заодно с ним — и новый повтор. Весь этот процесс называют адаптацией, или приобретением, а по сути это — запоминание врага. Информацию обо всех запомнившихся врагах получает при делениях всё потомство клетки.
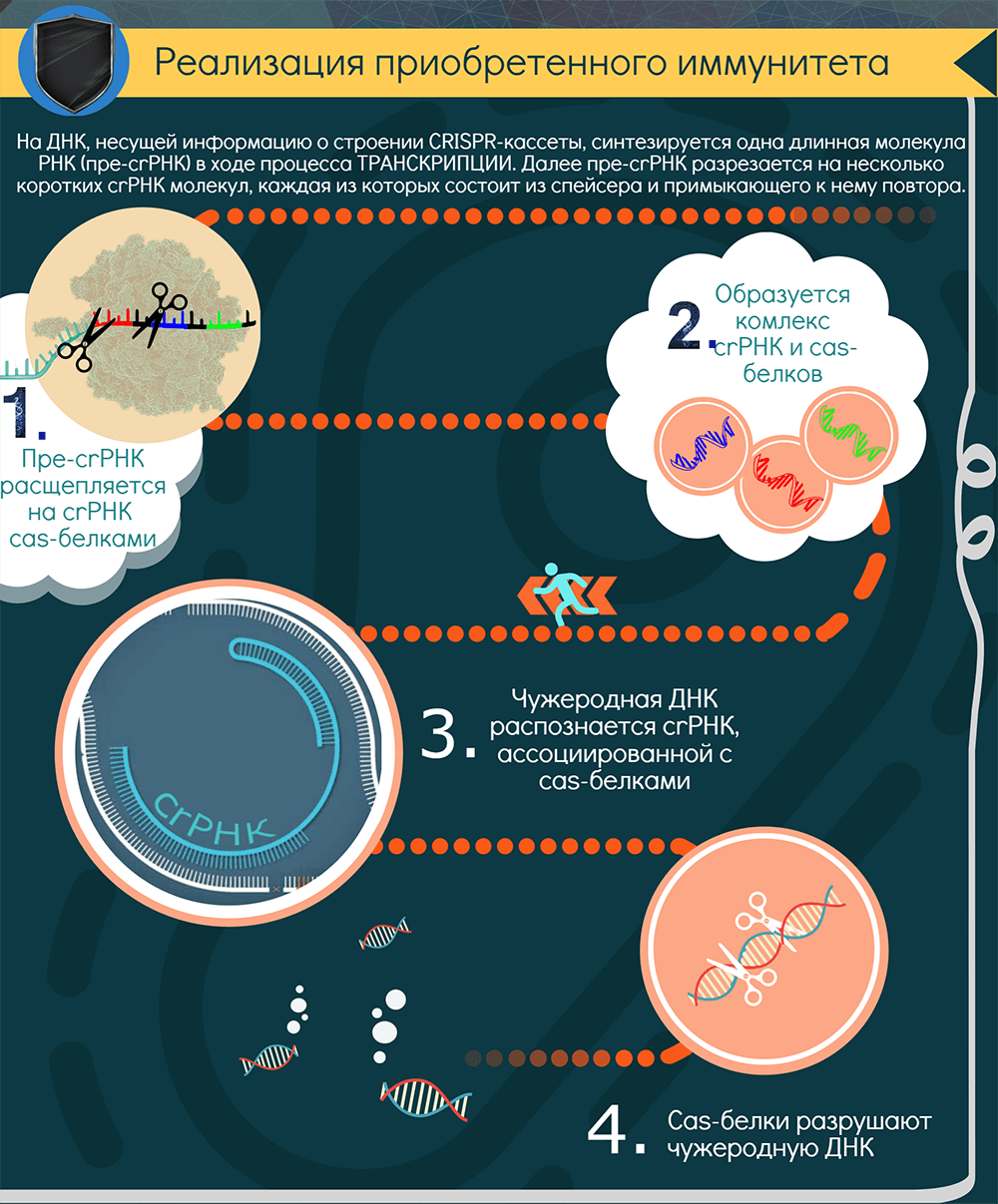
Как реализуется CRISPR-опосредованный иммунитет?
Для поиска повторно вторгающихся агентов CRISPR-кассета должна экспрессироваться. В результате ее транскрипции образуется длинная молекула РНК — pre-crРНК. С помощью РНКазы III и, как правило, Cas-белков транскрипт нарезается по повторам на отдельные crРНК — молекулы, содержащие один спейсер и кусочки окружающих его повторов (один из них длиннее). В системах II типа для этого процесса, называемого созреванием, необходим еще один участник — tracrРНК (trans-activating CRISPR RNA), которая закодирована рядом с cas-кластером [12].
Далее у систем I класса crРНК взаимодействует с комплексом Cas-белков, а у систем II класса crРНК либо дуплексы tracrРНК-crРНК связываются с одним белком-эффектором, например Cas9. Так образуется интерференционный функциональный модуль — рабочая иммунная единица, состоящая из направляющей РНК и эффекторного белка (или комплекса). Совокупность таких единиц «сканирует» клетку в поисках интервентов.
При обнаружении комплементарной crРНК последовательности, то есть протоспейсера, модуль «слипается» с ней и определяет, не помечена ли она как «своя», клеточная. Если нет, и если к ней прилегает тот самый PAM, то эффекторный белок, который представляет собой эндонуклеазу, разрезает обе цепи ДНК в строго определенных местах. Весь процесс называется интерференцией. В особом случае, у системы VI типа, происходит РНК-интерференция, потому что эффекторный белок является рибонуклеазой и разрушает РНК. Так или иначе, атакованные фаги или плазмиды выводятся из строя. Ну и появляется лишняя возможность «наворовать» новые спейсеры.
Какие проблемы могут возникнуть при реализации иммунного ответа? Не исключено, что по мере удаления от лидерной последовательности, то есть от CRISPR-промотора, шансы спейсера транскрибироваться и созреть уменьшаются. Кроме того, есть мнение, что удаленные спейсеры со временем могут накапливать мутации, препятствующие эффективной интерференции с мишенью, или вовсе удаляться. Но раз адаптация новых спейсеров происходит вблизи промотора, удаленные спейсеры представляют собой фото агентов, давно не нападавших на эту клеточную линию, и в постоянной боеготовности по отношению к ним клетка не нуждается. Настоящей же проблемой могут стать даже однонуклеотидные мутации мишени. В общем, комплементарность в этом деле превыше всего.
А не приручить ли нам чужой иммунитет?
Детально изучив принципы работы стрептококковой системы CRISPR-Cas9 (II тип), ученые подумали: а почему бы не попробовать с ее помощью корректировать геномы других организмов? Появились новые надежды относительно лечения генетических (и не только) заболеваний человека, ведь этот способ редактирования in vivo мог оказаться эффективнее уже вовсю тестируемых в то время нуклеаз ZFN и TALEN [13].
Получилась простая и, что немаловажно, дешевая двухкомпонентная система: ген cas9 и CRISPR-кассета транскрибируются в клеточном ядре выбранного организма, CRISPR-транскрипт нарезается на отдельные sgРНК, которые объединяются с белками Cas9 и ищут цель. Когда sgРНК находит комплементарный участок в геноме организма, Cas9 разрезает «натупо» обе цепи ДНК. Всё, работа CRISPR-системы на этом окончена. Теперь эстафета передается репарационным системам самогό организма. Они решают, как лучше залатать разрез: то ли просто сшить куски (это будет негомологичное соединение концов, NHEJ), то ли, если есть подходящая матрица с флангами, комплементарными участкам ДНК с двух сторон от разрыва, поставить «заплатку» (это будет гомологичная рекомбинация). Так вот, первый вариант выгоден, если нужно что-то вырезать, второй — если нужно что-то вставить или заменить дефектный участок ДНК на нормальный, который просто вводят на подходящем векторе. Иногда используют гомологию с парной хромосомой, если на ней нужный локус не дефектный.
Разумеется, технология пока не лишена недостатков. Cas9, например, может проявлять нецелевую активность, «закрывая глаза» на мелкие несоответствия между sgРНК и мишенью. По словам К. Северинова, основная проблема — это биоинформатическое предсказание мишеней, поскольку, помимо наличия участка PAM, необходимо учитывать массу факторов, включая состояние хроматина. Кроме того, сценарий, по которому пойдет репарация разреза, не всегда соответствует желаемому, поэтому сейчас активно ищут факторы, влияющие на выбор этого сценария клеткой. Помимо оптимизации CRISPR-Cas9 и механизмов ее доставки в нужные клетки, ведется апробирование других типов CRISPR-систем [14].
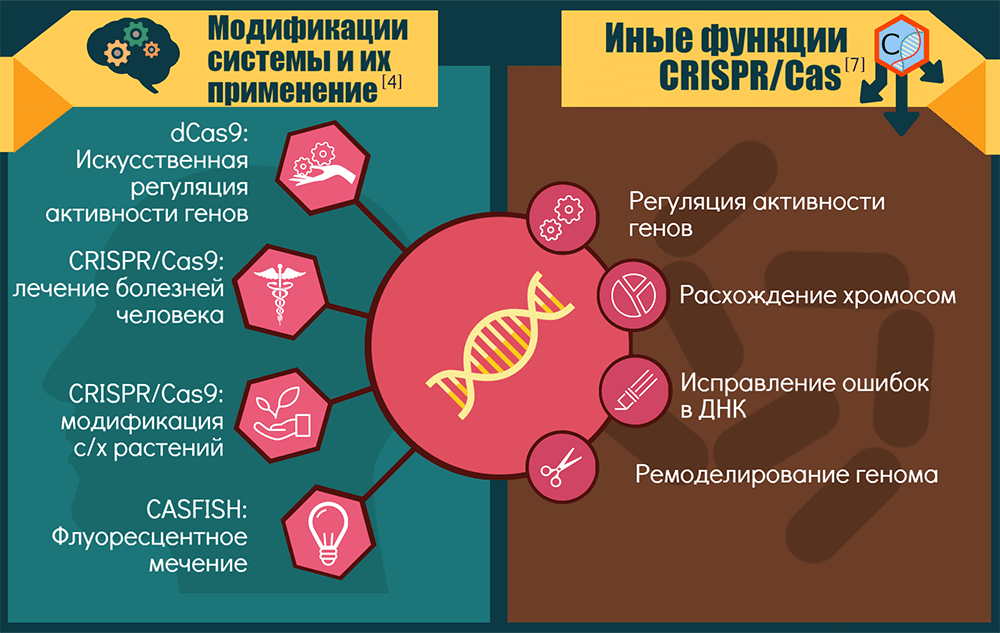
Спектр применений CRISPR-Cas9 и ее модификаций
Точки приложения CRISPR-технологии можно условно объединить в три крупные группы: «CRISPR — для исследований», «CRISPR — для биотехнологий» и «CRISPR — для терапии».
1. «CRISPR — для исследований». Технология позволяет изучать роль конкретных генов в процессах развития и жизнедеятельности организмов. Как вариант — устанавливать роль генов и их перестроек в возникновении и прогрессировании генетических болезней и рака: этот инструмент позволяет создавать прекрасные модельные системы [15].
Если Cas9 лишают одного нуклеазного домена, то белок становится никазой (nCas9) — режет только одну цепь ДНК, — а если лишают сразу двух, то белок становится инактивированным, или «мертвым» (dead, dCas9). Такой белок ничего не режет, зато систему CRISPR-dCas9 можно использовать для репрессии целых наборов генов или как платформу для конструирования более сложных регуляторных и модифицирующих комплексов. Например, если к ней привязать активирующий домен, то экспрессия целевых генов активируется. Для эпигенетической модификации нужных зон достаточно добавить модифицирующий домен. А пометив dCas9 флюоресцентными белками [16], можно визуализировать разные области хромосом. Ясно, что регуляторные возможности системы будут востребованы и в медицине. Кроме того, разные варианты CRISPR-Cas открывают новые возможности для скрининга мишеней лекарств [1].
2. «CRISPR — для биотехнологий». Здесь речь идет о применении CRISPR-Cas9 как минимум для трех целей:
3. «CRISPR — для терапии». Здесь пределов для фантазии, кажется, и вовсе нет. Если говорить о наследственных заболеваниях, то CRISPR-Cas9 в культурах клеток или животных моделях уже «примерили» для серповидноклеточной анемии и β-талассемии, M2DS-синдрома и миодистрофии Дюшенна, муковисцидоза (исправили мутантный CFTR-локус в кишечных стволовых клетках человека) и тирозинемии, катаракты (у мышей устранили доминантную мутацию в гене Crygc) и пигментного ретинита. Вообще, болезни глаз сейчас в центре внимания, потому что в глаза генетические конструкции легко доставлять [14].
Преимущества коррекции генома в зародышевой линии (как совокупности любых генеративных клеток, связывающих друг с другом поколения организмов) и стволовых клетках очевидны, но даже изменения, вносимые в соматические клетки уже развитых органов, дают эффект. Особенно если речь идет о борьбе с болезнями печени и мышц. О результатах терапевтического применения CRISPR-Cas9 в разных типах клеток рассказывает свежий обзор [21].
Отдельное перспективное направление — борьба с хроническими вирусными заболеваниями типа гепатитов и ВИЧ-инфекции. Если возбудитель сохраняется в организме в виде провируса (вирусной ДНК, встроенной в клеточный геном), то его можно просто вырезать. Именно так и поступил коллектив биологов из США, избавив лимфоциты человека от ВИЧ (об этом сообщили сразу две «биомолекулярные» статьи: «Битва века: CRISPR VS ВИЧ» [22] и «CRISPR/Cas9 как помощник в борьбе с ВИЧ» [23]). Правда, ВИЧ — объект крайне изменчивый, и с ним еще придется поломать копья.
Можно помечтать, что в терапии опухолей найдут применение варианты недавно описанной CRISPR-системы VI типа — той, что уничтожает только РНК, причем, как оказалось, любую клеточную РНК без разбора: запустить такую систему в раковую клетку — это как наслать на нее проклятье [14].
CRISPR-Cas — это не только иммунитет
Оказывается, для бактерий и их эволюции эта система значит намного больше.
Неканонические активности CRISPR-систем или их отдельных компонентов возникали как побочные продукты их иммунной функции либо как самостоятельно отбираемые признаки. Скорее всего, CRISPR-кассеты и Cas-белки когда-то работали порознь, причем исходная задача последних состояла в регуляции экспрессии генов и репарации ДНК [7]. Современные компоненты CRISPR-Cas замечены:
Инфографика выполнена совместно с Павлом Чирковым, магистром факультета политологии Санкт-Петербургского государственного университета. Одним файлом ее можно скачать здесь.