Что такое crispr cas9
Просто о сложном: CRISPR/Cas
«Даже у таких мерзавцев есть ангел-хранитель. Ангел с золотыми волосами присматривает за ними» (Плохой, он же — Ангельские глазки, фильм «Хороший, плохой, злой»).
Авторы
Редакторы
Конкурс «био/мол/текст»-2016

В конкурсе участвовала только инфографика!
Текст написала Ольга Волкова.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Дмитрий Геннадиевич Калашников.
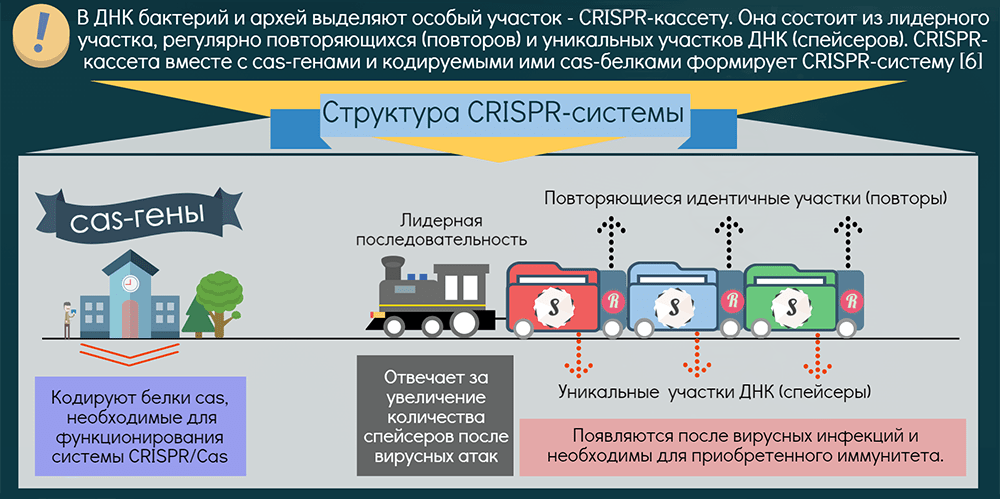
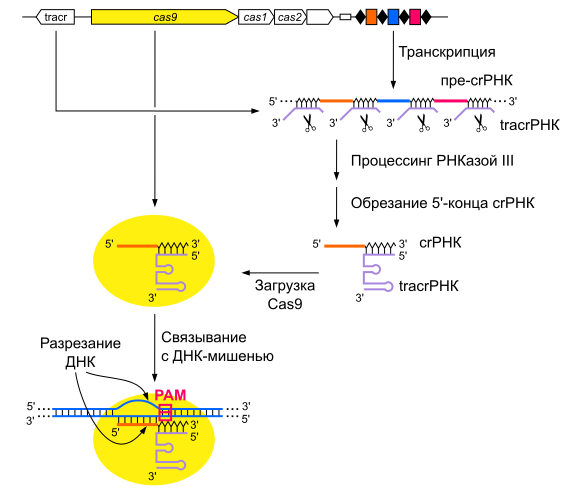
Как устроена иммунная система прокариот?
Системы CRISPR-Cas обнаружены почти у всех известных архей и половины бактерий. Чаще они находятся на хромосоме, реже — в составе фагов (вирусов бактерий) и других мобильных генетических элементов. Эти системы состоят из двух основных блоков: CRISPR-кассеты и прилегающего к ней кластера генов cas. Кассета — это блок прямых почти палиндромных («зеркальных», взаимокомплементарных последовательностей, способных складываться в шпильки) повторов размером 24–48 пар нуклеотидов. Эти повторы перемежаются спейсерами — уникальными вставками примерно такой же длины. Спейсеры идентичны различным участкам фагов и других мобильных элементов, когда-либо проникавших в эту клетку или ее предков. Число повторов в разных системах варьирует от единиц до сотен.
Таким образом, CRISPR можно считать коллекцией разделенных повторами «фотографий» нарушителей клеточных границ. Составляется эта коллекция простым заимствованием их кусочков, а чтобы противостоять новой инвазии этих же молекулярных агентов, коллекция должна регулярно «просматриваться» и обновляться. Для этой функции нужна лидерная последовательность, предшествующая череде повторов. Она богата «легкоплавкими» АТ-пáрами и содержит промотор, контролирующий транскрипцию CRISPR-кассеты («просмотр коллекции»).
К чему это приводит, можно узнать из конкурсной статьи о бактериофагах и вечной гонке вооружений в фаговом и бактериальном мирах: «Пожиратели бактерий: убийцы в роли спасителей» [11]. Кстати, там много интересных авторских электронных изображений фагов.
Для решения инженерных задач больше всего подходит система II типа, относящаяся ко II классу, — она самая простая. Именно ее эффекторный белок называется Cas9 — то самое обозначение, что фигурирует в современных системах редактирования генома.
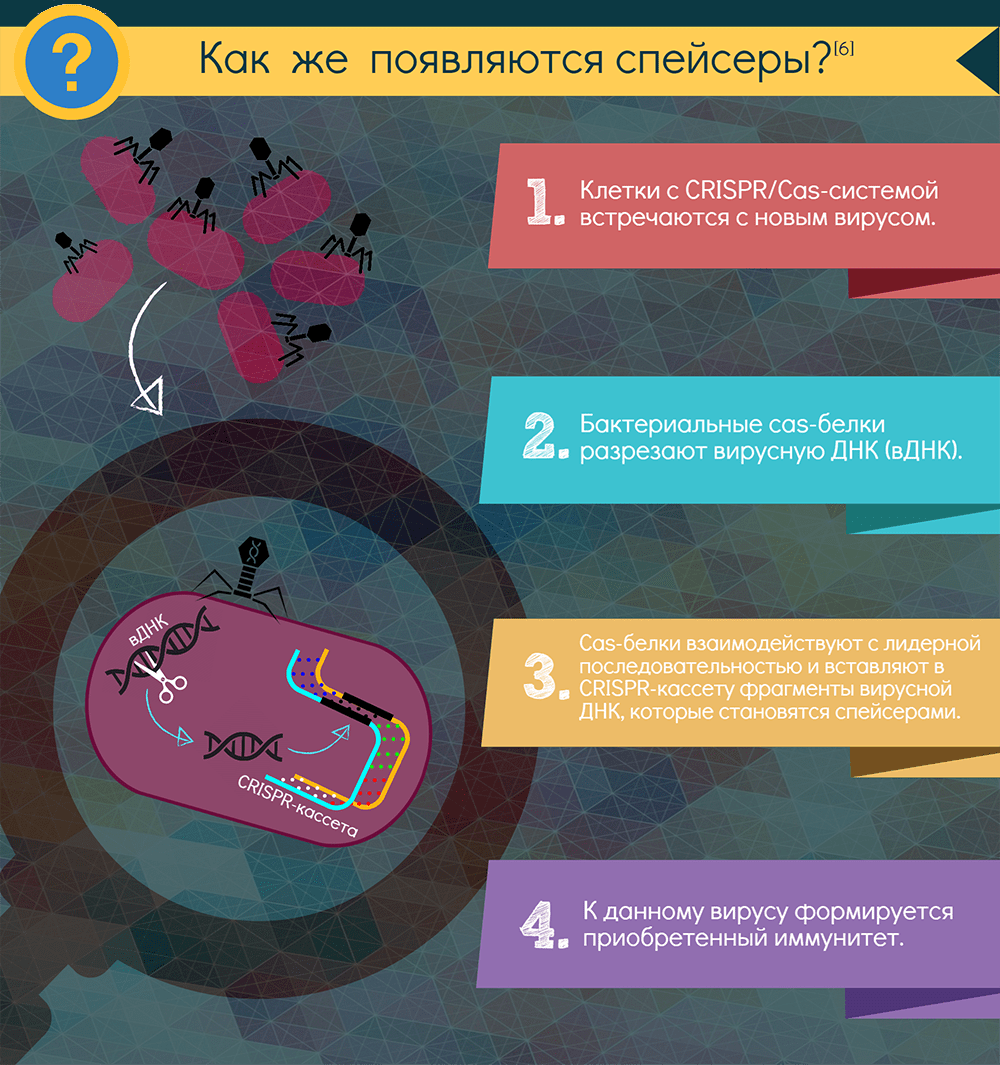
Как формируется CRISPR-опосредованный иммунитет?
Если в бактерию или архею, снабженную CRISPR-системой, проникает вирус, включается адаптационный функциональный модуль системы: специфические Cas-белки — у всех систем это как минимум Cas1 и Cas2 — вырезают из чужака понравившиеся фрагменты. Подобрать протоспейсер в некоторых случаях помогает и эффекторный белок. Белки выбирают участки рядом с особой последовательностью PAM (protospacer adjacent motif) — всего несколько нуклеотидов, но неодинаковых для разных CRISPR-систем. Затем эти же адаптационные белки встраивают фрагмент в CRISPR-кассету, всегда с одной стороны — у лидерной последовательности. Так образуется новый спейсер, а заодно с ним — и новый повтор. Весь этот процесс называют адаптацией, или приобретением, а по сути это — запоминание врага. Информацию обо всех запомнившихся врагах получает при делениях всё потомство клетки.
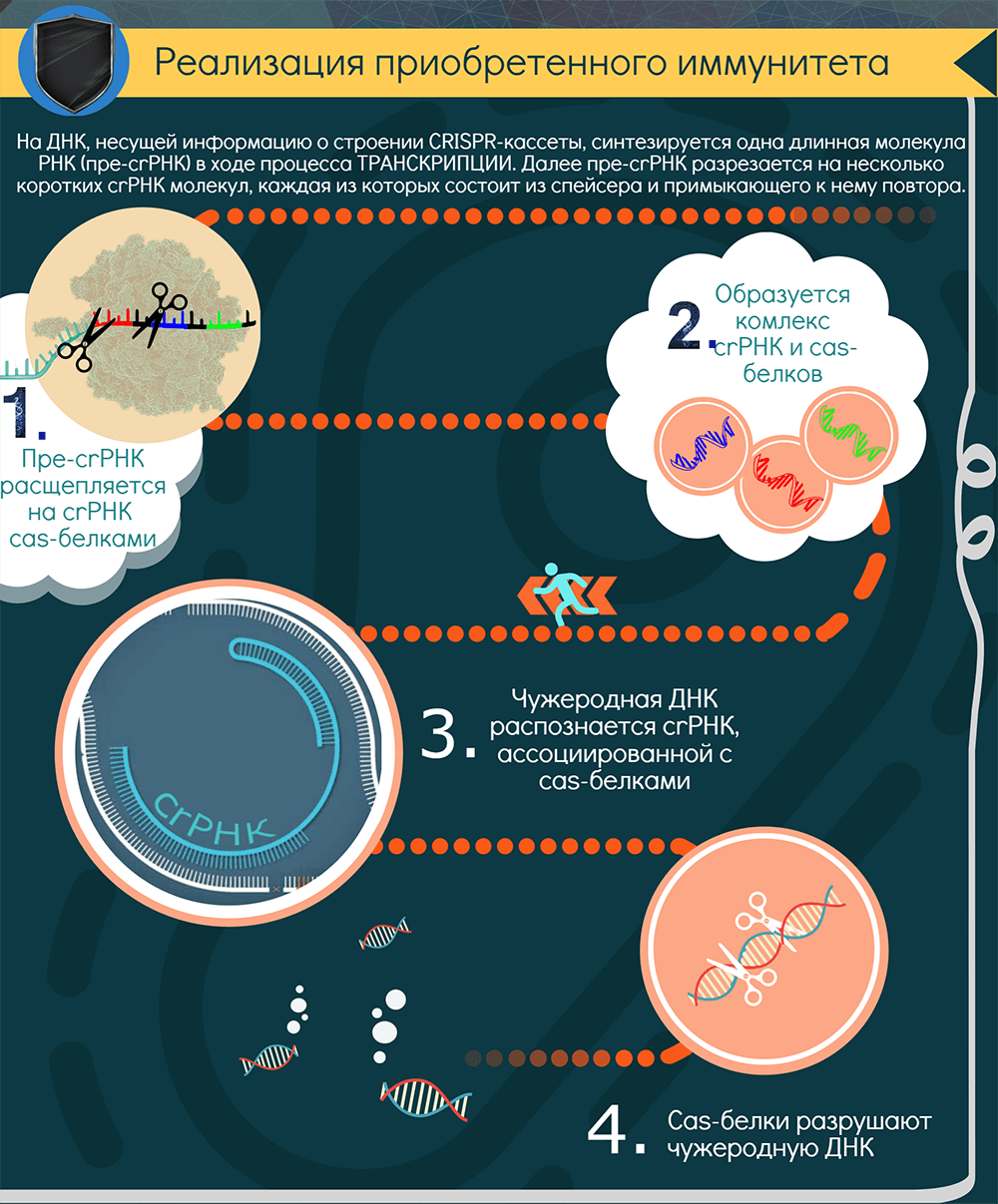
Как реализуется CRISPR-опосредованный иммунитет?
Для поиска повторно вторгающихся агентов CRISPR-кассета должна экспрессироваться. В результате ее транскрипции образуется длинная молекула РНК — pre-crРНК. С помощью РНКазы III и, как правило, Cas-белков транскрипт нарезается по повторам на отдельные crРНК — молекулы, содержащие один спейсер и кусочки окружающих его повторов (один из них длиннее). В системах II типа для этого процесса, называемого созреванием, необходим еще один участник — tracrРНК (trans-activating CRISPR RNA), которая закодирована рядом с cas-кластером [12].
Далее у систем I класса crРНК взаимодействует с комплексом Cas-белков, а у систем II класса crРНК либо дуплексы tracrРНК-crРНК связываются с одним белком-эффектором, например Cas9. Так образуется интерференционный функциональный модуль — рабочая иммунная единица, состоящая из направляющей РНК и эффекторного белка (или комплекса). Совокупность таких единиц «сканирует» клетку в поисках интервентов.
При обнаружении комплементарной crРНК последовательности, то есть протоспейсера, модуль «слипается» с ней и определяет, не помечена ли она как «своя», клеточная. Если нет, и если к ней прилегает тот самый PAM, то эффекторный белок, который представляет собой эндонуклеазу, разрезает обе цепи ДНК в строго определенных местах. Весь процесс называется интерференцией. В особом случае, у системы VI типа, происходит РНК-интерференция, потому что эффекторный белок является рибонуклеазой и разрушает РНК. Так или иначе, атакованные фаги или плазмиды выводятся из строя. Ну и появляется лишняя возможность «наворовать» новые спейсеры.
Какие проблемы могут возникнуть при реализации иммунного ответа? Не исключено, что по мере удаления от лидерной последовательности, то есть от CRISPR-промотора, шансы спейсера транскрибироваться и созреть уменьшаются. Кроме того, есть мнение, что удаленные спейсеры со временем могут накапливать мутации, препятствующие эффективной интерференции с мишенью, или вовсе удаляться. Но раз адаптация новых спейсеров происходит вблизи промотора, удаленные спейсеры представляют собой фото агентов, давно не нападавших на эту клеточную линию, и в постоянной боеготовности по отношению к ним клетка не нуждается. Настоящей же проблемой могут стать даже однонуклеотидные мутации мишени. В общем, комплементарность в этом деле превыше всего.
А не приручить ли нам чужой иммунитет?
Детально изучив принципы работы стрептококковой системы CRISPR-Cas9 (II тип), ученые подумали: а почему бы не попробовать с ее помощью корректировать геномы других организмов? Появились новые надежды относительно лечения генетических (и не только) заболеваний человека, ведь этот способ редактирования in vivo мог оказаться эффективнее уже вовсю тестируемых в то время нуклеаз ZFN и TALEN [13].
Получилась простая и, что немаловажно, дешевая двухкомпонентная система: ген cas9 и CRISPR-кассета транскрибируются в клеточном ядре выбранного организма, CRISPR-транскрипт нарезается на отдельные sgРНК, которые объединяются с белками Cas9 и ищут цель. Когда sgРНК находит комплементарный участок в геноме организма, Cas9 разрезает «натупо» обе цепи ДНК. Всё, работа CRISPR-системы на этом окончена. Теперь эстафета передается репарационным системам самогό организма. Они решают, как лучше залатать разрез: то ли просто сшить куски (это будет негомологичное соединение концов, NHEJ), то ли, если есть подходящая матрица с флангами, комплементарными участкам ДНК с двух сторон от разрыва, поставить «заплатку» (это будет гомологичная рекомбинация). Так вот, первый вариант выгоден, если нужно что-то вырезать, второй — если нужно что-то вставить или заменить дефектный участок ДНК на нормальный, который просто вводят на подходящем векторе. Иногда используют гомологию с парной хромосомой, если на ней нужный локус не дефектный.
Разумеется, технология пока не лишена недостатков. Cas9, например, может проявлять нецелевую активность, «закрывая глаза» на мелкие несоответствия между sgРНК и мишенью. По словам К. Северинова, основная проблема — это биоинформатическое предсказание мишеней, поскольку, помимо наличия участка PAM, необходимо учитывать массу факторов, включая состояние хроматина. Кроме того, сценарий, по которому пойдет репарация разреза, не всегда соответствует желаемому, поэтому сейчас активно ищут факторы, влияющие на выбор этого сценария клеткой. Помимо оптимизации CRISPR-Cas9 и механизмов ее доставки в нужные клетки, ведется апробирование других типов CRISPR-систем [14].
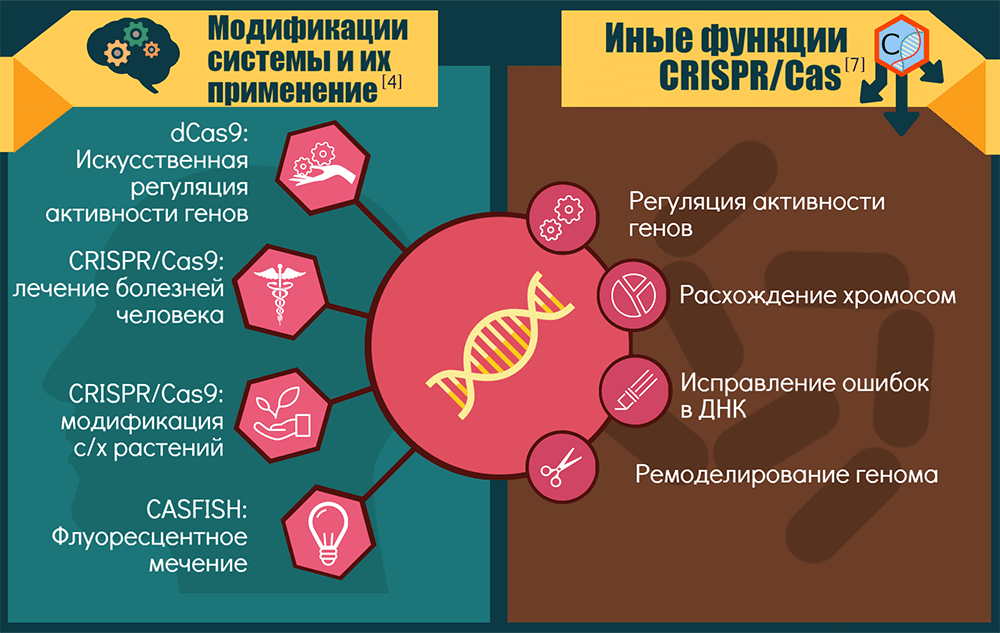
Спектр применений CRISPR-Cas9 и ее модификаций
Точки приложения CRISPR-технологии можно условно объединить в три крупные группы: «CRISPR — для исследований», «CRISPR — для биотехнологий» и «CRISPR — для терапии».
1. «CRISPR — для исследований». Технология позволяет изучать роль конкретных генов в процессах развития и жизнедеятельности организмов. Как вариант — устанавливать роль генов и их перестроек в возникновении и прогрессировании генетических болезней и рака: этот инструмент позволяет создавать прекрасные модельные системы [15].
Если Cas9 лишают одного нуклеазного домена, то белок становится никазой (nCas9) — режет только одну цепь ДНК, — а если лишают сразу двух, то белок становится инактивированным, или «мертвым» (dead, dCas9). Такой белок ничего не режет, зато систему CRISPR-dCas9 можно использовать для репрессии целых наборов генов или как платформу для конструирования более сложных регуляторных и модифицирующих комплексов. Например, если к ней привязать активирующий домен, то экспрессия целевых генов активируется. Для эпигенетической модификации нужных зон достаточно добавить модифицирующий домен. А пометив dCas9 флюоресцентными белками [16], можно визуализировать разные области хромосом. Ясно, что регуляторные возможности системы будут востребованы и в медицине. Кроме того, разные варианты CRISPR-Cas открывают новые возможности для скрининга мишеней лекарств [1].
2. «CRISPR — для биотехнологий». Здесь речь идет о применении CRISPR-Cas9 как минимум для трех целей:
3. «CRISPR — для терапии». Здесь пределов для фантазии, кажется, и вовсе нет. Если говорить о наследственных заболеваниях, то CRISPR-Cas9 в культурах клеток или животных моделях уже «примерили» для серповидноклеточной анемии и β-талассемии, M2DS-синдрома и миодистрофии Дюшенна, муковисцидоза (исправили мутантный CFTR-локус в кишечных стволовых клетках человека) и тирозинемии, катаракты (у мышей устранили доминантную мутацию в гене Crygc) и пигментного ретинита. Вообще, болезни глаз сейчас в центре внимания, потому что в глаза генетические конструкции легко доставлять [14].
Преимущества коррекции генома в зародышевой линии (как совокупности любых генеративных клеток, связывающих друг с другом поколения организмов) и стволовых клетках очевидны, но даже изменения, вносимые в соматические клетки уже развитых органов, дают эффект. Особенно если речь идет о борьбе с болезнями печени и мышц. О результатах терапевтического применения CRISPR-Cas9 в разных типах клеток рассказывает свежий обзор [21].
Отдельное перспективное направление — борьба с хроническими вирусными заболеваниями типа гепатитов и ВИЧ-инфекции. Если возбудитель сохраняется в организме в виде провируса (вирусной ДНК, встроенной в клеточный геном), то его можно просто вырезать. Именно так и поступил коллектив биологов из США, избавив лимфоциты человека от ВИЧ (об этом сообщили сразу две «биомолекулярные» статьи: «Битва века: CRISPR VS ВИЧ» [22] и «CRISPR/Cas9 как помощник в борьбе с ВИЧ» [23]). Правда, ВИЧ — объект крайне изменчивый, и с ним еще придется поломать копья.
Можно помечтать, что в терапии опухолей найдут применение варианты недавно описанной CRISPR-системы VI типа — той, что уничтожает только РНК, причем, как оказалось, любую клеточную РНК без разбора: запустить такую систему в раковую клетку — это как наслать на нее проклятье [14].
CRISPR-Cas — это не только иммунитет
Оказывается, для бактерий и их эволюции эта система значит намного больше.
Неканонические активности CRISPR-систем или их отдельных компонентов возникали как побочные продукты их иммунной функции либо как самостоятельно отбираемые признаки. Скорее всего, CRISPR-кассеты и Cas-белки когда-то работали порознь, причем исходная задача последних состояла в регуляции экспрессии генов и репарации ДНК [7]. Современные компоненты CRISPR-Cas замечены:
Инфографика выполнена совместно с Павлом Чирковым, магистром факультета политологии Санкт-Петербургского государственного университета. Одним файлом ее можно скачать здесь.
CRISPR/Cas9: Что он лечит, а главное — как?
[mybigtext]Человек многое заимствует у природы. Ласты в свое время были скопированы с перепончатых лап водоплавающих птиц, рубка деревьев ударами под углом взята у бобров, а приборы ночного видения вдохновлены устройством глаз змей. Такие природные технологии восхищают своей сложностью и при этом изящной простой. А что насчет микромира? Идея заимствовать что-то у бактерий и микроорганизмом казалась сомнительной еще 20 лет назад, сейчас на этом основана одна из самых перспективных технологий генной терапии — CRISPR/Cas9. О нем пишут в новостях, но что это и как работает — знают немногие. Так давайте разберемся.[/mybigtext]
Что значат эти буквы
Непосвященного человека в ступор ставит уже название технологии: CRISPR/Cas9. Выглядит, как длинная аббревиатура, набор букв или в крайнем случае инвентарный номер.
На самом деле, в этом названии практически исчерпывающе зашифрован принцип действия революционного метода.
[simple_tooltip content=’читается как «криспер»’]CRISPR[/simple_tooltip] — Clustered Regularly Interspaced Short Palindromic Repeat, то есть, по-русски, короткие палиндромные кластерные повторы. Мягко говоря, малопонятное словосочетание, но, как будет видно дальше, оно скрывает в себе центральный элемент всей технологии.
А Cas9 — это название белка, который умеет разрушать вредоносную ДНК, то есть он — главный «боец».
История открытия и принцип работы
Вариант тут только один — исправить генетическую структуру человека вручную. Но как? На помощь пришли бактерии.
Все началось в конце 80-х, когда японские ученые [simple_tooltip content=’расшифровали’]секвенсировали[/simple_tooltip] геном кишечной палочки. Их заинтересовал участок, в котором был набор повторяющихся последовательностей ДНК, разделенных различными участками-спейсерами. Специалистов привлек тот факт, что этот участок не кодировал ровным счетом ничего.
В 1960-х для тех последовательностей ДНК, которые не кодируют белков, ввели обидное, а как оказалось, и далеко не точное название — «мусорная ДНК». Дело в том, что большое количество [simple_tooltip content=’место гена’]локусов[/simple_tooltip] в геноме неизбежно ведёт к снижению приспособленности, а следовательно — к вымиранию. Японский ученый Сусуму Оно даже назвал точный предел объема генома для млекопитающих — 30000 локусов, и был прав: у человека, например, их всего 20000.
Все сказанное выше справедливо и для бактерий: лишние участки ДНК, которые ничего не кодируют, не нужны, как считалось раньше. А бактерии, в силу, в принципе, небольшого генома, относятся к своим локусам особо экономно. Значит последовательность зачем-то нужна бактерии?
Потом такие повторяющиеся цепочки кассет и спейсеров нашли у других бактерий, и стало понятно, что тут точно действует какой-то механизм, а не случайная мутация. Название CRISPR — «короткие палиндромные кластерные повторы» — точно описывает суть явления. Они и правда короткие: те участки, которые разделены спейсерами, повторяются, а по своей структуре эти «повторы» симметричны — читаются одинаково в обе стороны. В русском языке предложения типа «А роза упала на лапу Азора» читаются одинаково в обе стороны и называются палиндромами, вот и генетика решила позаимствовать этот термин.
Бактериальный иммунитет и йогурт
Итак, у нас были бактерии с CRISPR и не было понимания, для чего он нужен. Тем не менее информация о повторяющихся некодирующих участках копилась, и по их виду даже начали классифицировать микроорганизмы. Это стало удобным способом для защиты авторских прав на бактерии в кисломолочной промышленности: компания Danisco с помощью типирования своих штаммов по виду их CRISPR легко смогла выигрывать суды у тех, кто пользовался их патентами. Сами не зная того, Danisco внесли вклад в борьбу с болезнями, на след которых мы могли не напасть еще долго.
[mydoubleline]Danisco — датская пищевая компания, которая, помимо всего прочего, занимается производством пищевых заквасок. У компании внушительный пакет патентов — около 9300 штук.[/mydoubleline]
У Danisco была вполне практическая цель — заполучить бактерии, устойчивые к вирусам. Дело в том, что ферментация в промышленных масштабах происходит в огромных чанах с молоком, куда добавляют молочнокислые бактерии. Но если в [simple_tooltip content=’тот самый чан’]ферментер[/simple_tooltip] попадет вирус-бактериофаг, то ферментация нарушится, и будут убытки. Нужны устойчивые образцы. Как их заполучить? А просто: отобрать в лабораторных условиях такие бактерии, которые могут расти в присутствии вируса.
Danisco выращивала вирусостойкие бактерии и раньше, но до прорыва оставался один шаг. Случился он, когда специалисты обнаружили, что у устойчивых бактерий в последовательности CRISPR появились спейсеры, которые идентичны геному вируса. Последовал эксперимент, и организмам в CRISPR вживили кассеты генома вируса. В результате чего бактерии стали вирусостойкими. CRISPR освободился от звания «мусорной ДНК» — его истинная суть состояла в том, чтобы копировать участки вируса, выполняя роль иммунной системы.
Cas9: ДНК-скальпель
Еще до изысканий Danisco о защитных свойствах CRISPR говорил биоинформатик Евгений Кунин, который предложил детальную модель работы иммунной системы бактерий. По его мнению, бактерия, пережившая атаку вируса, копировала часть его генома, записывая новые блоки в последовательность CRISPR. Кунин обратил внимание на то, что рядом с CRISPR-кассетами часто располагается белок Cas. Он предположил, что Cas обнаруживает вирус по РНК-копии, синтезированной с CRISPR, а когда обнаруживает, то расщепляет его. Говоря проще, Cas — полицейский, CRISPR — база данных, РНК-копия — фоторобот или ориентировка, а вирус — преступник-рецидивист, который решил повторить своё злодеяние. Своё исследование Кунин опубликовал в ряде научных журналов, но фурора не вызвал. Теперь, после исследования Danisco и исследований, параллельных ему, был собран реальный фактический материал, и научное сообщество зашевелилось.
Еще один шаг в нужную сторону сделала Эммануэль Шарпентье, которая нашла тот самый девятый Cas. В прочих системах CRISPR, которые кодируют белки Cas, действовала целая система, если хотите — отдел полиции. Один белок обнаруживает вирус, другой синтезирует РНК, третий кусает. А Шарпентье нашла такой участок, который кодирует всего один белок, и он делает все сам. И если прочие системы были отделами полиции, то Cas9 — Раст Коул, который борет злодея в одиночку, да простит меня персонаж Вуди Харрельсона.
Дальше — больше, и специалистами была предложена схема, при которой РНК CRISPR кодируется не природными кассетами, которые содержит геном бактерии, а с помощью управляемой человеком ферментации. То есть белок Cas9 уже работал не по наводке природной РНК, а по той схеме, которую выбирал человек. И если запрограммировать CRISPR так, как надо нам, он в теории может разрезать мутировавший ген, отвечающий за болезнь.
Комплекс CRISPR/Cas9
От теоретических выкладок и экспериментов пищевых компаний CRISPR/Cas9 прошел путь до одной из самых востребованных технологий в генной терапии. Но основная битва у нас еще впереди. Технологии предстоит обрасти деталями и научиться сверхточному действию, прежде чем мы сможем победить генетические заболевания.
В идеале все выглядит так: больному, скажем, гемофилией, вводят бактерии с CRISPR, кодированным правильным образом. Cas9, пользуясь синтетической РНК, обнаруживает зараженные участки и разрезает их. Затем мы заменяем разрезанные участки на здоровую ДНК. Или она сама восстанавливается, используя схемы из здоровой парной хромосомы.
Сложность возникает с заболеваниями, к которым пока не могут найти четких участков генома. В их числе алкоголизм и шизофрения: у них есть явная генетическая база, но исследования постоянно опровергают друг друга, предлагая разные участки генома в качестве ответственного за недуг. У таких болезней непонятно, что нужно резать и как кодировать CRISPR.
Практического применения у технологии пока немного — нужно тщательно изучить детали, обезопасить пациента и повысить эффективность. Но есть и хорошие новости: например, в Китае с помощью CRISPR/Cas9 вылечили около 10% эмбрионов с болезнью крови [simple_tooltip content=’заболевание, при котором снижается синтез полипептидных цепей, входящих в структуру нормального гемоглобина’]бета-талассемией[/simple_tooltip]. Кстати, болезни крови — первая мишень для CRISPR/Cas9, в них достаточно исправить генетический дефект кроветворной системы. А с этим вполне можно справиться.
Послесловие
Безусловно, CRISPR/Cas9 «хайпанул» в мире науки. О нем теперь знают многие, и многие возлагают надежды на то, что он поборет ранее неизлечимые болезни. Пока идут споры и пишутся статьи, ученые дорабатывают технологию, узнают, что она может и чего не сможет никогда. Хотелось бы верить, что за теоретическим прорывом будет прорыв практический, и поколение второй половины XXI века не будет знать о лейкемии и гемофилии, как мы не знаем о чуме и оспе благодаря прививкам. Будущее покажет.
CRISPR/CAS9: что значит для человечества переход от чтения генома к его редактированию?
Технология CRISPR / Cas9, позволяющая вносить изменения в геном высших организмов (в том числе человека) стала в последние годы одной из самых обсуждаемых — не только молекулярными биологами, но и биотех-инвесторами, медиками, социологами — тем. Все дело в том, что CRISPR/Cas9 потенциально имеет перспективы применения для борьбы с многими тяжелыми заболеваниями, среди которых рак, наследственные болезни, ВИЧ. Если раньше генетические технологии применялись в первую очередь для диагностики, то теперь мы впервые подошли к новому рубежу — у нас есть инструмент редактирования ДНК, который, возможно, получит все больше внедрений в клиническую практику и программы лечения. Хотя ранее попытки редактирования генома уже были (например, для больных лейкемией) именно CRISPR/Cas9, как более универсальный инструмент, претендует на создание инструментов для все более активных внедрений. Старт дан: в Китае уже делают первые шаги в клинических испытаниях технологий, основанных на CRISPR/Cas9. Растущие возможности генной терапии ставят перед нами все больше вопросов, связанных с этикой. Чего ждать?
CRISPR/ Cas 9 — «ножницы» вместо «ножа» для ДНК
Способы редактирования генов в геномах живых существ изучаются с начала XX века – еще с открытия механизма индуцированного мутагенеза (то есть вызванного воздействием каких-нибудь внешних агентов – например, радиоактивного излучения или химических веществ). И если для бактерий механизмы достаточно точного модифицирования генов разработаны еще в середине XX века, то для более сложных организмов, в частности, человека, подходы появились лишь в конце прошлого века. Например, целое семейство вирусов, называемое ретровирусами (к которым относится и ВИЧ, вызывающий СПИД у человека), от природы получило механизм, согласно которому для функционирования вируса требуется встраивание его генома в геном организма-хозяина. Путем введения модификаций в геном ретровируса, то есть вставки измененных человеческих генов, можно добиться внедрения в геном хозяина таких квазичеловеческих элементов – вот и готовый механизм геномного редактирования. Существенным его недостатком является отсутствие специфичности встраивания, то есть вирусный геном может попасть в любой участок генома хозяина, а может и вообще не попасть. Для научных изысканий это нестрашно – всегда можно повторить эксперимент. Но для целей лечения конкретных пациентов подход с «повторить», как правило, не работает.
Другие способы модификаций генома связаны с технологиями ZFN и TALEN, активно обсуждаемые начиная с 2000-х годов. Идея этих подходов основана также на природных свойствах определенных белков, называемых нуклеазами. Эти активные белки (ферменты) умеют проводить специфическое, неслучайное вырезание участка исходного генома и встраивание в место разреза привнесенного с собой кусочка исправленной ДНК. Такой способ позволяет проводить целевую, гораздо более точную, чем просто ретровирусная, модификацию «сломанных» генов. Отличие ZFN и TALEN заключается в использовании разных видов ферментов, но итог их работы примерно одинаков.
В 2015 году технологию ZFN удалось успешно применить для терапии ВИЧ: в стволовых клетках донора был отредактирован участок, отвечающий за восприимчивость ВИЧ, затем они были трансплантированы пациенту. Стоит отметить, что примерно у каждого тысячного европейца имеется такой генотип, который гарантирует невозможность внедрения вириона (активной вирусной частицы, которая осуществляет заражение) внутрь клеток организма-хозяина, то есть невозможность инфицирования.
Но ZFN и TALEN оказались далеки от массового применения в медицине. Ученые пытались научить их узнавать специфическую, в идеале — любую заданную последовательность ДНК для «кусания». Иногда это работало, но для каждой последовательности приходилось создавать свой отдельный белок, а это кропотливая и долгая работа.
Пока неочевидно, какие технологии геномного редактирования будут наиболее активно применяться в медицине уже через 10 лет. Возможно, это будет CRISPR/ Cas 9 или текущие аналоги, а может быть, будет открыта новая технология, которая возникнет так же неожиданно и ярко, как CRISPR/ Cas 9.
А пока между двумя научными группами, которые в 2012 году одновременно нашли способ применения CRISPR/Cas9 для точечного редактирования геномов сложных организмов, идет патентная война. Группа в Калифорнийском университете в Беркли и группа из MIT и Broad Institute (институт MIT и Гарварда), подавшие заявки на патент в разное время в 2013 году, тратят десятки миллионов долларов на юристов и вряд ли остановятся — на кону миллиарды долларов, которые может принести технология. По прогнозам, патентный офис примет решение в 2017 году.
Применение и этические вопросы
Среди потенциальных применений новой технологии — лечение наследственных заболеваний (гемофилия, бета-талассемия, мышечная дистрофия), терапия онкологии и вирусных инфекций, включая ВИЧ.
Но есть и более экзотические потенциальные применения. Например, борьба с мультифакторными заболеваниями (диабет, шизофрения и др.) или редактирование эмбрионов при искусственном оплодотворении для подбора определенной внешности у детей. Именно здесь возникает множество этических вопросов, которые начали обсуждаться, но пока так и не получили консенсусного решения у мирового сообщества. Когда же можно, а когда нельзя применять редактирование генома? Пока, в отсутствие у человечества единой позиции, каждая из стран решает это по-своему.
Например, мир потрясли уже два исследования китайских ученых. В 2015 году группа китайских ученых применила геномное редактирование на 86 человеческих эмбрионах для того, чтобы изменить мутации, вызывающие тяжелую наследственную патологию бета-талассемию. Это тяжелая наследственная патология, которая связана с нарушением синтеза гемоглобина и разрушением эритроцитов, средняя продолжительность жизни носителей мутации — 17 лет. Несмотря на серьезную научную значимость исследования китайских ученых, два главных научных журнала Nature (Великобритания) и Science (США) отказались публиковать результаты, в частности из-за этических вопросов. Также это исследование показало неидеальность технологии CRISPR/Cas9, по крайней мере на данный момент. Из 86 эмбрионов точно поменять желаемый участок ДНК получилось только у 28. Процент ошибки оказался больше, чем ожидали исследователи исходя из опытов над эмбрионами животных. Какой участок ДНК нужно редактировать, определяется при помощи синтетической последовательности РНК (так называемый «гид»). Она комплементарна нужному участку ДНК. Но может оказаться, что в другой части генома также есть аналогичная последовательность нуклеотидов.
Исследование вызвало множество дискуссий. Должны ли западные страны очень аккуратно относиться к этическим вопросам при применении новых технологий геномного редактирования, либо же это приведет только к отставанию от Китая? По всей видимости, пока Запад рассматривает возможность терпимее относиться к генетическим модификациям — менее чем через полгода после скандальной публикации китайских исследователей в Великобритании были официально разрешены первые опыты по геномному редактированию эмбрионов человека, в Лондоне новые группы ученых уже ведут работу над дизайном новых экспериментов.
А в середине ноября группа китайских ученых анонсировала применение генной модификации клеток при помощи CRISPR/Cas9 для лечения пациента с агрессивным раком легкого. В журнале Nature эта статья анонсирована с подзаголовком: «Шаг китайских ученых может разжечь борьбу между Китаем и США в сфере биомедицины». Мир ждет результатов второго исследования китайских ученых.
Однако в будущем этических вопросов, связанных с новыми технологиями в области генетики и репродукции, будет еще больше. Биоэтика становится все более важной дисциплиной.
Например, у некоторых европейцев есть мутации в гене CCR5 — ее носители практически невосприимчивы к ВИЧ. В рамках генетического тестирования эти мутации могут быть исследованы. Но этично, корректно ли рассказывать человеку о наличии такой мутации? Мы, как компания, которая занимается генетическими тестами, решили, что нет.
Другие проблемы связаны с тем, что возможности генетического редактирования меняют само понятие семьи. С появлением искусственного оплодотворения и суррогатного материнства в принципе понимание института семьи усложнилось. Теперь у некоторых детей помимо отца могут быть две матери: суррогатная и «юридическая». А если для зачатия используются яйцеклетка и сперматозоид пары, которые затем переносятся в суррогатную мать, у ребенка тоже две матери — генетическая и суррогатная. Теоретически возможны ситуации, когда юридическая, генетическая и суррогатная мать — это три разных человека.
Юридические нюансы, возникающие в подобных случаях, уже получают оценки. Например, « Baby M Case »: у Элизабет Стерн был рассеянный склероз, который несет много рисков при беременности, поэтому семья Стерн обратилась в один из медицинских центров в Нью-Йорке для суррогатного материнства. Использовался генетический материал отца. Между сторонами был подписан договор, что юридическими родителями будут Стерны. Но вскоре после рождения суррогатная мать Мэри Бет Вайтхед под угрозой суицида потребовала вернуть ей ребенка. В дело включились полиция и суд. В итоге суд признал Стернов официальными родителями ребенка, но дал суррогатной матери возможность посещения ребенка. Интересно, что основной мотивацией суда было преследование «лучших интересов ребенка». В другой схожей истории, тоже произошедшей в Нью-Йорке, суд рассудил иначе: двое родителей лучше трех, решил суд, отказав в правах посещения ребенка суррогатной матери. Есть деталь: во втором случае пара использовала собственные яйцеклетку и сперму, которые были перенесены в суррогатную мать.
«Офшоры» для геномного редактирования
Недавно мир потрясло рождение ребенка от трех генетических родителей: в апреле 2016 года появился на свет ребенок, зачатие которого происходило с использованием митохондриальной ДНК третьего человека. Такая процедура была необходима, так как у матери ребенка есть патогенные мутации в митохондриях (органеллы внутри клеток человека, отвечающие за обеспечение клеток энергией, обладают собственным небольшим геномом, передаются ребенку от матери), которые могли привести к появлению у ребенка синдрома Лея, наследственному заболеванию, связанному с поражением ЦНС и энцефалопатией. Два первых ребенка матери погибли от синдрома Лея. Американский врач Джон Чанг, из клиники в Нью-Йорке вместе с родителями из Иордании прибыли в Мексику. И в Иордании, и в США подобные модификации генетического материала были запрещены.
Получается, в современном мире появляются «биомедицинские офшоры». Люди едут в страны с лояльным законодательством для осуществления процедур, неоднозначных с точки зрения этики и допустимости законодательством той или иной страны. Генная терапия уже становится в центре подобных «спорных» случаев. Например, американка Лиз Пэрриш утверждает, что прошла в Колумбии процедуру по редактированию специальных участков ДНК-теломер при помощи вируса. Длина теломер коррелирует со старением. Пэрриш стала первым человеком, решившимся на генетическую терапию для борьбы со старением, до нее эксперименты проводились только на животных. Научное сообщество отнеслось к самовольным клиническим испытаниям Пэрриш неоднозначно, многие подвергли ее действия критике.
В целом на данный момент мировое сообщество с очень большой осторожностью относится к редактированию генома, когда оно не связано напрямую с лечением тяжелых заболеваний, которые нельзя вылечить иным способом. Дело в том, что технологии еще несовершенны и не максимально специфичны. Так, в уже упомянутом эксперименте китайских ученых над эмбрионами в ДНК многих эмбрионов изменились не только участки, которые планировали изменить ученые, но и другие, случайные. Или, например, когда во Франции генную терапию решили применить для лечения врожденного X-сцепленного иммунодефицита, в ходе клинического испытания неожиданно в качестве побочного эффекта у больного развилась лейкемия.
Ребенок на заказ
В целом медицинское и научное сообщество сейчас более лояльно к генной терапии, которая будет влиять только на генетический материал самого человека. Генные модификации, которые передавались бы детям, все еще изучены недостаточно и остаются в «серой зоне». Но в определенной степени выбор определенных черт ребенка с помощью генетических технологий доступен уже сейчас.
В ходе искусственного оплодотворения можно пройти процедуру преимплантационной генетической диагностики или преимплантационного генетического скрининга. При ЭКО (искусственном оплодотворении, вне тела матери, с последующим переносом 2-5-дневного эмбриона в полость матки) на сегодняшний день оплодотворяется несколько яйцеклеток. Можно исследовать геном каждой из них и выбрать наиболее «подходящие» эмбрионы. Такая процедура уже довольно активно используется для профилактики тяжелых наследственных патологий у семей с соответствующими рисками. Однако данная технология, очевидно, может быть применена для выбора черт, не связанных со здоровьем — например, цвета глаз или волос. Это, безусловно, несколько пугающая ситуация, заставляет задуматься о способах применения новых генетических технологий для евгеники, для других манипуляций, описанных фантастами в антиутопиях. Разные страны уже вырабатывают позицию по влиянию родителей на генетические данные своих детей.
В Китае, например, запрещено использование преимплантационной генетической диагностики для выбора пола будущего ребенка. Но такая процедура не запрещена в Штатах. Но волнуют китайцев этические вопросы или для подобного законодательного регулирования важнее демографические причины — большой вопрос.
Но важно, чтобы свои взгляды на границы генетических вмешательств сформировали не только правительства, но и обычные люди. Иначе мы рискуем оказаться в ситуации неосведомленности населения о базовых принципах генетических технологий и распространения предрассудков. Недавняя волна заявлений об опасности ГМО для человека — яркое тому подтверждение. Один из опросов в Казани, например, показал, что почти половина респондентов считают, что «любые пищевые продукты, содержащие гены», должны быть изъяты из продажи и не должны импортироваться или производиться в стране. Очевидно, что гены есть в любом живом организме, так что такие результаты исследования просто плачевны. Впрочем, 15% опрошенных честно признались, что не представляют себе, что такое ГМО. Ученым, биомедикам и просто тем, кто верит в то, что технологии делают нашу жизнь лучше, теперь нужно сделать все, чтобы генетическое редактирование человека не столкнулось с той же волной необоснованной паники, а стало действительно эффективным инструментом в борьбе с болезнями.