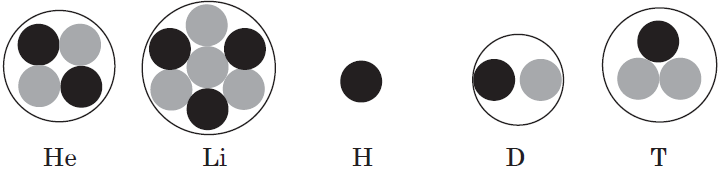
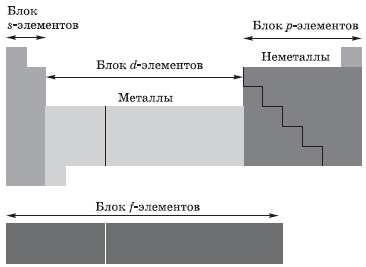
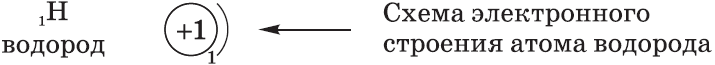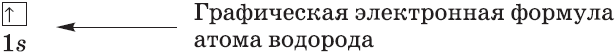Что значит сходная конфигурация внешнего энергетического уровня
Электронная конфигурация атома
Теория к заданию 1 из ЕГЭ по химии
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
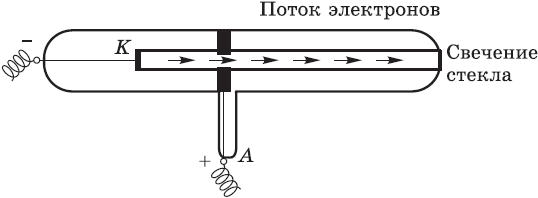
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
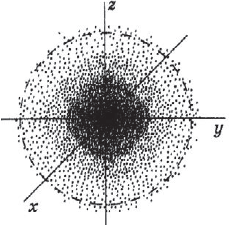
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
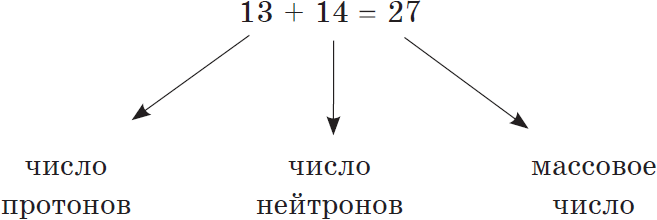
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Например, число нейтронов в атоме железа равно:
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
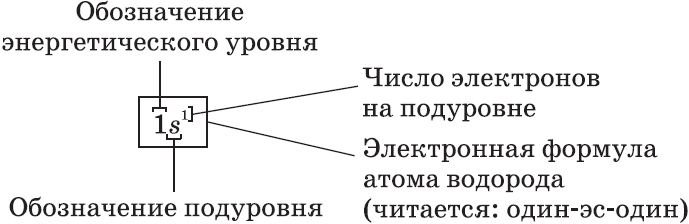
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
Элементы второго периода.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙<11> | 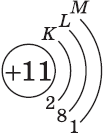 | $1s^2<2>s^2<2>p^6<3>s^1$ | 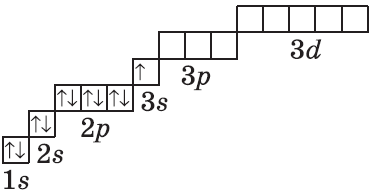 |
| $↙<13> | 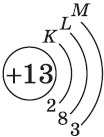 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^1$ | 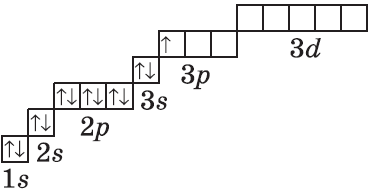 |
| $↙<18> | 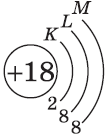 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^6$ | 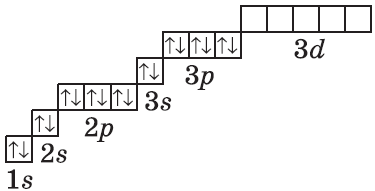 |
Элементы четвертого периода.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
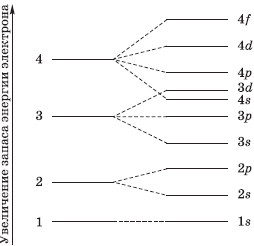
На рисунке показана схема деления энергетических уровней на подуровни.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
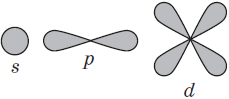
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Задание 1. Электронная конфигурация. ЕГЭ 2022 по химии
Теория к 1 заданию: читать
Задачи для практики
Задача 1
Решение
Электронная конфигурация ns 1 np 3 nd 1 в возбужденном состоянии показывает, что на внешнем слое у атома будет расположено 5 электронов, значит нужны элементы из пятой группы главной подгруппы, таких три: азот, фосфор и мышьяк. Однако атом азота не может переходить в возбужденное состояние, так как на втором энергетическом уровне нет d — подуровня, следовательно, ответ: фосфор и мышьяк.
Задача 2
Решение
Анионы образуются из нейтральных атомов неметаллов при присоединении электронов:
Вывод: правильные ответы — 1, 2.
Задача 3
1) Al 2) S 3) P 4) Cr 5) Si
Определите, атомы каких из указанных в ряду элементов в основном состоянии во внешнем слое содержат один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Решение
Здесь лучше всего расписать конфигурации атомов, но можно и запомнить, что 1 неспаренный электрон на внешнем уровне имеют атомы элементов 1,3 и 7 групп или атомы элементы с провалом электрона. В 3 группе находится алюминий (3s2 3p1), а у хрома имеется провал электрона (3d5 4s1)
Задача 4
1) Mg 2) Bi 3) Ba 4) Sr 5) Al
Решение
Задача 5
1) I 2) N 3) Br 4) P 5) Cl
Решение
Задача 6
1) Bi 2) N 3) Br 4) P 5) Cl
Решение
Задача 7
1) K 2) S 3) Na 4) Si 5) Se
Решение
Задача 8
1) S 2) Na 3) He 4) Cl 5) Se
Решение
Задача 9
1) Mg 2) Al 3) Sb 4) N 5) Bi
Решение
Задача 10
1) Cu 2) Te 3) Se 4) Ag 5) O
Решение
Элементы с такой конфигурацией должны находиться в побочной подгруппе, поскольку заполняется d подуровень ( произошел перескок электрона в связи с устойчивостью полностью заполненного d подуровня), поскольку внешних электронов 1, то группа первая. Ищем элементы I группы побочной подгруппы.
Задача 11
1) Ti 2) Cl 3) Zr 4) I 5) F
Решение
Задача 12
1) S 2) K 3) O 4) Te 5) Na
Решение
Задача 13
1) N 2) S 3) P 4) Se 5) As
Решение
Задача 14
1) Mg 2) Cl 3) S 4) Br 5) Ca
Решение
Задача 15
1) Te 2) Be 3) I 4) Ba 5) Sr
Решение
Задача 16
1) Li 2) Se 3) K 4) S 5) Cs
Решение
Задача 17
1) O 2) S 3) N 4) Te 5) P
Решение
Задача 18
1) Ga 2) S 3) B 4) In 5) Se
Решение
Задача 19
1) As 2) Cr 3) Na 4) V 5) Sc
Определите, атомы каких из указанных в ряду элементов имеют 1 неспаренный электрон во внешнем слое в основном состоянии. Запишите в поле ответа номера выбранных элементов.
Решение
Для определения количества неспаренных электронов на внешнем слое нужно представить электронную конфигурацию атома. Атом натрия находится в 3 периоде, поэтому имеет 3 слоя. Всего он имеет 11 электронов, поэтому на последнем слое атом натрия имеет один неспаренный электрон. Атом хрома находится в 4 периоде, он имеет 4 слоя, 3d подуровень заполняется после 4s, но у хрома происходит провал электрона, один электрон с 4s падает на 3d, чтобы быть более энергетически устойчивым, так как в таком случае атом не будет иметь пустых орбиталей на 3d. У мышьяка 3 неспаренных электрона на внешнем слое. У скандия и ванадия их нет.
Необходимо зарегистрироваться
Для доступа к решениям необходимо включить уведомления от группы Турбо в вк — это займет буквально 10 секунд. Никакого спама, только самое важное и полезное для тебя. Ты всегда можешь запретить уведомления.
Теория для 1 задания ЕГЭ по химии
Для правильного выполнения этого задания полезно помнить последовательность заполнения электронами атомных орбиталей, которую легко понять по этому рисунку:
Атом является электронейтральной частицей. Положительный заряд ядра уравновешивается числом отрицательно заряженных электронов, которые движутся в его поле. Заряд ядра атома химического элемента равен его порядковому номеру в периодической системе Д.И. Менделеева. При переходе от одного элемента к следующему заряд ядра увеличивается на единицу. И на единицу возрастает число электронов в атоме. Каждый следующий добавляемый электрон занимает низшую свободную атомную орбиталь.
У атома гелия (заряд ядра +2) следующий электрон займет ту же самую s-орбиталь, однако спин у него будет противоположный (стрелка, изображающая электрон, направлена в другую сторону):
На этом ёмкость 1 энергетического уровня становится полностью заполненной. Поэтому следующий электрон, который появляется у атома лития, займёт s-орбиталь второго энергетического уровня (2s-орбиталь). Его электронная формула записывается:
Правило Хунда: электроны заполняют атомную орбиталь таким образом, чтобы её суммарный спин был максимальным.
Другими словами, при заполнении p, d, f-орбиталей электроны сначала будут занимать квантовые ячейки орбитали по одному, и только потом будут спариваться. По этому поводу можно привести хорошую аналогию: при размещении пассажиров в изначально пустом трамвае, если все люди незнакомы, они будут занимать сначала места по одному, и только когда мест станет не достаточно, незнакомые люди станут занимать места рядом с теми, кто зашел в трамвай раньше. На этом основании запишем электронную конфигурацию атома серы и изобразим распределение электронов по квантовым ячейкам:
В образовании химических связей участвуют только электроны внешнего (валентного) энергетического уровня. В атоме серы таким уровнем является третий. На нём расположено шесть электронов, два из которых не спарены.
Число валентных электронов в атоме равно номеру группы (исключения: атомы кобальта и никеля, у них число валентных электронов равно 9 и 10, соответственно).
Особой энергетической устойчивостью обладают наполовину и полностью заполненные орбитали.
Распределим 24 электрона по орбиталям, пользуясь уже известными нам правилами. Помним, что между 4s и 4p-орбиталями заполняется 3d-орбиталь:
Однако, на d-орбитали не хватает одного электрона до наполовину заполненного состояния. А наполовину заполненные орбитали отличаются пониженной энергией. Всё в мире стремится к минимуму энергии; и атом тоже. Поэтому один электрон с 4s-орбитали перескакивает на 3d-орбиталь, благодаря близости энергий этих орбиталей. В результате реальная электронная конфигурация атома хрома записывается так:
Таким же исключением из правил является атом меди. Ему не хватает одного электрона для полного заполнения 3d-орбитали. И он, как и хром, берет этот электрон с 4-s орбитали:
Пользуясь информацией, изложенной выше, можно легко вычислить число валентных, внешних и неспаренных электронов в атоме и безошибочно выполнить первое задание ЕГЭ, за которое можно получить 1 первичный балл.
Второе вещество — оксид серы(VI). Это кислотный оксид неметалла в высшей степени окисления. Способен реагировать с веществами основной природы — основаниями и основными оксидами. Растворяется в воде с образованием кислоты. Выбираем ряд под номером 2.
Третье вещество — гидроксид цинка. Это амфотерный гидроксид — проявляет как кислотные, так и основные свойства. Реагирует с кислотами и щелочами. Выбираем ряд под номером 4.
Четвертое вещество — бромид цинка. Это средняя соль. Вступает в реакции ионного обмена с кислотами, солями, основаниями, если в результате образуется осадок, газ или слабый электролит. Следует помнить, что если в результате ионного обмена образуется соль слабого основания и слабой кислоты, то она полностью гидролизуется с образованием этих самых слабого основания и слабой кислоты. Также нужно помнить, что галогениды способны вытеснятся из их солей более активными галогенами. Выбираем ряд под номером 1.
Напоследок поговорим о том, как можно осилить это задание, если всё совсем плохо и не получается найти необходимый ряд веществ. Воспользуемся методом исключения! Если в ряду хоть один реагент точно не реагирует с нашим веществом, то этот ряд можно исключить. Разберем на примере серы из задания выше. Из неметаллов только галогены могут вытеснять менее активные галогены из их солей. Другие неметаллы с солями никогда не реагируют. Таким образом нам точно не подходит ряд 1 (нитрат серебра) и ряд 5 (хлорид бария). Из неметаллов только кислород может реагировать с некоторыми оксидами, значит убираем ряд 2 (оксид бария). Ряд четыре не подходит, потому что бром более сильный неметалл, и сера не вытеснит бром из его кислоты. Остается вариант 3))
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.