Что значит электронейтральная частица
Атомы
Атом — это мельчайшая химически неделимая частица вещества, а также наименьшая часть химического элемента, являющаяся носителем его свойств. Химически неделимая означает, что атом в ходе химических реакций не делится на более мелкие части.
Атомы очень маленькие частицы, их размер находится в диапазоне от одного до пяти ангстрем (обозначается — Å.). Один ангстрем — это 10 –10 метра.
Состав и строение атомов
Атомы состоят из ещё более мелких частиц.
Пример. Атом гелия состоит из ядра, в котором находятся два протона и два нейтрона, и двух электронов:
Ядро атома — это центральная часть атома, в которой сосредоточена основная его масса и весь положительный электрический заряд. Ядро атома состоит из протонов и нейтронов.
Протоны и нейтроны имеют общее название — нуклоны.
Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтронов. По величине заряд равен количеству протонов в ядре и совпадает с порядковым номером элемента в периодической системе.
Протоны, нейтроны и электроны имеют общее название — элементарные частицы или субатомные частицы.
| Название | Символ | Заряд |
|---|---|---|
| Протон | p + | +1 |
| Нейтрон | n 0 | 0 |
| Электрон | e | -1 |
Заряд протона и электрона одинаковы по величине, но противоположны по знаку. Любой атом содержит равное число протонов и электронов, значит заряд ядра и суммарный заряд всех электронов атома одинаковы по величине, но противоположны по знаку. Следовательно, атомы являются электронейтральными частицами.
Атомы и электроны
Атомно-молекулярное учение
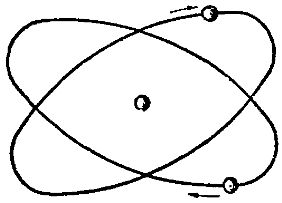
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Атом, электрон и электрическое поле
Весь окружающий нас мир состоит из частиц. К такому выводу пришли древнегреческие ученые, ведь во времена до нашей эры доказательством какого-то суждения служила логично выстроенная философская мысль, ведь физических приборов, таких как электронный микроскоп и масс-спректрограф, не было. Ученые того времени, что скорее являлись философами, рассуждали следующим образом: если взять топор и полено, то можно колоть его на щепки до тех пор, пока не останется неделимая щепочка. Эту щепочку назвали атом, что в переводе с греческого «неделимый». Все уникальные атомы перечислены в таблице Менделеева, а различные их комбинации создают наш удивительный мир и нас самих.
Только в 17-18 веках химики показали делимость атома на еще более мельчайшие, так называемые субатомные частицы. А позднее были открыты составляющие атома:
Для представления структуры атома можно воспользоваться планетарной моделью атома*, названной так по аналогии с Солнечной системой. В центре атома находится массивное* ядро (из протонов и нейтронов), а вокруг него вращаются электроны. Но такая модель противоречит современным законам электродинамики, так как движущиеся частицы излучают энергию, а значит все электроны давным давно попадали бы на ядра (и Вселенной не было бы). Но для наших целей нам вполне можно вообразить себе ядро вмсето Солнца и электроны вместо планет.
Так, например, меньше всего протонов (один) у атома водорода, поэтому он первый в таблице Менделева, а у кислорода протонов 8, и как вы догадались, он восьмой в таблице*.
Остановимся подробнее на электроне, элементарной* частице, имеющей отрицательный электрический заряд*. Название частицы произошло от греческого слова янтарь. Древние греки заметили, что при натирании янтаря кусочком материи, янтарь начинает притягивать к себе небольшие предметы. Это связано с явлением электризации. При трении электроны с одного объекта могут перескакивать на другой. Тело, которое потеряло электроны будет заряжено положительно, тело, которое приобрело излишек электронов – отрицательно.
Масса электрона очень мала, она равна 9∗10−31 кг, то есть 0,0000000000000000000000000000009 кг. Для сравнения масса комара 0,0000007 г, или 780000000000000000000 электронов.
В некоторых веществах электроны могут свободно перемещаться под действием электрического поля. Это упорядоченное движение называется электрическим током. А такие вещества – проводниками электрического тока. Скорость электронов, именуемая дрейфовой скоростью, меньше 0,1 мм/с, что медленне улитки в 20 раз. Но тогда почему, включая свет, даже самый большой зал освещается мгновенно? Все дело в том, что электроны находятся во всем проводнике в огромном количестве, а скорость распространения электромагнитных волн равна скорости света* (300 000 км/c), поэтому замыкая цепь, электромагнитное поле воздействует на все электроны в проводнике практически мгновенно, и те электроны, что находятся ближе всего к лампочке начинают питать энергией лампочку.
Чтобы представить себе насколько огромна скорость света, рассмотрим расстояние от Москвы до Нью-Йорка (7510 км), свету потребуется всего лишь 25 мс, чтобы преодолеть этот путь.
А теперь немного о технической стороне прогресса. Движение электронов в вакууме и управление этим процессом широко применялось в ламповых радиоприемниках, но с приходом транзисторов оказалось никому не нужным, за исключением профессиональных студий с кристальным звуком. Но вакуумные лампы применяются в магнетронах современных микроволновых печей и никакой альтернативы для более быстрого и недорогого разогрева пищи пока нет, хотя к нам уже шагает семимильными шагами технология индукционных плит, но о их работе мы поговорим в последнем разделе о магнетизме.
Корпускулярно-волновой дуализм подтвердили экспериментально. Что это значит?
Иногда вещи, которые на первый взгляд кажутся невероятно простыми, на самом деле оказываются чуть ли не самыми сложными. Взять, к примеру, свет. Древние цивилизации испытывали больше трудностей в понимании его природы, чем в понимании вещества – чего-то, к чему можно прикоснуться. Сегодня мы знаем, что свет – это не только способ переноса энергии от Солнца к Земле, делающей жизнь на нашей планете возможной, но и невидимая сеть из фотонов, которая позволяет электромагнетизму работать на расстоянии. Интересно, что до конца XVII века существовало две противоположные теории света. Так, Ньютон считал, что свет состоит из крошечных частиц, которые он назвал корпускулами. Но другие ученые, включая современников английского физика, полагали, что свет состоит из волн, как рябь, движущаяся по поверхности воды. Многим позже шотландскому физику Джеймсу Клерку Максвеллу удалось объединить Ньютоновские корпускулы и волновую теорию света, создав теорию, в которой эти явления были хорошо собраны воедино.
Перед вами первый в истории снимок света и как волны, и как частицы. Фото сделано в лаборатории Фабрицио Карбоне (Fabrizio Carbone) в Федеральной политехнической школе Лозанны
Интересный факт
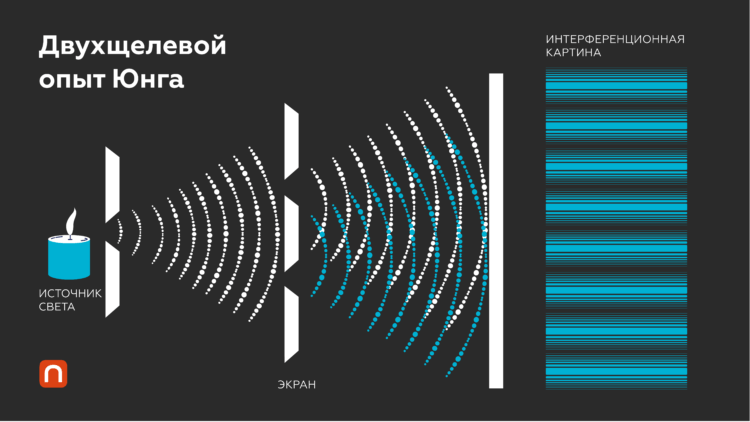
В работе 1801 года английский физик Томас Юнг описал создание двух узких пучков лучей, идущих от одного и того же источника. Опыт показал, что световые волны интерферируют друг с другом, приводя к появлению на экране темных и светлых полос. Используя пару узких щелей Юнг в конечном итоге заставил свет охватить весь листок бумаги.
Природа света
Сегодня мы знаем, что свет может вести себя как частица и как волна. Но достигнуть этого понимания было непросто. Так, к началу XIX века было известно, что волны света могут интерферировать друг с другом (то есть усиливать или ослаблять друг друга).
Если бросить в воду два камушка, в некоторых точках водной глади волны от этих камней будут одновременно подниматься, усиливая друг друга и порождая интенсивную волну. При этом в других точках они будут колебаться в противоположных направлениях и гасить друг друга. В ходе эксперимента Томас Юнг увидел на листе бумаги светлые и темные полосы – это означает, что световые волны подвергались такому же процессу интерференции.
Интерференция волн. Изображение: Юлия Кузьмина для ПостНауки
Основоположником волновой теории света был Христиан Гюйгенс, развивал ее Опасен-Жен Френель, а Джеймс Клерк Максвелл описал электромагнитное поле и электромагнитное излучение в своих уравнениях, сделав возможным понимание природы света. На основе интерференции можно строить голограммы и объяснить интерференцию и дифракцию.
Однако свет можно также рассматривать как поток частиц – фотонов или квантов света. В основе корпускулярной теории лежат идеи Исаака Ньютона. В ХХ веке эти положения развил Макс Планк. Интересно, что используя представление о свете как о потоке частиц, можно объяснить фотоэффект и теорию излучения. В настоящее время считается, что свет может проявлять себя и как волна и как поток частиц.
Корпускулярно-волновой дуализм
Итак, свет может в любой момент времени вести себя как частица или волна, однако демонстрировать одно из двух состояний одновременно он не может. Если эксперимент требовал от него свойств волны, то свет вел себя как волна – и то же самое для частицы. Позже этот принцип стал известен как корпускулярно-волновой дуализм.
Эту по-настоящему странную картину в итоге удалось завершить французскому физику Луи де Бройлю в 1924 году. Если свет, который рассматривается как волна, может вести себя как поток частиц, то, возможно, частицы, например электроны, могут вести так, как если бы они были волнами.
Древние греки считали, что свет является формой огня, предполагая, что он направлялся из глаз к объектам, которые человек мог видеть.
По сути, концепция де Бройля иллюстрировала, насколько квантовая физика подрывала старые предположения, ведь составляющими веществами материи были электроны, или вещества, а фотоны образовывали невидимый свет. И тем не менее, при некоторых обстоятельствах они вели себя как волны, а при других – как частицы. Как только квантовый мир ворвался в мир классической физики, прежние различия стали менее определенными.
Хотите всегда быть в курсе последних новостей из мира науки и высоких технологий? Подписывайтесь на наш новостной канал в Telegram чтобы не пропустить ничего интересного!
Между тем, идея о том, что электроны могут проявлять волновые свойства, отлично вписывалась в модель атома Нобелевского лауреата Нильса Бора. В ней электрон мог занимать только определенные орбитали вокруг ядра и прыгать между орбиталями в квантовых скачках при потере или получении энергии в виде фотона. Напомню, что структура волны электрона, окружающая ядро атома, также известна под названием «орбиталь».
Квантовая революция
Основоположник современной атомной физики, Нильс Бор, пытался разрешить экзистенциальную дилемму квантовой механики. Он изобрел принцип дополнительности, согласно которому в некоторых экспериментах квантовые объекты будут локализованы и действовать как частицы, а в других различных экспериментах точно такой же квантовый объект будет распространяться и действовать как волна.
В 2018 году исследователи из Университета Рочестера в статье, опубликованной в научном журнале Optica, сообщили, что разрешили эту странную и неизбежную корпускулярно-волновую двойственность, обнаружив тесную связь между двойственностью и другой столь же странной особенностью квантовой механики, а именно квантовой запутанностью. Подробнее о том, что представляет собой это удивительное явление, я рассказывала в этой статье.
Ведущий автор исследования Сяофэн Цянь и его коллеги пришли к выводу, что каждая из особенностей квантовой странности — запутанность и двойственность — точно контролирует другую.
Запутанность – это квантово-механическое поведение двух частиц, в котором ни одна из них не может быть описана отдельно, независимо от описания другой, даже если частицы разделены огромным расстоянием. Это то же самое свойство, которое нобелевский лауреат по физике Эрвин Шредингер использовал для объяснения своего знаменитого мысленного эксперимента с участием кошки, счетчика Гейгера и небольшого количества яда в запечатанной коробке.
Совсем недавно запутанность стала важным элементом в продолжающемся развитии квантовых вычислений и квантовой информатики.
Новое открытие вытекает из открытия о двойственности, сделанного Уильямом Вуттерсом и Войцеком Зуреком, двумя аспирантами-физиками Техасского университета в Остине, когда они размышляли о знаменитом эксперименте по оптике, проведенном Томасом Юнгом. В 1979 году Вуттерс и Зурек предсказали, что в одном и том же эксперименте можно измерить как волнообразное рассеяние, так и частичную локализацию света, но сумма измеренных величин не может быть больше.
Исследователи из Рочестера, однако, отмечают, что эксперимент с двумя щелями Юнга также может привести к тому, что обе меры будут равны нулю, что противоречит принципу дополнительности Бора. Согласно общепринятой интерпретации, это означает, что ни частицы, ни волны нет, но свет все еще можно обнаружить, – говорит Цянь.
Это исследование мало назвать революционным – результатом является первое полное описание взаимодополняемости – недостающей части головоломки квантовой запутанности. Описывая способ учета запутанности, наряду с наличием волн и частиц, работа исследователей из Рочестера означает, что каждый эксперимент Юнга, связанный с двойственностью, даст измеренную сумму с точным значением, которая удовлетворяет условиям, изложенным Бором более девяти десятилетий назад.
Новые особенности
Но вернемся к корпускулярно-волновому дуализму. Для количественной проверки его фундаментального принципа и взаимодополняемости необходима квантовая составная система, которой можно управлять с помощью экспериментальных параметров. После того, как Нильс Бор ввел концепцию «взаимодополняемости» в 1928 году, лишь несколько идей были проверены экспериментально.
Таким образом, концепция дополнительности и корпускулярно-волнового дуализма все еще остается неуловимой и еще не полностью подтверждена экспериментально.
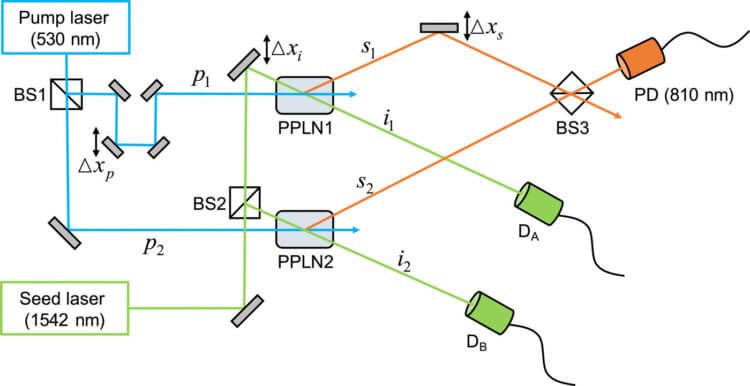
Но эта проблема, как и любая другая, имеет решение. Так, исследовательская группа из Института фундаментальных наук (IBS, Южная Корея) воспользовалась результатами опытов в «схеме однофотонной интерферометрии с частотной гребенкой» (оптическая схема, которую физики использовали для демонстрации однофотонной интерферометрии с частотной гребенкой, для проверки предсказанных ранее соотношения дополнительности).
Новое, разработанное исследователями устройство – двухлучевой интерферометр – генерирует фотоны когерентного сигнала (кванты), которые используются для измерения квантовых помех. Затем кванты проходят по двум отдельным путям, прежде чем достичь детектора.
Сопряженные «холостые» фотоны используются для получения информации о пути частиц с контролируемой точностью, что позволяет количественно оценивать комплементарность, – пишет портал Phys.org со ссылкой на исследование.
Схема эксперимента. PPLN1 и PPLN2 – это СПР кристаллы, BS1, BS2 и BS3 – светоделители, DA и DB – детекторы холостой моды. PD – фотодетектор, фиксирующий квантовую интерференцию между сигнальными фотонами.
T. H. Yoon / Science Advances, 2021; Перевод N+1
Физики также отмечают, что данные, полученные ими на этой установке ранее, могут быть использованы для исследования связи предсказуемости, видимости и квантовой запутанности. В ходе эксперимента им удалось управлять числом фотонов в «холостых модах» с помощью маломощного лазера и, следовательно, чистотой состояний сигнальных фотонов. Полученные результаты продемонстрировали, что экспериментальные данные довольно точно описываются выведенными соотношениями.
Интересный факт
Как пишет в своей книге «Физика для каждого образованного человека» Спектор Анна Артуровна, фотоэлементы сделали возможным звуковое кино. На кинопленку стали наносить звуковую дорожку – прозрачные окошки различной площади. Свет через них достигал фотоэлемента, затем преобразовывался в электрический сигнал и подавался на громкоговоритель.
В целом, из всего вышеописанного можно сделать вывод, к которому в свое время пришел один из выдающихся исследователей ХХ века, физик Ричард Фейнман. «Решение загадки квантовой механики заключается в понимании эксперимента с двумя щелями», – писал он.
Все потому, что результаты нового исследования, вероятно, будут иметь фундаментальные последствия для лучшего понимания принципа дополнительности и количественного соотношения двойственности волны и частицы. Вообщем, фундаментальные силы природы, кажется, все больше поддаются изучению.

Сложными веществами называются такие вещества, которые путем химических реакций могут быть разложены на другие, более простые вещества. В отличие от сложных простыми веществами называются такие, которые химическим путем не могут быть разложены на еще более простые вещества.
Примером сложного вещества может служить вода, которая путем химической реакции может быть разложена на два других, более простых вещества — водород и кислород. Что же касается последних двух, то они химическим путем уже не могут быть разложены на более простые вещества, а поэтому являются простыми веществами, или, иначе, химическими элементами.
Изучая свойства химических элементов, Д. И. Менделеев подметил, что свойства их периодически повторяются в зависимости от их атомного веса. Эту периодичность он отобразил в форме таблицы, вошедшей в науку под названием «Периодическая система элементов Менделеева».
Ниже приведена современная периодическая таблица химических элементов Менделеева.
Согласно современным представлениям науки каждый химический элемент состоит из совокупности мельчайших материальных (вещественных) частиц, называемых атомами.
Атомом называется самая малая доля химического элемента, которая уже не может быть разложена химическим путем на другие, более мелкие и простые материальные частицы.
Атомы различных по своей природе химических элементов отличаются друг от друга своими физико-химическими свойствами, структурой, размерами, массой, атомным весом, собственной энергией и некоторыми иными свойствами. Например, атом водорода резко отличается по своим свойствам и структуре от атома кислорода, а последний — от атома урана и т. д.
За условную единицу измерения атомных весов химических элементов принята 1/16 часть веса атома кислорода, В соответствии с этим атомным весом химического элемента называют отвлеченное число, показывающее, во сколько раз вес данного химического элемента больше 1/16 части веса атома кислорода.
В периодической таблице элементов Д. И. Менделеева приведены атомные веса всех химических элементов (см. число, помещенное под названием элемента). Из этой таблицы мы видим, что наиболее легким атомом является атом водорода, имеющий атомный вес 1,008. Атомный вес углерода равен 12, кислорода — 16 и т. д.
Что же касается более тяжелых химических элементов, то их атомный вес превышает атомный вес водорода более чем в двести раз. Так, атомный вер ртути равен 200,6, радия — 226 и т.д.Чем выше порядок номера, занимаемого химическим элементом в периодической системе элементов, тем больше атомный вес.
Большая часть атомных весов химических элементов выражается дробными числами. Это в известной мере объясняется тем, что такие химические элементы состоят из совокупности скольких сортов атомов, обладающих различными атом весами, но одинаковыми химическими свойствами.
Химические элементы, занимающие один вый номер в периодической системе элементов, а следовательно, обладающие одинаковыми химическими свойствами, но различными атомными весами, называются изотопами.
Элементарные частицы вещества
Долгое время считалось, что атомы химических элем являются пределом делимости вещества, т. е. как бы элементарными «кирпичиками» мироздания. Современная наука отвергла эту гипотезу, установив, что атом любого химического эле представляет собой совокупность еще более мелких материальных частиц, чем сам атом.
Чтобы понять строение атомов и физико-химические процессы в них, необходимо хотя бы вкратце ознакомиться с основными характеристиками элементарных частиц, входящих в состав атомов.
Исключительно малая «масса покоя» электрона свидетельствует о том, что инертные свойства электрона проявляются исключительно слабо, а это значит, что электрон под влиянием переменной электрической силы может колебаться в пространстве с частотой во много миллиардов периодов в секунду.
Масса электрона настолько мала, что для получения одного грамма электронов их потребовалось бы взять 1027 единиц. Чтобы иметь хотя бы некоторое физическое представление об этом колоссально большом числе, приведем такой пример. Если бы можно было один грамм электронов расположить на прямой линии вплотную друг к другу, то они образовали бы цепочку длиной в четыре миллиарда километров.
Масса электрона, как и всякой иной вещественной микрочастицы, зависит от скорости его движения. Электрон, находясь в состоянии относительного покоя, обладает «массой покоя», имеющей механическую природу, как и масса всякого физического тела. Что же касается «массы движения» электрона, увеличивающейся с ростом скорости его движения, то она электромагнитного происхождения. Она обусловлена наличием у движущегося электрона электромагнитного поля как некоторого вида материи, обладающего массой и электромагнитной энергией.
Чем быстрее движется электрон, тем больше проявляются инерционные свойства его электромагнитного поля, тем, следовательно, больше масса последнего и соответственно электромагнитная энергия его. Так как электрон со своим электромагнитным полем составляет единую, органически связанную материальную систему, то естественно, что массу движения электромагнитного поля электрона можно непосредственно приписать самому электрону.
Электрон, помимо свойств частицы, обладает и волновыми свойствами. Опытом установлено, что поток электронов, подобно световому потоку, распространяется в форме волнообразного движения. Характер волнового движения электронного потока в пространстве подтверждается явлениями интерференции и дифракции электронных волн.
Интерференция электронов — это явление наложения электронных воли друг на друга, а дифракция электронов — это явление огибания электронными волнами краев узкой щели, сквозь которую проходит электронный поток. Следовательно, электрон — это не просто частица, а «частица-волна», длина которой зависит от массы и скорости движения электрона.
Установлено, что электрон, помимо своего поступательного движения, совершает еще и вращательное движение вокруг своей оси. Этот вид движения электрона получил название «спина» (от английского слова «спин» — веретено). В результате такого движения электрон, кроме электрических свойств, обусловленных электрическим зарядом, приобретает еще и магнитные свойства, напоминая в этом отношении элементарный магнитик.
Протон — это вещественная частица, обладающая положительным электрическим зарядом, равным по абсолютной величине электрическому заряду электрона.
В отличие от электрона и протона, нейтрон не обладает электрическим зарядом, т. е. он является электронейтральной «элементарной» частицей вещества. Масса нейтрона практически равна массе протона.
Электроны, протоны и нейтроны, находясь в составе атомов, взаимодействуют друг с другом. В частности, электроны и протоны взаимно притягиваются друг к другу как частицы, обладающие разноименными электрическими зарядами. Одновременно с этим электрон от электрона и протон от протона отталкиваются как частицы, обладающие одноименными электрическими зарядами.
Взаимодействие всех этих электрически заряженных частиц происходит через их электрические поля. Эти поля представляют собой особый вид материи, состоящей из совокупности элементарных материальных частиц, называемых фотонами. Каждый фотон обладает строго определенным присущим ему количеством энергии (квантом энергии).
Ядерные силы значительно превосходят по своей величине электрические силы взаимного отталкивания протонов в ядре атома. Это приводит к тому, что они в состоянии не только преодолеть внутри ядер атомов силы взаимного отталкивания протонов, но и создать из совокупности протонов и нейтронов весьма прочные системы ядер.
Устойчивость ядра каждого атома зависит от соотношения двух противоречивых сил — ядерных (взаимное притяжение протонов и нейтронов) и электрических (взаимное отталкивание протонов).
Мощные ядерные силы, действующие в ядрах атомов, способствуют превращению нейтронов и протонов друг в друга. Эти взаимопревращения нейтронов и протонов осуществляются в результате выделения или поглощения ими более легких элементарных частиц, например мезонов.
Рассмотренные нами частицы названы элементарными потому, что они не состоят из совокупности других, более простых частиц материи. Но в то же время не надо забывать, что они способны превращаться друг в друга, возникать за счет друг друга. Таким образом, эти частицы являются некоторыми сложными образованиями, т. е. их элементарность условна.
Химическое строение атомов
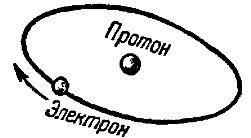
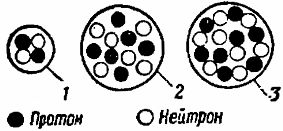
Простейшим по своему устройству атомом является атом водорода. Он состоит из совокупности только двух элементарных частиц — протона и электрона. Протон в системе атома водорода играет роль центрального ядра, вокруг которого по некоторой орбите вращается электрон. На рис. 1 схематически показана модель атома водорода.
Рис. 1. Схема строения атома водорода
Эта модель — только грубое приближение к действительности. Дело в том, что электрон как «частица-волна» не обладает резко отграниченным от внешней среды объемом. А это значит, что следует говорить не о некоторой точной линейной орбите электрона, а о своеобразном электронном облачке. При этом электрон чаще всего занимает некоторую среднюю линию облачке, являющуюся одной из возможных орбит его в атоме.
Надо сказать, что и сама орбита электрона не является строга неизменной и неподвижной в атоме — она тоже в силу изменения массы электрона совершает некоторое вращательное движение. Следовательно, движение электрона в атоме носит относительно сложный характер. Так как ядро атома водорода (протон) и вращающийся вокруг него электрон обладают разноименными электрическими зарядами, то они взаимно притягиваются.
Одновременно с этим стой энергии электрон, вращаясь вокруг ядра атома, развивает центробежную силу, стремящуюся удалить его от ядра. Следовательно, электрическая сила взаимного притяжения ядра атома и электрона и центробежная сила, действующая на электрон, — силы противоречивые.
При равновесии их электрон занимает относительно устойчивое положение на некоторой орбите в атоме. Так как масса электрона очень мала, то для уравновешивания силы притяжения к ядру атома он должен вращаться с громадной скоростью, равной примерно 6 · 10 15 оборотам в секунду. Это значит, что электрон в системе атома водорода, как и всяком ином атоме, движется по своей орбите с линейной скоростью, превышающей тысячу километров в секунду.
В нормальных условиях электрон вращается в атоме рода по наиболее близко расположенной к ядру орбите. При этом он обладает минимальным возможным количеством энергии. Если же по тем или иным причинам, например под воздействием каких-либо иных материальных частиц, вторгнувшихся систему атома, электрон перейдет на более удаленную от атома орбиту, то он уже будет обладать несколько большим количеством энергии.
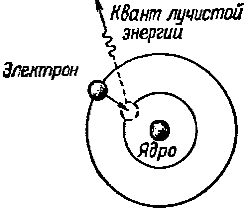
Однако на этой новой орбите электрон но пребывает ничтожно малое время, после чего он снова вращается на ближайшую к ядру атома орбиту. При этом ходе он отдает излишек своей энергии в виде кванта эле магнитного излучения — лучистой энергии (рис. 2).
Рис. 2. Электрон при переходе с далекой орбиты на более близкую к ядру атома излучает квант лучистой энергии
Чем больше получает извне энергии электрон, тем на удаленную от ядра атома орбиту он переходит и тем большее количество электромагнитной энергии он излучает, когда вращается на ближайшую к ядру орбиту.
Измеряя количество энергии, излучаемой электроном при переходе с различных орбит на ближайшую к ядру атома, удалось установить, что электрон в системе атома водорода, как и в системе любого иного атома, может переходить не на любую произвольную орбиту, на строго определенную в соответствии с той энергией, которую он получает под действием внешней силы. Орбиты, которые может занимать электрон в атоме, называются дозволенными орбитами.
Так как положительный заряд ядра атома водорода (заряд протона) и отрицательный заряд электрона численно равны, то суммарный их заряд равен нулю. Это значит, что атом водорода, находясь в нормальном состоянии, является электронейтральной частицей.
Это справедливо для атомов всех химических элементов: атом любого химического элемента, находящийся в нормальном со стоянии, является электронейтральной частицей из-за численного равенства его положи тельных и отрицательных зарядов.
Поскольку в состав ядра атома водорода входит только одна «элементарная» частица — протон, то так называемое массовое число этого ядра равно единице. Массовым числом ядра атома любого химического элемента называется общее число протонов и нейтронов входящих в состав этого ядра.
Природный водород в основном состоит из совокупности атомов с массовым числом, равным единице. Однако в составе его имеется и другой сорт атомов водорода, с массовым числом равным двум. Ядра атомов этого тяжелого водорода называемые дейтонами, состоят из двух частиц — протона и нейтрона. Этот изотоп водорода называется дейтерием.
В природном водороде дейтерия содержится весьма незначительное количество. На каждые шесть тысяч атомов легкого водорода (массовое число равно единице) приходится только один атом дейтерия (тяжелого водорода). Существует еще один изотоп водорода — сверхтяжелый водород получивший название тритий. В ядрах атома этого изотопе водорода имеются три частицы: протон и два нейтрона, связанных друг с другом ядерными силами. Массовое число ядра атома трития равно трем, т. е. атом трития в три раза тяжелей атома легкого водорода.
Хотя атомы изотопов водорода и имеют различные массы но все же они обладают одинаковыми химическими свойствами, Например, легкий водород, вступая в химическое взаимодействие с кислородом, образует с ним сложное вещество — воду. Аналогично этому изотоп водорода — дейтерий, соединяясь с кислородом, образует воду, которая в отличие от обычной воды называется тяжелой водой. Тяжелая вода находит большое применение в процессе производства ядерной (атомной) энергии.
Следовательно, химические свойства атомов зависят не от массы их ядер, а только от строения электронной оболочки атома. Поскольку в атомах легкого водорода, дейтерия и трития имеется одинаковое количество электронов (по одному на каждый атом), эти изотопы имеют одинаковые химические свойства.
Химический элемент водород не случайно занимает первый номер в периодической системе элементов. Дело в том, что между номером любого элемента в периодической системе элементов и величиной заряда ядра атома этого элемента существует некоторая связь. Ее можно сформулировать так: порядковый номер всякого химического элемента в периодической системе элементов численно равен положительному заряду ядра этого элемента, а следовательно, и числу вращающихся вокруг него электронов.
Так как водород занимает первый номер в периодической системе элементов, то это значит, что положительный заряд ядра его атома равен единице и что вокруг ядра вращается один электрон.
Химический элемент гелий занимает второй номер в периодической системе элементов. Это значит, что он имеет положительный электрический заряд ядра, равный двум единицам, т. е. в составе его ядра должно быть два протона, а в электронной оболочке атома — два электрода.
Природный гелий состоит из двух изотопов — тяжелого и легкого гелия. Массовое число тяжелого гелия равно четырем. Это значит, что в состав ядра атома тяжелого гелия, помимо вышеупомянутых двух протонов, должны входить еще два нейтрона. Что же касается легкого гелия, то его массовое число равно трем, т. е. в состав его ядра, помимо двух протонов, должен входить еще один нейтрон.
Установлено, что в природном гелии число атомов легкого гелия составляет примерно одну миллионную долю атомов тяжелого гения. На рис. 3 показана схематически модель атома гелия.
Рис. 3. Схема строения атома гелия
Дальнейшее усложнение строения атомов химических элементов идет за счет увеличения количества протонов и нейтронов в ядрах этих атомов и одновременно за счет увеличения количества электронов, вращающихся вокруг ядер (рис. 4). Пользуясь периодической системой элементов, легко определить число электронов, протонов и нейтронов входящих в состав различных атомов.
Порядковый номер химического элемента равен числу протонов, находящихся в ядре атома, а одновременно с этим числу электронов, вращающихся вокруг ядра. Что же касается атомного веса, то он приближенно равен массовому числу атома, т. е. числу вместе взятых протонов и нейтронов в ядре. Следовательно, вычитая из атомного веса элемента число, равное порядковому номеру элемента, можно определить, какое количество нейтронов содержится в данном ядре.
Установлено, что ядра легких химических элементов, имеющих в своем составе поровну протонов и нейтронов, отличаются весьма большой прочностью, так как ядерные силы в них относительно велики. Например, ядро атома тяжелого гелия отличается исключительно большой прочностью, так как оно составлено из двух протонов и двух нейтронов, связанных друг с другом мощными ядерными силами.
Ядра атомов более тяжелых химических элементов содержат в своем составе уже неодинаковое количество протонов и нейтронов, поэтому их связь в ядре слабее, чем в ядрах легких химических элементов. Ядра этих элементов могут быть относительно легко расщеплены при бомбардировке их атомными «снарядами» (нейтронами, ядрами атома гелия и т. д.).
Что же касается наиболее тяжелых химических элементов, в частности радиоактивных, то их ядра отличаются настолько малой прочностью, что они самопроизвольно распадаются на составные части. К примеру, атомы радиоактивного элемента радия, состоящего из совокупности 88 протонов и 138 нейтронов, самопроизвольно распадаются, превращаясь в атомы радиоактивного элемента радона. Атомы же последнего в свою очередь распадаются на составные части, переходя в атомы других элементов.
Ознакомившись вкратце с составными частями ядер атомов химических элементов, рассмотрим строение электронных оболочек атомов. Как известно, электроны могут вращаться вокруг ядер атомов только по строго определенным орбитам. При этом они так сгруппированы в электронной оболочке каждого атома, что можно различить отдельные слои электронов.
В каждом слое может находиться количество электронов, не превышающее строго определенного числа. Так, например, в первом, ближайшем к ядру атома электронном слое может находиться максимум два электрона, во втором — не более восьми электронов и т. д.
Те атомы, у которых внешние электронные слои целиком заполнены, имеют наиболее устойчивую электронную оболочку. Это значит, что данный атом прочно держит все свои электроны и не нуждается в получении извне добавочного количества их. Например, атом гелия имеет два электрона, целиком заполняющих первый электронный слой, а атом неона имеет десять электронов, из которых первые два целиком заполняют первый электронный слой, а остальные — второй (рис. 5).
Рис. 5. Схема строения атома неона
Следовательно, атомы гелия и неона имеют вполне устойчивые электронные оболочки, не стремятся их как-нибудь видоизменить количественно. Такие элементы химически инертны, т. е. не вступают в химическое взаимодействие с другими элементами.
Или, например, атом кислорода имеет восемь электронов, из которых два целиком заполняют первый слой, а остальные шесть размещены во втором слое. Таким образом, для полного завершения построения второго электронного слоя в атоме кислорода ему не хватает только двух электронов. Поэтому атом кислорода не только прочно удерживает свои шесть электронов во втором слое, но и обладает возможностью притянуть к себе два недостающих ему электрона для заполнения своего второго электронного слоя. Этого он достигает путем химического соединения с атомами таких элементов, у которых внешние электроны слабо связаны со своими ядрами.
Химические элементы, атомы которых не имеют целиком заполненных электронами внешних электронных слоев, как правило, химически активны, т. е. охотно вступают в химическое взаимодействие.
Итак, электроны в атомах химических элементов располагаются в строго определенном порядке и всякое изменение их пространственного расположения или количества в электронной оболочке атома приводит к изменению физико-химических свойств последнего.
Равенство числа электронов и протонов в системе атома является причиной того, что суммарный электрический заряд его равен нулю. Если равенство числа электронов и протонов в системе атома нарушается, то атом становится электрически заряженной системой.
Атом, в системе которого нарушено равновесие разноименных электрических зарядов вследствие того, что он потерял часть своих электронов или, наоборот, приобрел лишнее количество их, называется ионом.
Способность разноименных ионов взаимно притягиваться друг к другу является причиной того, что они химически соединяются, образуя более сложные частицы вещества — молекулы.
В заключение следует отметить, что размеры атома очень велики по сравнению с размерами тех вещественных частиц, из которых они состоят. Ядро самого сложного атома вместе со всеми электронами занимает миллиардную долю объема атома. Простой подсчет показывает, что если бы удалось один кубический метр платины сжать так крепко, чтобы исчезли внутриатомные и междуатомные пространства, то получился бы объем, равный примерно одному кубическому миллиметру.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети: