Что такое asap в медицине
Интерпретация результатов биопсии простаты: современные аспекты проблемы
 | Баходур Камолов К.м.н., отделение урологии РОНЦ им. Н.Н. Блохина РАМН kamolov@roou.ru |
 | Алексей Викторович Живов К.м.н., доцент кафедры урологии МГМСУ urorec@gmail.com |
Широкое распространение скринингового исследования мужчин для выявления рака предстательной железы путем определения уровня простатспецифического антигена (ПСА) привело к значительному увеличению числа трансректальных биопсий предстательной железы – метода, счи тающегося «золотым стандартом» диагностики рака простаты. Биопсия простаты, выполненная по надлежащим показаниям и с использованием оптимальной методики, предоставляет врачу необходимую информацию о наличии у пациента предракового поражения (простатическая интраэпителиальная неоплазия – ПИН – высокой степени) либо рака простаты, локализации опухоли, протяженности опухоли в биоптате, наличии периневральной инвазии или инвазии капсулы предстательной железы, стадии дифференцировки опухолевых клеток (градация по шкале Глисона). Эти показатели в сочетании с другими клиническими данными позволяют установить стадию Т и степень риска прогрессирования заболевания и/или рецидива после радикальной простатэктомии (РПЭ) либо иного терапевтического вмешательства. Без этих сведений невозможно принять правильное решение по выбору метода лечения и дальнейшему ведению пациента, и потому интерпретация результатов биопсии простаты – одна из важнейших задач, которые стоят перед специалистом, практикующим в области урологии и онкоурологии.
Прежде чем коснуться вопросов диагностики собственно рака простаты, заметим, что патоморфологическое исследование биоптата может выявить наличие незлокачественных изменений железистого эпителия, ассоциированных с повышенным риском развития рака простаты у пациента и в связи с этим требующих проведения повторной биопсии. К таким настораживающим находкам относятся атипия c подозрением на аденокарциному или атипичная мелкоацинарная пролиферация (ASAP) и ПИН высокой степени. В первом случае в препарате обнаруживаются мелкие пролиферирующие ацинусы, вызывающие подозрение на аденокарциному (может наблюдаться ядерная/ядрышковая атипия, отсутствие базальных клеток и другие признаки нарушения дифференцировки). Термин ASAP (atypical small acinar proliferation, мелкие участки атипичной пролиферации ацинусов), или «атипия с подозрением на аденокарциному», широко распространен за рубежом, однако отечественные патоморфологи достаточно редко дают такое заключение по результатам биопсии. Сразу подчеркнем, что ASAP не является предраковым состоянием, а выражает лишь неясность диагноза, т.е. патолог не может с уверенностью сказать, соответствует ли наблюдаемая картина аденокарциноме или доброкачественному поражению. В связи с этим при получении диагноза ASAP рекомендуется консультация с пересмотром гистологических стекол у другого специалиста (желательно экспертного уровня), возможно использование иммуногистохимических методов анализа биоптатов. Показано, что атипия с подозрением на рак ассоциирована примерно с 50%-ной вероятностью диагноза аденокарциномы при повторной биопсии, причем локализация аденокарциномы в большинстве случаев соответствует участку обнаруженной ранее атипии. Поэтому в течение 3 месяцев пос ле первой биопсии рекомендуется провести повторную биопсию по расширенной схеме, причем для повышения диагностической ценности ребиопсии NCCN (Национальная всеобщая он кологическая сеть США) рекомендует брать дополнительные пробы из участка атипии. Если при повторной биопсии рак не обнаружен, показано тщательное наблюдение с периодическим измерением уровня ПСА, проведением пальцевого ректального исследования и повторной биопсии (известно, впрочем, что проведения двух повторных биопсий после первоначальной достаточно для диагностики подавляющего большинства опухолей простаты). Диагноз ПИН означает, что в биоптате обнаружены железы, ацинусы и про токи которых выстланы атипичными клетками, однако присутствует интактный базальный слой, что отличает ПИН от аденокарциномы. Считается, что ПИН – это предраковое состояние: она может иметь высокую или низкую степень в зависимости от спектра и выраженности наблюдаемых неопластических изменений. В западных странах распространено убеждение, что не следует указывать ПИН низкой степени в патоморфологическом заключении, поскольку этот диагноз имеет плохую воспроизводимость среди различных патологов и не ассоциирован с повышенным риском рака при последующей биопсии. Исследования прошлых лет показали, что ПИН высокой степени ассоциирована с 30–50%-ным риском выявления рака простаты при ребиопсии, однако более современные работы, включившие данные расширенных биопсий, свидетельствуют о том, что риск все же не столь высок и составляет примерно 10–20%. В соответствии с рекомендациями NCCN в случае обнаружения ПИН высокой степени после стандартной секстантной биопсии (либо биопсии с количеством взятых проб менее 10) необходимо через 3 месяца про вести повторную биопсию по расширенной методике (10 и более биоптатов). Если же с самого начала была проведена расширенная биопсия, больного следует подвергнуть повторной биопсии через 6–12 месяцев с использованием расширенной или сатурационной методики.
В тех случаях, когда при оценке срезов, окрашенных гематоксилин-эозином, нель зя сделать окончательное заключение, соответствует ли наблюдаемая картина злокачественному поражению или нет, патологи могут прибегнуть к помощи иммуногистохимического анализа. К наиболее часто используемым иммуногистохимическим маркерам, позволяющим отличить злокачественные клетки от доброкачественных, относятся антитела к цитокератинам 5 и 14, белку р63 и альфаметилацилкоэнзим А-рацемазе (AMACR). Положительное окрашивание ткани на цитокератины 5 и 14 и белок р63, которые постоянно экспрессируются базальными клетками нормального эпителия простаты (а также при доброкачественной гиперплазии простаты, атрофии и ПИН высокой степени), свидетельствует об отсутствии злокачественного поражения. Напротив, AMACR в большинстве случаев гиперэкспрессируется клетками рака простаты, поэтому положительное окрашивание ткани антителами к этому ферменту свидетельствует о наличии рака.
Если в препарате все же обнаружен рак, то перед патологом встает задача охарактеризовать наблюдаемую картину, а перед урологом – сделать из данной характеристики выводы относительно выбора оптимальной тактики дальнейшего ведения больного. Наиболее широкоиспользуемая система патоморфологического стадирования рака простаты – это система градации Глисона, вошедшая в прак тику врачей уже более 40 лет назад. Оценка опухоли по Глисону основана исключительно на рассмотрении гистологической структуры ткани без учета каких-либо цитологических (ядерных/ядрышковых) признаков атипии. Данная система подразумевает оценку гистологической структуры опухоли по 5-балльной шкале, в которой 1 балл соответствует наиболее дифференцированной структуре, а 5 баллов – наименее дифференцированной. Рак предстательной железы, как известно, весьма гетерогенный и зачастую имеет несколько участков различной степени дифференцировки, поэтому в заключении патолога указывается сумма Глисона – сумма баллов, присвоенных наиболее распространенной (первичный показатель) и второй по распространенности (вторичный показатель) гистологической картине опухоли в биоптате. При этом патолог должен указать не только само значение суммы, но и ее слагаемые, ставя на первое место первичный показатель. В последние годы количество проводимых биопсий простаты и РПЭ значительно возросло по сравнению с тем временем, когда была создана система Глисона. Многочисленные исследования последних лет свидетельствуют о том, что оценка по старой системе Глисона биоптата опухоли, полученного после трансректальной биопсии простаты, и образца той же опухоли после простатэктомии совпадает только в 35–45% случаев, причем первоначальная недооценка стадии опухоли встречалась почти в 2 раза чаще, чем переоценка. В связи с вышесказанным возникла необходимость в доработке системы Глисона и адаптирования ее к сложившимся условиям. Современная модифицированная система Глисона была предложена и введена в практику в 2005 г., после состоявшейся в Сан-Антонио конференции урологических патологов, организованной ISUP (International Society of Urological Pathology) и призванной достичь соглашения в противоречивых и спорных аспектах системы Глисона. В результате в систему Глисона были введены поправки, сделавшие ее более надежным диагностическим инструментом. Во-первых, была уточнена процедура выбора и оценки вторичного показателя Глисона. В случае если вторичный показатель имеет более низкую степень дифференцировки по сравнению с первичным, то он учитывается, даже если соответствующий ему участок опухоли занимает менее 5% всего объема опухолевой ткани в биоптате. В то же время, если вторичная по распространенности гистологическая картина имеет, наоборот, более высокую степень дифференцировки, она принимается во внимание, только если на нее приходится более 5% объема опухоли, в противном случае число баллов преобладающей картины просто удваивается. Если в опухоли можно выделить три различные по степени дифференцировки картины – 3, 4 и 5, то в сумму входят первичный и наихудший показатели. Также было решено не выставлять сумму Глисона 2 или 3 независимо от типа и состояния исследуемого образца (считается, что во времена, когда система Глисона только была разработана, показатель 1 балл по Глисону зачастую присваивался не аденокарциноме, а аденозу или атипичной аденоматозной гиперплазии, кроме того, он встречается очень редко и обладает плохой воспроизводимостью). Что же касается значения суммы 4 (2+2), его также предписано избегать вследствие чрезвычайно плохой воспроизводимости среди различных экспертов и низкой корреляции с результатами, полученными после резекции простаты или РПЭ (как правило, на самом деле имеет место более высокий балл). Тем не менее возможность постановки диагноза с суммой по Глисону 4 балла осталась с оговоркой, что диагноз этот может поставить не общий патолог, а только патолог-эксперт, специализирующийся в урологии, при этом в заключении рекомендуется указывать, что вероят ность обнаружения картины, соответствующей большему числу баллов при резек ции/удалении простаты, очень велика. На конец, были нес колько изменены сами кри терии отнесения наблюдаемой гистологической картины к той или иной степени дифференцировки по Глисону. Примером может послужить оценка криброзного варианта железистых структур: старая система допускала наличие этого варианта при 2, 3 и 4-й степенях дифференцировки, в новой же системе криброзный вариант по большей части относится к 4-й степени, в то время как критерии его диагностики в рамках 3-й степени в значительной степени ужесточились.
Теперь, спустя 4 года, появилась возможность судить об итогах вышеописанных изменений. Большинство авторов сходятся во мнении, что модификация пошла на пользу старой системе Глисона. По сравнению с традиционной системой значительно возросли воспроизводимость результатов оценки и процент совпадения диагноза при оценке образцов ткани железы, полученных путем биопсии или после РПЭ (по данным исследования Helpap и Egevad, включившего 3000 образцов простаты, процент совпадения вырос с 58 до 72%).
Теперь перейдем к вопросу, представляющему непосредственный интерес для практикующего уролога: какие выводы можно извлечь из полученной по результатам биопсии информации? Во многих исследованиях было показано, что сумма Глисона – независимый и очень сильный прогностический фактор не только для предсказания естественного протекания болезни, но также и риска рецидива после РПЭ или лучевой терапии (по некоторым данным, прогностическая ценность исследования по модифицированной системе Глисона в отношении оценки риска рецидива после РПЭ достоверно повысилась). Величина суммы Глисона, полученная как по старой системе, так и по новой, коррелирует с другими прогностическими параметрами: возрастом, уровнем ПСА в сыворотке крови, клинической и патологической стадией рака. Считается, что показатель 4 балла негативно отражается на прогнозе. В ряде исследований было показано, что сумма Глисона 7b с первичным показателем 4 (т.е. 4+3) отражает более «продвинутую» патологическую стадию рака и более высокий риск прогрессирования заболевания после РПЭ, чем сумма Глисона 7a с первичным показателем 3 (3+4). Современные исследования свидетельствуют о том, что подавляющая часть образцов опухоли, полученных при биопсии ткани простаты у больных с концентрацией ПСА менее 10 нг/мл и распространенностью опухоли менее 10%, получают оценку не более чем 7а по Глисону. Также, по некоторым данным, 95% опухолей с оценкой 7а имеют стадию рТ2, в то время как 70% опухолей с оценкой 7b имеют стадию рТ3-4. Прогностические различия суммы Глисона 7а и 7b нашли отражение, в частности, в таблицах Партина – широко используемом инструменте оценки прогноза в зависимости от величины ПСА, суммы Глисона и клинической стадии рака. Кроме того, было показано, что преобладание паттерна 4 хотя бы в одном столбике или его наличие в трех столбиках и более повышает риск инвазии регионарных лимфатических узлов до 20–45%.
Изучая полученный препарат ткани простаты, патолог может не только качественно оценить обнаруженное злокачественное поражение, но и дать его количественную оценку. Наиболее часто применяются следующие методики: 1) подсчет общего числа позитивных проб (столбиков ткани, содержащих опухолевую ткань) или их процентного содержания, 2) общее процентное содержание опухолевой ткани в пробах, 3) наибольший процент опухолевой ткани в индивидуальной пробе, 4) количество опухолевой ткани в миллиметрах в одном столбике либо суммарно во всех пробах.
В ряде исследований была продемонстрирована положительная корреляция количества опухолевой ткани в биоптате с размером опухоли, риском экстрапростатического распространения рака, инвазии семенных пузырьков и положительных хирургических краев после РПЭ. Систематический обзор литературы, проведенный британскими исследователями Harnden и соавт. в 2008 г. подтверждает, что процентное содержание опухолевой ткани в биоптате (общее процентное содержание или процент в «наихудшей» пробе) является независимым предиктором исхода заболевания и динамики уровня ПСА, причем прогностическая ценность этих методов оценки превышает таковую при простом подсчете позитивных проб. В соответствии с клиническими рекомендациями Европейской ассоциации урологов (ЕАУ), подсчет количества опухоли в миллиметрах или в процентах имеет одинаковую прогностическую ценность. Тем не менее, до сих пор нет единого мнения по вопросу, имеет ли показатель количества опухолевой ткани, взятый изолированно от других параметров, какую-либо прогностическую ценность в клинической практике, поэтому для определения прогноза его надо рассматривать в комплексе с другими факторами. Кроме того, получены данные о том, что малый объем опу холи в биоптате (микрофокальный рак) не исключает последующего биохимического и клинического рецидива рака после РПЭ или лучевой терапии, и, таким образом, не является критерием хорошего прогноза.
Наконец, хотелось бы сказать несколько слов о таком параметре гистоморфологической оценки биоптата, как наличие/отсутствие периневральной инвазии (ПНИ). Считается, что ПНИ – это основной механизм распространения раковых клеток за пределы простаты. Обнаружение ПНИ в препарате ассоциировано, по данным некоторых исследований, с экстрапростатическим распространением опухоли и биохимическим рецидивом после РПЭ. До сих пор, однако, нет единой точки зрения насчет того, является ли ПНИ независимым прогностическим фактором и добавляет ли что-либо к прогнозу, когда уже учтены уровень ПСА, клиническая стадия и сумма Глисона. Несмотря на то, что проводилось множество исследований, посвященных этому вопросу, их результаты противоречивы и трудно поддаются оценке при попытках проведения метаанализа – главным образом из-за большой вариабельности и недоработок в дизайне исследования (пример часто встречающейся курьезной недоработки – вклю чение в исследование биоптатов, не содержащих нервы, и трактовка таковых как отрицательные, т.е. без ПНИ). Имеются также данные о том, что при наличии в биоптате ПНИ удаление сосудисто-нервных пучков при РПЭ может снизить частоту выявления позитивных хирургических краев у пациентов группы низкого риска, однако требуется большее число исследований, чтобы сделать какой-либо окончательный вывод.
В добавление к вышесказанному нам представляется важным упомянуть о том, что правильное проведение и интерпретация результатов биопсии простаты может не только помочь определить прогноз при лечении рака простаты, но также выделить группу пациентов, которым не требуется немедленное активное вмешательство. Так, в соответствии с рекомендациями NCCN «активное наблюдение» (выжидательная тактика с тщательным наблюдением пациента и вмешательством в случае прогрессии) возможно для пациентов группы низкого риска (стадия T1-T2a, сумма Глисона не более 6, ПСА менее 10 нг/мл), а также для пациентов группы среднего риска при ожидаемой продолжительности жизни менее 10 лет. Помимо вышеупомянутых основных критериев, некоторые авторы рассматривают и другие – плотность ПСА (менее 0,15), кинетику ПСА, процент позитивных проб по результатам биопсии (менее 33%), объем опухолевой ткани в «наихудшей» пробе (менее 50%). Проблема отбора больных для проведения тактики «активного наблюдения» весьма актуальна, поскольку пациенты, имеющие хороший прогноз, могут больше пострадать от лечения, чем от самого рака.
В заключение мы будем рады сообщить читателю о том, что Российское общество онкоурологов планирует в 2010 г. проведение школы, посвященной рассмотрению спорных вопросов методики выполнения и трактовки результатов биопсии простаты. С учетом важности рассматриваемых вопросов, а также проблемы дефицита информации в среде российских врачей мы не сомневаемся в том, что участие в школе будет интересно и полезно врачам-урологам, а также патологам, лучевым терапевтам и врачам смежных специальностей.
Особенности ранней диагностики рака простаты
Ранняя диагностика рака предстательной железы (РПЖ) является одной из приоритетных задач современной урологии и здравоохранения в целом. В настоящее время, в большинстве экономически развитых стран Европы и Северной Америки, РПЖ выходит на второе, а в США на первое место по распространенности среди онкологических заболеваний. В России РПЖ занимает второе место после меланомы кожи и значительно превосходит злокачественные новообразования легких и желудка. Среди онкоурологической патологии РПЖ выявляется чаще, чем опухоль мочевого пузыря и почек.
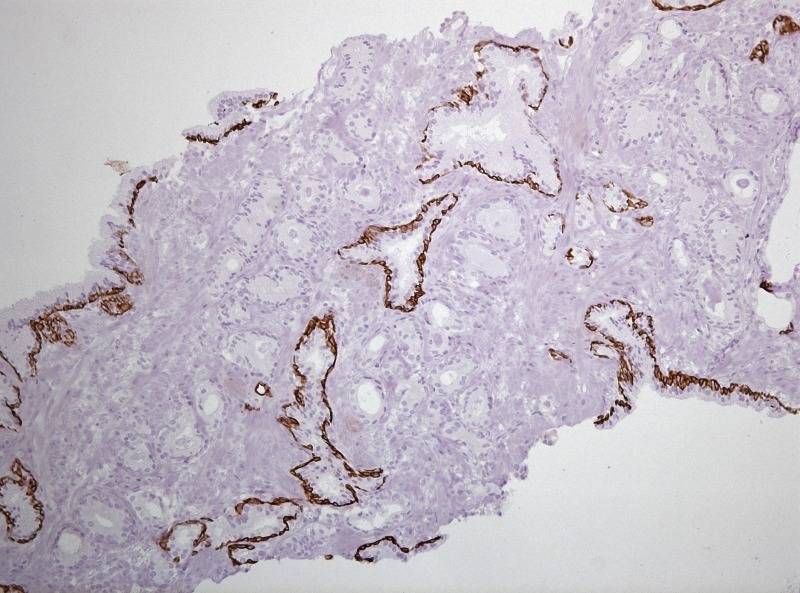
Внимание исследователей к проблеме РПЖ связано не только с увеличением общего количества больных, но и с ростом смертности от этого заболевания. Причем, характерным является быстрый рост числа вновь выявленных случаев РПЖ. Столь резкий рост заболеваемости большинство урологов объясняют широким распространением программы скрининга РПЖ, усовершенствованием техники пункционной биопсии предстательной железы. Определение ПСА является обязательным для всех мужчин в возрасте от 45 лет. Сейчас пороговым значением ПСА является 2,5 нг/мл у мужчин в возрасте до 65 лет. При значении ПСА, превышающем 2,5 нг/мл, показана биопсия предстательной железы. Методика выполнения биопсии из 6 точек, так тазываемая секстантная биопсия,под контролем трансректального ультразвукового исследования (ТРУЗИ) была предложена в 1989 году (K. Hodgeetal). В последующих исследованиях было установлено, что первичная расширенная биопсия под ТРУЗИ контролем из 10 – 12 точек, картирование простаты в ходе выполнения биопсии улучшает выявляемость РПЖ на 24 – 38% по сравнению с биопсией из 6 точек. Среди показаний к повторной биопсии выделяют такие морфологические данные как: выявление в первичной биопсии ПИН высокой степени и участков атипической мелкоацинарной пролиферации (ASAP). В 80% случаев аденокарцинома простаты располагается в перефиреческой зоне и морфологически представлена железистой атипией. Железы аденокарциномы мредставлены мелкими единообразными железами, клетки которых содержат видимые ядрышки, железы не имеют слоя базальных клеток и не имеют дольчатой организации. Термин атипическая мелкоацинарная пролиферация используется в тех случаях, когда в биоптате простаты выявляются фокусы атипических желез, подозрительные на аденокарциному, но в то же время не соответствующие указанным минимальным диагностическим критериям РПЖ. Данный термин является собирательным и включает в себя как фокусы, подозрительные на аденокарциному, так и фокусы аденокарциномы, в объеме не достаточном для постановки диагноза. Выявление фокусов, подозрительных на аденокарциному, без возможности выполнения иммуногистохимического исследования, является показанием для повторной биопсии простаты. В нашей клинике всем пациентам в случае выявления фокусов мелкоацинарной пролиферации проводится иммуногистохимическое исследование (ИГХ). В клинике урологии «Московского государственного медико-стоматологического университета им. А.И. Евдокимова» МЗ РФ с декабря 2011 года по настоящее время с целью диагностики рака простаты, пациентам с атипической мелкоацинорной пролиферацией выполняется серия ИГХ исследований. Всем пациентам в неоднозначных для постановки диагноза случаях выполненяется ИГХ исследование с использованием антител Cytoceratin HMWClone 34βE12 и AMACRClone 13H4 (Dako), согласно протоколу DakoNorthAmerica. Согласно полученным результатам, атипическая мелкоацинарная пролиферация чаще всего представляет собой аденокарциному простаты. Иммуногистохимические методы окраски тканей, полученных в ходе биопсии предстательной железы, являются важным диагностическим исследованием у пациентов с подозрением на рак простаты. И позволяют повысить диагностическую значимость биопсии простаты сократив количество повторных биопсий у пациентов с подозрением на рак предстательной железы.
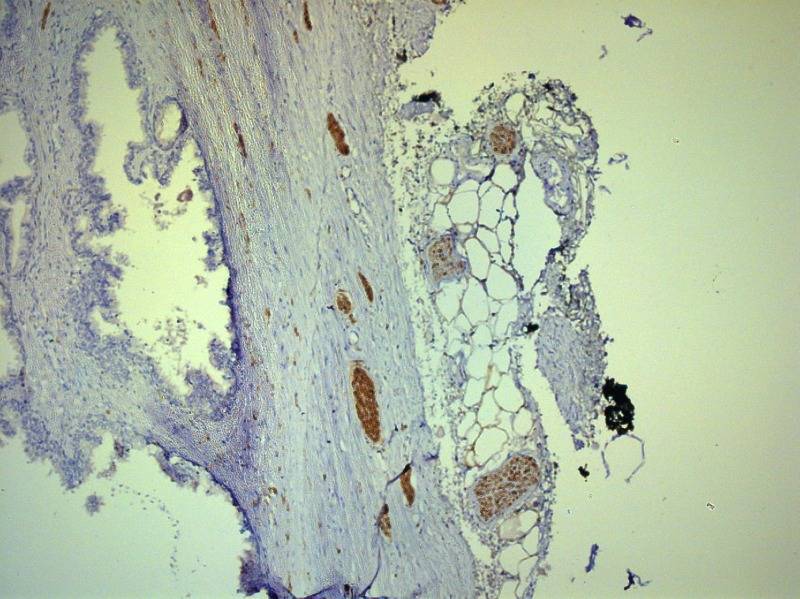
Рисунок №1 Нервные волокна в парапростатической ткани и капсуле простаты ИГХ окраска S100
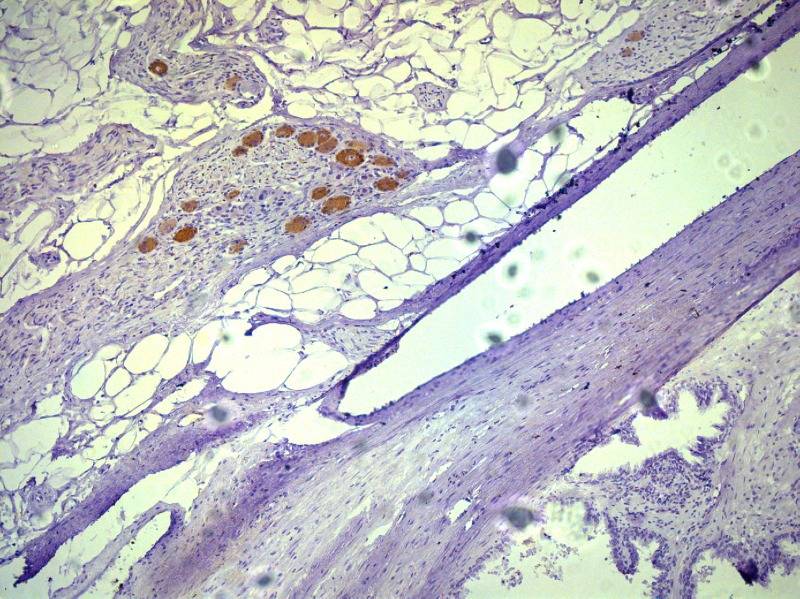
Рисунок №2 Парасимпатические нервные волокна в парапростатической ткани Окраска ИГХ Nitric oxide
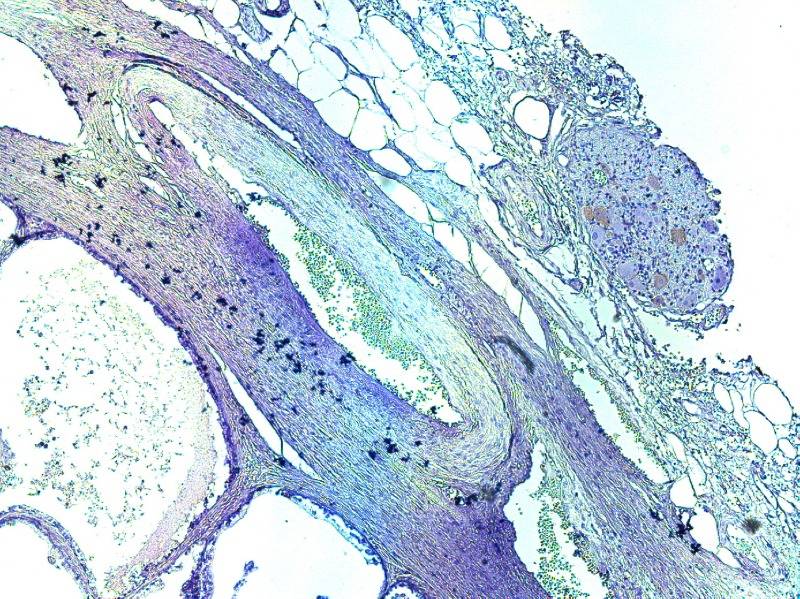
Рисунок №3 Симпатические нервные волокна в парапростатической ткани окраска ИГХ Tyrosine hydroxylase
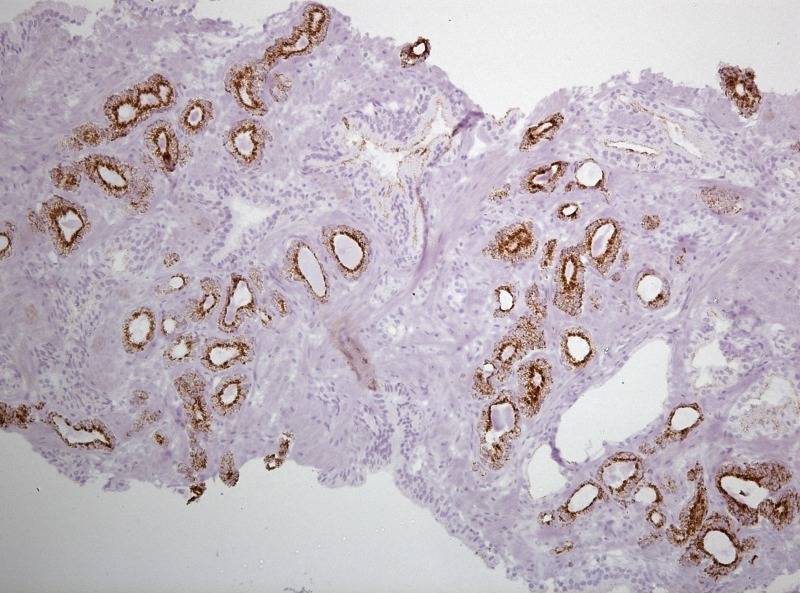
Рисунок №4 Фокус ацинарной аденокарциномы простаты Глисон 3+3 окраска ИГХ AMACR
Рисунок №5 Фокус ацинарной аденокарциномы простаты Глисон 3+3 окраска ГЭ
Рисунок №6 Фокус ацинарной аденокарциномы простаты Глисон 3+3 окраска ИГХ Cytokeratin HMW
Редкие опухоли и опухолеподобные процессы предстательной железы
Простатическая интраэпителиальная неоплазия
J.E. McNeal и D.G. Bostwick разработали диагностические критерии внутрипротоковой дисплазии, ввели термин «простатической интраэпителиальной неоплазии» (prostatic intraepithelial neoplasia, простатическая интраэпителиальная неоплазия (PIN)), выделив три степени.
В настоящее время выделяют две степени: PIN высокой (high-grade PIN) и PIN низкой степени (low-grade PIN).
Простатическая интраэпителиальная неоплазия высокой степени считается ранней стадией канцерогенеза, характеризуется большинством фенотипических, биохимических и генетических признаков рака без инвазии фибромускулярной стромы.
Изолированная PIN высокой степени в среднем выявляется в 9% биоптатов простаты (диапазон 4-24%).
Диагностические критерии
Пролиферация эпителия и наличие клеточной атипии с ядерным полиморфизмом и появлением ядрышек. PIN высокой степени характеризуется проли ферацией эпителия протоков в виде розеток, микрососочков, криброзных структур или плоских поражений (рис. 3.57-3.62). В структурах простатической интраэпителиальной неоплазии высокой степени могут выявляться перстневидные и нейроэндокринные клетки, муцинозные, ксантомные и структуры.

Рис. 3.57. PIN высокой степени. Криброзные структуры. Окраска гематоксилином и эозином. х100

Рис. 3.58. PIN высокой степени. Криброзные структуры. Окраска гематоксилином и эозином. х400

Рис. 3.59. Простатическая интраэпителиальная неоплазия высокой степени. Муцинозные структуры. Окраска гематоксилином и эозином. х200

Рис. 3.60. PIN высокой степени. Сосичковые структуры. Окраска гематоксилином и эозином. х200

Рис. 3.61. PIN высокой степени. Пролиферация с формированием сосочковых структур при сохраненном слое базальных клеток. Окраска гематоксилином и эозином. х630

Рис. 3.62. Простатическая интраэпителиальная неоплазия высокой степени. Выраженные ядрышки в эпителии при сохраненном слое базальных клеток. Окраска гематоксилином и эозином. х630
В сомнительных случаях для дифференциальной диагностики между PIN высокой степени и инвазивной аденокарциномой используется иммуногистохимический (ИГХ) метод. Индекс пролиферативной активности Ki-67 не может быть диагностическим критерием из-за вариабельности результатов. Панель антител включает цитокератин 34вE12, р63 для выявления базального слоя клеток и рацемазу.
При оценке результатов следует помнить, что мозаичная реакция с маркерами базальных клеток не может однозначно свидетельствовать в пользу рака, кроме того, базальные клетки отсутствуют в купферовских железах, они могут повреждаться и слущиваться при воспалении.
Мозаичная реакция или отсутствие реакции базального слоя характерны для структур атипической аденоматоидной гиперплазии, атрофии или постатрофической гиперплазии. Редко (0,2% случаев) аденокарциномы дают фокальное окрашивание с антителами к цитокератину 34вЕ12, в то время как в базальноклеточных карциномах преобладают цитокератины высокой молекулярной массы (СК-Н). Кроме цитокератина 34вЕ12 и р63 можно использовать СК5 и СК14.
Рацемаза выявляется в анаплазированном простатическом эпителии, ее гиперэкспрессия отмечается в раке в виде гранулярного окрашивания цитоплазмы. Однако рацемаза неспецифична для рака простаты и, по некоторым данным, экспрессируется в 90% PIN высокой степени. Чаще всего используют сочетание 340Е12, р63и рацемазы.
Большинство генетических повреждений выявляется как в раке, так и в простатической интраэпителиальной неоплазии высокой степени (8р12-21, 8р24, PTEN и др.), причем не только в эпителии, но и в окружающей строме.
Дифференциальный диагноз
Дифференцировать PIN высокой степени следует с атрофией, постатрофической гиперплазией, атипической базальноклеточной гиперплазией, криброзной гиперплазией, метапластическими изменениями при лучевом воздействии, простатите и инфарктах.
При большинстве из них наблюдается структурная и клеточная атипия, включая увеличение ядрышек. Криброзная карцинома, протоковая (эндометриоидная) карцинома, уротелиальная карцинома, вовлекающая протоки и ацинусы простаты, могут трактоваться как PIN высокой степени.
Атипическая мелкодцинарная пролиферация
Около 4% биоптатов простаты содержат мелкие ацинарные структуры, крайне подозрительные по принадлежности к раку, однако малые по объему для категорического диагноза. У большинства пациентов (> 60%) с атипической мелкоацинарной пролиферацией (atypical small acinar proliferation, ASAP) при повторных биопсиях выявляется инвазивная аденокарцинома.
ASAP — это мелкий фокус атипичных структур (не более 7 ацинусов, менее булавочной головки), недостаточный для постановки диагноза рака. (рис. 3.63 и 3.64).

Рис. 3.63. Очаг атипической мелкоацинарной пролиферации. Окраска гематоксилином и эозином. х100

Рис. 3.64. Очаг атипической мелкоацинарной пролиферации. Окраска гематоксилином и эозином. х200
При ИГХ-исследовании базальные клетки в таких очагах не выявляются и отмечается гиперэкспрессия рацемазы, однако категорический диагноз инвазивного рака по столь малому фокусу не совсем корректен. Диагноз ASAP служит показанием для повторной биопсии.
В последнее время широко применяется термин «микрокарцинома предстательной железы». Опухоль представляет собой единичный очаг аденокарциномы менее 1 мм в диаметре, по Глисону не оценивается (рис. 3.65 и 3.66).

Рис. 3.65. Микрокарцинома предстательной железы. Опухоль менее 1 мм в диаметре. Окраска гематоксилином и эозином. х50

Рис. 3.66. Микрокарцинома предстательной железы Опухоль менее 1 мм в диаметре. Окраска гематоксилином и эозином. х200
Молекулярно-генетические исследования
Самыми частыми генетическими нарушениями эпителиальных опухолей служат гомозиготные и гетерозиготные делеции. Рак предстательной железы характеризуется в первую очередь хромосомными делециями участков 3р, 8р (описано в 80% случаев), 10q, 13q и 16q, амплификациями локусов 7q, 8q, что приводит к снижению или потери экспрессии генов-супрессоров. Реже встречаются делеции в участках 6q, 17р и 18q.
Частота обнаружения химерных генов при раке предстательной железы достигает 79%. Гены образованы слиянием 5′-нетраслируемой области гена TMPRSS2 с генами семейства транскрипционных факторов ETS.
Последние регулируют экспрессию генов, вовлеченных в процессы клеточного роста, дифференцировки и трансформации. Результатом генетических изменений становится образование андроген-чувствительных химерных транскриптов, обеспечивающих механизм гиперэкспрессии транскрипционных факторов ETS.
Наиболее частым вариантом представляется слияние TMPRSS2 с расположенным рядом геном ERG4 (21q22.2). Показано, что эта мутация связана с неблагоприятным прогнозом у больного: инвазия в семенные пузырьки, ранний рецидив и агрессивное течение, поздние стадии заболевания и метастазирование, летальный исход.
При раке предстательной железы описано более 40 генов, которые подвергаются аномальному гиперметилированию и кодируют супрессоры опухолевого роста и белки, принимающие участие в сигнальных путях гормонального ответа, в опухолевой инвазии, контроле клеточного цикла и репарации повреждений ДНК.
Впервые гиперметилирование промоторной области при раке предстательной железы было показано для GSTP1, кодирующего глутатионтрансферазу S (фермент, отвечающий за детоксикацию электрофильных и кислых ксенобиотиков). Это изменение считается самым частым и наиболее ранним событием канцерогенеза.
По данным разных авторов, частота метилирования GSTP1 вы является в 70-100% случаев аденокарциномы предстательной железы, а также обнаруживается при изменениях простатической интраэпителиальной неоплазии и пролиферативной атрофии.
Метилирование промоторной области гена Е-кадгерина, регулирующего адгезию клеток, обнаруживается с частотой до 70% и связано со снижением экспрессии соответствующего белка Для других генов, вовлеченных в кадгерин-катениновую адгезивную систему (CD44, CDH13, CAV1, LAMb3), описана эпигенетическая инактивация путем метилирования промоторных областей, но с меньшей частотой.
Метилирование классического гена-супрессора опухолевого роста RASSF1 — раннее событие развития рака предстательной железы и нарастает по мере прогрессии заболевания. Имеется связь гиперметилирования генов RARb, Erb и 77G со стадией процесса и степенью дифференцировки опухоли.
Опухоли из специализированной стромы
Саркомы и другие опухоли специализированной стромы простаты обнаруживаются редко. К ним относят опухоль с неясным потенциалом злокачественности (stromal proliferations of uncertain malignant potential, STUMP) и стромальную саркому.
Дифференциальный диагноз между ними базируется на клеточности. количестве митозов, наличии некроза, степени разрастания стромы. Диаметр опухолей редко превышает 1 см, но описаны узлы, занимающие всю предстательную железу.
Дифференциальный диагноз проводится с высокодифференцированной лейомиосаркомой. При ИГХ-исследовании выявляется экспрессия CD34, рецепторов прогестерона, редко — эстрогена. (Экспрессия гормональных рецепторов подтверждает теорию происхождения этих опухолей из гормонально-активных мезенхимных клеток специализированной стромы.)
Редкое доброкачественное поражение неясной (возможно, реактивной) этиологии. Образование содержит веретеновидные клетки со скудной цитоплазмой и мелким ядром. Клетки формируют разнонаправленные пучки, иногда с формированием «муаровых» структур. Митозы редкие, типичные, число их не превышает 3 в 10 полях зрения. Иммунофенотип не имеет специфических черт, выявляется виментин, гладкомышечный актин, CD34, S-100.
Послеоперационный веретеноклеточный узел
Синоним: послеоперационная воспалительная миофибробластическая опухоль.
Морфологическая картина сходна с воспалительной миофибробластической опухолью. Это крайне редкое поражение всегда связано с травматическим повреждением. У пациентов в анамнезе отмечается травма или оперативное вмешательство в срок 4-12 нед. перед появлением узла в простате. Диаметр образования не превышает 1 см, могут быть типичные митозы и очаги некроза.
Обработка операционного материала после радикальной простатэктомии
Прежде всего, необходимо правильно расположить препарат (ориентируясь по семенным пузырькам), определить правую и левую доли, переднюю и заднюю поверхности, базальную часть и апекс железы. Провести измерение железы, семенных пузырьков, семявыносящих протоков.
С помощью специальных красителей или чернил окрасить поверхность предстательной железы и основание семенных пузырьков (рис. 3.67).

Рис. 3.67. Окрашенный препарат предстательной железы до фиксации
Можно использовать два цвета, отдельно промаркировав правую и левую доли при вырезке.
Стоит уделить особое внимание возможному повреждению поверхности железы в ходе операции, так как это может привести к диагностике ложноположительного хирургического края.
Препарат фиксируют в 10% забуференном формалине в течение 24-36 ч.
• Положить предстательную железу на заднюю поверхность.
• Перпендикулярно к уретре отрезать апекс — пластинку толщиной 7 мм.
• Остальную часть простаты резать параллельно базису на пластины с шагом 3 мм.
• Апекс маркируется отдельно, так как именно в этой зоне, по статистическим данным, чаще всего отмечается прорастание рака за пределы псевдокапсулы железы. Цель исследования апекса — оценить хирургический край, поэтому он режется на пластинки параллельно уретре (сагиттально) и таким образом укладывается в кассеты (рис. 3.68 и 3.69).

Рис. 3.68. Схема вырезки предстательной железы

Рис. 3.69. Вырезка предстательной железы. Левая доля окрашена желтым, правая — красным
• Пластины делят на 4 или более частей (по размеру кассеты).
• При маркировке материала важно отметить правую и левую доли, переднюю и заднюю поверхности железы.
Данная схема вырезки операционного материала позволяет более точно определить локализацию и объем опухолевых очагов (рис. 3.70 и 3.71).

Рис. 3.70. Топическая диагностика рака предстательной железы. Сканированное изображение, белым цветом выделены участки аденокарциномы

Рис. 3.71. Топическая диагностика рака предстательной железы. Сканированное изображение срезов, голубым цветом выделены участки аденокарциномы
Рак предстательной железы характеризуется мультицентрическим ростом и зачастую не выявляется макроскопически. В связи с этим необходимо взять в работу достаточное количество материала и оставить сырой запас при большом объеме органа.
В том случае, если при исследовании операционного материала диагноз рака не подтверждается, следует провести тотальное изучение запаса (особенно тщательно исследуются препараты предстательной железы после предоперационного лечения).
Гистологическое заключение
В гистологическом заключении кроме формы рака предстательной железы необходимо указать распространенность опухоли по зонам (периферическая, переходная, центральная, апекс) и долям, сумму Глисона, наличие периневральной, периваскулярной, лимфоваскулярной инвазии, врастание/прорастание псевдокапсулы железы, распространение на семенные пузырьки, простатический отдел уретры.
Проводится оценка маркированного хирургического края и лечебного патоморфоза опухоли в случаях предоперационного лечения. Положительным хирургическим краем (опухоль в крае резекции) считается непосредственное наличие структур опухоли в маркированной красителем линии. В этом случае желательно локализацию и протяженность положительного края (рис. 3.72) для планирования тактики послеоперационного лечения.

Рис. 3.72. Положительный хирургический край. Гранулы желтого красителя располагаются непосредственно в опухолевых структурах. Окраска гематоксилином и эозином. х100
При наличии хотя бы малой прослойки нормальной ткани между окрашенной линией и опухолевыми комплексами (даже 2 ряда клеток) край считается отрицательным (рис. 3.73).

Рис. 3.73. Негативный хирургический край Гранулы желтого красителя отделены от опухоли прослойкой стромы. Окраска гематоксилином и эозином. х 100