Чем отличаются истинные растворы коллоидные и грубодисперсные системы
Понятие дисперсных систем и их классификация
Дисперсные системы — что это такое в химии
Чистые вещества встретить в природном мире практически невозможно. В большинстве случаев они представляют собой гомогенную субстанцию, содержащую в своем составе частицы различных примесей. При этом не является обязательным наличие двух компонентов в смеси. Их количество может быть любым. Если одно вещество равномерно распределено в другом и не растворяется в нем, то такая система называется дисперсной системой.
Дисперсная система — гетерогенная (не однородная система), состоящая минимум из двух компонентов (фаз), один из которых (называемый дисперсной фазой) равномерно распределен по объему другого (называемого дисперсионной средой).
В составе типичной двухфазной системы выделяют:
В том случае, когда в системе несколько фаз, их можно отделить друг от друга. Для этого используют разные физические способы, к примеру, центрифугирование, сепарация. Типичные дисперсные системы относятся к коллоидным растворам (золям).
Характеристика и особенности строения
Дисперсные системы являются гетерогенными смесями, в которых одно или более веществ распределены в другом. Каждый компонент системы обладает собственными свойствами. После извлечения его из системы его состояние будет соответствовать начальному.
Вещество, содержание которого в дисперсной системе выше, называют дисперсионной средой.
Второстепенное вещество является дисперсной фазой. В дисперсной системе не наблюдается взаимное взаимодействие между частицами. При этом имеется некая прослойка, которая их разделяет. Функцию этой прослойки выполняет вещество, образующее дисперсионную среду. В связи с этим системы называют гетерогенными или неоднородными.
В качестве примеров дисперсных систем можно привести:
Перечисленные системы могут обладать любым агрегатным состоянием. В некоторых случаях допускается наличие одновременно нескольких фаз. Выделить их можно с использованием центрифуги или сепарированием.
Дисперсная фаза — вещество, равномерно распределенное в окружающей ее дисперсионной среде и не взаимодействующее с ней либо с другой дисперсной фазой при ее наличии в дисперсной системе.
Дисперсная фаза может состоять из аналогичных или неодинаковых по величине частиц, капель, либо пузырьков, которые расположены на некотором расстоянии друг от друга. По кинетическим свойствам (подвижность фазы), выделяют следующие типы дисперсных систем:
Свойства, которые характеризуют дисперсные системы, зависят от одного ключевого фактора. В результате их формирования образуется четкая межфазная граница.
В природе чаще можно встретить грубодисперсные системы. В этом случае фазу и среду различают при рассмотрении под микроскопом, а иногда и невооруженным глазом.
Рассмотренные системы характеризуются следующими показателями:
В окружающей среде дисперсные системы встречаются повсеместно. Они могут быть природного и естественного происхождения. Существуют системы, выводимые в искусственном виде. В основе разных лекарственных составов, минеральных и химических удобрений, технологических процессов лежит явление дисперсности.
Классификация дисперсных систем
Дисперсные системы являются образованиями, в состав которых включено две фазы и более, почти не смешивающихся и не взаимодействующих друг с другом. В одном веществе, определяемом как дисперсионная среда, распределено другое вещество в виде дисперсной фазы. В зависимости от размеров частиц дисперсной фазы, системы классифицируют таким образом:
За основу максимально полной классификации дисперсных систем принимают агрегатное состояние среды и фазы. Благодаря сочетаниям трех типов агрегатного состояния, выделяют девять разновидностей двухфазных дисперсных систем.
Краткая запись таких систем имеет вид дроби с числителем, указывающим на дисперсную фазу, и знаменателем, определяющим дисперсионную среду. В качестве примера можно привести обозначение Г/Ж для системы «газ в жидкости».
Исходя из характера кинетических свойств фазы, двухфазные дисперсные системы разделяют на два класса:
Рассмотренные дисперсные системы разделяют согласно степени дисперсности. В том случае, когда частицы дисперсной фазы в системе обладают идентичными размерами, такую систему называют монодисперсной. Если частицы фазы отличаются по размерам, то система является полидисперсной. Чаще в реальном мире можно встретить полидисперсные системы.
Существуют примеры дисперсных систем, которые отличаются большим количеством фаз. Такие комплексы называют сложными дисперсными системами. В качестве примера можно рассмотреть процесс вскипания жидкой дисперсионной среды с твердой дисперсной фазой, который приводит к образованию трехфазной системы «пар — капли — твердые частицы».
К сложным дисперсным системам можно отнести молоко. В веществе содержатся в большой концентрации, за исключением воды, жир, казеин, молочный сахар. Жир в молоке имеет вид эмульсии, в процессе хранения продукта он медленно поднимается наверх, образуются сливки.
Казеин является коллоидным раствором и не способен самостоятельно выделяться. С другой стороны, казеин достаточно просто выпадает в осадок в процессе подкисления молока, к примеру, с помощью уксуса. В результате образуется творог. Естественное выделение казеина можно наблюдать, когда молоко скисает. Молочный сахар в молоке представляет собой молекулярный раствор, который способен выделяться только в процессе испарения воды.
Классификация свободнодисперсных систем в зависимости от размеров частиц:
Ультрамикрогетерогенные системы по-другому называют коллоидными или золями. Исходя из того, какова природа дисперсионной среды, золи классифицируют следующим образом:
Микрогетерогенные системы представлены следующими типами:
Среди наиболее распространенных грубодисперсных систем можно отметить комплексы «твердое тело — газ». Примером такой системы является песок.
Взвеси — являются дисперсионными системами, в которых фазы хорошо различимы визуально даже невооруженным глазом.
Ключевой характеристикой взвесей служит непрозрачность. При необходимости отделения среды и второстепенного вещества допустимо использовать стандартные фильтры или провести процедуру отстаивания. Классификация взвесей:
Взвеси обладают большим значением для хозяйственной деятельности человека и природных процессов. В производстве активно применяют растворы. В окружающей среде распространены натуральные водные соединения, благодаря которым образуются почвы, и грунт насыщается питательными веществами. Взвеси являются непосредственными участниками жизнедеятельности всех живых существ.
Коллоидные системы важны для биологии и жизни человека. Биологические жидкости организма состоят из веществ, которые находятся в коллоидном состоянии. Такие биологические объекты, как клетки мышц и нервов, рассматривают в качестве коллоидных растворов. Дисперсионная среда крови представлена в виде плазмы, то есть водного раствора неорганических солей и белков.
Коллоидные системы отличаются от взвесей тем, что их разделение возможно лишь при наличии современного оборудования и специальных препаратов. Визуально данные комплексы можно идентифицировать, как однородные субстанции. По этой причине затруднено определение дисперсности коллоидных систем. Выделяют следующие типы:
Коллоидные системы имеют большое значение для химии. Данные системы получают с помощью смешивания в специальной технике. Производство подобных структур способствует созданию множества медицинских средств, удобрений и других полезных материалов.
Типы растворов высокомолекулярных веществ:
Принадлежность к той или иной группе определяется качествами высокомолекулярного вещества такими, как:
Свойства высокомолекулярных веществ:
Самопроизвольное образование характерно для определенных полимерных растворов. В том случае, когда набухание выполняется неорганическим методом, дисперсная система прекращает свое существование. Это связано с полным растворением фазы в среде, что сопровождается химической реакцией. Если метод набухания органический, то можно наблюдать получение студня.
Отдельно выделяют связнодисперсные системы, к которым относят пористые материалы. В зависимости от размеров пор, данные вещества классифицируют таким образом (классификация М.М. Дубинина):
Согласно рекомендациям ИЮПАК, микропористыми называют пористые материалы с размерами пор до 2 нм, мезопористыми — от 2 до 50 нм, макропористыми — свыше 50 нм.
Классификация пористых материалов в зависимости от структуры:
В зависимости от геометрических признаков пористые структуры классифицируют следующим образом:
Большинство пористых материалов обладают стохастической структурой.
В качестве примера твердых гетерогенных систем можно привести композитные материалы. Композиты являются искусственно полученными сплошными, но неоднородными структурами. В состав данных материалов может быть включено два компонента и более. Отличительной особенностью являются четкие границы раздела между составными элементами. Кроме слоистых, большинство компонентов композитных материалов подразделяются на следующие группы:
Старейшими композитами являются саман, железобетон, булат, папье-маше. В современной промышленности активно практикуют применение фиброармированных пластиков, стеклопластика, металлокерамики.
Движение дисперсных систем
Движение дисперсных систем изучает наука механика многофазных сред. К примеру, для исследования в области пристеночных течений системы «газ — жидкие капли» используют математическое моделирование. На основе полученных данных разрабатывают технологии нанесения разнообразных покрытий и оптимизируют различное теплоэнергетическое оборудование — такое, как паротурбинные установки и теплообменники.
С другой стороны, наличие разных типов структуры пристеночных течений многофазных сред делает необходимым учет различных факторов — таких, как инерционность капель, формирование жидкой пленки, фазовые переходы. Данные задачи решают путем конструирования особых математических моделей многофазных сред, разработки которых активно ведутся в настоящее время.
Возможности для изучения аналитическим методом нестационарных газодинамических течений многофазных дисперсных сред с несущей фазой в виде газа, которая включает в себя мелкие частицы твердого или жидкого вещества, значительно ограничены. В этом случае предпочтение отдается способам вычислительной механики.
Актуальны исследования подобных течений, когда существуют интенсивные фазовые переходы. В качестве примера можно привести:
При рассмотрении свободнодисперсных систем, среда в которых представлена в газообразном или жидком агрегатном состоянии — например, аэрозолей, коллоидных растворов, газовых эмульсий, мицеллярных растворов поверхностно-активных веществ, — можно сделать вывод о подвижности дисперсных частиц. Они могут совершать вращательные движения, колебания с неодинаковой амплитудой.
Подвижность дисперсных частиц, особенно высокодисперсных и ультрадисперсных, является фундаментальным свойством свободнодисперсных систем. Дисперсные частицы движутся за счет различных факторов. Процесс определяется размером частиц. Для высокодисперсных частиц характерны малые размеры, что способствует их активному участию в броуновском движении. Такое явление рассматривают в качестве проявления молекулярно-кинетических свойств дисперсных систем.
Другим молекулярно-кинетическим свойством является диффузия дисперсных частиц, в процессе которой они перемещаются по причине неодинаковой концентрации в разных участках дисперсной системы. Благодаря диффузии, концентрация частиц постепенно становится однородной. Согласно второму началу термодинамики, при диффузии можно наблюдать увеличение энтропии дисперсной системы.
Дисперсные частицы, обладающие большими размерами (в том числе, твердые частицы, капли, газовые пузыри), почти не принимают участия в броуновском движении. Таким образом, для грубодисперсных систем не характерны молекулярно-кинетические свойства. Данный признак позволяет квалифицировать системы на высокодисперсные и грубодисперсные.
Основная причина движения крупных дисперсных частиц заключается в разнице между плотностями дисперсной фазы и дисперсионной среды. В том случае, когда плотность дисперсной фазы больше, частицы медленно выпадают в осадок в результате воздействия силы тяжести. Такое явление называют седиментацией. Частицы, которые обладают меньшим весом, всплывают на поверхность. Тогда процесс называют обратной седиментацией.
На движение дисперсных частиц оказывают влияния другие внешние силы. Большое значение для коллоидной химии имеет движение заряженных частиц дисперсной фазы в электрическом поле. Такой процесс носит название электрофорез.
В отдельную группу выделяют перемещения дисперсных частиц, происходящие совместно с движущейся дисперсионной средой. Данные потоки являются двухфазными и обладают рядом существенных отличий от однофазных потоков газов или жидкостей.
К примеру, наличие в жидком веществе малого количества дисперсных частиц способствует увеличению степени вязкости дисперсной системы в сравнении с аналогичными показателями дисперсионной среды.
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
5.4. ДИСПЕРСНЫЕ И КОЛЛОИДНЫЕ СИСТЕМЫ
Важная роль в пищевой технологии принадлежит дисперсным и коллоидным системам и их свойствам.
Дисперсные системы гетерогенны и состоят из двух фаз. Одна из них — сплошная, называется дисперсионной средой. Другая — раздробленная и распределенная в первой, называется дисперсной фазой.
Дисперсными системами являются большинство продуктов питания, сырье и полуфабрикаты: хлеб, мука, шоколад, сыры, творог, сухое молоко, соки, шампанское, пиво, конфеты и т. п.
5.4.1. Классификация дисперсных систем
Все дисперсные системы классифицируют по степени дисперсности.
Дисперсные системы с частицами, размер которых превышает 10
3 см, относятся к грубодисперсным системам. Эти частицы при распределении в жидкости или газе, где они постепенно оседают или всплывают, наблюдаются визуально.
Дисперсные системы классифицируются не только по размерам частиц, но и по агрегатному состоянию дисперсной фазы и дисперсионнойсреды.
Сочетание трех агрегатных состояний (твердое, жидкое и газообразное) дает 9 типов дисперсных систем (см. табл. 3). Условно их обозначают дробью, числитель которой указывает на агрегатное состояние дисперсной фазы, а знаменатель— дисперсионной среды. Например, обозначение Г/Ж показывает, что система состоит из газообразной дисперсной фазы и жидкой дисперсионной среды (газообразное вещество в жидкости).
Типы дисперсных систем
5.4.2. Коллоидные системы
Дисперсные системы с частицами коллоидных размеров принято называть золями (от лат. solutio — раствор).
Системы с газовой дисперсионной средой независимо от природы газа называют аэрозолями. Системы с жидкой дисперсионной средой — лиозолями (от греч. lios — жидкость).
По размеру частиц золи занимают промежуточное положение между истинными растворами и грубодисперсными системами — порошками, суспензиями и эмульсиями.
Коллоидные системы образуются двумя путями.
При этом необходимыми условиями образования коллоидных систем являются нерастворимость вещества дисперсной фазы в дисперсионной среде; достижение частицами дисперсной фазы коллоидной дисперсности; наличие стабилизатора, сообщающего коллоидной системе агрегативную устойчивость.
Стабилизаторами могут быть вещества, специально вводимые в дисперсионную среду, например, поверхностно-активные вещества или продукты взаимодействия дисперсной фазы с дисперсионной средой. Стабилизаторы создают вокруг коллоидных частиц адсорбционный защитный слой, препятствующий их агрегатированию.
В производстве различных пищевых продуктов диспергирование и конденсация занимают одно из ведущих мест. Это обусловлено особенностями вещества в дисперсном состоянии, которые обеспечивают удобства фасования, транспортирования, дозирования, способствуют увеличению скоростей химических и биохимических реакций и процессов растворения, сорбции, экстракции и других процессов.
Диспергирование используют при дроблении и измельчении зерна в муку, какао-бобов в какао тертое и какао-порошок, сахара в сахарную пудру, в консервной промышленности при гомогенизации плодово-ягодных пюре и т. п.
Конденсация возникает в ректификационных аппаратах при получении спирта, кристаллизации сахара, выпаривании растворов, оклейке вин и т. д.
Коллоидные системы обладают молекулярно-кинетическими свойствами, обусловленными самопроизвольным движением частиц. Это такие свойства, как диффузия, осмотическое давление и распределение частиц по высоте.
На коллоидные частицы, распределенные в дисперсионной среде, действуют две противоположно направленные силы: сила тяжести и сила диффузии. Под действием силы тяжести частицы стремятся осесть на дно — седиментировать (от латинского слова sedimentum — осадок). Силы диффузии же стремятся распределить частицы равномерно по всему объему системы. Таким образом, дисперсные системы способны сохранять определенное распределение частиц по объему. Эта способность называется седиментационной или кинетической устойчивостью.
Грубодисперсные системы кинетически неустойчивы, их частицы велики и поэтому под действием силы тяжести оседают на дно. Молекулярные системы (газы, растворы) обладают очень высокой кинетической устойчивостью. Кинетическая устойчивость коллоидных систем зависит от размеров их частиц: чем меньше размер частиц, тем более кинетически устойчива коллоидная система.
5.4.3. Микрогетерогенные системы
СУСПЕНЗИИ
Суспензии представляют собой дисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой. К ним относятся фруктовые и овощные пасты, помадные конфетные массы, какао тертое и др.
ЭМУЛЬСИИ
Дисперсные системы, состоящие из жидкой дисперсной фазы и жидкой дисперсионной среды, называются эмульсиями. Обязательное условие образования эмульсии — нерастворимость вещества дисперсной фазы в дисперсионной среде.
Обычно эмульсии получают методом механического диспергирования. Для этого используют различные мешалки, смесители, гомогенизаторы, коллоидные мельницы и ультразвук.
Жидкости, из которых получают эмульсии, нерастворимы друг в друге и, следовательно, отличаются по своим свойствам. Практически одной из жидкостей всегда является вода, а другой — какая-либо неполярная, нерастворимая в воде жидкость, например, масло.
Эмульсии — неустойчивые системы. Неустойчивость этой системы проявляется в самопроизвольном слиянии капелек дисперсной фазы — коалесценции, что приводит к разрушению эмульсии и разделению ее на два слоя.
Устойчивость эмульсиям может придать только третий компонент — стабилизатор или эмульгатор. Роль эмульгатора в образовании устойчивой эмульсии заключается, во-первых, в том, что он адсорбируется на границе раздела фаз масло — вода (М/В) и снижает межфазное поверхностное натяжение, т. е. является поверхностно- активным веществом, а во-вторых, концентрируясь на поверхности капелек дисперсной фазы, эмульгатор образует механически прочный слой (пленку). Наличие такой защитной пленки на поверхности частиц дисперсной фазы препятствуют их слиянию, т. е. предохраняет эмульсию от коалесценции.
Природа эмульгатора определяет не только устойчивость, но и тип эмульсии. Эмульгаторы, растворимые в воде, способствуют образованию прямых эмульсий (М/В); эмульгаторы, растворимые в неполярных жидкостях, дают обратные эмульсии (В/М).
К представителям эмульсий относится ряд важнейших жиросодержащих продуктов, например, молоко, сливки, сливочное масло, сметана и майонез. Все это — эмульсии.
АЭРОЗОЛИ И ПОРОШКИ
Аэрозоли и порошки — это дисперсные системы, дисперсионной средой которых является газ (воздух), а дисперсной фазой могут быть твердые частицы или капельки жидкости.
Аэрозоли имеют большое практическое значение в ряде отраслей пищевой промышленности. К типичным аэрозолям относятся водяной туман, топочный дым, мучная и сахарная пыль. В ряде случаев в промышленности прибегают к искусственному получению аэрозолей. Так, для высушивания соки, пюре, молоко распыляют до мельчайших капелек в сухом горячем воздухе. Из образующегося аэрозоля благодаря его большой удельной поверхности испарение влаги идет очень интенсивно, и сушка заканчивается за 15-20 с.
Образование аэрозолей может привести к нежелательным и опасным последствиям. Так, пыль многих веществ — муки, сахара, крахмала, угля — образует с воздухом взрывоопасные смеси.
Порошки можно рассматривать как осажденные аэрозоли с твердыми частицами. Однако частицы в них могут быть более крупными и достигать в диаметре 1-2 мм. Размер частиц промышленных порошков определяется их целевым назначением и часто является одним из основных показателей качества продукта. Например, дисперсность и распределение частиц по размерам в какао-порошке влияют на вкусовые качества и пищевую ценность этого продукта. Степень помола зерна оказывает влияние на качество муки.
ПЕНЫ
Высококонцентрированные дисперсные системы, в которых дисперсионная среда — жидкость, а дисперсная фаза — газ, называются пенами.
Пузырьки газа в пенах имеют большие размеры, форму многогранников и отделены друг от друга очень тонкими слоями дисперсионной среды.
Для получения пен применяют диспергационные методы: интенсивное встряхивание или перемешивание жидкости.
Устойчивую пену можно получить только в присутствии стабилизатора — пенообразователя. Это связано с тем, что поверхность жидкости, соприкасающаяся с газообразной средой, находится в особых условиях по сравнению с основной массой жидкости. Эти условия возникают потому, что молекулы поверхностного слоя жидкости в отличие от молекул, находящихся в глубине, подвергаются неодинаковому притяжению молекул жидкости и газа. Каждая молекула внутри жидкости со всех сторон притягивается соседними молекулами, расположенными на расстоянии радиуса сферы действия межмолекулярных сил. В результате силы притяжения компенсируются, и равнодействующая этих сил равна нулю. У молекул поверхностного слоя часть сферы действия межмолекулярных сил находится в газовой фазе, плотность которой меньше плотности жидкости, поэтому равнодействующая всех сил притяжения будет направлена внутрь жидкости перпендикулярно к ее поверхности. Вследствие этого поверхностные молекулы жидкости всегда находятся под действием силы, стремящейся втянуть их внутрь. Это приводит к тому, что поверхность жидкости всегда стремится сократиться. Этим объясняются и шарообразная форма капли жидкости (шар имеет минимальную поверхность), и идеально гладкая поверхность жидкости в широком сосуде. При увеличении поверхности некоторое число молекул из глубины жидкости переходит на поверхность. Процесс переноса молекул из равновесного состояния в особое состояние молекул поверхностного слоя требует затраты внешней работы. Работа по увеличению площади поверхности жидкости переходит в потенциальную энергию молекул поверхностного слоя— поверхностную энергию. Последняя, в свою очередь, отнесенная к единице поверхности, называется поверхностным натяжением.
Пенообразующие вещества с длинной молекулярной цепью уменьшают поверхностное натяжение, облегчают образование пены и придают ей стабильность, так как они адсорбируются на границе вода-воздух и образуют высоковязкую структурированную пленку, препятствующую стеканию жидкости. В этом случае толщина слоя жидкости между пузырьками воздуха уменьшается медленно, и пена может существовать длительное время.
Пенообразование имеет важное практическое значение. В частности, многие продукты, такие как хлеб, ряд кондитерских изделий, имеют структуру пены, что определяет их вкусовые свойства и пищевую ценность.
5.4.4. Молекулярные коллоиды (растворы высокомолекулярных соединений)
Вещества, имеющие молекулярную массу от 10000 до нескольких миллионов, называются высокомолекулярными соединениями (ВМС). Размеры макромолекул этих соединений в вытянутом состоянии могут достигать 1000 нм и более, т. е. они соизмеримы с размерами частиц ультрамикрогетерогенных (коллоидных) дисперсных систем.
Вследствие большой молекулярной массы и гибкости цепей макромолекул ВМС га растворы обладают специфическими свойствами: способностью образовывать волокна и пленки, эластичностью, набухаемостью, структурообразованием.
К важнейшим природным полимерам относятся белки и полисахариды.
По химической структуре белки являются полиамидами, исходными мономерами для их синтеза служат а-аминокислоты.
Полисахариды представляют собой соединения, состоящие из многих сотен и даже тысяч моносахаридных звёньев. К наиболее важным полисахаридам относятся крахмал, целлюлоза, пектин и др.
Растворы ВМС по своим свойствам аналогичны коллоидным системам. Так же, как и у коллоидных растворов, у них сравнительно невелика скорость диффузии, небольшое осмотическое давление, они не проходят через полунепроницаемые мембраны.
В отличие от золей растворы ВМС образуются самопроизвольно и не нуждаются в стабилизаторе.
Растворению ВМС предшествует его набухание.
Набухание — это самопроизвольный процесс поглощения низкомолекулярного растворителя высокомолекулярным веществом, сопровождающийся увеличением массы и объема последнего. Набухание часто является начальным этапом растворения высокомолекулярных веществ.
Существует ограниченное и неограниченное набухание. При ограниченном набухании объем и масса полимера достигают определенных значений, и дальнейший контакт полимера с растворителем не приводит к каким-либо изменениям. Ограниченно набухший полимер называется студнем. У неограниченного набухания отсутствует предел набухания; с течением времени полимер поглощает все большее количество жидкости и набухание переходит в растворение.
Причиной набухания является диффузия молекул низкомолекулярного растворителя в высокомолекулярное вещество. Между макромолекулами полимера обычно имеются небольшие промежутки, размер которых соизмерим с размером молекул растворителя. Благодаря этому молекулы низкомолекулярной жидкости достаточно быстро проникают между макромолекулами, раздвигая молекулярные цепи.
Набухание включает не только простую диффузию, но и сольватацию макромолекул, т. е. взаимодействие молекул растворителя с молекулами полимера.
При взаимодействии высокомолекулярного вещества с полимером сольватируется не вся макромолекула. Если растворитель полярен, то сольватируются полярные группы, если неполярен — то сольватируются неполярные группы. В зависимости от того, каких групп в полимере больше, он будет быстрее набухать в полярном или неполярном растворителе. Обычно набухание — избирательное явление, так как полимер набухает в жидкостях, близких к нему по химическому строению. Так, углеводородные полимеры типа каучук набухают в неполярных жидкостях — бензине, бензоле. Полимеры, в состав молекул которых входят полярные группы, набухают в воде и спиртах.
Чаще всего жидкой дисперсионной средой в пищевых производствах служит вода. При этом следует учитывать, что часть воды находится в свободном состоянии, а часть — в связанном.
В системах, в состав которых входят биополимеры (высокомолекулярные природные соединения — белки, полисахариды), часть воды, прочно связанная с поверхностью этих макромолекул, образует гидратную оболочку. Например, 1 г яичного альбумина связывает 0,25 г воды, образуя гидратный слой толщиной 0,25 нм.
Свободная же вода служит реакционной средой и растворителем веществ. При участии гидролитических ферментов она вступает во множество реакций, в результате которых образуются новые вещества. Таким образом, свободная вода является и активным участником биохимических реакций.
Мука, состоящая главным образом из сухих протеиновых гелей и крахмальных зерен, при замешивании теста (при взаимодействии с водой) проявляет коллоидные свойства.
Крахмал муки, смоченный водой при комнатной температуре, может адсорбционно связать 35-40% влаги. При более высокой температуре и достаточном количестве воды связывание крахмала с водой увеличивается, и при температуре 60°С и избытке воды происходит процесс клейстеризации крахмала, т. е. нарушение структуры крахмальных зерен и образование коллоидного раствора.
Крахмал, смоченный водой в любом соотношении и в любых условиях, не образует связного теста.
Ведущая роль в образовании теста принадлежит белкам пшеничной муки.
Белки способны набухать в холодной воде и удерживать воду в количестве в 2-2,5 раза больше своей массы. При замешивании теста из пшеничной муки белки при достаточном количестве воды легко и сравнительно быстро (через 3-5 мин) образуют тончайшие нити и пленки, связывающие и склеивающие между собой зерна увлажненного крахмала. Благодаря этому пшеничное тесто приобретает упруговязкопластичные свойства, какими не обладает тесто из других злаков.
Крахмал муки состоит из двух основных фракций — амилозы и амилопектина. Амилоза содержится внутри крахмальных зерен, а амилопектин образует их наружную оболочку. Амилоза отличается меньшей величиной частиц и меньшей молекулярной массой (около 80000), а амилопектин — большей величиной частиц и большей молекулярной массой (115000). Это позволяет рассматривать зерно крахмала как осмотическую ячейку, внутри которой находится растворимая низкомолекулярная фракция — амилоза, обусловливающая избыточное осмотическое давление и приток воды внутрь ячейки.
Гидратация муки при разных температурах зависит от поведения белков и крахмала. В температурном интервале 25-40°С гидратация муки происходит преимущественно за счет белков клейковины. Повышение температуры до 60°С приводит к резкому усилению этого процесса в результате значительного увеличения гидратации крахмала при понижении этой способности у белков клейковины.
Таким образом, набухание пшеничной муки при низкой температуре (25-40°С) в основном протекает вследствие осмотического набухания бежов, а при более высокой температуре (60°С) — в результате осмотического связывания воды крахмалом.
В связи с этим схему образования теста можно представить в следующем виде.
Белки, содержание которых в пшеничной муке составляет 10- 20%, при температуре замеса около 30°С поглощают незначительное количество воды путем взаимодействия гидрофильных групп белка с водой, а значительное количество воды диффундирует внутрь белка в результате наличия в нем избыточного осмотического давления.
Крахмал, содержание которого в пшеничной муке достигает 70%, при той же температуре теста поглощает до 30% воды благодаря активности гидрофильных групп. Так как крахмал количественно преобладает в муке, то содержание влаги, связанное крахмалом и белками клейковины, приблизительно одинаково.
При неограниченном оводнении коллоидов муки часть воды находится в свободном состоянии в капиллярах теста. Незначительная часть растворимых белков, а также сахара и неорганические соли находятся в растворе.
Набухшие белки во время замеса плотно соприкасаются друг с другом и образуют сплошную белковую сетку с адсорбционно связанными с ними, слабо набухшими крахмальными зернами. В белковую сетку, кроме того, входят другие нерастворимые вещества. Это приводит к образованию массы (теста), обладающей упруговязкопластичными свойствами.
Недостаточное количество воды при замесе теста приводит к получению несвязной массы увлажненного сырья. При избыточном количестве воды, добавляемой к муке, не образуется связного теста, а получается мучная болтушка, в которой частицы набухшего белка разделены водными оболочками, препятствующими соприкосновению их и образованию клейковинных нитей.
Тесто, используемое для мучных кондитерских изделий, — более сложный комплекс, так как в состав его кроме муки и воды входят и другие виды сырья, в первую очередь сахар и жир, влияющие на набухаемость коллоидов муки.
Сахар, присутствующий в кондитерском тесте в виде водного раствора, оказывает влияние на степень набухания белков клейковины. С увеличением концентрации сахара степень набухания белков снижается.
Жир, адсорбируясь на поверхности белков, образует пленки, препятствующие проникновению воды внутрь макромолекул белков, что ослабляет связь между ними, при этом уменьшается упругость и увеличивается пластичность теста.
Таким образом, регулируя количество сахара и жира, добавляемых при замесе теста, можно получать тесто с определенными физическими свойствами.
5.4.5. Структурообразование в дисперсных системах
Одно из важных свойств дисперсных систем и растворов ВМС — способность их к структурообразованию.
Коллоидные системы, частицы которых удалены друг от друга на достаточно большое расстояние и практически не взаимодействующие между собой, называются свободнодисперсными системами. Такие коллоидные системы по своим свойствам похожи на обычные жидкости. Их вязкость очень мало отличается от вязкости дисперсионной среды.
Дисперсные системы, в которых частицы связаны между собой и не способны к взаимному перемещению, называются связнодис- персными системами. В таких системах частицы дисперсной фазы образуют пространственную сетку или структуру.
Рассмотрим процесс структурообразования на примере пектина при производстве фруктового желе.
Желеобразная консистенция фруктовых консервов достигается благодаря присутствию в сырье пектина, который образует в сахарокислотном растворе пространственную сетку. Пектин при нагревании образует коллоидные растворы. На поверхности молекул пектина адсорбированы молекулы воды, которые создают сольватную (водную) оболочку вокруг частиц пектина. Это препятствует соединению пектиновых молекул для образования пространственной сетки. Для формирования желе необходимо присутствие наряду с пектином Сахаров и кислот.
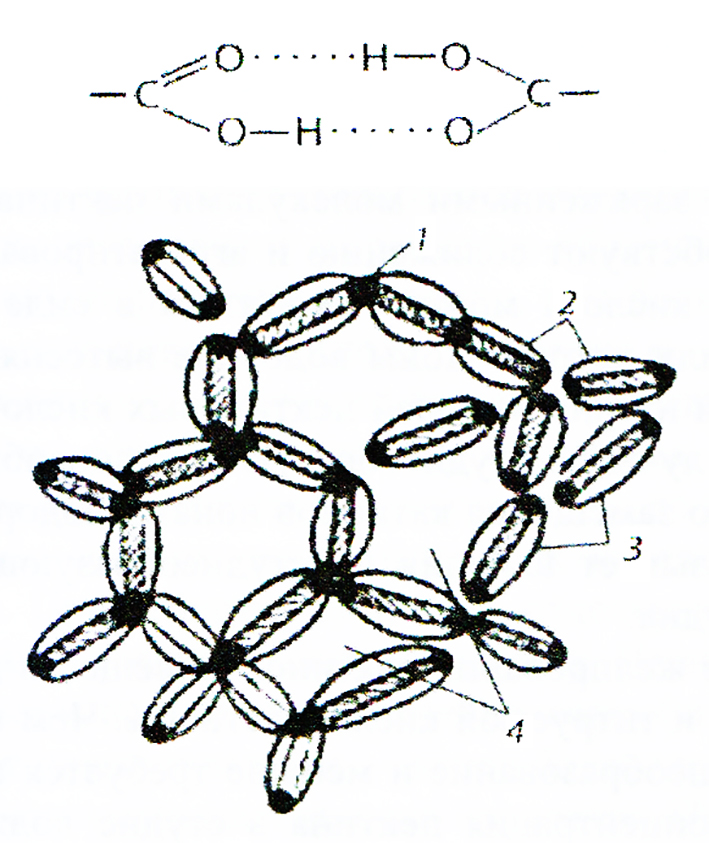
Сила притяжения частиц пектина сосредоточена по краям молекулы. Соединение частиц концами приводит к образованию пространственной сетки, которая охватывает весь объем продукта и служит каркасом студня (см. рис. 25). Укрепление сетки происходит за счет водородных мостиков, которые образуются между карбоксильными и гидроксильными группами соседних пектиновых молекул.
Образовавшиеся ячейки внутри заполнены жидким сахарокислотным раствором. По мере остывания студня тепловое движение замедляется и продолжается процесс укрупнения студня, т. е. сближение молекул и образование цепей. Чем выше концентрация пектина, тем легче сближение молекул и прочнее их сцепление и тем быстрее идет застудневание.
Механическое воздействие на студень при его остывании ослабляет его прочность. Но при нагревании структура студня может быть восстановлена. Это свойство пектиновых студней называется тиксотропией.
Пектино-сахаро-кислотный студень — упруго-эластичная система, в которой каждый компонент выполняет свои функции.
Схема сцепления частиц пектина в желе:
1 — концевые участки, свободные от зарядов; 2 — частицы пектина; 3 — соль- ватные оболочки;
4 — петли пектиновой сетки с дисперсионной средой.
Каркас студня составляет пектин, поэтому прочность студня будет зависеть от вида и качества пектина. Лучше и прочнее студень образуется в присутствии высокометоксилированного пектина, который имеет длинную цепочку с числом метоксильных групп более 70%. Значение имеет также общее содержание пектина в сырье и его природа. Наилучшей желирующей способностью обладает пектин яблок, крыжовника, черной смородины, кожуры цитрусовых. Концентрация пектина должна быть около 1%.
Количество сахара, которое требуется для образования студня, зависит от свойств и количества применяемого пектина. Чем больше пектина и выше его желирующие свойства, тем больше требуется сахара для студнеобразования. Максимальное количество сахара, которое может быть использовано для образования студня, — показатель «сахароемкости» пектина. Он определяет студнеобразующую способность и измеряется в градусах. Это масса сахара, приходящаяся на единицу массы пектина. Для пектина средней студнеобразующей способности содержание сахара должно быть близким к насыщенному раствору при комнатной температуре, т. е. 65%.
Еще один компонент пектинового студня — кислота. Она определяет рН студня. Чем больше диссоциирована кислота, тем более она способствует образованию агрегатов пектиновых молекул, так как при диссоциации кислоты в растворе появляются свободные положительно заряженные ионы водорода (Н + ). Они взаимодействуют с отрицательно заряженными молекулами пектина, нейтрализуют их заряд и способствуют сближению и агрегатированию. Полиметилга-лактуроновая кислота может находиться в виде слаборастворимых солей калия или натрия. Ионы водорода вытесняют и замещают катионы калия и натрия из солей пектиновых кислот, а пектиновые кислоты имеют лучшую студнеобразующую способность, чем их соли. После полного замещения катионов ионами водорода добавление кислоты не оказывает влияния на студнеобразующую способность и прочность студня.
Хорошее желирование пектиновых веществ достигается при рН среды 3,0-3,4 и титруемой кислотности 1%. Чем ниже рН, тем быстрее идет студнеобразование и меньше требуется пектина. Например, при рН 3,1 концентрация пектина в студне должна быть не менее 0,7%, при рН 3,-0,8%, при рН 3,-0,9%. При рН более 3,5 студень образуется непрочный.
Используя способность ВМС к образованию студней, можно получить более сложные дисперсные системы, например, пенообразные кондитерские массы (пастилу). Эти изделия являются в основном агаровым студнем. Он имеет пористую структуру с ячейками микроскопических размеров (до 20 мкм).
В пастильном студне распределены мелкие воздушные пузырьки, и готовая сухая пастила напоминает по своей структуре твердый крем. В производстве пастилы процесс обычного студнеобразования мармелада сочетается с процессом пенообразования (сбивания) яблочно-сахарной смеси.
При сбивании пастилы путем продолжительного встряхивания яблочно-сахарной смеси происходит вспенивание ее, т. е. масса насыщается воздухом; при этом воздух захватывается яблочно-сахарной массой и дробится на мелкие частички. По мере увеличения скорости механического взбалтывания степень раздробленности воздуха увеличивается, размеры пузырьков воздуха уменьшаются, а вязкость массы повышается. Постепенно образуется густая пена, состоящая из мелких пузырьков воздуха, затянутых в тонкую пленку из окружающей полужидкой яблочно-сахарной смеси.
В физико-химическом смысле пена представляет собой двухфазную систему газ-жидкость. В данном случае дисперсной фазой является газ-воздух, а дисперсионной средой — полужидкий раствор сахара, кислоты и пектина. Этот раствор образует оболочку дисперсных частиц газа (воздуха), которая несет на себе поверхностный пограничный слой, отделяющий одну фазу от другой.
В процессе образования пены происходит сильное развитие поверхности раздела на границах газообразной и жидкой фаз. Увеличение поверхности раздела зависит от размеров образующихся воздушных ячеек. Чем меньше размеры последних, тем больше эта поверхность, тем больше сила поверхностного натяжения o.
Сила поверхностного натяжения всегда стремится сократить до минимума общую поверхность раздела всей системы, сделать ее наименьшей. В данном случае она стремится сократить до возможных пределов общую сумму поверхностей отдельных капелек, образующих пенную эмульсию. При действии этой силы отдельные пузырьки воздуха в пене стремятся соединиться в одну массу. Пленка капелек прорывается, отдельные капельки, постепенно сливаясь (агрегируясь) друг с другом, образуют новые пузырьки — капли более крупных размеров, степень дисперсности уменьшается, пена «опадает». Процесс самопроизвольного разрушения пены и эмульсии называется коалесценцией.
В пенах процесс коалесценции идет весьма интенсивно благодаря близкому расположению капелек по отношению друг к другу.
Чтобы сделать пену более устойчивой, стабилизировать ее, в качестве пенообразующего средства (ПАВ) при сбивании пастилы обычно используют белок куриного яйца, который, располагаясь в поверхностном слое пленки пузырьков пены, увеличивает механическую прочность этого слоя и тем самым препятствует прорыванию пленки пузырьков и агрегированию последних.
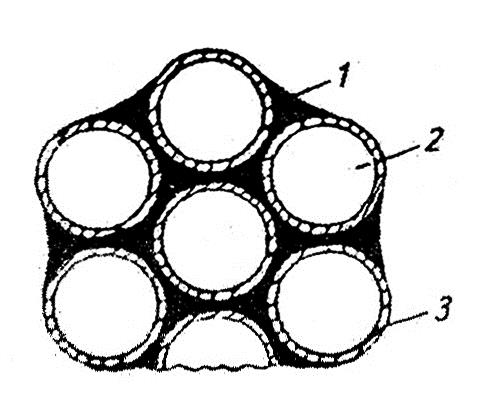
Механизм совмещения студневой и пенной структур при смешивании сбитой массы с агаровой (или мармеладной) можно представить так: при смешивании с холодной сбитой массой горячая масса агарового сиропа или мармелада заполняет воздушные пространства между пузырьками сбитой массы, вытесняя оттуда воздух (см. рис. 26).
При этом прочность пленки структурных элементов массы значительно увеличивается. Последняя возрастает благодаря тому, что температура всей массы поднимается до 50°С и адсорбированный альбуминовый гель пленки при указанной температуре, близкой к свертыванию альбумина, фиксируется в ней в виде плотного коагулята. Одновременно же по мере остывания массы в пространстве между пузырьками происходит формирование прочного агарового (или пектинового) студня. Смешивание сбитой массы с горячей желейной (или мармеладной) массой создает, таким образом, необходимые условия для образования структуры пастилы.
Схема совмещения пенной и студневой структур пастилы:
1 — агаро-сахаро-водный студень; 2 — воздух; 3 — пектино-белково-сахаро- водная пленка.
После остывания массы получается характерный пастельный студень, который отличается от мармеладного только пористой структурой благодаря мельчайшим воздушным включениям, равномерно распределенным в его массе.