Чем отличается молекулы льда и воды
Чем отличаются молекулы воды и молекулы льда?
Понятие молекулы ( и производные от него представления о молекулярном строении вещества, структуры собственно молекулы) позволяет понимать свойства веществ создающих мир. Современные, как и ранние, физико-химические исследования опираются и базируются на грандиозном открытие об атомно-молекулярном строении вещества. Молекула – единая «деталь» всех веществ, существование которой предположил ещё Демокрит. Потому именно её структура и взаимосвязь с другими молекулами (образуя определенное строение и состав) и определяет/объясняет все различия между веществами, их видом и свойствами.
Сама молекула, будучи не самой мельчайшей составной частью вещества (коей является атом) имеет определенную структуру, свойства. Определяется структура молекулы числом вхожих в неё определенных атомов и характером связи (ковалентной) между ними. Состав этот неизменен, даже если вещество преобразуется в другое состояние(как примеру, происходит с водой – об этом пойдет речь дальше).
Характеристики воды, её состояния
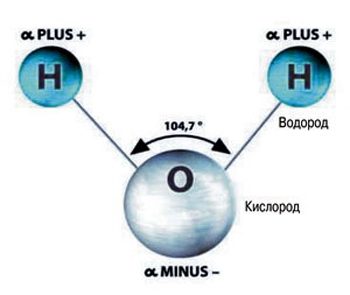
Состав такого вещества, как вода (равно как и её химическая формула) знаком каждому. Каждую её молекулу составляют три атома: атом кислорода, обозначающийся буквой «О», и атомы водорода – латинская «Н», в количестве 2-х. Форма молекулы воды не симметрична (схожа с равнобедренным треугольником).
Вода, как вещество, составляющие её молекулы, реагирует на внешнюю «обстановку», показатели окружающей среды — температуру, давление. Зависимо от последних вода способна изменять состояние, которых три:
Помимо данных различий, естественно, разнятся и способы «перехода» вещества из одного состояния (жидкого) в другие. Эти переходы и трансформируют вещество, и провоцируют передачу энергии (выделение/поглощение). Среди них есть процессы прямые – преобразование жидкой воды в пар (испарение), в лед (замерзание) и обратные – в жидкость из пара (конденсация), из льда (таяние). Также и состояния воды — парообразное и лед — могут трансформироваться друг в друга: возгонка – лед в пар, сублимация – обратный процесс.
Специфичность льда как состояния воды
Широко известно, что лед замерзает ( трансформируется из воды) при пересечении температурой в сторону уменьшения границы в ноль градусов. Хотя, в этом всем понятном явлении, есть свои нюансы. К примеру, состояние льда неоднозначно, различны его виды, модификации. Отличаются они первоочередно условиями, при которых возникают – температурой, давлением. Таких модификаций насчитывается аж пятнадцать.
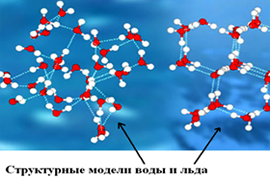
Лед в разных своих видах имеет различное молекулярное строение (молекулы же неотличимы от молекул воды). Природный и естественный лед, в научной терминологии обозначающийся как лед Ih — вещество с кристаллической структурой. То есть, каждая молекула с четырьмя окружающими её «соседками» (расстояние между всеми равное) создают геометрическую фигуру тетраэдр. Другие фазы льда обладают более сложной структурой, к примеру высокоупорядоченная структура тригонального, кубического или моноклинного льда.
Основные отличия льда от воды на молекулярном уровне
Первое и напрямую не относящееся к молекулярному строению воды и льда различие между ними – показатель плотности вещества. Кристаллическая структура, присущая льду, образовываясь, способствует одновременному уменьшению плотности (с показателя почти в 1000 кг/м³ до 916,7 кг/м³). А это стимулирует увеличение объема на 10%. 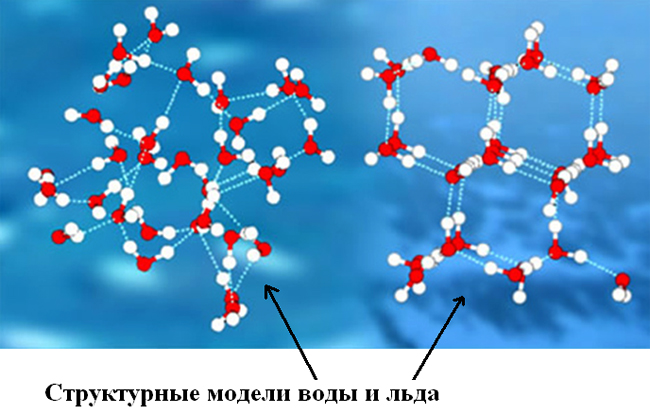
Основное же отличие в молекулярном строении этих агрегатных состояний воды (жидкого и твердого) в количестве, виде и силе водородных связей между молекулами. Во льду же (твердом состоянии) ими объединены пять молекул, а собственно связи водородные прочнее.
Отличает вещество воды в разных её состояниях (агрегатных) не только структура расположения молекул (молекулярное строение), но и движение их, сила взаимосвязи/притяжения между ними. Молекулы воды в жидком состоянии достаточно слабо притягиваются, обеспечивая текучесть воды. В твердом же льду наиболее сильно притяжение молекул, потому и мала их двигательная активность (она обеспечивает постоянство формы льда).
Разница между водой и льдом
В ключевое отличие между водой и льдом заключается в том, что вода не имеет регулярного расположения молекул, тогда как лед имеет определенную кристаллическую структуру. С начальных этапов эволюции Зе
Содержание:
В ключевое отличие между водой и льдом заключается в том, что вода не имеет регулярного расположения молекул, тогда как лед имеет определенную кристаллическую структуру.
С начальных этапов эволюции Земли вода была основной частью Земли. На сегодняшний день вода покрывает более 70% поверхности земли. Отсюда большая часть воды находится в океанах и морях; что составляет около 97%. Реки, озера и пруды содержат 0,6% воды, и около 2% приходится на полярные ледяные шапки и ледники. Некоторое количество воды находится под землей, а незначительное количество находится в газовой форме в виде паров и облаков. Среди них менее 1% воды осталось для непосредственного использования человеком. Эта чистая вода также загрязняется день ото дня, и должен быть надлежащий план экономии воды.
Что такое вода?
Что такое лед?
Водородные связи важны для создания этой упорядоченной твердой структуры во льду. Водородные связи удерживают H2Молекулы O находятся на определенном расстоянии друг от друга, образуя кристаллическую структуру. При этом объем той же массы H2O расширяется (это означает, что при замерзании масса воды становится сравнительно большим, образуя лед). Поскольку при замерзании объем воды увеличивается, плотность льда ниже, чем у воды. Следовательно, он может плавать на воде. Это предотвращает замерзание воды на дне водоемов в зимний период, тем самым защищая водную жизнь.
В чем разница между водой и льдом?
Кроме того, мы можем определить разницу между водой и льдом по их объему и плотности. То есть; при той же массе объем воды сравнительно меньше льда. Потому что плотность воды выше, чем у льда. Приведенная ниже инфографика о разнице между водой и льдом показывает больше различий между ними.