Чем отличается коллаген 1 и 2 типа
Какие бывают типы и виды коллагена?
Коллаген − это белок, состоящий из нескольких аминокислот, включая гидроксипролин, глицин, лизин, аргинин. Он является основой и строительным материалом для всех соединительных тканей в человеческом организме. Это вещество содержится в наших суставах, хрящах, связках, коже и ногтях, но постепенно его количество уменьшается в организме, и поэтому добавки и косметика с коллагеном стали настолько популярными.
Коллаген подразделяется на типы – делится по принципу пользы для организма, и виды – по принципу источника, из которого выделяют коллаген. Разберёмся в нюансах классификации этого важного для человека белка.
Существующие типы коллагена
I и III тип
Первый и третий тип часто ставят рядам, т.к. отвечают они за схожие функции. А именно – за эластичность кожи и обновление её клеток, водный баланс, уменьшение степени изменений, приходящих с возрастом, и усвоение питательных веществ. В продающихся коллагеновых добавках эти два типа тоже часто объединены вместе.
Первый тип является в человеческом организме основным и также находится в наших костях, сухожилиях, связках и дёснах. Третий – в мышцах и кровеносных сосудах. Но основная их функция в поддержании кожных покровов в нормальном состоянии.
II тип
Типы коллагена в продуктах
Коллаген можно получать не только из БАДов, но и из привычных нам продуктов питания.
Как принимать разные типы коллагена?
Дневная норма
Рекомендуемая профилактическая доза I и III типа коллагена − 5000 мг. Так вы улучшите состояние волос и эластичность кожи.
Терапевтическая доза I и III типа коллагена составляет 10000 мг. Такое количество стоит принимать при различных травмах и переломах. Принимать коллаген для терапевтического эффекта стоит 2-3 раза в день, т.к. за один раз усваивается только 5000 мг.
II тип коллагена стоит принимать только для терапевтического эффекта, например, при заболеваниях суставов – дозировка составляет 40 мг в сутки.
Сколько пить по времени?
Стандартный профилактический курс приёма коллагена – 2-3 месяца, всё индивидуально, нужно учитывать свой возраст и цели, преследуемые приёмом коллагена, с последующим трёхмесячным отдыхом. Потом курс следует повторить. При проблемах со здоровьем, суставами, менопаузе или возрастных изменениях курс лечения составляет 6 месяцев с последующими 2 месяцами отдыха.
Производители всегда прикладывают инструкции с рекомендуемой схемой и длительностью приёма именно их биологически активной добавки – прислушивайтесь к ним.
Как пить?
Существующие виды коллагена
Под видом, источником, коллагена подразумевается сырьё, из которого его получают. Коллаген по такому принципу делят на животный, морской и растительный.
Эффективность и биологическая доступность коллагеновой добавки полностью зависит от источника белка.
Животный
Коллаген животного происхождения (говяжий) является наиболее популярной разновидностью такого белка. Его получают путём обработки сырых шкур, суставов и хрящевой ткани крупных рогатых животных. Этот вид достаточно хорошо усваивается и обладает эффектом заживления ран, способствует регенерации и увлажнению. Стоимость этой добавки самая демократичная из всех трёх видов, но есть два недостатка:
Морской
Морской коллаген (его ещё именуют «рыбным») получают из чешуи морских рыб и других обитателей моря. По своему составу этот вид коллагена ближе всего к человеческому, поэтому он легче и лучше воспринимается нашим организмом. Основное преимущество морского коллагена заключается в том, что он может стимулировать производство собственного коллагена в организме и менее аллергенен, чем животный вид.
Минусы морского вида коллагена:
Чем отличается коллаген 1 и 2 типа
• Основная функция коллагена состоит в обеспечении структурной опоры тканей
• Коллагены представляют собой семейство, состоящее более чем из 20 различных белков внеклеточного матрикса. Эти белки — наиболее распространенные в царстве животных
• Все коллагены организованы в тройные спирализованные «коллагеновые субъединицы», обладающие суперспиральной структурой и состоящие из трех отдельных полипептидов
• Коллагеновые субъединицы выходят из клеток и затем, во внеклеточном пространстве, собираются в более крупные фибриллы и волокна
• Мутации в коллагеновых генах вызывают множество патологических состояний, начиная от появления морщин до развития хрупкости костей и таких тяжелых заболеваний, как образование кожных волдырей
Семейство коллагенов включает более 20 белков, которые относятся к наиболее распространенным белкам клеток животных. У многоклеточных организмов коллагены существуют по крайней мере 500 млн лет. Почти все клетки животных синтезируют и секретируют по меньшей мере одну из форм коллагена.
Коллагены обеспечивают тканям структурную поддержку и существуют во множественных формах, организованных в различные структуры. Все белки семейства коллагенов характеризуются одним общим свойством: они собраны в тонкие (примерно 1,5 нм диаметром) тройные спиральные суперспирализованные структуры, состоящие из трех субъединиц коллагеновых белков, которые удерживаются вместе ковалентными и нековалентными связями.
где они связаны между собой другими белками внеклеточного матрикса, включая коллагены, связанные с фибриллами.
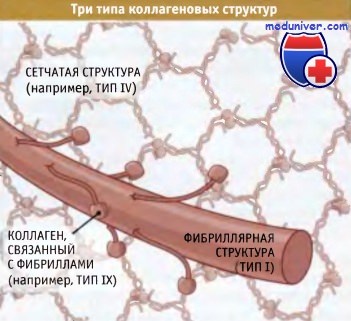
Суперспирализованные структуры бывают трех типов — фибриллярные, слоистые и связанные с фибринами:
• В фибриллярных коллагенах суперспирализованные спирали организованы в фибриллы или «канаты», которые обеспечивают прочность структуры вдоль единственнной оси (такая структура напоминает прочный стальной трос, образованный проволочными пучками). Когда эти фибриллы собраны в параллельно расположенные пучки, как в сухожилиях, они обеспечивают невероятную прочность структуры, которая способна противостоять усилиям, развиваемым мышцами, закрепленными на костях.
• Слоистые коллагены представляют собой сеть, состоящую из суперспирализованных спиральных структур. Они в меньшей степени устойчивы к мышечным усилиям, но гораздо лучше противостоят растяжению в нескольких направлениях. Сеть таких структур, например, характерна для кожи.
• Третий тип коллагена, известный как «фибриллярные связки», образует суперспирализованные спиральные структуры, связывающие коллагеновые фибриллы вместе.
Независимо от организации, коллагены образуют основную каркасную структуру внеклеточного матрикса. Такие входящие во внеклеточный матрикс белки, как фибронектин и витронектин, связываются с коллагенами и вплетены в структуры, образованные коллагеновым каркасом. Один из представителей семейства коллагенов представляет собой трансмембранный белок, который участвует в формировании межклеточных контактов.
Существует примерно 20 различных типов коллагена, большая часть которых может быть сгруппирована в четыре класса. Каждая из тройных спиралеобразных структур обозначается римской цифрой (I, II, III и т. д.). Каждая коллагеновая субъединица имеет обозначение как субъединица а, а ее типу присвоен номер (а1, а2, а3 и т. д.), после которого римской цифрой обозначен тип, в котором она находится. Например, основной фибриллярный коллаген хвоста (и других тканей) крыс относится к типу I и состоит из двух копий субъединиц а1(1) и одной копии субъединицы а2 (I).
На рисунке ниже представлена структура коллагеновых волокон. Три полипептидные субъединицы параллельно обернуты вокруг друг друга и образуют суперспирализованную спиральную структуру длиной 300 нм. Для коллагенов характерна повторяющаяся последовательность аминокислот, содержащая элемент глицин-X-Y, где X и Y могут представлять собой любую аминокислоту, но обычно это пролин и гидроксипролин соответственно.
Такая последовательность способствует плотной упаковке трех субъединиц и облегчает образование суперспиральной структуры. Субъединицы длиной 300 нм скрепляются вместе посредством ковалентных связей, которые образуются между N-концевым участком одной субъединицы и С-концевым участком примыкающей к ней. Суперспирализованные спиральные структуры располагаются параллельно, образуя между собой небольшие зазоры (64-67 нм). Эти зазоры обеспечивают характерный вид (исчерченность) фибрилл, видимый в электронном микроскопе.

характеру полимерных форм и по распределению в тканях. Некоторые группы включают коллагены нескольких типов.
Полностью собранные коллагеновые структуры (фибриллярные или сетчатые) по размерам оказываются гораздо больше, чем сами клетки; некоторые фибриллы могут достигать нескольких миллиметров длины. Таким образом, субъединицы коллагена синтезируются и секретируются в виде суперспирализованных спиральных структур, и окончательные этапы их сборки происходят вне клетки. Как показано на рисунке ниже, синтез коллагена и дальнейший его процессинг происходят на протяжении всего секреторного пути. При синтезе коллагеновые белки направляются в гранулярный эндоплазматический ретикулум (ЭПР) при участии частиц, распознающих сигнал и связанного с ними белкового аппарата.
Коллагеновые субъединицы синтезируются в виде крайне длинных полипептидов, которые называются проколлагены и содержат пропептиды, представляющие собой «хвосты», расположенные на амино- и карбоксильном концах.
После того как проколлагены попали в просвет ЭР, по мере транспорта из ЭР через аппарат Гольджи и в секреторные везикулы, они претерпевают серию модификаций. В процессе транспорта проколлагена через ЭР и аппарат Гольджи, к боковым цепям пролина и лизина, находящимся в средней части молекул проколлагена, добавляются гидроксильные группы (-ОН). При этом образуются гидроксипролин и гидроксилизин.
Эти модификации обеспечивают правильное образование водородных связей, которые скрепляют вместе три субъединицы в суперспирализованной спиральной структуре. Между амино- и карбоксиконцевыми частями пропептидов образуются дисульфидные связи, которые затем обеспечивают правильное расположение трех проколлагеновых субъединиц с образованием тройной спиральной суперспирализованной структуры. Затем спираль образуется спонтанно, в направлении от С-конца к N-концу.
Пропептиды препятствуют взаимодействию суперспирализованных спиралей друг с другом, тем самым предотвращая полимеризацию коллагена в клетке. Когда произошла секреция тройных спиралей проколлагена, ферменты, которые называются протеазы проколлагена, отщепляют пропептиды. Остающийся белок, известный под названием тропоколлагена, почти весь организован в тройную спираль и представляет собой основную структурную единицу коллагеновой фибриллы.
Фибриллы собираются просто: боковые цепи лизина в тропоколлагене модифицируются при действии фермента лизилоксидазы, образуя аллизины. Эти модифицированные лизины образуют ковалентные сшивки, которые обеспечивают полимеризацию тропоколлагенов. Лизилоксидаза представляет собой внеклеточный фермент, и эта стадия сборки фибрилл происходит только после выхода проколлагена из клетки. После сборки фибриллы могут объединяться, образуя большие пучки или волокна, характерные для фибриллярного коллагена.
Принимая во внимание всю важность коллагена в обеспечении структурной поддержки тканей, можно представить, какие тяжелые последствия для организма будет иметь нарушение процесса сборки фибрилл. Мутации в генах, кодирующих синтез коллагенов или ферментов, модифицирующих проколлаген, вызывают развитие множества генетических заболеваний, затрагивающих практически все ткани. Например, коллаген типа I представляет собой основной структурный белок костной ткани. Мутации в коллагеновых генах этого типа служат причиной незавершения остеогенеза, т. н. развития «болезни хрупких костей».
Мутации в коллагеновом гене типа IV приводят к нарушению сборки базальной ламины в большинстве эпителиальных тканей и к развитию такого кожного заболевания, как буллезный эпидермоз.
Клетки связываются с коллагеном посредством специфических рецепторов, называемых интегринами. Эти рецепторы обеспечивают возможность обратимого связывания клеток с коллагенами по мере их движения по внеклеточному матриксу. Интегриновые рецепторы также активируют пути передачи сигналов, так что связывание с коллагенами (и с другими белками внеклеточного матрикса) изменяет активность в клетке биохимических процессов и, таким образом, способствует контролю над ростом и дифференцировкой клеток.
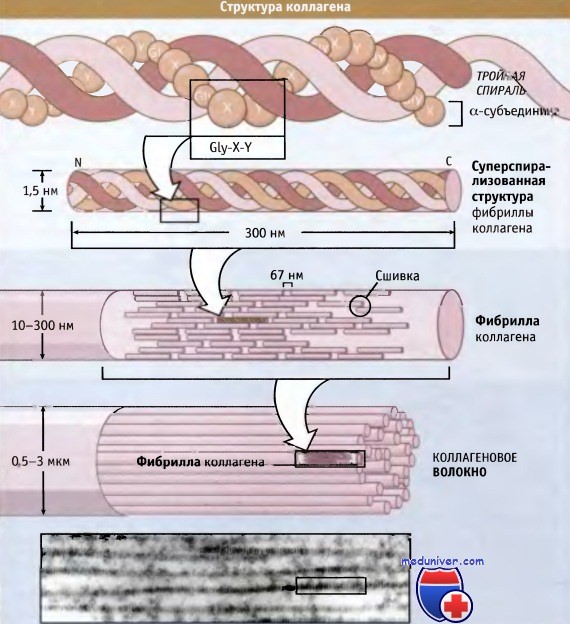
организация витой структуры в фибрилле (в середине) и фибрилл в коллагеновом волокне (внизу).
Наличие 67-нм зазора между соседними спиральными структурами обусловливает видимую в электронном микроскопе исчерченность фибрилл, составляющих волокно. 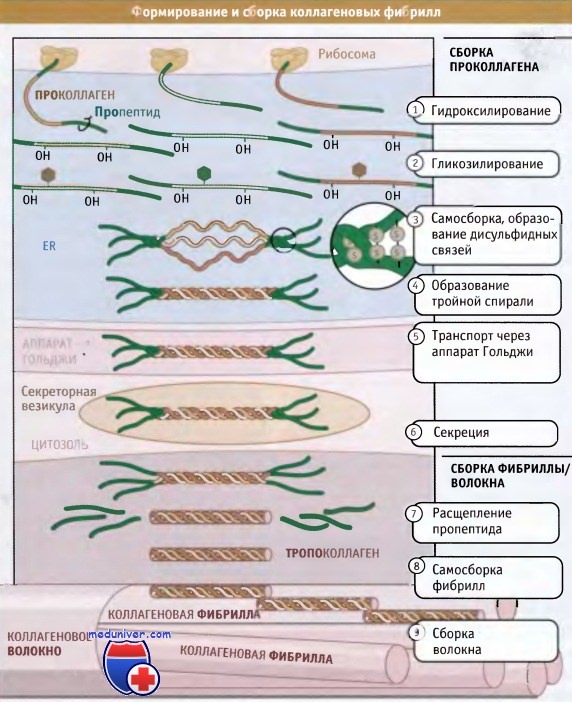
Однако сборка фибрилл происходит во внеклеточном пространстве после секреции тройных спиралей, обладающих витой структурой.
Для упрощения в тройных структурах не показаны гидроксильные группы и сахарные остатки. 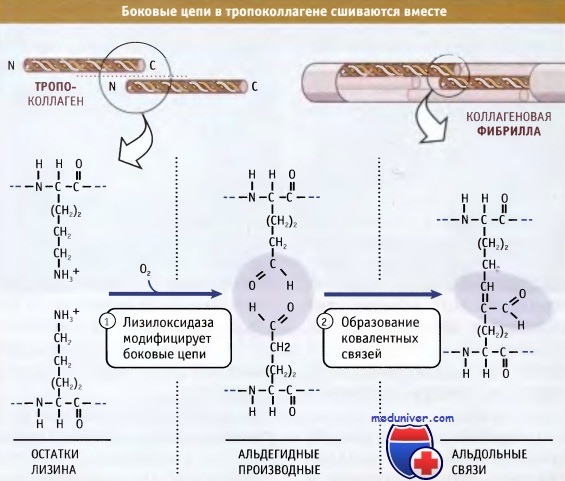
которые затем образуют между собой альдольную связь.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Коллаген — белок молодости: как правильно выбрать и принимать
В статье мы расскажем:
Коллаген — один из основных компонентов соединительной ткани и, беспорно, наиболее популярная (наравне с омега-3-полиненасыщенными жирными кислотами) биологически активная добавка. Его называют белком молодости — и это, как мы продемонстрируем несколько позже, весьма обосновано.
Впрочем, иногда погоня за красотой может обернуться весьма неприятными последствиями: ведь неполное понимание процессов биохимической трансформации не освобождает от ответственности. Так, в частности, следует осознавать, что существует огромное количество разнообразных типов коллагена — их число давно перевалило за два десятка — каждый из которых имеет свою определенную локализацию, а следовательно, те или иные функции. Так что же выбрать и каким образом стимулировать образование собственного протеина? Давайте разбираться.
Коллаген и его структура
Коллаген — белок соединительной ткани, вырабатываемый специальными клетками — фибробластами. Примечательно, что он является наиболее распространенным протеином во всем организме — на его долю приходится ¼ всех белков. Впечатляет, не так ли?
Коллаген имеет интересную пространственную структуру, во многом определяющую его свойства: он состоит из трех переплетенных цепей. Впрочем, с точки зрения понимания процессов, приводящих к его недостаточной выработке, куда более важен именно его аминокислотный состав — те рабочие кирпичики, что создают исходный каркас.
Для построения правильных полипептидных последовательностей коллагена необходимо три аминокислоты: глицин, пролин и лизин. Первая — заменимая: наш организм способен самостоятельно на клеточных фабриках воспроизводить ее синтез. В частности, это наблюдается и в головном мозге: ведь, как известно, глицин выступает одним из нейромедиаторов — химических соединений, способствующих передачи нервного импульса от одного нейрона к другому.
Гематоэнцефалический барьер — паспортный контроль на границе “нервная ткань-кровь” — непроницаем для этой аминокислоты, а специфических переносчиков, способствующих ее транспорту из просвета сосудов в структуры мозга нет. Вот и приходится клеткам нервной системы выкручиваться и справляться самим — возбуждение и торможение передавать-то как-то надо.
И если пролин, другая аминокислота в составе коллагена, также способна к эндогенному образованию, то лизин должен исключительно поступать с биологически активными добавками или компонентами пищи. Так, скажем, им богаты:
говядина и телятина;
курица, индейка, мясо кролика;
сельдь, тунец и креветки;
соевые бобы и фасоль.
Кроме того, в процессе синтеза коллагена происходит ряд важных трансформаций, ключевой из которых, несомненно, является превращение под действием специфического фермента (гидроксилазы) пролина и лизина в гидроксипролин и гидроксилизин. Функционирование этого энзима невозможно без меди, а также участия витамина С.
Так, в частности, один из наиболее ярких признаков, указывающих на гиповитаминоз аскорбиновой кислоты и требующих прицельного внимания со стороны специалистов по питанию и врачей, — кровоточивость десен — развивается вследствие повышенной ломкости сосудов, наблюдаемой в отсутствии протекания реакций гидроксилирования соответствующих аминокислот в составе коллагенового волокна.
Последние исследования указывают также и на то, что этот процесс существенным образом подавляется гомоцистеином — наиболее значимым маркером сердечно-сосудистых патологий. Таким образом, можно сделать закономерный вывод: без отслеживания в динамике данного показателя и без оказания должной поддержки реакциям метилирования, в которых происходит превращение гомоцистеина, о производстве качественного коллагена можно забыть. Об этом мы расскажем несколько ниже.
Типы коллагена
Количество известных на данный момент типов коллагена приближается к трем десяткам, и каждый из них обладает собственной локализацией. Появление не в характерном месте того или иного типа свидетельствует, ровно как и изменение аминокислотного состава, о системных заболеваниях соединительной ткани — коллагенозах.
Наиболее важными для взрослого человека (особенно в контексте красоты и молодости) представляются именно первые три типа:
1-й содержится практически во всех соединительных тканях, включая кости и зубы, роговицу глаз, сухожилия, волокнистые хрящи и связки. Это толстые волокна, что также являются основным компонентом образующегося на месте большинства повреждений рубца.
2-й тип коллагена расположен в гиалиновых хрящах, покрывающих суставные поверхности; в сухожилиях; стекловидном теле глаза, которое обеспечивает преломление поступающих на сетчатку лучей света; а также в межпозвоночных дисках.
3-й тип, наконец, сконцентрирован в стенках артериальных сосудов, в коже, кишечнике, матке, хрусталике, сухожилиях и хрящах.
Причины нехватки собственного коллагена
Учитывая, что коллаген — это белок, его структурными кирпичиками являются аминокислоты, недостаточное поступление которых вместе с компонентами пищи будет приводить и к снижению эндогенного синтеза.
Нарушение переваривания и расщепления белка в желудке, наблюдаемое при уменьшении секреции клетками слизистой оболочки соляной кислоты, обычно проявляется комплексом характерных жалоб:
вздутие и газообразование;
Характерно снижение показателя общего белка в биохимическом анализе крови, а также возможно компенсаторное увеличение фракции альбуминов.
Гипоацидность ассоциируется и с более низкой устойчивостью организма к различного рода инфекциям — в частности, паразитарным. Причиной подобного уменьшения секреции соляной кислоты могут быть:
распространение H.pylori по всему периметру желудка;
частое воздействие стрессовых факторов: выделяемые при этом корой надпочечников гормоны приводят к спазмированию сосудов и, таким образом, ухудшают кровоснабжение слизистой;
образование антител к собственным клеткам — характерно для аутоиммунного гастрита;
обратный заброс желчи;
нарушение процессов метилирования.
Любой из вышеперечисленных факторов, приводящий к снижению кислотности, тормозит и активацию под действием соляной кислоты протеолитических ферментов — расщепление связей в полипептидных цепях нарушается.
Экзокринная недостаточность поджелудочной железы, вырабатываемые которой энзимы осуществляют окончательное ферментативное расщепление в полости кишечника и на ворсинках его эпителиальной выстилки.
Нарушение оттока желчи, выступающей в качестве активатора панкреатических ферментов, наблюдается при закупорке камнями выводных протоков, при глистной инвазии, уменьшении текучести желчи в связи с повышением содержания в ее составе холестерина.
Синдром мальабсорбции, целиакия и другие патологии, при которых, в существенной мере, тормозится процесс всасывания питательных веществ на ворсинках кишечника.
Увеличение концентрации аминокислоты гомоцистеин, нарушающей образование правильной структуры коллагенового белка, отмечается при дефицитах витаминов В2, В6, В9, В12, а также при недостатке в организме цинка и мутациях в наиболее важных, контролирующих весь процесс метилирования, генах: MTRR, MTHFR. MTR.
Гиповитаминоз аскорбиновой кислоты.
Дефицит меди — минерала, также необходимого для преобразования аминокислоты лизин в гидроксилизин.
Признаки нехватки коллагена
Учитывая, что образование коллагена в организме в значительной мере снижается не только с возрастом, но и при определенных, описанных ранее состояниях, настоятельно рекомендуем обращать внимание на хорошо видимые признаки дефицита данного белка соединительной ткани:
хрупкостей костей — коллаген представляет из себя своеобразный каркас, к которому прикрепляются участвующие в формировании кости минералы;
проблемы с межпозвоночными дисками;
Отдельно хочется добавить о гиповитаминозе аскорбиновой кислоты — ведь, как уже было сказано, в условиях ее дефицита превращение лизина и пролина невозможно. Вы можете ориентироваться на показатели органических кислот и аминокислот в моче — в частности, на повышение:
Для недостатка витамина С характерны следующие симптомы:
Частые простудные заболевания вследствие снижения активности иммунной системы и уменьшения образования защитных белков нейтрофилами.
Дефицит железа из-за нарушения его всасывания в желудочно-кишечном тракте — вплоть до анемии.
Длительное заживление ран — особенно хорошо прослеживается на царапинах, повреждениях от прыщиков.
Кровотечения из носовой полости и десен.
Нарушения образования коллагеновых волокон возникает и при избыточной концентрации в крови аминокислоты гомоцистеин, что, как правило, наблюдается в условиях нехватки фолиевой кислоты, витамина В6 или кобаламина, а также при мутациях в соответствующих генах. Таким образом, измерение уровня гомоцистеина может быть диагностически важным параметром.
Определение дефицита фолиевой кислоты (витамина В9):
↑ MCV (среднего объема эритроцитов) в общем анализе крови;
↑Форминоглутаминовой кислоты в орг.кислотах в моче;
На дефицит В12 указывают:
↑ MCV (среднего объема эритроцитов) в общем анализе крови;
↑ метилмалоновой кислоты в орг.кислотах в моче;
Генетика фолатного цикла: MTHFR, MTR, MTRR.
Какой коллаген выбрать
Ранее широкой популярность пользовался коллаген млекопитающих — особенно в регенеративной медицине. Он использовался в виде каркасного материала при восстановлении поврежденных или пораженных болезнью тканью.
Впрочем, сейчас, после выявления достаточно высокого риска заражениями инфекционными заболеваниями (в частности, неизлечимой, характеризующейся неизменно летальным исходом губчатой энцефалопатией, птичьим и свиным гриппом) от его применения постепенно стали отказываться в пользу морского коллагена, добываемого из чешуи, кожи и костей рыб. Последний обладает, к тому же, биосовместимостью, низкой антигенностью (иными словами, вызывал меньшие реакции со стороны иммунной системы), а также имел хорошую биоразлагаемость.
В качестве пищевой добавки, морской коллаген также занимает лидирующие позиции, хотя и несколько уступает пептидам коллагена, положительно зарекомендовавшим себя в контексте заживления ран, уменьшения болей в области суставов и сухожилий.
С того момента, как впервые было опубликовано исследование о способности гидролизатов коллагена — гетерогенных (то есть неоднородных) смесей его пептидов, полученных в процессе ферментативного расщепления содержащих данный белок тканей — стимулировать образование коллагена хрящевыми клетками, их применение получило широкое распространение. Сегодня они рассматриваются как безопасный метод (или компонент к основной терапии) лечения остеоартрита — наиболее распространенного заболевания суставов, поражающего более 60% пациентов пожилого возраста и имеющего прогрессирующий характер.
Однако, учитывая тесную взаимосвязь между превращениями аминокислот в составе коллагена, и витамином С, еще раз хотим подчеркнуть: для достижения большего эффекта следите, чтобы в покупаемых вами добавках содержалась аскорбиновая кислота (или же, в случае ее отсутствия, принимайте ее отдельно).
Добавки, стимулирующие синтез коллагена
В последнее время все более чаще стали проводиться исследования касательно влияния прекурсоров (предшественников) аминокислот, входящих в состав коллагена, на эндогенное образование, то есть непосредственно в клетках человеческого организма, этого белка соединительной ткани.
Так, в частности, изучалось применение аминокислот аргинина и орнитина (которые участвуют в обезвреживании токсического для наших тканей — в особенности нервной — аммиака) в качестве исходного субстрата для продукции пролина — одного из основных кирпичиков в полипептидных цепях коллагена.
Аргинин, в отличии от орнитина, гораздо более распространен в белковых продуктах, а также в достаточном количестве продуцируется в организме человека для поддержания и нормального функционирования мышечной и соединительной ткани, но, вероятнее всего, его образование всё же не удовлетворяет потребности для адекватного биосинтеза коллагена при заживлениях раны с последующим рубцеванием места повреждения.
Весьма заинтересовали ученых работы, впервые проведенные на лабораторных животных: так, они, придерживаясь в течение 4-6 недель диеты с дефицитом аргинина, характеризовались более высокой частотой смертности и повышенной потерей веса после того, как подвергались незначительной травме в виде разреза на спине. В дальнейшем были проведены эксперименты и на здоровых добровольцах, результаты которых показали: употребление добавок аргинина не влияло на скорость образования эпителиальной ткани в месте повреждения кожи, но существенным образом сказывалась на отложении коллагена в ране — подобное наблюдалось и у мышей, дополнительно получавших вместе с пищей аминокислоту орнитин.
Аргинин, вдобавок, участвует в образовании оксида азота, способствующего расширению сосудов и критически важного в контексте заживления ран. Эта аминокислота (наравне с орнитином) стимулирует секрецию гормона роста, а также активирует клеточное звено иммунитета — в частности, Т-лимфоциты.
Кроме аргинина и орнитина, приводится информация и о цитруллине — еще одной шахматной фигуре в цикле мочевины, который обеспечивает детоксикацию аммиака. Эта аминокислота является прямым предшественником аргинина — так, ее применение ассоциировалось с повышением концентрации последнего в плазме у животных с коротким пищеварительным трактом. Впрочем, на данный момент, какого-либо другого косвенного влияния цитруллина на образование коллагена не отмечается.
Продукты, способствующие выработке коллагена
Для укрепления кожи, поддержания ее тургора и эластичности, профилактики развития морщин и сохранения молодости рекомендуем вам обратить внимание на следующие продукты и блюда:
Бульоны — современные молодильные яблока. Получаемые при отварах мяса на костях (в особенности говяжьего) они служат прекрасными источниками коллагена и широкого спектра аминокислот.
Жирная рыба — прекрасный источник омега-3-полиненасыщенных жирных кислот, обладающих провоспалительным действием, а также некоторых минералов — в частности, цинка, необходимого для протекания реакций фолатного цикла.
Яйца — богаты аминокислотами, входящими в состав коллагена. Для уменьшения рисков развития пищевых непереносимостей (всвязи с высокой степенью иммунизации куриного белка) советуем делать упор на перепелиные, а не куриные.
Листовые овощи: шпинат, руккола, салат. Они богаты фолиевой кислотой, которая участвует в реакциях метилирования и обезвреживания гомоцистеина.
Источники витамина С, обеспечивающего превращение аминокислот пролин и лизин:
Продукты, содержащие в составе медь:
кунжут и семена подсолнечника.
Как стимулировать выработку собственного коллагена
При условии здоровой слизистой желудка можно начать работу по повышению кислотности — залога хорошего усвоения белка.
Рекомендуем вам рассмотреть прием следующих биологически активных добавок:
Для работы с желчеоттоком (опять же, только после предварительного восстановления целостности кишечного эпителия и при отсутствии конкрементов) отлично подойдут:
горечи: настойка полыни и корень одуванчика;
прием теплой, богатой жирами пищи;
препараты, содержащие желчь животных.
При снижении ферментативной активности поджелудочной железы необходимо индивидуально подобрать подходящие энзимы (растительного или белкового происхождения).
Уменьшение потребления быстрых углеводов и транс-жиров для предотвращения увеличения концентрации холестерина и, таким образом, снижения текучести желчи.
Работа с фолатным циклом — прием витаминов в их активных формах и доноров метильных групп:
триметилглицина (бетаина) — при отсутствии повреждения слизистой желудка.
Прием витамина С — не более 2000 мг/сут для взрослых.
Устранение или сведение к минимуму стрессовых факторов.
Материал основан на исследованиях:
Рекомендации для вас
Международный институт интегративной нутрициологии
2021 © ВСЕ ПРАВА ЗАЩИЩЕНЫ
Мы в социальных сетях
Настоящая Политика конфиденциальности персональных данных (далее — Политика конфиденциальности) действует в отношении всей информации, которую данный сайт, на котором размещен текст этой Политики конфиденциальности, может получить о Пользователе, а также любых программ и продуктов, размещенных на нем.
1. Определение терминов
1.1 В настоящей Политике конфиденциальности используются следующие термины:
1.1.1. «Администрация сайта» – уполномоченные сотрудники на управления сайтом, действующие от его имени, которые организуют и (или) осуществляет обработку персональных данных, а также определяет цели обработки персональных данных, состав персональных данных, подлежащих обработке, действия (операции), совершаемые с персональными данными.
1.1.2. «Персональные данные» — любая информация, относящаяся к прямо или косвенно определенному или определяемому физическому лицу (субъекту персональных данных).
1.1.3. «Обработка персональных данных» — любое действие (операция) или совокупность действий (операций), совершаемых с использованием средств автоматизации или без использования таких средств с персональными данными, включая сбор, запись, систематизацию, накопление, хранение, уточнение (обновление, изменение), извлечение, использование, передачу (распространение, предоставление, доступ), обезличивание, блокирование, удаление, уничтожение персональных данных.
1.1.4. «Конфиденциальность персональных данных» — обязательное для соблюдения Администрацией сайта требование не допускать их умышленного распространения без согласия субъекта персональных данных или наличия иного законного основания.
1.1.5. «Пользователь сайта (далее Пользователь)» – лицо, имеющее доступ к сайту, посредством сети Интернет и использующее данный сайт для своих целей.
1.1.6. «Cookies» — небольшой фрагмент данных, отправленный веб-сервером и хранимый на компьютере пользователя, который веб-клиент или веб-браузер каждый раз пересылает веб-серверу в HTTP-запросе при попытке открыть страницу соответствующего сайта.
1.1.7. «IP-адрес» — уникальный сетевой адрес узла в компьютерной сети, построенной по протоколу IP.
2. Общие положения
2.1. Использование Пользователем сайта означает согласие с настоящей Политикой конфиденциальности и условиями обработки персональных данных Пользователя.
2.2. В случае несогласия с условиями Политики конфиденциальности Пользователь должен прекратить использование сайта.
2.3.Настоящая Политика конфиденциальности применяется только к данному сайту. Администрация сайта не контролирует и не несет ответственность за сайты третьих лиц, на которые Пользователь может перейти по ссылкам, доступным на данном сайте.
2.4. Администрация сайта не проверяет достоверность персональных данных, предоставляемых Пользователем сайта.
3. Предмет политики конфиденциальности
3.1. Настоящая Политика конфиденциальности устанавливает обязательства Администрации сайта по умышленному неразглашению персональных данных, которые Пользователь предоставляет по разнообразным запросам Администрации сайта (например, при регистрации на сайте, оформлении заказа, подписки на уведомления и т.п).
3.2. Персональные данные, разрешённые к обработке в рамках настоящей Политики конфиденциальности, предоставляются Пользователем путём заполнения специальных форм на Сайте и обычно включают в себя следующую информацию:
3.2.1. Имя Пользователя;
3.2.2. Контактный телефон Пользователя;
3.2.3. Адрес электронной почты (e-mail);
3.3. Администрация сайта также принимает усилия по защите Персональных данных, которые автоматически передаются в процессе посещения страниц сайта: IP адрес; информация из cookies; информация о браузере (или иной программе, которая осуществляет доступ к сайту); время доступа; посещенные адреса страниц; реферер (адрес предыдущей страницы) и т.п.
3.3.1. Отключение cookies может повлечь невозможность доступа к сайту.
3.3.2. Сайт осуществляет сбор статистики об IP-адресах своих посетителей. Данная информация используется с целью выявления и решения технических проблем, для контроля корректности проводимых операций.
3.4. Любая иная персональная информация не оговоренная выше (история покупок, используемые браузеры и операционные системы и т.д.) не подлежит умышленному разглашению, за исключением случаев, предусмотренных в п.п. 5.2. и 5.3. настоящей Политики конфиденциальности.
4. Цели сбора персональной информации пользователя
4.1. Персональные данные Пользователя Администрация сайта может использовать в целях:
4.1.1. Установления с Пользователем обратной связи, включая направление уведомлений, запросов, касающихся использования сайта, оказания услуг, обработка запросов и заявок от Пользователя.
4.1.2. Подтверждения достоверности и полноты персональных данных, предоставленных Пользователем.
4.1.3. Уведомления Пользователя сайта о состоянии Заказа.
4.1.4. Предоставления Пользователю эффективной клиентской и технической поддержки при возникновении проблем связанных с использованием сайта.
5. Способы и сроки обработки персональной информации
5.1. Обработка персональных данных Пользователя осуществляется без ограничения срока, любым законным способом, в том числе в информационных системах персональных данных с использованием средств автоматизации или без использования таких средств.
5.2. Пользователь соглашается с тем, что Администрация сайта вправе передавать персональные данные третьим лицам, в частности, курьерским службам, организациями почтовой связи, операторам электросвязи, исключительно в целях выполнения заявок Пользователя.
5.3. Персональные данные Пользователя могут быть переданы уполномоченным органам государственной власти только по основаниям и в порядке, установленным действующим законодательством.
6. Обязательства сторон
6.1. Пользователь обязуется:
6.1.1. Предоставить корректную и правдивую информацию о персональных данных, необходимую для пользования сайтом.
6.1.2. Обновить или дополнить предоставленную информацию о персональных данных в случае изменения данной информации.
6.1.3. Принимать меры для защиты доступа к своим конфиденциальным данным, хранящимся на сайте.
6.2. Администрация сайта обязуется:
6.2.1. Использовать полученную информацию исключительно для целей, указанных в п. 4 настоящей Политики конфиденциальности.
6.2.2. Не разглашать персональных данных Пользователя, за исключением п.п. 5.2. и 5.3. настоящей Политики Конфиденциальности.
6.2.3. Осуществить блокирование персональных данных, относящихся к соответствующему Пользователю, с момента обращения или запроса Пользователя или его законного представителя либо уполномоченного органа по защите прав субъектов персональных данных на период проверки, в случае выявления неправомерных действий.
7. Ответственность сторон
7.1. Администрация сайта несёт ответственность за умышленное разглашение Персональных данных Пользователя в соответствии с действующим законодательством, за исключением случаев, предусмотренных п.п. 5.2., 5.3. и 7.2. настоящей Политики Конфиденциальности.
7.2. В случае утраты или разглашения Персональных данных Администрация сайта не несёт ответственность, если данная конфиденциальная информация:
7.2.1. Стала публичным достоянием до её утраты или разглашения.
7.2.2. Была получена от третьей стороны до момента её получения Администрацией сайта.
7.2.3. Была получена третьими лицами путем несанкционированного доступа к файлам сайта.
7.2.4. Была разглашена с согласия Пользователя.
7.3. Пользователь несет ответственность за правомерность, корректность и правдивость предоставленной Персональных данных в соответствии с действующим законодательством.
8. Разрешение споров
8.1. До обращения в суд с иском по спорам, возникающим из отношений между Пользователем сайта и Администрацией сайта, обязательным является предъявление претензии (письменного предложения о добровольном урегулировании спора).
8.3. При недостижении соглашения спор будет передан на рассмотрение в судебный орган в соответствии с действующим законодательством.
8.4. К настоящей Политике конфиденциальности и отношениям между Пользователем и Администрацией сайта применяется действующее законодательство.
9. Дополнительные условия
9.1. Администрация сайта вправе вносить изменения в настоящую Политику конфиденциальности без согласия Пользователя.
9.2. Новая Политика конфиденциальности вступает в силу с момента ее размещения на Сайте, если иное не предусмотрено новой редакцией Политики конфиденциальности.