Чем отличается коллаген разных типов
Чем отличается коллаген разных типов
Структура соединительных
тканей суставов
Такой сложный орган как сустав состоит из костей, хрящей, связок, сухожилий, стекловидного тела. Хрящевая ткань локализована в тех участках опорно-двигательного аппарата, которые испытывают наибольшую механическую нагрузку. Изменения в суставах при болезнях начинаются прежде всего в гиалиновом хряще, а затем распространяются на кость и другие ткани. С оединительные ткани суставов образованы из специализированных клеток и внеклеточного матрикса (ВКМ). Матрикс содержит коллагеновые и эластиновые фибриллы, протеогликаны и гликопротеины. Механическая прочность матрикса определяется жесткой структурой коллагеновых и эластиновых фибрилл. Коллаген является основным структурным белком соединительных тканей. Фибриллы формируются из коллагенов типов I, II, III и их комплексов с минорными коллагенами типов IX, X, XI, XII, XIV. В хрящах преобладает коллаген типа II [1]. Фибриллы коллагена типа VI
соединяют основные фибриллы между собой. Коллагеновые фибриллы в матриксе образуют трехмерную сеть. П ротеогликаны и г ибкие фибриллы малого диаметра, но содержащие большое количество ковалентных поперечных связей, придают эластичность тканям. Протеогликаны и гликопротеины заполняют пространство между фибриллами и клетками. Гликопротеины, связываясь с рецепторами на поверхности хондроцитов, осуществляют взаимодействие матрикса с клетками. Протеогликаны образуются из комплексов аггреканов, связущего белка и гиалуроновой кислоты. В состав аггреканов входят гликозаминогликаны: хондроитин-4-сульфат, хондроитин-6-сульфат, кератан-сульфат. Специфическая структура матрикса обеспечивает как биомеханические свойства хряща, так и способствует его питанию путем диффузии. Известно, что кровеносная система в гиалиновых хрящах отсутствует [1]. Тем не менее внутритканевая вода, ее большое количество и растворенные в ней вещества обеспечивают интенсивный обмен веществ. Протеогликаны, обладая катионными и анионными свойствами, регулируют физико-химические свойства матрикса. Изменение содержания коллагеновых белков, протеогликанов, гликозаминогликанов, ионов металлов, воды нарушает структуру хрящевой ткани, приводит к болезням. Патологические процессы при артрозах сопровождаются пониженными концентрациями коллагена и гликозаминоглика-
нов [5]. Ослаблена структура коллагеновых фибрилл в суставах при наследственном заболевании гипермобильность суставов, при котором также истончается кожа [2]. Нарушения структуры матрикса и размеров коллагеновых фибрилл в таких разных тканях, как хрящи и кожа, происходят в отсутствии коллагена типа VI, дефиците солей и витаминов [2]. Восполнение недостающих компонентов матрикса в организме человека можно проводить применением лечебных средств профилактического действия, а также нутрицевтиков. Лекарствами-хондропротекторами являются гиалуроновая кислота и сульфатированные гликозаминогликаны. Их выделяют из п ротеогликановых комплексов, содержащихся в тканях позвоночных животных и гидробионтов. Заложенные природой в организме человека и животных макромолекулы соединительных тканей могут быть лекарствами полифармацевтического и биофармацевтического действия.
Получение гидролизатов коллагена и нутрицевтиков на их основе
Несмотря на то что коллаген является основным белком суставов, коллагеновые нутриенты относительно недавно стали применять для лечения артритов и артрозов. В организм человека к оллаген поступает с пищей после ее тепловой обработки. Денатурированным видом коллагена является лекарственный и пищевой желатин. Коллагеновые белки и желатин под действием ферментов желудочно-кишечного тракта (ЖКТ) могут расщепляться до аминокислот и полипептидов. Большая длина молекул и фибрилл коллагена, имеющих относительно высокую молекулярную массу, препятствует их эффективному перевариванию. Гидролизаты коллагена, содержащие набор аминокислот и полипептидов, более доступны для усвоения в организме человека. Поступающие в кровь аминокислоты накапливаются в соединительных тканях и клетках. Гидролизованный коллаген, как источник специфических аминокислот, может быть строительным материалом для биосинтеза матрикса этих тканей. Из экстрактов кожной ткани получали фармацевтический желатин. Для того, чтобы повысить усвоение желатина, дополнительно проводили его ферментативный гидролиз [4].
Гидролизат коллагена из кожи крупного рогатого скота «Колламин-80» был получен под влиянием ферментов поджелудочной железы свиней [3]. «Колламин-80» содержит аминокислоты, дипептиды, трипептиды и полипептиды. На основе «Колламин-80» в России были разработаны нутрицевтики «Коллаген УЛЬТРА» (ООО «Алина Фарма», Московская обл., Чеховский р-н, пос. Любучаны) и «Коллаген-С» (ООО «АРТ Современные научные технологии», Московская обл., Солнечногорский р-н, д. Голиково). Их основным компонентом является гидролизат коллагена типов I и III. В состав нутриентов входит витамин С. «Хонда drink» (ЗАО «Эвалар», г. Бийск Алтайского края), состоящий из гидролизата кожного коллагена, витаминов С и В2, глюконата марганца, дополнен гликозаминогликанами. Однако используемый во всех нутрицевтиках гидролизат кожной ткани не содержит полноценного набора аминокислот, специфичных для фибрилл хрящей и суставов. На основании различия по аминокислотному составу коллагенов типов I, II и III мы предполагаем, что нутриенты из коллагенов кожи могут слабее влиять на образование прочных фибрилл в тканях опорно-двигательной системы.
Из хрящей цыплят, применяя протеолитические ферменты папаин, фицин и бромелайн, в США были получены гидролизаты коллагена типа II [9]. Молекулярная масса пептидов изменяется от 50 до 10000 Д. Наряду с коллагеном типа II гидролизат «BioCell Collagen II» содержит гликозаминогликаны: гиалуроновую кислоту, хондроитин-сульфат. На основе этих гидролизатов были разработаны нутрицевтики с набором других компонентов: JointFlex Complete, Flex-a-Min, Flex-A-Min Triple Strength (Arhritis Research Corporation, USA).
Эксперименты в культуре клеток
Показано, что в хондроцитах in vitro после 11 дней культивирования в среде с гидролизатом коллагена типа II количество аминокислот возрастает в 2,5 раза по сравнению с контролем (среда без гидролизата коллагена) [10]. Стимуляция коллагенообразования из аминокислот в клетках регулируется ферментами, на активность которых влияют витамины и катионы металлов. Синтез коллагена и его фибриллообразование – сложный многоэтапный процесс. Биосинтез протекает в специализированных клетках (хондроциты в хрящах), а фибриллообразование – вблизи поверхности клеток. Реакции гидроксилирования позволяют модифицировать молекулы коллагена. Катализируют гидроксилирование ферменты: пролил-4-гидроксилаза и лизил-5-гидроксилаза с целью превращения пролина в оксипролин, а лизина в оксилизин. Ферменты активны в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин С). Особенностью фибрилл коллагена высокой степени прочности является большое содержание аминокислотных остатков с альдегидными группами. В норме из лизина и оксилизина образуются их альдегидные формы аллизин и оксиаллизин, которые участвуют в образовании прочных ковалентных связей между молекулами коллагена. Поэтому нутрицевтики из гидролизатов коллагена в комплексе с аскорбиновой кислотой (витамин С) более эффективно влияют
на фибриллообразование.
Хрящ суставов аккумулирует аскорбиновую кислоту. В хондроцитах аскорбиновая кислота и дигидроаскорбат перемещаются, соответственно, через натрий-зависимый транспорт витамина C (SVCT-2) и транспорт глюкозы GLUT 1 [11]. In vitro аскорбат и аскорбиновая кислота стимулировали в хондроцитах суставов синтез коллагена типов I, II, протеогликанов и аггреканов [11].
Исследование in vivo на мышах линии STR/ort (у которых развили остеоартрит) показало, что длительный приём гидролизата коллагена может снижать дегенеративность хрящевой ткани, поражённой остеоартритом, и задерживать его развитие [11].
После клинических испытаний хондропротекторов наблюдали как положительные, так и отрицательные результаты от применения хондроитин-сульфата и гиалуроновой кислоты [5]. Установлено также незначительное влияние этих хондропротекторов на снижение боли у пациентов. Противоречивость наблюдаемого различия, по-видимому, обусловлена разным источником и методом получения хондропротекторов. Если наряду с гликозаминогликанами в состав лекарства входят коллагеновые белки, лекарство может обладать стимулирующим действием. Недостаток коллагеновых белков в осполняется приемом нутрицевтиков.
Проверяли влияние фармацевтического гидролизата коллагена (ФГК) на обмен веществ у больных остеоартритом [4]. Пациенты с остеоартритом коленного сустава принимали ежедневно по 10 г ФГК или 12 г лактозы (плацебо) на протяжении 24 недель. Клинические исследования в медицинских центрах трех стран выявили улучшение функций суставов и преимущество лечения ФГК над плацебо лишь в Германии. Ни в США, ни в Великобритании не были получены статистически достоверные результаты.
Определена специфичность соединительной ткани для получения гидролизатов коллагена и более эффективного лечения суставов. После применения гидролизата коллагена типа II в течение 24 недель в группе спортсменов – здоровых людей, но с внутрисуставной болью – наблюдали увеличение подвижности суставов, снижение болевого синдрома и уменьшение зависимости от анальгетиков [12]. У пациентов с первичным остеоартрозом при тех же условиях приема гидролизата коллагена происходило улучшение функционирования коленного сустава по оценке визуальной аналоговой шкалы и WOMAC. У пациентов с симптомами лёгкого остеоартроза коленного сустава, которые применяли гидролизат коллагена (10 г/день) с кальцием (300 мг/день) и витамином C (60 мг/день) в течение 14 недель, по изометрическим и изокинетическим тестам повышалась функциональная подвижность колена. Также более высокие результаты наблюдали у пациентов с тяжёлыми формами остеоартроза.
Неденатурированный коллаген типа II применяли для лечения ревматоидного артрита. Исследование выполнено в Гарвардском университете в 1993 г. Получены результаты, что неденатурированный коллаген типа II
может повлиять на подвижность суставов и сокращение в них боли, а также улучшить функциональное состояние больных остеоартритом [13]. Потенциальный механизм действия неденатурированного коллагена типа II, вероятно обусловлен «переобучением» T-клеток к иммунной устойчивости [14].
Поступающий в ЖКТ неповреждённый коллаген типа II повторно создаёт антигенные взаимодействия с древовидными клетками и регуляторными T-клетками в лимфе кишечной ткани. Регуляторные T-клетки секретируют цитокины, такие, как интерлейкин-10 и трансформирующий фактор роста, которые ингибируют иммунный ответ на антиген (коллаген типа II) [14]. Цитокины могут повлиять на снижение иммунного ответа к коллагену типа II внутри ВКМ суставного хряща и таким образом предотвратить противовоспалительную острую реакцию на суставной хрящ в условиях артрита. Учитывая комплементарный механизм действия неденатурированного коллагена типа II в дополнение к его эффективности, он может быть рассмотрен как комплексно действующая добавка и может приниматься по 40 мг ежедневно.
Нутрициология в профилактике болезней суставов
В настоящее время задачами лечения больных артритом и артрозом является повышение подвижности суставов и снижение боли. Подвижность суставов определяется оптимальными размерами коллагеновых фибрилл и протеогликанов. Известно, что в хрящах обновление матрикса происходит через год [1]. Поэтому длительное и систематическое применение комплекса из специфических аминокислот и гликозаминогликанов в гидролизатах коллагена типа II позволяет восстановить и укрепить структуру тканей суставов человека. Рекомендуемая доза – 10 г гидролизата коллагена в день [4, 14]. Нутрицевтики на основе гидролизата коллагена эффективно влияют как на раннюю стадию болезней суставов, так и на профилактику таких болезней. Хронические болезни человека вследствие дисплазии соединительной ткани (ДСТ) закладываются на эмбриональной стадии развития и/или на этапах роста детей и подростков. Нутрицевтические добавки из аминокислот коллагена помогают ослабленным детям в укреплении хрящевой, костной и других соединительных тка-
ней [2]. Применением нутрицевтиков из гидролизатов коллагена в комплексе с гликозаминогликанами, витаминами и катионами металлов можно стимулировать в клетках биосинтез макромолекул и структуру ВКМ, нарушенных в результате болезней. Если действие современных лекарств направлено на снижение воспалительных и болевых симптомов в период болезни или ее обострения, то нутрицевтики имеют преимущество в профилактике заболеваний.
Принимая во внимание, что коллаген является основным структурным белком костей, хрящей, связок, сухожилий в суставах, рассмотрена роль коллагеновых гидролизатов в лечении и профилактике заболеваний суставов. Для получения гидролизатов с высоким содержанием аминокислот эффективен биокаталитический подход и оптимизация ферментативного гидролиза. Представленные в обзоре данные показывают, что коллагеновые гидролизаты могут облегчить симптомы болезней суставов. Однако роль питания в снижении развития заболевания остаётся слабо изученной. Исследования по лечению и профилактике болезней соединительных тканей с помощью нутрицевтиков находятся на начальной стадии развития. Было получено и испытано всего лишь несколько видов гидролизата коллагена. Более того, определена специфичность гидролизата коллагена типа II из хрящевой ткани для улучшения функционирования суставов. Поскольку увеличение подвижности суставов может регулироваться размерами фибрилл коллагена и протеогликанов, потребуется определить взаимосвязь между составом коллагеновых гидролизатов и структурой матрикса. Если фармакологический метод основан на исследовании одна молекула/одна цель, то нутрициология является более целостным видом методологии: многие ингредиенты/множественные цели. Нутрициология, как раздел современной биофармацевтики, представляет ее новое направление, исследует возможные механизмы и способы для предупреждения заболеваний человека.
Рецензенты:
Брусков В.И., д.х.н., профессор, заведующий Лабораторией изотопных исследований, ФГБУН «Институт теоретической и экспериментальной биофизики Российской академии наук», г. Пущино;
Кичигина В.Ф., д.б.н., заведующая Лабораторией системной организации нейронов, ФГБУН «Институт теоретической и экспериментальной биофизики Российской академии наук», г. Пущино.
Научная электронная библиотека
1.2. Коллаген
Коллагены составляют основу структуры кожи, костей, хрящей, сухожилий, кровеносных сосудов и играют важную роль в сохранении нормальной структуры и функции соединительной ткани всех животных (Слуцкий, 1969, 1985; Риггз, Мелтон, 2000; Руденская, 2003).
Коллаген (К) – нерастворимый фибриллярный белок, первичная структура которого складывается из повторяющихся последовательностей триплетов аминокислот глицин-X-Y, где X и Y позиции чаще заняты, соответственно, пролином и гидроксипролином. Эти повторяющиеся последовательности позволяют трем коллагеновым полипептидам (называемым α-цепями) формировать полужесткие, очень стабильные трехспиральные молекулы (рис. 3). Они могут быть гомополимерными (три идентичные α-цепи) и гетерополимерными (две или три разные α-цепи). Под влиянием регулярно располагающихся остатков пролина и оксипролина цепь принимает форму ломаной спирали; это обусловливается жесткостью боковых групп пролина, а также тем обстоятельством, что пептидные связи, в образовании которых участвуют пролин и оксипролин, не могут образовать водородных связей. Остатки глицина образуют межцепочечные водородные связи, способствующие сохранению прочности структуры коллагена.


Рис. 3. Структура коллагена: а – электронная микрофотография коллагена соединительной ткани. Расстояние между повторяющимися структурными единицами равно 700 Å; б – конформация полипептидных цепей в трёхцепочечной молекуле тропоколлагена; в – ступенчатое расположение молекул тропоколлагена обусловливает появление в гидратированных волокнах коллагена повторяющихся структурных единиц, расстояние между которыми равно 700 Å (по Мусил и др., 1984)
Аминокислотные цепи коллагена обернуты друг вокруг друга и образуют «трехволоконный канат», где отдельные волокна связаны между собой водородными связями. Такая пространственная структура возможна, только если аминокислотная последовательность строго соблюдается.
В результате образуется трехволоконная фибриллярная молекула – тропоколлаген, обладающая большой прочностью на растяжение. Это название происходит от слова тропос – обращенный внутрь – из-за того, что коллагеновые волокна всех соединительных тканей, выстланы тропоколлагеновыми молекулами, соединенными «конец в конец» и «бок о бок» – в шахматном порядке. Гидроксильные группы некоторых остатков лизина и оксилизина участвуют в образовании связи между соседними молекулами тропоколлагена. Таким образом, формируется жесткое нерастяжимое волокно. Фибробласты синтезируют молекулы тропоколлагена и выбрасывают их в матрикс, и только здесь происходит сборка коллагеновых волокон (рис. 4).
Коллагены кожи содержат в больших концентрациях пролин и оксипролин (около 20 % от всех остальных аминокислот), глицин и аланин (свыше 50 % от содержания других аминокислотных остатков), ароматические и серосодержащие аминокислоты практически отсутствуют или содержатся в весьма малых количествах. Кроме того, коллаген является одним из немногих белков, содержащих оксипролин и оксилизин. Оксипролин и оксилизин образуются в молекуле проколлагена не в результате биосинтеза, а при гидроксилировании пролина и лизина, которое начинается в период трансляции коллагеновой мРНК на рибосомах (Неклюдов, 2003).
Рис. 4. Строение фибробласта и основные этапы синтеза коллагена. Г – аппарат Гольджи; Я – ядро; ШЭР – шероховатый эндоплазматический ретикулум; СП –секреторный пузырек; ТК – тропоколлаген; КВ – коллагеновое волокно
В настоящее время идентифицировано более 25 различных α-цепей, из которых формируется до 14 разных типов коллагеновых молекул, некоторые из них являются тканеспецифичными (Ленинджер, 1974; Риггз, Мелтон, 2000).
Таким образом, коллагены – это белки, которые:
б) могут состоять из трех цепей с повторяющимися последовательностями, обладающими способностью к сворачиванию в характерную тройную спираль. По меньшей мере, 19 белков определены в настоящее время как принадлежащие к коллагенам. 10 родственных им белков содержат коллагеноподобные домены.
Коллагеновые белки составляют около половины массы сухого вещества суставного хряща; вблизи суставной поверхности их концентрация приближается к 90 %. В других видах хрящевой ткани коллагены количественно преобладают над другими белками, обеспечивая прочность на растяжение и разрыв. (Слуцкий, 1985). Количественно преобладающим белком протеогликанового комплекса хрящевой ткани является коллаген второго типа (КII). Он в незначительных количествах обнаружен в других специализированных тканях, например, в стекловидном теле глаз некоторых видов животных. Хрящевой ткани присущ необычный полиморфизм коллагеновых компонентов, проявляющийся присутствием большого числа минорных коллагенов. Молекулярная формула КII хрящевой ткани имеет следующий вид: [α1(ΙΙ)]3, что означает наличие трех идентичных α1(II)-цепей, которые отличаются от α1(I)-цепей более высоким содержанием оксилизина. Столь высокая концентрация оксилизина способствует увеличению количества связанных с ним углеводов. По-видимому, такая структура обеспечивает большую сольватную оболочку коллагена типа II по сравнению с типами I или III. В процессе биосинтеза коллагена С-пропептиды соединяются между собой бисульфидными мостиками и после отщепления от молекулы образуют белок, который называется хондрокальцин, с м.м. около 100 000 Да (Слуцкий, 1985).
Коллаген одиннадцатого типа (КXI) составляет приблизительно 3 % хрящевого коллагена и образован двумя разными типами цепей (формула молекулы α1(XI)2 α2(XI)). Со старением организма его количество в хряще уменьшается в пользу коллагена пятого типа (КV) (Канунго, 1982; Риггз и Мелтон, 2000).
Для хрящевой ткани характерно наличие наибольшего количества минорных коллагеновых компонентов. Такой полиморфизм коллагенов позволяет считать минорные компоненты регуляторами адаптационной пластичности хряща, метаболизма хондроцитов и морфогенетических процессов (Слуцкий, 1985).
Содержание коллагена в различных тканях и органах сельскохозяйственных животных (КРС, свиньи) характеризуют следующие данные (% от массы сухого вещества): дерма – 80–90; ахиллово сухожилие – 86; костная ткань – 17,5–25; хрящи – 46–67; роговица и склера глаз – 70; мышцы – 10. При этом коллаген составляет от 25 до 33 % от общего количества белка (Титов, Апраксина, 1995). У костистых рыб коллагеновые белки преобладают в коже, сухожилиях, плавательном пузыре; у кольчатых червей и иглокожих в кожно-мускульном мешке; у моллюсков в кожных покровах и опорных хрящевых элементах.
Наиболее изучены свойства коллагенов в коже и мышечной ткани рыб. Коллаген кожи костистых рыб характеризуется частой встречаемостью молекул, состоящих из трех генетически различающихся α-цепочек, гетеротримера α1 α2 α3; среди изученных позвоночных животных цепочка α3 отмечена лишь у костистых рыб. В целом коллагены мышечной ткани костистых рыб, полученные методом электрофореза, идентичны соответствующим коллагенам типа I из кожи и имеют сходный аминокислотный состав. Однако коллагены мышечной ткани рыб более устойчивы к тепловой денатурации (более 100 °С), чем коллагены кожи, что объясняется более высокой степенью гидроксилирования пролина в мышечном коллагене. Термальная устойчивость мышечного коллагена определяется видом рыбы и по мере ее возрастания рыб можно расположить в следующем порядке: карп, угорь, скумбрия, сайра, кета.
В табл. 1 приведены данные о содержании коллагена и гексозаминов в соединительных тканях различных видов животных.
Составы субъячеек коллагена I типа из мышечной ткани и кожи являются идентичными у угря, скумбрии, сайры и карпа и отличаются у кеты. У последней коллаген кожи состоит из α1 α2 α3 гетеротримеров, а основная часть мышечного коллагена – из (α1)2α2 гетеротримеров (Богданов, Сафронова, 1993).
Содержание гексозаминов и коллагена в соединительной ткани животных
Чем отличается коллаген разных типов
С.И. Суркичин (1), Е.А. Коган (2), Л.С. Холупова (1)
1) Центральная государственная медицинская академия УДП РФ, Москва, Россия; 2) Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва, Россия
Введение
Кожа – это уникальный орган человеческого организма. Она является защитным барьером и первой встречает агрессивное воздействие окружающей среды, поэтому первые признаки старения отмечаются на наименее закрытых участках – лице и руках. Внешний вид кожи влияет на психоэмоциональное состояние и качество жизни человека.
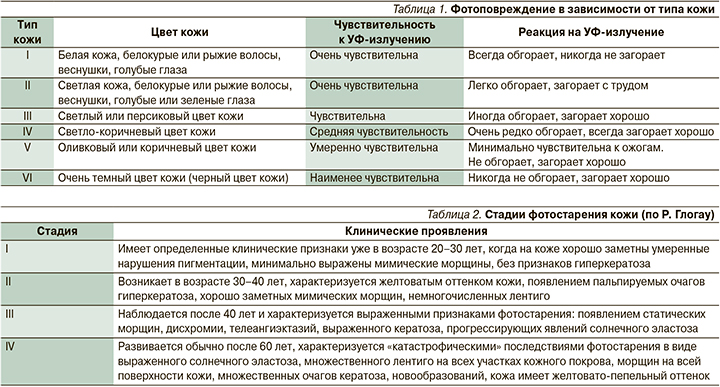
Факторы внешней среды могут по-разному сказываться на состоянии здоровья кожи как органа и на ее внешнем виде. Основным повреждающим внешним фактором в настоящее время считается ультрафиолетовое (УФ) излучение, которое приводит к раннему появлению возрастных изменений (не связанных с внутренним процессом старения). Фотоповреждение – это сложный биологический процесс. Его степень зависит от индивидуальных особенностей, в т.ч. от типа кожи (типы кожи по Фицпатрику, табл. 1).
Фотостарение – симптомокомплекс, включающий ряд признаков, характеризующих изменения эпидермиса, дермы и сосудов, возникающие вследствие длительного УФ-излучения. Процесс фотостарения характеризуется клиническими, гистологическими и биохимическими признаками, имеющими отличия от хронологического старения областей кожного покрова, закрытых от воздействия ультрафиолетовых лучей [1].
Клинически выделяют IV стадии фотостарения кожи (по Р. Глогау, табл. 2).
Старение кожи происходит в соответствии с общими закономерностями возрастной инволюции (биологическое или хронологическое старение), а также под действием факторов внешней среды, наибольшее значение из которых имеет УФ-излучение (фотоповреждение и фотостарение кожи). Процессы старения напрямую отражаются на состоянии коллагенового каркаса дермы. H.S. Talwar, C.E. Griffiths, G.J. Fisher, T.A. Hamilton, J.J. Voorhees в своем исследовании количественно оценили связь между уровнями проколлагена типа 1 и типа 3 и степенью фотоповреждения кожи человека. Поскольку проколлагены 1-го и 3-го типов являются молекулами – предшественницами зрелого коллагена, их уровни обычно отражают таковой биосинтеза коллагена. Сравнивали их количество на открытых участках кожи (предплечье) и закрытых (подмышечная или ягодичная области). В группе с незначительным фотоповреждением уровень проколлагена 3-го типа не отличался, а проколлагена 1-го типа был меньше на 16% на фотоповрежденном участке. В группе с сильным фотоповреждением уровни проколлагена типов 1 и 3 были значительно снижены (приблизительно на 40%) [2].
Коллаген – основной структурный белок межклеточного матрикса. Он составляет 25–33% от общего количества белка в организме, т.е.
6% массы тела. У человека 50% всего коллагена содержится в костях, где он составляет 90% органического матрикса. Вторая половина сосредоточена в коже, соединительной ткани, хрящах, стенках сосудов, базальных мембранах и т.д. В разных тканях преобладают разные типы коллагена, а это в свою очередь определяется той ролью, которую коллаген играет в конкретном органе или ткани.
В коже (дерме) коллагеновые волокна организованы в трехмерную сеть фибрилл, особенно хорошо развитую в участках кожи, которые испытывают сильное давление (кожа подошв, локтей, ладоней). Коллагеновые волокна малорастяжимы, однако благодаря определенному образу переплетения позволяют коже значительно растягиваться без повреждения [3].
Общее содержание коллагена уменьшается с увеличением возраста. Сразу после рождения в нормальной коже человека деградация коллагена 3-го типа превышает его образование. Синтез коллагена 1-го типа в нормальной коже человека доминирует до 8 лет, а затем имеет противоположную тенденцию [4].
С возрастом коллагеновые волокна не утолщаются, однако их количество увеличивается, причем отмечается увеличение соотношения коллагена типов 3/1 в сторону коллагена 3-го типа [5].
На протяжении всей жизни человека содержание коллагена уменьшается примерно на 1% в год, причем соотношение типов коллагена меняется в сторону увеличения содержания коллагена типа 3 – прежде всего за счет уменьшения содержания коллагена типа 1. Иммуногистохимические исследования дермы после инсоляции показывают снижение коллагенов 1-го и 3-го типов на 20–30%, что может быть следствием, с одной стороны, усиленного распада, с другой – уменьшения его синтеза фибробластами [6].
Одним из актуальных способов воздействия при фотоповреждении кожи является фотодинамическая терапия (ФДТ). Она представляет собой метод воздействия, основанный на системном или местном применении фотосенсибилизаторов в комплексе со световым или лазерным излучением различной длины волны, базирующийся на достижениях квантовой физики, фотохимии и фотобиологии, включающий 3 компонента: фотосенсибилизатор и квант света (экзогенные факторы), и генерируемые в результате их взаимодействия через каскад биохимических реакций активные формы кислорода, главным образом синглетный (экзогенный фактор).
Известно более 1000 соединений, способных выступать в качестве фотосенсибилизаторов. К трем основным группам относятся хлорины, порфирины и фталоцианины [7].
В настоящее время ведется поиск новых, более эффективных фотосенсибилизаторов в различных классах органических красителей, прежде всего среди порфиринов и их синтетических аналогов. Хлорины (дигидропорфирины) характеризуются сильным возрастанием интенсивности длинноволновой полосы и ее смещением в красную область по сравнению с порфиринами [8].
Хлорин Е6 (трисмеглуминовая соль) является мощным фотосенсибилизатором с полосой поглощения в красной области спектра с длиной волны 660±2 и 405±2 нм (генерируемой аппаратом на сверхъярких светодиодах – LED, либо соответствующим полупроводниковым лазером). После нанесения препарата на кожу происходит накопление на мембранах клеточных структур пораженной ткани производных хлорина Е6. Воздействие на эти клетки светом в интервале длин волн (660±2 нм), совпадающих со спектром поглощения производных хлорина Е6, приводит к активации клеточных и гуморальных факторов иммунной системы человека.
Спектр поглощения хлорина E6 в видимой области спектра характеризуется наличием высокоинтенсивной полосы Cope (Soret) c =403 нм, характерной для всех порфиринов, наличием плато в интервале длин волн =450–615 нм с небольшими пиками в области 504 нм, 533 и 599 нм, а также явно выраженным пиком с=653 нм [12].
Фотодинамическая терапия широко применяется в лечении фотоповреждений кожи и связанных с этим заболеваний. В ряде исследований показано, что после фотодинамического воздействия с использованием 5-аминолевулиновой кислоты (АЛА ФДТ) происходит увеличение количества коллагена 1-го типа за счет активации фибробластов [9].
При исследовании результатов ФДТ in vitro отмечены увеличение синтеза коллагена, уменьшение синтеза эластина, индуцирование активации внеклеточных сигнал-регулирующих киназ, что приводит к увеличению количества коллагена 1-го типа, а также к активации матриксных металлопротеиназ 3-го типа – ММП-3 [10].
Предполагается, что увеличение ММП-3 способствует деградации и удалению поврежденного коллагена, в то время как фибробласты активируются для синтеза нового. Важную роль играют эпителиально-мезенхимальные взаимоотношения со стимуляцией кератиноцит-индуцированного синтеза цитокинов в фибробластах [11].
Цель исследования
В своем эксперименте мы оценили количество коллагена 1-го и 3-го типов до и после курса сеансов ФДТ с использованием фотосенсибилизатора на основе хлорина Е6.
Методы
Исследовались панч-биоптаты околоушной области 3 женщин 38–45 лет с признаками фотостарения кожи II–III стадий (до и после проведения курса процедур ФДТ с использованием хлорина Е6 1 раз в 7 дней, № 5).
Биоптаты фиксировались в 10%-ном нейтральном формалине, заливались в парафин по общепринятой методике. Серийные парафиновые срезы окрашивались по Ван-Гизону. Определялись иммуногистохимические показатели: коллаген 1-го и 3-го типов.
Процедуры проводились 1 раз в 7 дней 5 раз. Фотосенсибилизатор – топическое средство на основе фотосенсибилизирующего комплекса последнего поколения сферометаллохлорина (производное хлорина Е6). Источник света – LED-лампа с возможностью генерировать излучение 410 нм, 580 и 630 нм.
Перед процедурой использовались средства с эксфолиативным и очищающим действиями (очищающий гель с папаином) для лучшего проникновения фотосенсибилизатора в кожу. После 30-минутной экспозиции топического средства с хлорином Е6 проводилось световое воздействие с использованием длин волн 410 нм 15 минут+630 нм 15 минут 2 пациентками (общее время – 30 минут) или 410 нм 15 минут+630 нм 15 минут 1 пациенткой (общее время – 30 минут).
Панч-биопсия в заушной области проводилась до начала курса процедур и сразу после последнего сеанса.
Результаты
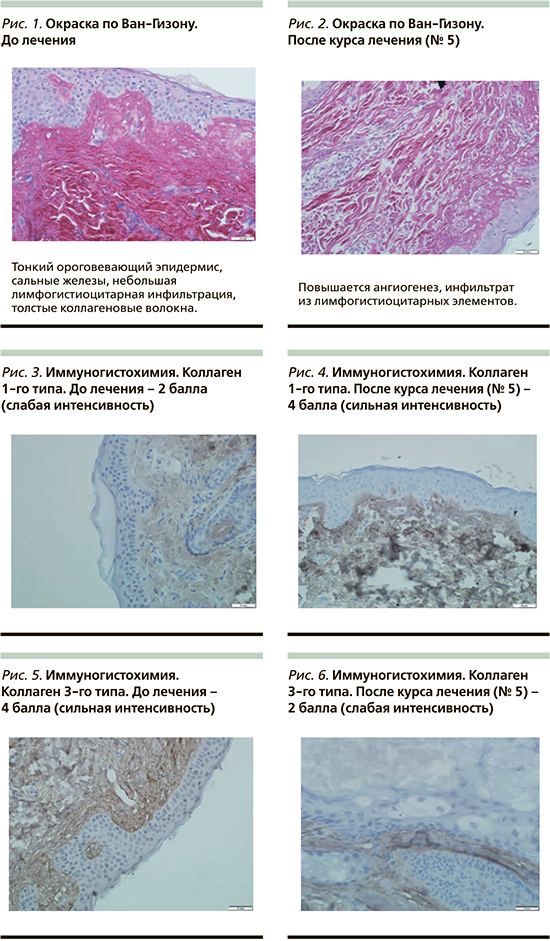
Результаты исследования представлены на рис. 1–6.
Полученные данные при проведении процедур с параметрами воздействия 410+630 нм 2 пациенткам и 410+630 нм 1 пациентке сопоставимы. В гистологических образцах, взятых до воздействия, наблюдается тонкий ороговевающий эпидермис, присутствуют сальные железы, небольшая лимфогистиоцитарная инфильтрация, толстые коллагеновые волокна. При иммуногистохимическом исследовании экспрессия коллагена 1-го типа имеет слабую интенсивность (2 балла), экспрессия коллагена 3-го типа – сильную интенсивность (4 балла). В гистологических образцах, взятых после воздействия, наблюдается тонкий ороговевающий эпидермис, по сравнению с образцом «до» повышается ангиогенез, имеется инфильтрат из лимфогистиоцитарных элементов. При иммуногистохимическом исследовании экспрессия коллагена 1-го типа имеет сильную интенсивность (4 балла), экспрессия коллагена 3-го типа – слабую интенсивность (2 балла).
Обсуждение
В результате проведения курса процедур 1 раз в 7 дней, № 5, наблюдается повышение количества коллагена 1-го типа и уменьшение количества коллагена 3-го типа. Это происходит за счет активации макрофагов, которые выделяют ММП, расщепляющие избирательно коллаген 3-го типа. Полученные нами результаты совпадают с исследованиями, проведенными с использованием АЛА ФДТ, в которых зарегистрировано усиление синтеза коллагена 1-го типа за счет активации фибробластов [9]; с исследованием действия АЛА ФДТ in vitro, где отмечено увеличение синтеза коллагена, уменьшение синтеза эластина, индуцирование активации внеклеточных сигнал-регулирующих киназ, что приводит к активации ММП-3 [10].
В своем исследовании мы использовали производные хлорина Е6 для фотосенсибилизации и получили аналогичные результаты. Это может свидетельствовать о том, что для восстановления соотношения коллагенов 1-го и 3-го типов при коррекции возрастных изменений вследствие фотостарения ключевым фактором является образование активных форм кислорода, которое происходит при ФДТ и служит сутью данного воздействия.
Заключение
Таким образом, можно заключить, что воздействие ФДТ при фотостарении приводит к нормализации соотношения коллагена 1-го и 3-го типов. Использование производных хлорина Е6 в качестве фотосенсибилизатора приводит к изменениям, аналогичным использованию 5-аминолевулиновой кислоты в отношении коллагена 1-го и 3-го типов и может быть рекомендовано для клинического применения.
Литература
1. Кубанов А.А., Жилова М.Б., Кубанова А.А. Фотостарение кожи: механизмы развития, особенности клинических проявлений. Вестник дерматологии и венерологии. 2014;5:53–9.
2. Talwar H.S., Griffiths C.E., Fisher G.J., et al. Reduced type I and type III procollagens in photodamaged adult human skin. J Invest Dermatol. 1995;105(2):285–90. Doi: 10.1111/1523-1747.ep12318471.
3. Потехина Ю.П. Структура и функции коллагена. Российский остеопатический журнал. 2016;1–2(32–33):87–99.
4. Rong Y.H., Zhang G.A., Wang C., Ning F.G. Zhonghua Shao Shang Za Zhi. 2008;24(1):51–3.
5. Целуйко С.С., Малюк Е.А., Красавина Л.С., Корнеева Н.П. Морфофункциональная характеристика дермы кожи и еe изменения при старении. Бюллетень физиологии и патологии дыхания. 2016;60:111–66.
6. Fisher G.J., Datta S.С., Таlwar H.S., et al. Molecular basis of sun-induced premature skin ageing and retinoid antagonism. Nature. 1996;379:335–39. Doi: 10.1038/379335a0.
7. Баткаев Э.А., Кузьмин С.Г., Димитриади О.В., Бакурова В.А., Набатникова Н.Е. Опыт применения фотодинамической терапии с препаратом фотосенс в дерматологии. РМЖ. 2013;8:406.
8. Лукьянец Е.А. Поиск новых фотосенсибилизаторов для фотодинамической терапии. Фотодинамическая терапия и фотодиагностика. 2013;2(3):3–16.
9. Marmur E.S., Phelps R., Goldberg D.J. Ultrastructural changes seen after ALA-IPL photorejuvenation: a pilot study. J Cosmet Laser Ther. 2005;7:21–4. Doi: 10.1080/147641700510037725.
10. Jang Y.H., Koo G.B., Kim J.Y., et al. Prolonged activation of ERK contributes to the photorejuvenation effect in photodynamic therapy in human dermal fibroblasts. J Invest Dermatol. 2013;133:2265–75. Doi: 10.1038/jid.2013.25.
11. Kim S.K., Koo G.B., Kim Y.S., Kim Y.C. Epithelial-mesenchymal interaction during photodynamic therapy- induced photorejuvenation. Arch Dermatol Res. 2016;308:493–501. Doi: 10.1007/s00403-016-1666-3.
12. Клименко И.В., Лобанов А.В. Спектрально-флуоресцентные свойства хлорина е6 в различных супрамолекулярных системах. Актуальные вопросы биологической физики и химии. 2016;2:71–4.