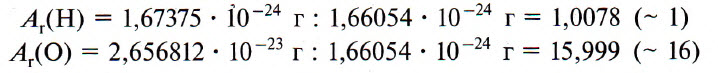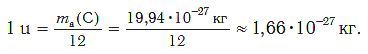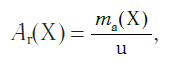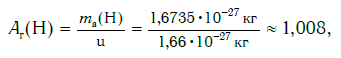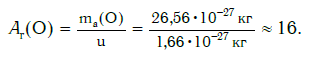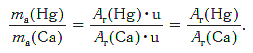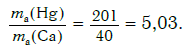Чем определяются свойства химических элементов величиной относительной атомной массы
Зачет по химии
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Зачет по теме для учащихся 8-9 классов.
«Периодический закон. Периодическая система химических элементов Д.И. Менделеева. Строение атома»
1) Какая формулировка Периодического закона является современной?
а) Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины их атомной массы.
б) Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов их атомных ядер.
2) С увеличением порядкового номера элемента в периоде:
а) радиусы атомов увеличиваются
б) радиусы атомов уменьшаются
в) радиусы атомов не изменяются
3) Радиус какого атома больше:
4) Чем определяется место химического элемента в периодической системе Д.И.Менделеева?
а) количеством электронов на внешнем энергетическом уровне атома
б) количеством нейтронов в ядре атома
в) зарядом ядра атома
5)Как определить, используя периодическую систему химических элементов Д.И. Менделеева, количество энергетических уровней атома элемента?
а) по порядковому номеру элемента
б) по номеру группы
в) по номеру периода
6) Сколько энергетических уровней у атома скандия?
7) Чем определяются свойства химических элементов?
а) величиной относительной атомной массы элемента
б) числом электронов на внешнем энергетическом уровне атома
в) зарядом ядра атома
г) количеством валентных электронов
8) Как изменяются химические свойства элементов в периоде периодической системы химических элементов с увеличением заряда ядер их атомов?
а) усиливаются металлические свойства
б) усиливаются неметаллические свойства
в) ослабевают металлические свойства
г) ослабевают неметаллические свойства
9) Укажите элемент с металлическими свойствами, возглавляющий большой период периодической системы химических элементов ( см. периодическую таблицу).
а) медь (№29) б) серебро(№47) в) калий(№19) г)золото(№79)
10) Определите элемент, проявляющий наиболее ярко выраженные металлические свойства
а) магний б) алюминий в) кремний
11) В чём основная причина изменения свойств химических элементов в периоде периодической системы Д.И. Менделеева?
а) в постепенном увеличении числа электронов на внешнем энергетическом уровне
б) в увеличении атомных масс
в) в увеличении количества электронов в атоме
г) в увеличении количества нейтронов в ядре атома
12) Как изменяются свойства элементов внутри периода с увеличением заряда ядер их атомов?
а) плавно б) скачкообразно
а) появление нового электронного уровня
б) постепенное накопление электронов на внешнем энергетическом уровне атома
в) постепенное увеличение атомных масс
г) увеличение количества нейтронов в ядре атома
14) Как изменяются свойства химических элементов в главных подгруппах с увеличением заряда ядер их атомов?
а) усиливаются металлические свойства
б) ослабевают металлические свойства
в) усиливаются неметаллические свойства
г) ослабевают неметаллические свойства
15) В чём основная причина изменения свойств химических элементов в главных подгруппах периодической системы?
а) в постепенном увеличении атомных масс
б) в появлении нового энергетического уровня
в) в увеличении количества электронов в атоме
г) в увеличении количества нейтронов в ядре атома
16) Какой элемент возглавляет главную подгруппу четвертой группы периодической системы химических элементов?
а) селен(№34) б)углерод (№6) в)титан (№22) г)кремний (№14)
17)Какой элемент проявляет наиболее ярко выраженные неметаллические свойства?
18) Какой из высших оксидов относится к оксиду, образованному элементом четвёртой группы?
19) Какую общую формулу имеют гидроксиды, образованные элементами шестой группы?
20)Используя периодическую таблицу химических элементов, установите, какой из указанных элементов может образовывать газообразное водородное соединение
а) № 22 б) № 6 в) № 23 г) № 24
а) траектория, по которой движется электрон
б) вероятность нахождения электрона в данной точке атомного пространства
в) пространство вокруг ядра атома, в котором наиболее вероятно пребывание электрона
г) определённый энергетический уровень, на котором находится электрон
22) На какой орбитали электрон имеет наибольшую энергию
а) 1s б) 2 s в) 3s г) 2 p
23)Определите номер химического элемента в периодической системе, электронная формула атома которого 1 s 1 2 s 2 2 p 3
24)Какое число валентных электронов у атома кальция?
25) Используя периодическую систему химических элементов, определите низшую валентность хлора.
а) бор б) хлор в) магний г)фосфор
а) в химических реакциях вещество может быть как окислителем, так и восстановителем.
б) образует летучее водородное соединение
в) раствор водородного соединения в воде- слабая кислота
г) гидроксид высшего оксида обладает основными свойствами
28)Химические элементы каких групп периодической системы могут образовывать летучие водородные соединения?
29) Установите формулы кислотных оксидов, образованных элементами одного периода
30) Определите формулу амфотерного оксида, образованного элементом третьего периода
31) Укажите элемент, оксид которого проявляет основной характер
а) барий (№56) б)алюминий(№13) в)сурьма (№51) г)селен(№34)
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Ищем педагогов в команду «Инфоурок»
Зачет по теме «Периодический закон. Периодическая система химических элементов Д. И. Менделеева. Строение атома» Зачет для учащихся 8 класса после изучении темы «Периодический закон. Периодическая система химических элементов Д. И. Менделеева. Строение атома». Этот зачет можно провести для учащихся 11 классов при подготовке к единому государственному экзамену. Зачет состоит из 31 вопросов в конце которого ответы на каждый вопрос. Большинство вопросов состоит из 4-х ответов, который ученик выбирает 1 или 2 правильных ответов.
Номер материала: 255003
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Псковских школьников отправили на дистанционку до 10 декабря
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Учителям истории предлагают предоставить право бесплатно посещать музеи
Время чтения: 2 минуты
Международный конгресс-выставка «Молодые профессионалы» пройдет с 12 по 14 декабря в Москве
Время чтения: 1 минута
В России утвердили новый порядок формирования федерального перечня учебников
Время чтения: 1 минута
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Чем определяются свойства химических элементов величиной относительной атомной массы
Ключевые слова конспекта: атомная единица массы, относительная атомная масса химических элементов, относительная молекулярная масса.
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Обратите внимание! На Земле встречаются три разновидности атомов углерода, различающиеся только массой. Такие разновидности атомов одного и того же элемента называют изотопами. В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают Аr (А — от слова «атом», r — от латинского слова relativus — относительный).
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
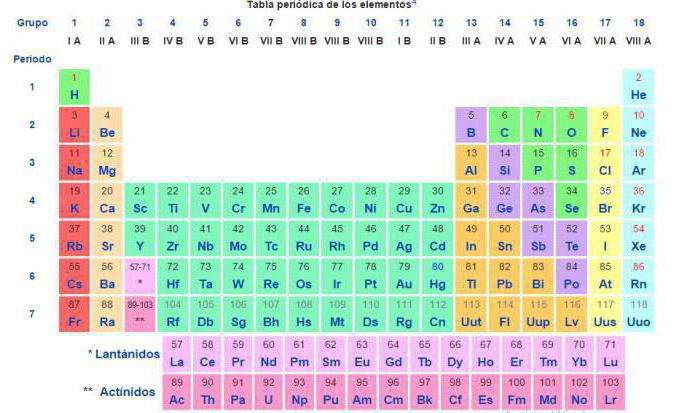
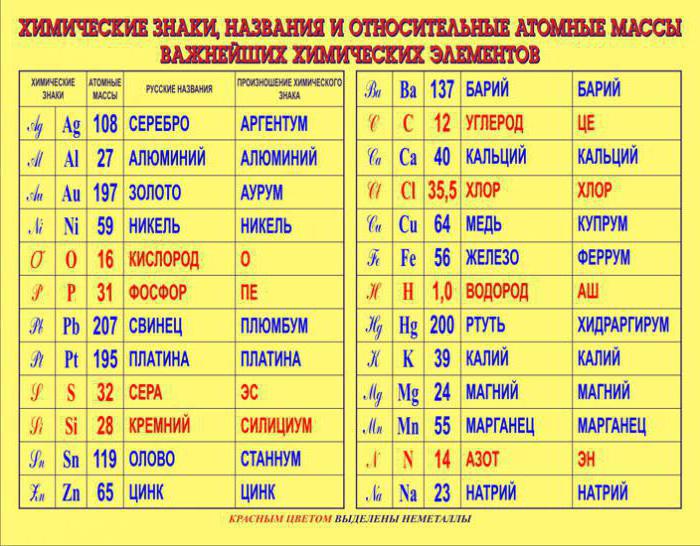
Так как первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г, то в память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da). Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.
Относительная молекулярная масса
Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная молекулярная масса Мr — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:
Конец конспекта «Относительная атомная масса. Относительная молекулярная масса».
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
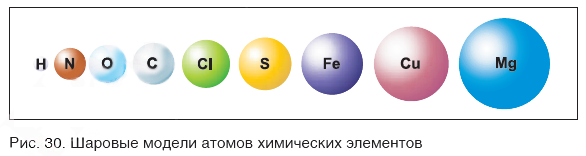
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
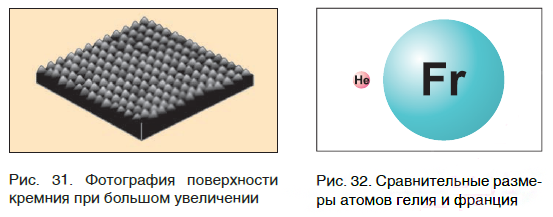
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Относительная атомная масса элемента в химии и история её определения
В процессе развития науки химия столкнулась с проблемой подсчёта количества вещества для проведения реакций и полученных в их ходе веществ.
На сегодня для подобных расчётов химической реакции между веществами и смесями используют значение относительной атомной массы, внесённой в периодическую таблицу химических элементов Д. И. Менделеева.
Химические процессы и влияние доли элемента в веществах на ход реакции
Современная наука под определением «относительная атомная масса химического элемента» подразумевает, во сколько раз масса атома данного химического элемента больше одной двенадцатой части атома углерода.
С зарождением эры химии потребность в точных определениях хода химической реакции и её результатов росла.
Исторический ход подсчёта вещества
Изначально использовался водород, затем кислород. Но этот способ расчёта оказался неточным. Причиной тому послужило наличие в кислороде изотопов с массой 17 и 18.
Дальтон заложил основы относительной атомной массы элемента
Лишь спустя некоторое время, в 19-м веке, Дальтон предложил вести расчёт по самому лёгкому химическому элементу – водороду. На лекциях своим студентам он демонстрировал на вырезанных из дерева фигурках, как соединяются атомы. По другим элементам он использовал данные, ранее полученные другими учёными.
По экспериментам Лавуазье в воде содержится пятнадцать процентов водорода и восемьдесят пять процентов кислорода. Имея эти данные, Дальтон рассчитал, что относительная атомная масса элемента, входящего в состав воды, в данном случае кислорода, составляет 5,67. Ошибочность его расчётов связана с тем, что он считал неверно относительно количества атомов водорода в молекуле воды.
Изотопная составляющая вещества влияет на значение точности относительного атомного веса
Относительная атомная масса изотопов водорода составляет соответственно два и три. «Тяжёлая» вода (образованная дейтерием и тритием) испаряется хуже. Поэтому в парообразном состоянии изотопов воды меньше, чем в жидком состоянии.
Избирательность живых организмов к различным изотопам
Существование в природе нестабильных веществ
У некоторых элементов относительная масса указана в квадратных скобках. Как видно, это элементы, расположенные после урана. Дело в том, что они не имеют устойчивых изотопов и распадаются с выделением радиоактивного излучения. Поэтому в скобках указан наиболее устойчивый изотоп.
В процессе синтеза новых изотопов и измерения их продолжительности жизни порой удавалось обнаружить нуклиды с продолжительностью полураспада в миллионы раз дольше.
Урок №57. Периодический закон Д. И. Менделеева
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
К 70-м гг. XIX в. было уже известно более 60 химических элементов. Возникла необходимость в их классификации.
1. Вначале учёные попытались все химические элементы разделить на две группы – металлы и неметаллы:
Еще алхимики пытались найти закон природы, на основе которого можно было бы систематизировать химические элементы. Но им недоставало надежных и подробных сведений об элементах. К середине XIX в. знаний о химических элементах стало достаточно, а число элементов возросло настолько, что в науке возникла естественная потребность в их классификации. Первые попытки классификации элементов на металлы и неметаллы оказались несостоятельными. Предшественники Д.И.Менделеева (И. В. Деберейнер, Дж. А. Ньюлендс, Л. Ю. Мейер) многое сделали для подготовки открытия периодического закона, но не смогли постичь истину. Дмитрий Иванович установил связь между массой элементов и их свойствами.
Дмитрий Иванович родился в г. Тобольске. Он был семнадцатым ребенком в семье. Закончив в родном городе гимназию, Дмитрий Иванович поступил в Санкт-Петербурге в Главный педагогический институт, после окончания которого с золотой медалью уехал на два года в научную командировку за границу. После возвращения его пригласили в Петербургский университет. Приступая к чтению лекций по химии, Менделеев не нашел ничего, что можно было бы рекомендовать студентам в качестве учебного пособия. И он решил написать новую книгу – «Основы химии».
Открытию периодического закона предшествовало 15 лет напряженной работы. 1 марта 1869 г. Дмитрий Иванович предполагал выехать из Петербурга в губернии по делам.
Периодический закон был открыт на основе характеристики атома – относительной атомной массы.
Менделеев расположил химические элементы в порядке возрастания их атомных масс и заметил, что свойства элементов повторяются через определенный промежуток – период, Дмитрий Иванович расположил периоды друг под другом, так, чтобы сходные элементы располагались друг под другом – на одной вертикали, так была построена периодическая система элементов.
1 марта 1869 г. Формулировка периодического закона Д.И. Менделеева
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
К сожалению, сторонников периодического закона сначала было очень мало, даже среди русских ученых. Противников – много, особенно в Германии и Англии.
Открытие периодического закона – это блестящий образец научного предвидения: в 1870 г. Дмитрий Иванович предсказал существование трех еще неизвестных тогда элементов, которые назвал экасилицием, экаалюминием и экабором. Он сумел правильно предсказать и важнейшие свойства новых элементов. И вот через 5 лет, в 1875 г., французский ученый П.Э. Лекок де Буабодран, ничего не знавший о работах Дмитрия Ивановича, открыл новый металл, назвав его галлием. По ряду свойств и способу открытия галлий совпадал с экаалюминием, предсказанным Менделеевым. Но его вес оказался меньше предсказанного. Несмотря на это, Дмитрий Иванович послал во Францию письмо, настаивая на своем предсказании.
Ученый мир был ошеломлен тем, что предсказание Менделеевым свойств экаалюминия оказалось таким точным. С этого момента периодический закон начинает утверждаться в химии.
В 1879 г. Л. Нильсон в Швеции открыл скандий, в котором воплотился предсказанный Дмитрием Ивановичем экабор.
В 1886 г. К. Винклер в Германии открыл германий, который оказался экасилицием.
Но гениальность Дмитрия Ивановича Менделеева и его открытия — не только эти предсказания!
В четырёх местах периодической системы Д. И. Менделеев расположил элементы не в порядке возрастания атомных масс:
Ещё в конце 19 века Д.И. Менделеев писал, что, по-видимому, атом состоит из других более мелких частиц. После его смерти в 1907 г. было доказано, что атом состоит из элементарных частиц. Теория строения атома подтвердила правоту Менделеева, перестановки данных элементов не в соответствии с ростом атомных масс полностью оправданы.
Современная формулировка периодического закона:
Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней валентной электронной оболочки.
И вот спустя более 130 лет после открытия периодического закона мы можем вернуться к словам Дмитрия Ивановича, взятым в качестве девиза нашего урока: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются». Сколько химических элементов открыто на данный момент? И это далеко не предел.
Графическим изображением периодического закона является периодическая система химических элементов. Это краткий конспект всей химии элементов и их соединений.