Чем определяется вторичная структура белка
Чем определяется вторичная структура белка
Для всякого белка характерна, помимо первичной, еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину.
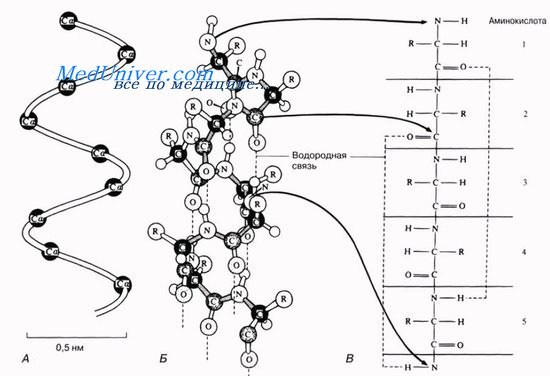
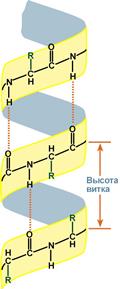
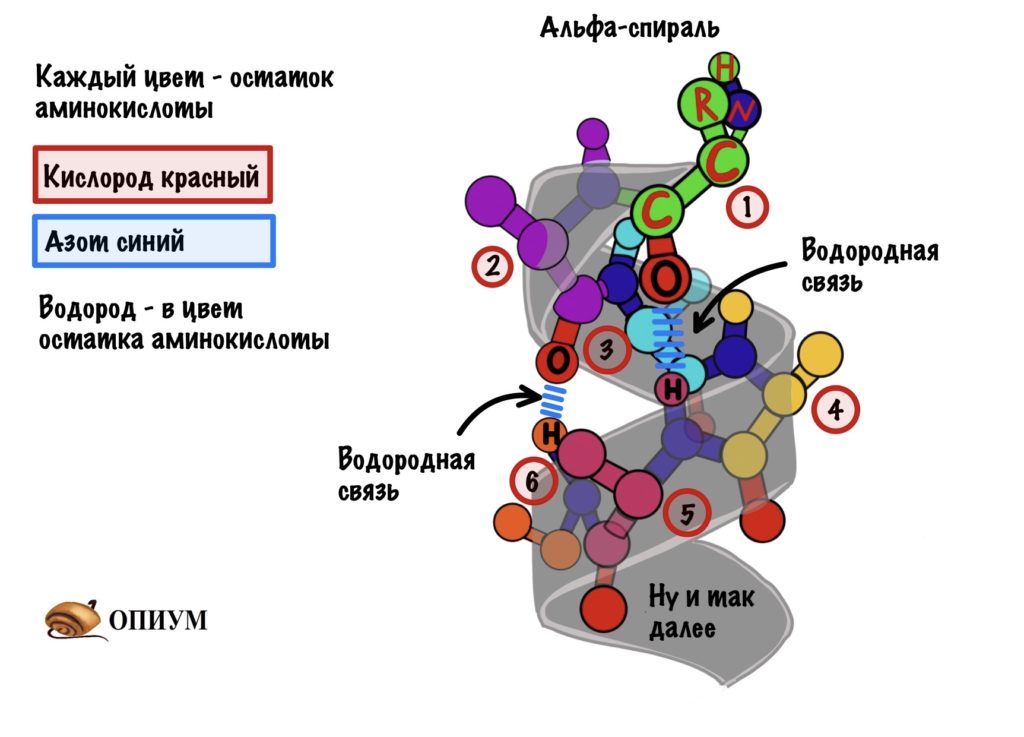
Это так называемая а-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга СО- и NH-группами. Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода СО-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка.
Таким образом аминокислота 1 оказывается связанной с аминокислотой 5, аминокислота 2 — с аминокислотой 6 и т. д. Рентгеноструктурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка.
Полностью а-спиральную конформацию и, следовательно, фибриллярную структуру имеет белок кератин. Это структурный белок волос, шерсти, ногтей, клюва, перьев и рогов, входящий также в состав кожи позвоночных.
Твердость и растяжимость кератина варьируют в зависимости от числа дисульфидных мостиков между соседними полипептидными цепями (от степени сшивки цепей).
Теоретически все СО- и NH-группы могут участвовать в образовании водородных связей, так что а-спираль — это очень устойчивая, а потому и весьма распространенная конформация. Участки а-спирали в молекуле напоминают жесткие стержни. Тем не менее большинство белков существует в глобулярной форме, в которой также имеются участки (3-слоя (см. ниже) и участки с нерегулярной структурой.
Объясняется это тем, что образованию водородных связей препятствует ряд факторов: наличие некоторых аминокислотных остатков в полипептидной цепи, наличие дисульфидных мостиков между различными участками одной и той же цепи и, наконец, тот факт, что аминокислота пролин вообще неспособна образовывать водородные связи.
Бета-Слой, или складчатый слой — это другой тип вторичной структуры. Белок шелка фиброин, выделяемый шелкоотделительными железами гусениц шелкопряда при завивке коконов, представлен целиком именно этой формой. Фиброин состоит из ряда полипептидных цепей, вытянутых сильнее, чем цепи с конформацией альфа-спирали.
Эти цепи уложены параллельно, но соседние цепи по своему направлению противоположны одна другой (антипараллельны). Они соединены друг с другом при помощи водородных связей, возникающих между С=0- и NH-группами соседних цепей. В этом случае в образовании водородных связей также принимают участие все NH- и С=0-группы, т. е. структура тоже весьма стабильна.
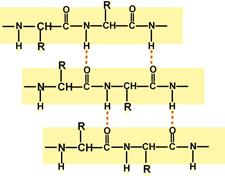
Такая конформация полипептидных цепей называется бета-конформацией, а структура в целом — складчатым слоем. Фиброин обладает высокой прочностью на разрыв и не поддается растяжению, но подобная организация полипептидных цепей делает шелк очень гибким. В глобулярных белках полипептидная цепь может складываться на себя, и тогда в этих точках глобулы возникают участки, имеющие структуру складчатого слоя.
Еще один способ организации полипептидных цепей мы находим у фибриллярного белка коллагена. Это тоже структурный белок, обладающий подобно кератину и фиброину высокой прочностью на разрыв. У коллагена три полипептидные цепи свиты вместе, как пряди в канате, образуя тройную спираль. В каждой полипептидной цепи этой сложной спирали, называемой тропоколлагеном, содержится около 1000 аминокислотных остатков. Отдельная полипептидная цепь представляет собой свободно свернутую спираль (но не а-спираль;).
Три цепи удерживаются вместе водородными связями. Из многих тройных спиралей, располагающихся параллельно друг другу и удерживаемых вместе ковалентными связями между соседними цепями, образуются фибриллы. Они в свою очередь объединяются в волокна. Структура коллагена формируется, таким образом, поэтапно — на нескольких уровнях — подобно структуре целлюлозы. Коллаген также невозможно растянуть, и это его свойство существенно для той функции, которую он выполняет, например, в сухожилиях, костях и других видах соединительной ткани.
Белки, существующие только в полностью спирализованной форме, подобно кератину и коллагену, представляют собой исключение среди прочих белков.
Вторичная структура белка
Рентгеноструктурная кристаллография решает две главные проблемы белковой химии: закономерности чередования последовательности аминокислотных остатков в полипептидной цепи и закономерности конфигурации белковой молекулы.
Первые рентгенограммы белков, полученные еще в 30-х годах У. Астбю-ри, а затем Л. Полингом и Р. Кори, позволили установить наличие в белках наряду с линейной полипептидной цепью участков, определенным образом скрученных.
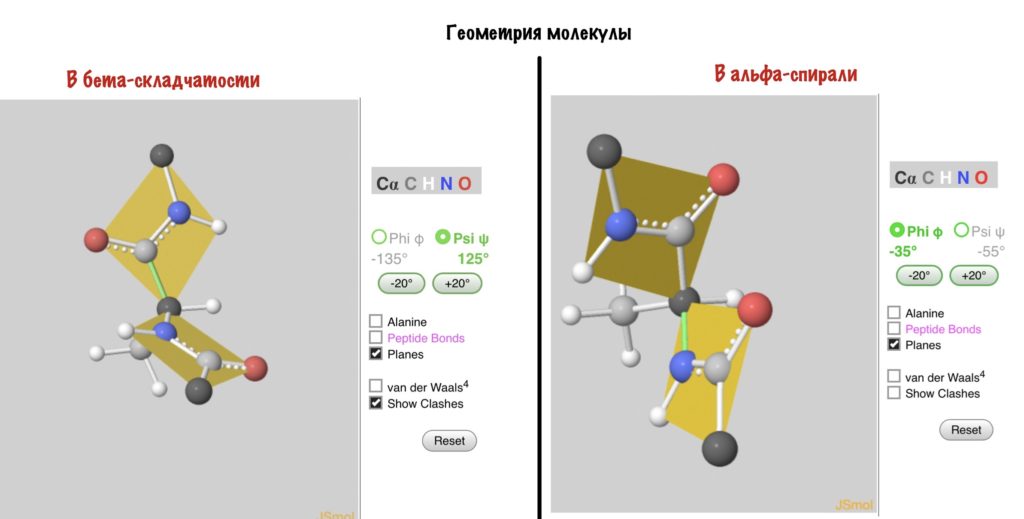
Под вторичной структурой белка подразумевают конфигурацию полипептидной цепи, т. е. способ свертывания, скручивания (складывание, упаковка) полипептидной цепи в спиральную или какую-либо другую конформацию. Процесс этот протекает не хаотично, а в соответствии с программой, заложенной в первичной структуре. Подробно изучены две основные конфигурации полипептидных цепей, отвечающих структурным требованиям и экспериментальным данным: α-спирали и β-структуры.
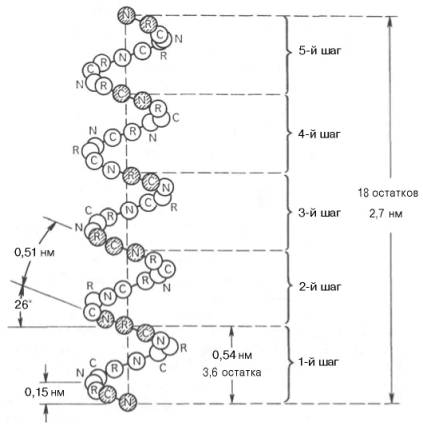
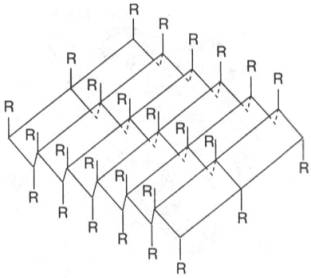
Благодаря исследованиям Л. Полинга наиболее вероятным типом строения глобулярных белков принято считать α-спираль (рис. 1.17). Закручивание полипептидной цепи происходит по часовой стрелке (правый ход спирали), что обусловлено L-аминокислотным составом природных белков. Движущей силой в возникновении α-спиралей (так же как и β-структур) является способность аминокислот к образованию водородных связей. В структуре α-спиралей открыт ряд закономерностей. На каждый виток (шаг) спирали приходится 3,6 аминокислотных остатка. Шаг спирали (расстояние вдоль оси) равен 0,54 нм на виток, а на один аминокислотный остаток приходится 0,15 нм. Угол подъема спирали 26°, через 5 витков спирали (18 аминокислотных остатков) структурная конфигурация полипептидной цепи повторяется. Это означает, что период повторяемости (или идентичности) α-спиральной структуры составляет 2,7 нм.
Для каждого белка характерна определенная степень спирализации его полипептидной цепи. Степень спирализации устанавливают путем измерения удельного вращения плоскости поляризованного света. Изменение последнего находится в прямой зависимости от степени спирализации белковой молекулы. Не все глобулярные белки спирализованы на всем протяжении полипептидной цепи. В молекуле белка α-спиральные участки чередуются с линейными. В частности, если α- и β-цепи гемоглобина спирализованы, например, на 75%, то лизоцима – на 42%, а пепсина – всего на 30%.
Рис. 1.17. Структура и параметры α-спирали.
Таким образом, стабильность вторичной структуры обеспечивается в основном водородными связями (определенный вклад вносят и главно-валентные связи – пептидные и дисульфидные).
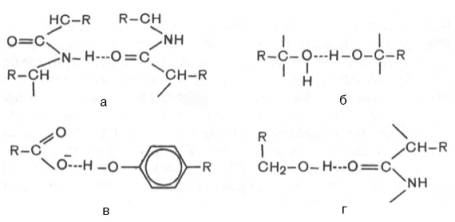
Водородная связь представляет собой слабое электростатическое притяжение (взаимодействие, связь) между одним электроотрицательным атомом (например, кислородом или азотом) и водородным атомом, кова-лентно связанным со вторым электроотрицательным атомом. Типы водородных связей представлены далее.
По современным представлениям, водородная связь включает не только электростатические силы притяжения между полярными группами (взаимодействие атомов водорода с электроотрицательными элементами: кислородом, азотом, хлором), но и электронные связи такого же типа, как в ряде комплексных соединений. Водородные связи, являясь нековалентными, отличаются малой прочностью. Так, если для разрыва химических межатомных связей необходимо затратить от 84 до 8400 кДж, то для разрыва одной водородной связи требуется затратить всего лишь 6,3 кДж на 1 моль. Поскольку в белковой молекуле число водородных связей очень велико (в образование водородных связей вовлечены все пептидные группы), они в сумме обеспечивают скручивание полипептидной цепи в спиральную структуру, сообщая ей компактность и стабильность.
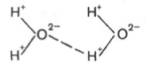
Механизм возникновения водородных связей в элементарной форме может быть представлен на примере взаимодействия двух молекул воды (диполи). В диполе воды, как известно, избыток положительных зарядов приходится на атомы водорода, а избыток отрицательных – на атомы кислорода.
Благодаря особенностям строения атома водорода при достаточном сближении двух молекул воды возникает электростатическое взаимодействие между атомом кислорода одной молекулы и атомом водорода второй молекулы воды. Следствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле воды и соответственно возникновение новой, непрочной связи (отмечена пунктиром) между атомом водорода первой молекулы и атомом кислорода второй молекулы воды. Эту непрочную связь принято обозначать водородной связью.
В белковой молекуле наиболее важные водородные связи образуются между ковалентно связанным атомом водорода, несущим частичный положительный заряд, и отрицательно заряженным ковалентно связанным атомом кислорода. Ниже представлены примеры водородных связей в белковой молекуле: а) между пептидными цепями; б) между двумя гидрок-сильными группами; в) между ионизированной СООН-группой и ОН-груп-пой тирозина; г) между ОН-группой серина и пептидной связью.
В зависимости от химической природы атома-акцептора водородные связи отличаются друг от друга степенью прочности. О количестве водородных связей в белковой молекуле судят по данным изотопного метода, в частности по времени обмена атомов водорода, участвующих в образовании водородной связи, на дейтерий (при обработке белка тяжелой водой D2O, в которой вместо обычного водорода содержится его тяжелый изотоп дейтерий).
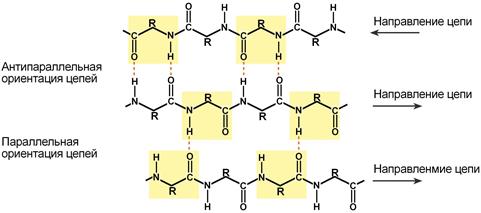
Другой тип конфигурации полипептидных цепей, обнаруженный в белках волос, шелка, мышц и в других фибриллярных белках, получил название β-структуры. В этом случае две или более линейные полипептидные цепи, расположенные параллельно или, чаще, антипараллельно, прочно связываются межцепочечными водородными связями между NH-и СО-группами соседних цепей, образуя структуру типа складчатого слоя (рис. 1.18).
Рис. 1.18. β-Структура полипептидных цепей.
В природе существуют белки, строение которых, однако, не соответствует ни β-, ни α-структуре. Типичным примером таких белков является коллаген – фибриллярный белок, составляющий основную массу соединительной ткани в организме человека и животных (см. главу 21).
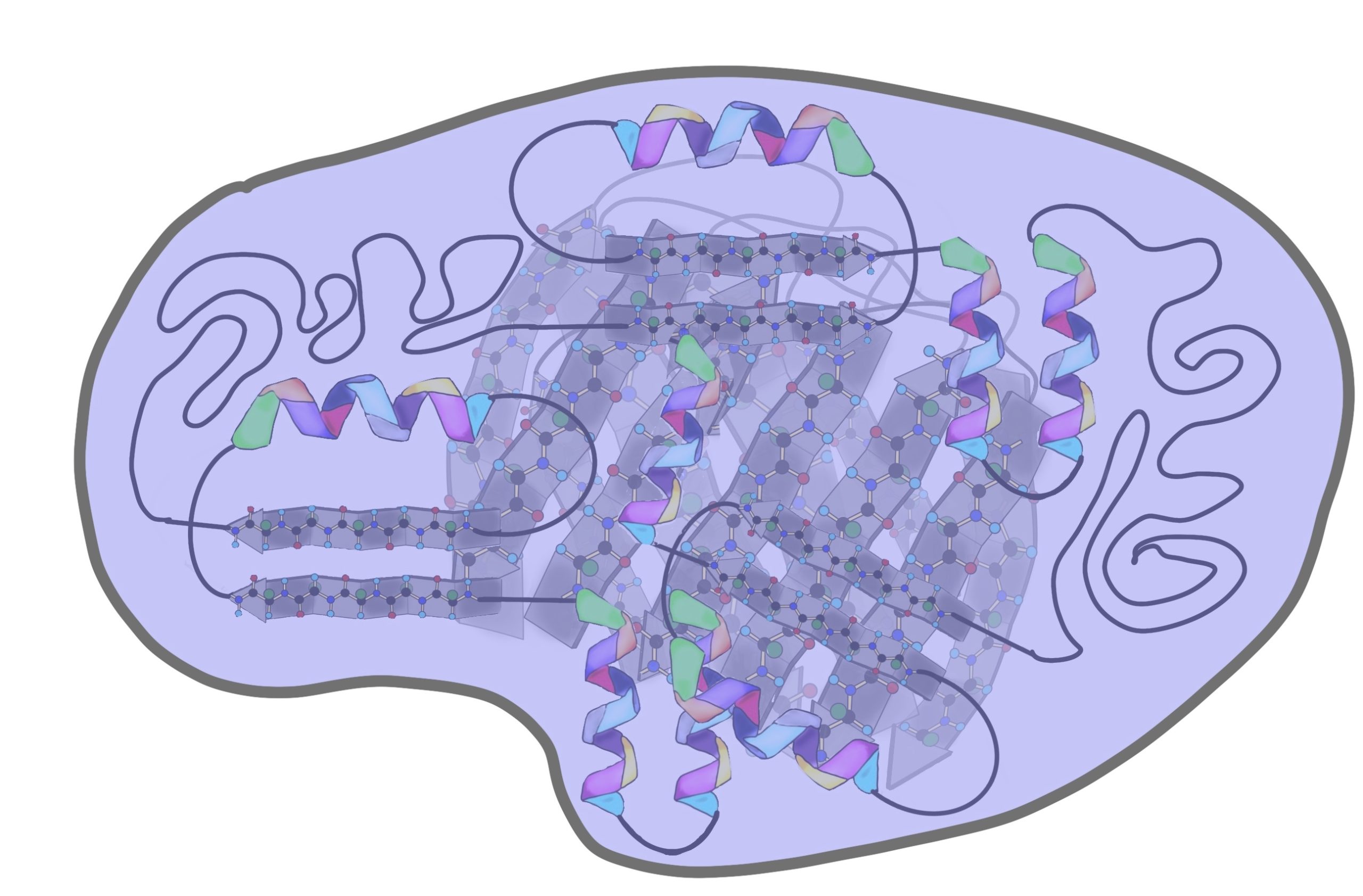
Методами рентгеноструктурного анализа в настоящее время доказано существование еще двух уровней структурной организации белковой молекулы, оказавшихся промежуточными между вторичной и третичной структурами. Это так называемые надвторичные структуры и структурные домены.
Надвторичные структуры представляют собой агрегаты полипептидных цепей, обладающих собственной вторичной структурой и образующихся в некоторых белках в результате их термодинамической или кинетической стабильности. Так, в глобулярных белках открыты (βхβ)-элементы (представлены двумя параллельными β-цепями, связанными сегментом х), βαβαβ-элементы (представлены двумя сегментами α-спирали, вставленными между тремя параллельными β-цепями) и др. В больших глобулярных белках иногда содержатся неодинаковые структурные домены, выполняющие разные функции, как и однотипные домены в пределах одного мономерного белка, образующиеся, вероятнее всего, как результат влияния генов в первом случае или дупликации генов – во втором. Домены создаются объединением и чередованием α-спиралей и β-слоев, между которыми открываются более рыхлые структуры (рис. 1.19).
Домен – это компактная глобулярная структурная единица внутри полипептидной цепи. Домены могут выполнять разные функции и подвергаться складыванию (свертыванию) в независимые компактные глобулярные структурные единицы, соединенные между собой гибкими участками внутри белковой молекулы. Открыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям доменов, кодируемых разными генами.
Вторичная структура белка двояка
Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей.
Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством связей между пептидными группами. Тип вторичной структуры зависит от устойчивости пептидной связи, подвижности связи между центральным атомом углерода и углеродом пептидной группы, размером аминокислотного радикала. Все указанное вкупе с аминокислотной последовательностью впоследствии приведет к строго определенной конфигурации белка.
Выделяют два возможных варианта вторичной структуры: в виде «каната» – α-спираль (α-структура), и в виде «гармошки» – β-складчатый слой (β-структура). В одном белке, как правило, одновременно присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д.
 Водородные связи в альфа-спирали
Водородные связи в альфа-спирали