Чем определяется кислотность или основность раствора
Разница между Кислотностью и Основностью
Основное различие между Кислотностью и Основностью заключается в том, что Кислотность вызывает низкий рН, тогда как Основность вызывает высокий рН в водной среде.
Кислотность и основность соединений влияют на показатели уровня рН. Кислотность среды вызвана кислотными соединениями, которые могут выделять ионы водорода (H + ), что приводит к низкому pH в этой среде. Основность среды обусловлена основными соединениями, которые могут выделять гидроксид- ионы (ОН — ), что приводит к высокому рН в этой среде.
Содержание
Что такое Кислотность?
Кислотность — это уровень кислоты в веществах. Концентрация ионов водорода (Н + ) является основным параметром, используемым для определения кислотности. Концентрация ионов водорода выражается в виде значения рН. pH — это отрицательный логарифм концентрации ионов водорода. Следовательно, чем выше концентрация ионов водорода, тем ниже pH. Низкое значение pH указывает на более высокую кислотность.
Лимонный сок обладает высокой кислотностью
В зависимости от кислотности веществ существует два типа кислот: сильные и слабые кислоты. Сильные кислоты вызывают более высокий уровень кислотности в водной среде, тогда как слабые кислоты приводят к низкой кислотности. Сильные кислоты могут полностью диссоциировать на ионы, высвобождая все возможные ионы водорода (Н + ). Напротив, слабая кислота частично диссоциирует, выделяя только некоторые ионы водорода. Кислоты также могут быть классифицированы как монопротонные кислоты и полипротонные кислоты:
Величина кислотности у кислот определяется рКа кислоты. рКа — это отрицательный логарифм Ка. Ка — это константа диссоциации кислоты раствора, кроме того э то количественная величина силы кислоты в растворе (кислотность). Чем ниже рКа, тем сильнее кислота. Чем выше рКа, тем слабее кислота.
Что такое Основность?
Основность вещества — это число атомов водорода, заменяемых основанием в конкретной кислоте. Другими словами, основность соединения — это число ионов водорода, которые могут полностью реагировать с ионами гидроксида, высвобождаемыми основанием.
Химическая структура гидроксид-иона
Факторы, которые могут повлиять на основность соединения:
Электроотрицательность атома относится к его сродству к электронам. Атом, имеющий высокую электроотрицательность, притягивает электроны по сравнению с атомами с более низкой электроотрицательностью. Чем выше электроотрицательность, тем ниже основность. Чтобы высвободить ион гидроксида, электроны связи между атомом кислорода и остальной частью молекулы должны полностью притягиваться атомом кислорода (атом кислорода в гидроксидной группе должен быть более электроотрицательным, чем другой атом, с которым он связан). Пример: если основность ROH высока, электроотрицательность R меньше, чем у атома кислорода.
Мыло является слабым основанием, образованными реакцией жирных кислот с гидроксидом натрия или гидроксидом калия
Радиус атома является еще одним фактором, который влияет на основность соединения. Если радиус атома маленький, электронная плотность этого атома высокая. Следовательно, гидроксид-ион может быть легко освобожден. Тогда основность этого соединения сравнительно высока.
Формальные заряды, являются либо положительными, либо отрицательными. Положительный формальный заряд указывает на меньшую плотность электронов. Следовательно, связующие электроны не могут полностью притягиваться гидроксид-ионом. При этом, ионы гидроокиси не могут быть легко отпущены, указывая на более низкую основность. Напротив, отрицательный формальный заряд вызывает более высокую основность.
В чем разница между Кислотностью и Основностью?
| Кислотность против Основности | |
| Кислотность — это уровень кислоты в веществах | Основность относится к состоянию основания, которое может высвобождать гидроксид-ионы (ОН-) |
| pH | |
| Кислотность вызывает низкий pH в водных средах | Основность вызывает высокий рН в водных средах |
| Ионы | |
| Кислотность свидетельствует о высокой концентрации ионов водорода в среде | Основность указывает на высокую концентрацию гидроксид-ионов в среде |
| Периодические Тенденции | |
| Кислотность увеличивается слева направо на период и вниз по группе | Основность уменьшается слева направо на период и вниз по группе |
| Влияние электроотрицательности | |
| Кислотность высока, если высока электроотрицательность атома, с которым связан атом водорода | Основность высока, если низкая электроотрицательность атома, с которым связан атом кислорода гидроксид-иона |
Заключение — Кислотность против Основности
Кислотность и Основность — два фундаментальных термина, используемых в химии. Кислотность обусловлена кислотными соединениями. Основность обусловлена основными соединениями. Основное различие между Кислотностью и Основностью заключается в том, что Кислотность вызывает низкий рН, тогда как Основность вызывает высокий рН в водной среде.
Вам также может понравиться
Разница между Ионными и Бинарными соединениями
Ключевое различие между Ионными и Бинарными соединениями состоит в том, что Ионные соединения содержат два заряженных компонента, тогда как Бинарные соединения содержат […]
Разница между Гипсом и Фосфогипсом
Основное различие между Гипсом и Фосфогипсом заключается в том, что Гипс является природной формой сульфата кальция, тогда как Фосфогипс является синтетической формой […]
Разница между Хлоридом магния и Сульфатом магния
Основное различие между Хлоридом магния и Сульфатом магния заключается в том, что молекула Хлорида магния имеет один катион магния, связанный с двумя хлорид-анионами, тогда как […]
Разница между кальцием и магнием
Основное различие между кальцием и магнием состоит в том, что кальций выглядит как матово-серый металл с бледно-желтым оттенком, тогда как магний выглядит как блестящий серый металл. Кроме […]
Кислотность и основность разбавленных растворов кислот и оснований
Мерой силы кислоты или основания, согласно теории Брёнстеда – Лоури является константа кислотности или основности соответственно. Поскольку наиболее распространенным растворителем является вода, измерения проводят обычно в воде. Кислота в воде отдает ей свой протон:
НХ + Н2 O ↔ Н3 O + + X –
Применяя закон действующих масс, получим:
В разбавленных растворах [Н2 O ] = const (=55,5 моль/л), поэтому можно записать
Применяя аналогичный вывод для основания, получим:
Величина Кв называется константой основности и является мерой основности относительно стандарта (в данном случае Н2O ). Аналогично величине pH константы кислотности и основности можно выразить в логарифмической форме:
Константы кислотности и основности связаны соотношением:
где Kw — константа автопротолиза растворителя (для воды — ионное произведение). Принимая во внимание ( 75 ), получаем уравнение ( 76 ) в виде:
pKw=pKa +pKв ( 77)
рКа = 14 – рКв (78)
Константы кислотности слабых кислот, нерастворимых в воде, определяют в других растворителях относительно друг друга, выстраивая таким образом единую шкалу кислотности. Полученные значения рКа носят приблизительный характер и могут быть использованы только для качественных оценок, например, данные таблицы 6-4 по константам кислотности относительно воды некоторых кислот Бренстеда.
Согласно табл. 6-4, в воде кислотами являются HCIO4, СН3СООН, основаниями — С2Н5ОН, С2Н2, NH3, С2Н4, С2Н6; в аммиаке кислоты — HCIO4, СН3СООН, С2Н5ОН, С2Н2, основания — С2Н4 и С2Н6.
Кислотность и основность
Для характеристики кислотности и основности органических соединений применяют теорию Бренстеда. Основные положения этой теории:
1) Кислота – это частица, отдающая протон (донор Н + ); основание – это частица, принимающая протон (акцептор Н + ).
2) Кислотность всегда характеризуется в присутствии оснований и наоборот.
А – Н + : В Û А – + В – Н +
К-та Осн-ие Сопряженное Сопряженная
К-та Осн-ие Сопряженное Сопряженная
К-та Осн-ие Сопряженная Сопряженное
Кислоты Бренстеда
3) К-ты Бренстеда делятся на 4 вида в зависимости от кислотного центра:
— ОН к-ты (спирты, фенолы, карбоновые к-ты),
— NН к-ты (амины, амиды),
В этом ряду сверху вниз кислотность уменьшается.
4) Сила к-ты определяется стабильностью образующегося аниона. Чем стабильнее анион, тем сильнее к-та. Стабильность аниона зависит от делокализации (распределения) «-» заряда по всей частице (аниону). Чем больше делокализован «-» заряд, тем стабильнее анион и сильнее к-та.
Делокализация заряда зависит:
a) от электроотрицательности (ЭО) гетероатома. Чем больше ЭО гетероатома, тем сильнее соответствующая к-та.
Например: R – ОН и R – NН2
Спирты более сильные к-ты, чем амины, т.к. ЭО (О) > ЭО (N).
б) от поляризуемости гетероатома. Чем больше поляризуемость гетероатома, тем сильнее соответствующая к-та.
Например: R – SН и R – ОН
Тиолы более сильные к-ты, чем спирты, т.к. атом S более поляризован, чем атом О.
в) от характера заместителя R (длины его, наличие сопряженной системы, делокализации электронной плотности).

Кроме того карбоксилат-анион более стабилен, чем анион спирта за счет р,p-сопряжения в карбоксильной группе.
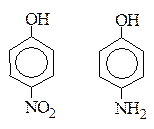
р-Нитрофенол более сильная к-та, чем р-аминофенол, т.к. группа –NО2 является ЭА.
Трихлоруксусная к-та во много раз сильнее СН3СООН за счет – I атомов Сl как ЭА.
Муравьиная к-та Н–СООН сильнее СН3СООН за счет +I группы СН3– уксусной к-ты.
д) от характера растворителя.
Дата добавления: 2015-07-22 ; просмотров: 1482 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Кислотность и основность органических соединений.
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Кислотность и основность – важнейшие понятия, определяющие многие фундаментальные физико-химические свойства и биологическую активность органических соединений.
Теории кислот и оснований:
– теория электролитической диссоциации (Аррениус);
– протолитическая теория (Бренстед-Лоури, 1923 г.);
– теория Льюиса (1925 г.).
Протолитическая теории Бренстеда
Кислота – это вещество, способное отдавать протон. Основание – это вещество, способное присоединять протон. Кислота + основание = сопряженная пара
Кислоты
Атом, с которым связан протон, – центр кислотности. Центрами кислотности могут быть атомы C, O, N, S: Соответственно – CH-, OH-, NH- и SH-кислоты.
Основания
Центрами основности являются атомы, имеющие неподеленную пару электронов (n-электроны): N, O, S. Соответственно различаются аммониевые, оксониевые и тиониевые основания (n-основания). Это могут быть нейтральные молекулы или анионы.
Существуют также π-основания – соединения с кратными связями или сопряженной системой π-связей. Они присоединяют протон, образуя сопряженные кислоты – π-комплексы.
Количественная оценка кислотности
Сила кислоты – это степень сдвига вправо следующего равновесия:
Количественная оценка основности
Сила основания – это степень сдвига вправо следующего равновесия:
Из этих соотношений следует, что для сопряженной пары мерой основности основания В может быть кислотность сопряженной кислоты ВН+: рКВ = 14 – рКВН+
Сила основания↑ → КВ↑ → рКВ↓ → рКВН+↑
Качественная оценка кислотности
Сила кислоты определяется устойчивостью сопряженного основания (аниона).
Чем стабильнее анион, тем сильнее кислота.
Устойчивость аниона, в свою очередь, зависит от следующих факторов:
– свойства атома в центре кислотности – его электроотрицательность и поляризуемость
– степень делокализации (-)-заряда в анионе в результате сопряжения;
– действие окружающих заместителей;
– способность аниона к сольватации.
Факторы, определяющие кислотность
1. Свойства атома в центре кислотности
а) электроотрицательность
С увеличением электроотрицательности атома Х полярность связи Х-Н увеличивается, прочность её уменьшается, облегчается отрыв протона. В результате кислотность увеличивается. ЭО↑ → Кислотность↑

Выделяются три типа органических оснований:
Сила основания определяется стабильностью образующегося катиона, а также доступностью
неподеленной пары электронов для присоединения протона. На силу основания влияют те же факторы, что и на силу кислоты, но направление действие их противоположно.
Амины – наиболее сильные основания. Они образуют с кислотами устойчивые соли растворимые в воде. Это свойство аминов широко применяется для их выделения и очистки, а также для получения растворимых лекарственных форм.
Ряд уменьшения основности: R-NH-R > R-O-R > R-S-R
– основность оксониевых оснований уменьшается за счет большей ЭО кислорода;
– тиониевые основания более слабые, чем оксониевые потому, что больший радиус серы увеличивает длину связи S-H в катионе, делает её менее прочной и тем самым снижает устойчивость катиона.
На силу оснований большое влияние оказывают заместители у центра основности:
а) электроноакцепторы
Электроноакцепторы увеличивают (+)-заряд на катионе, уменьшают его устойчивость и, следовательно, уменьшают основность.
б) электронодоноры
Электронодоноры уменьшают (+)-заряд на катионе, увеличивают его устойчивость и, следовательно, увеличивают основность.
Включение неподеленной электронной пары в сопряженную систему понижает её доступность для присоединения протона и снижает основность:
Из-за такого сопряжения основность амидов по сравнению с аминами резко снижена, в водных растворах амиды не протонируются (их основность ниже, чем у воды):
Теория кислот и оснований Льюиса
Кислота – акцептор электронов; Основание – донор электронов
При взаимодействии кислот и оснований образуются донорно-акцепторные комплексы:
Кислотность и основность
В органической химии наиболее широко пользуются двумя концепциями кислотности и основности теорией Бренстеда[1]-Лоури[2] и теорией Льюиса[3].
v Кислотность по Бренстеду-Лоури. По теории Бренстеда-Лоури кислота находится в сопряжении с основанием. Чем сильнее кислота, тем слабее сопряженное основание и наоборот.
Ø Кислотность – способность отдавать протон. Основность – способность присоединять протон.
Количественной оценкой кислотности может послужить константа равновесия представленного выше взаимодействия кислоты и основания.
Для растворов слабых электролитов, к которым относятся большинство органических кислот, в качестве основания выступает растворитель.
В этом случае константа равновесия реакции имеет следующий вид:

§ Так как в уравнении константы равновесия концентрацию воды можно считать постоянной, то определяют константу кислотности
Ка = Кр [Н2О] = 
Практически все органические соединения, для которых принципиально возможно отщепление протона, можно отнести к кислотам. В зависимости от природы атома, с которым связан кислый атом водорода, различают ОН-, SH-, NH- и СН-кислоты. Примеры таких кислот и значения их кислотности приведены в табл. 4.1.
Значения рКа кислот Бренстеда по отношению к воде
| Название кислоты | Формула | рКа | Название кислоты | Формула | рКа |
| ОН-кислоты | |||||
| Муравьиная кислота | НСООН | 3,75 | Фенол | С6Н5ОН | 10,0 |
| Уксусная кислота | СН3СООН | 4,76 | п-Аминофенол | Н2NС6Н4ОН | 10,5 |
| Пропионовая кислота | СН3СН2СООН | 4,87 | п-Нитрофенол | O2NС6Н4ОН | 7,1 |
| Хлоруксусная кислота | ClСН2СООН | 2,86 | Пикриновая кислота | (O2N)3С6Н2ОН | 0,8 |
| Трихлоруксусная кислота | Cl3ССООН | 0,66 | Метанол | СН3ОН | 15,5 |
| Трифторуксусная кислота | F3ССООН | 0,23 | Этанол | СН3СН2ОН | 15,9 |
| Бензойная кислота | С6Н5СООН | 4,19 | 2-Метилпропанол-2 | (СН3)3CОН | 18,0 |
| SН-кислоты | |||||
| Этантиол | СН3СН2SН | 10,5 | Тиофенол | С6Н5SН | 6,5 |
| NН-кислоты | |||||
| Аммиак | NН3 | Ацетамид | СН3СОNН2 | 15,1 | |
| CН-кислоты | |||||
| Метан | СН4 | Бензол | С6Н6 | ||
| Этилен | Н2С=СН2 | Хлороформ | СНCl3 | 15,7 | |
| Ацетилен | HCºCH | Нитрометан | СН3NO2 | 10,6 | |
| Неорганические кислоты | |||||
| Иодоводородная кислота | HI | -11 | Фосфорная кислота * | H3PO4 | 2,1 |
| Бромоводородная кислота | HBr | -9 | Угольная кислота * | H2CO3 | 6,4 |
| Хлорводородная кислота | HCl | -7 | Вода | Н2О | 15,7 |
* Первая константа диссоциации
Значения рКВН + оснований Бренстеда по отношению к воде
| Название основания | Формула основания | Формула сопряженной кислоты | pKВН + |
| Аммиак | NН3 | NН4 + | 9,25 |
| Метиламин | СН3NН2 | СН3NН3 + | 10,6 |
| Диметиламин | (СН3)2NН | (СН3)2NН2 + | 10,7 |
| Триметиламин | (СН3)3N | (СН3)3NН + | 9,8 |
| Этиламин | СН3СН2NН2 | СН3СН2NН3 + | 10,7 |
| Пиперидин | (СН2)5NН | (СН2)5NН2 + | 11,1 |
| Пиридин | С5Н5NН | С5Н5NН2 + | 5,2 |
| Гуанидин | (NН2)2С=NН | [(NН2)2С=NН] + | 13,5 |
| Анилин | С6Н5NН2 | С6Н5NН3 + | 4,6 |
| п-Нитроанилин | O2NС6Н4NН2 | O2NС6Н4NН3 + | 1,0 |
Экспериментально константы диссоциации кислот в воде можно определить только до рКа
15. В других растворителях диапазон определения кислотности можно увеличить, например, в жидком аммиаке предел определения рКа
33. Сравнивая значения констант кислотности одного и того же соединения в различных растворителях можно провести корреляцию этих данных. Для очень слабых кислот, например СН-кислот, значения рКа достаточно приблизительны и зависят от метода расчета. Поскольку для многих органических соединений кислотность трудно определить физическими методами, то проводят ее качественную оценку через стабильность сопряженных оснований (анионов). Стабильность анионов определяется степенью делокализации отрицательного заряда, а она в свою очередь зависит: а) от природы атома; б) от возможности стабилизации за счет сопряжения; в) от строения радикала и других факторов.
Кислотами Льюиса также являются многие электрофильные реагенты, например: Br2, CO2, SO3.
Соответственно, основания Льюиса подразделяются на:
Примеры кислотно-основных взаимодействий по Льюису:
v Теория жестких и мягких кислот и оснований(ЖМКО). Принцип ЖМКО в последнее время широко применяется в органической химии. Он был предложен Р. Пирсоном в 1963 г. в качестве дополнения к теории кислот и оснований Льюиса для объяснения аномальной и необъяснимой с точки зрения классических представлений о кислотно-основном взаимодействии склонности определенных льюисовских кислот соединяться с определенными основаниями Льюиса. Например, фторид-ион склонен образовывать прочные комплексы с катионами щелочноземельных металлов, но не образует таковых с катионами тяжелых металлов, таких как ртуть или серебро. В то же время иодид-ион хорошо комплексует именно с катионами ртути и серебра и плохо со щелочноземельными металлами. Таким образом, иодид-ион является сильным основанием, если в качестве кислоты использовать катион двухвалентной ртути и слабым, если в качестве кислоты применять катион магния. Для объяснения множества подобных фактов и был предложен принцип ЖМКО (принцип Пирсона), который формулируется следующим образом:
Ø жесткие основания Льюиса предпочтительно взаимодействуют с жесткими кислотами Льюиса и, соответственно, мягкие основания ‑ с мягкими кислотами.
Разделение кислот и оснований Льюиса на жесткие и мягкие осуществляется в соответствии с поляризуемостью акцепторного или донорного атома в реагенте. Если акцепторный атом в кислоте или донорный в основании является легко поляризуемым, то такой реагент называется мягким. Донорные или акцепторные атомы жестких реагентов обладают малой поляризуемостью.
С высокой поляризуемостью связаны следующие свойства: низкая электроотрицательность, большие размеры, низкая степень окисления, легкая деформируемость валентных оболочек. Напротив, низкая поляризуемость присуща атомам с малыми размерами, высокой электроотрицательностью, высокой степенью окисления и слабо деформируемой валентной оболочкой. В соответствии с этим, для изоэлектронных частиц жесткость оснований в периодической системе увеличивается снизу вверх и слева направо. Жесткость кислот возрастает в группах периодической системы снизу вверх. Примеры реагентов, характеризующихся различной степенью жесткости приведены в табл. 4.3.
Таблица 4.3
Жесткие и мягкие кислоты и основания
Применение принципа Пирсона будет рассмотрено на примере реакций енолятов ацетоуксусного эфира в главе 21 «Оксокислоты».
[1] Бренстед Й. (1879-1947) – датский физикохимик. Основные исследования в области катализа, в том числе кислотно-основного катализа. Разработчик (1923-1929) общей теории кислот и оснований.
[2] Лоури Т. (1874-1936) – английский химик. Основные работы посвящены оптической активности органических соединений. Независимо от Й. Бренстеда в 1928 г. разработал протолитическую теорию кислотно-основного равновесия.
[3] Льюис Г. (1875-1946) – американский физикохимик. Исследования в области химической термодинамики и строении вещества. Ввел концепцию обобщенной электронной пары. В 1926 г. предложил новую теорию кислот и оснований.













