Чем обусловлена вторичная структура белка
Вторичная структура белка
Содержание
Вторичная структура белка [ править | править код ]
Вторичную структуру белка определяют водородные связи между атомами, образующими пептидную связь. Третичная структура белков обусловлена связями между радикалами аминокислот.
β-Цепь и β-слой [ править | править код ]
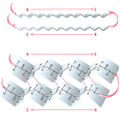
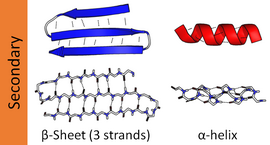
По своей структуре полипептидная цепь может быть организована как β-цепь. Когда несколько таких β-цепей связываются друг с другом, они формируют параллельный или антипараллельный β-слой.
Рис. 7.1. Антипараллельный β-слой. Полипептидная цепь существует в виде зигзагообразной β-цепи. β-Цепи могут связываться друг с другом водородными связями, образуя β-слой. Если соседние β-цепи в β-слое ориентированы противоположно, эта структура называется «антипараллельный β-слой»
Рис. 7.2. Параллельный β-слой. Три β-цепи связываются водородными связями, формируя р-складчатый слой. Поскольку β-цепи ориентированы в одном направлении, β-слой называется параллельным
α-Спираль [ править | править код ]
Полипептидные цепи стабилизируются водородными связями с образованием правозакрученной а-спирали (рис. 7.3).
При изменениях первичной структуры белка меняется и его вторичная структура: так, делеция одной аминокислоты вызывает муковисцидоз
Первичной структурой белка называют последовательность аминокислот в пептидной цепи. Всего лишь одна неправильная аминокислота в цепи из 1480 аминокислот может изменить функции белка. Именно это происходит при муковисцидозе. Это врожденное заболевание, при котором нарушена структура гена CFRT (cystic fibrosis transmembrane conductance regulator — трансмембранный регулятор проводимости при муковисцидозе). Продукт этого гена — трансмембранный белок, который в норме выполняет функцию транспортера для ионов хлорида; однако в случае муковисцидоза его функции нарушаются. Самая распространенная причина муковисцидоза, которая наблюдается у 70% больных, — делеция трех пар оснований в гене CFRT, из-за чего мутантный белок CFRT не содержит фенилаланина в положении 508 (рис. 7.4). Эта мутация называется ДР508-мутацией (А — делеция, F — фенилаланин, 508 — положение фенилаланина в первичной структуре белка). После синтеза дефектный CFTR-белок сворачивается в неправильную вторичную структуру и удерживается в эндоплазматическом ретикулуме. Из-за отсутствия транспортера для ионов хлора клетки секретируют густую вязкую слизь, которая накапливается в дыхательных путях и нарушает функционирование легких. Кроме того, нарушается экзокринная функция поджелудочной железы, что проявляется в синдроме мальабсорбции.
Перестройка вторичной структуры приона вызывает губчатую энцефалопатию (болезнь Крейтцфельда-Якоба, «коровье бешенство»)
Рис. 7.3. Правозакрученная α-спираль
Рис. 7.4. Мутация AF508 вызывает муковисцидоз. Из-за делеции трех оснований — СТТ — в белке CFRT отсутствует фенилаланин в позиции 508. Функции такого белка нарушены, и вследствие этого развивается муковисцидоз. Примечание: делеция основания не влияет на изолейцин в позиции 507, так как и АТС, и ATT кодируют изолейцин
Рис. 7.5. Белки прионы. В норме белок прион (РrР с ) растворим и состоит в основном из а-спиралей. Но в мутантной форме приона, которая вызывает почесуху (РrР sc ), часть а-спиралей переходит в р-складчатую конформацию, и белок становится нерастворимым. Мутантная форма РrР sc «инфекционна», так как в ее присутствии а-спирали трансформируются в β-конформацию
СОДЕРЖАНИЕ
| Атрибут геометрии | α-спираль | 3 10 спиралей | π-спираль |
|---|---|---|---|
| Остатки за ход | 3,6 | 3.0 | 4.4 |
| Перевод на остаток | 1,5 Å (0,15 нм) | 2,0 Å (0,20 нм) | 1,1 Å (0,11 нм) |
| Радиус спирали | 2,3 Å (0,23 нм) | 1,9 Å (0,19 нм) | 2,8 Å (0,28 нм) |
| Подача | 5,4 Å (0,54 нм) | 6,0 Å (0,60 нм) | 4,8 Å (0,48 нм) |
Считается, что низкочастотные коллективные колебания чувствительны к локальной жесткости внутри белков, показывая, что бета-структуры в целом более жесткие, чем альфа или неупорядоченные белки. Измерения нейтронного рассеяния напрямую связали спектральные особенности на
1 ТГц с коллективными движениями вторичной структуры бета-бочкообразного белка GFP.
Классификация DSSP
Словарь вторичной структуры белка, сокращенно DSSP, обычно используется для описания вторичной структуры белка с помощью однобуквенных кодов. Вторичная структура назначается на основе моделей водородных связей, как это было первоначально предложено Pauling et al. в 1951 г. (до того, как какая-либо структура белка была установлена экспериментально). DSSP определяет восемь типов вторичной структуры:
«Катушка» часто обозначается как «» (пробел), C (катушка) или «-» (тире). Все спирали (G, H и I) и листовые конструкции должны иметь разумную длину. Это означает, что 2 соседних остатка в первичной структуре должны образовывать один и тот же узор водородных связей. Если спиральный или листовой рисунок водородных связей слишком короткий, они обозначаются буквами T или B соответственно. Существуют и другие категории вторичной структуры белков (крутые повороты, петли Омега и т. Д.), Но они используются реже.
Классификация SST
SST обнаруживает π и 3 10 спиральных крышек до стандартных α- спиралей и автоматически собирает различные удлиненные пряди в согласованные β-гофрированные листы. Он обеспечивает читаемый вывод рассеченных вторичных структурных элементов и соответствующий загружаемый PyMol скрипт для индивидуальной визуализации назначенных вторичных структурных элементов.
Экспериментальное определение
Прогноз
60% точности в предсказании, какое из трех состояний (спираль / лист / рулон) принимает остаток, оценки слепых вычислений позже показали, что фактическая точность была намного ниже.
Значительное увеличение точности (почти до
80%) было достигнуто за счет использования множественного выравнивания последовательностей ; знание полного распределения аминокислот, которые встречаются в позиции (и в ее окрестностях, обычно
90% в целом из-за особенностей стандартного метода ( DSSP ) для присвоения классов вторичной структуры (спираль / нить / спираль) структурам PDB, с которыми сравниваются прогнозы.
Точное предсказание вторичной структуры является ключевым элементом в предсказании третичной структуры во всех случаях, кроме простейших ( моделирование гомологии ). Например, уверенно предсказанный паттерн из шести элементов вторичной структуры βαββαβ является признаком ферредоксиновой складки.
Приложения
Было показано, что α-спирали более стабильны, устойчивы к мутациям и поддаются конструированию, чем β-цепи в природных белках, поэтому создание функциональных all-α белков, вероятно, будет проще, чем создание белков как со спиралями, так и с цепями; это недавно было подтверждено экспериментально.
Строение белков. Структуры белков
Структуры белков: первичная, вторичная, третичная и четвертичная
Белки
Название «белки» происходит от способности многих из них при нагревании становиться белыми. Название «протеины» происходит от греческого слова «первый», что указывает на их важное значение в организме. Чем выше уровень организации живых существ, тем разнообразнее состав белков.
Белки образуются из аминокислот, которые соединяются между собой ковалентной – пептидной связью: между карбоксильной группой одной аминокислоты и аминогруппой другой. При взаимодействии двух аминокислот образуется дипептид (из остатков двух аминокислот, от греч. пептос – сваренный). Замена, исключение или перестановка аминокислот в полипептидной цепи вызывает возникновение новых белков. Например, при замене лишь одной аминокислоты (глутамина на валин) возникает тяжелая болезнь – серповидно-клеточная анемия, когда эритроциты имеют другую форму и не могут выполнять свои основные функции (перенос кислорода). При образовании пептидной связи отщепляется молекула воды. В зависимости от количества аминокислотных остатков выделяют:
– олигопептиды (ди-, три-, тетрапептиды и т. п.) – содержат до 20 аминокислотных остатков;
– полипептиды – от 20 до 50 аминокислотных остатков;
– белки – свыше 50, иногда тысячи аминокислотных остатков
По физико-химическим свойствам различают белки гидрофильные и гидрофобные.
Существуют четыре уровня организации белковой молекулы – равноценные пространственные структуры (конфигурации, конформации) белков: первичная, вторичная, третичная и четвертичная.
Первичная структура
Первичная структура белков является простейшей. Имеет вид полипептидной цепи, где аминокислоты связаны между собой прочной пептидной связью. Определяется качественным и количественным составом аминокислот и их последовательностью.
Вторичная структура
Вторичная структура образована преимущественно водородными связями, которые образовались между атомами водорода NH-группы одного завитка спирали и кислорода СО-группы другого и направлены вдоль спирали или между параллельными складками молекулы белка. Белковая молекула частично или целиком скручена в α-спираль или образует β-складчатую структуру. Например, белки кератина образуют α-спираль. Они входят в состав копыт, рогов, волос, перьев, ногтей, когтей. β-складчатую имеют белки, которые входят в состав шелка. Извне спирали остаются аминокислотные радикалы (R-группы). Водородные связи значительно более слабые, чем ковалентные, но при значительном их количестве образуют довольно прочную структуру.
Функционирование в виде закрученной спирали характерно для некоторых фибриллярных белков – миозин, актин, фибриноген, коллаген и т. п.
Третичная структура
Третичная структура белка. Эта структура постоянна и своеобразна для каждого белка. Она определяется размером, полярностью R-групп, формой и последовательностью аминокислотных остатков. Полипептидная спираль закручивается и укладывается определенным образом. Формирование третичной структуры белка приводит к образованию особой конфигурации белка – глобулы (от лат. globulus – шарик). Его образование обуславливается разными типами нековалентных взаимодействий: гидрофобные, водородные, ионные. Между остатками аминокислоты цистеина возникают дисульфидные мостики.
Гидрофобные связи – это слабые связи между неполярными боковыми цепями, которые возникают в результате взаимного отталкивания молекул растворителя. При этом белок скручивается так, что гидрофобные боковые цепи погружены вглубь молекулы и защищают ее от взаимодействия с водой, а снаружи расположены боковые гидрофильные цепи.
Третичную структуру имеет большинство белков – глобулины, альбумины и т. п.
Четвертичная структура
Четвертичная структура белка. Образуется в результате объединения отдельных полипептидных цепей. В совокупности они составляют функциональную единицу. Типы связей разные: гидрофобные, водородные, электростатические, ионные.
Электростатические связи возникают между электроотрицательными и электроположительными радикалами аминокислотных остатков.
Для одних белков характерно глобулярное размещение субъединиц – это глобулярные белки. Глобулярные белки легко растворяются в воде или растворах солей. К глобулярным белкам принадлежит свыше 1000 известных ферментов. К глобулярным белкам относятся некоторые гормоны, антитела, транспортные белки. Например, сложная молекула гемоглобина (белка эритроцита крови) является глобулярным белком и состоит из четырех макромолекул глобинов: двух α-цепей и двух β-цепей, каждая из которых соединена с гемом, содержащим железо.
Для других белков характерно объединение в спиральные структуры – это фибриллярные (от лат. fibrilla – волоконце) белки. Несколько (от 3 до 7) α–спиралей свиваются вместе, подобно волокнам в кабеле. Фибриллярные белки нерастворимы в воде.
Белки делят на простые и сложные.
Простые (протеины)
Состоят только из остатков аминокислот. К простым белкам относят глобулины, альбумины, глутелины, проламины, протамины, пистоны. Альбумины (например, альбумин сыворотки крови) растворимы в воде, глобулины (например, антитела) нерастворимы в воде, но растворимы в водных растворах некоторых солей (хлорид натрия и т. п.).
Сложные (протеиды)
Включают в состав, кроме остатков аминокислот, соединения другой природы, которые называются простетическою группой. Например, металлопротеиды – это белки, содержащие негеминовое железо или связанные атомами металлов (большинство ферментов), нуклеопротеиды – белки, соединенные с нуклеиновыми кислотами (хромосомы и т. п.), фосфопротеиды –белки, в состав которых входят остатки фосфорной кислоты (белки яичного желтка и т. п.), гликопротеиды –белки в соединении с углеводами (некоторые гормоны, антитела и т. п.), хромопротеиды – белки, содержащий пигменты (миоглобин и т. п.), липопротеиды – белки, содержащие липиды (входят в состав мембран).
Чем обусловлена вторичная структура белка
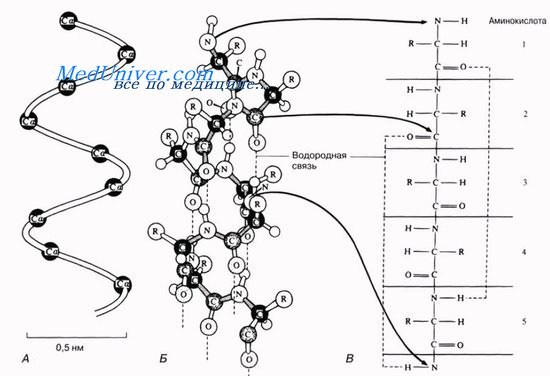
Для всякого белка характерна, помимо первичной, еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину.
Это так называемая а-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга СО- и NH-группами. Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода СО-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка.
Таким образом аминокислота 1 оказывается связанной с аминокислотой 5, аминокислота 2 — с аминокислотой 6 и т. д. Рентгеноструктурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка.
Полностью а-спиральную конформацию и, следовательно, фибриллярную структуру имеет белок кератин. Это структурный белок волос, шерсти, ногтей, клюва, перьев и рогов, входящий также в состав кожи позвоночных.
Твердость и растяжимость кератина варьируют в зависимости от числа дисульфидных мостиков между соседними полипептидными цепями (от степени сшивки цепей).
Теоретически все СО- и NH-группы могут участвовать в образовании водородных связей, так что а-спираль — это очень устойчивая, а потому и весьма распространенная конформация. Участки а-спирали в молекуле напоминают жесткие стержни. Тем не менее большинство белков существует в глобулярной форме, в которой также имеются участки (3-слоя (см. ниже) и участки с нерегулярной структурой.
Объясняется это тем, что образованию водородных связей препятствует ряд факторов: наличие некоторых аминокислотных остатков в полипептидной цепи, наличие дисульфидных мостиков между различными участками одной и той же цепи и, наконец, тот факт, что аминокислота пролин вообще неспособна образовывать водородные связи.
Бета-Слой, или складчатый слой — это другой тип вторичной структуры. Белок шелка фиброин, выделяемый шелкоотделительными железами гусениц шелкопряда при завивке коконов, представлен целиком именно этой формой. Фиброин состоит из ряда полипептидных цепей, вытянутых сильнее, чем цепи с конформацией альфа-спирали.
Эти цепи уложены параллельно, но соседние цепи по своему направлению противоположны одна другой (антипараллельны). Они соединены друг с другом при помощи водородных связей, возникающих между С=0- и NH-группами соседних цепей. В этом случае в образовании водородных связей также принимают участие все NH- и С=0-группы, т. е. структура тоже весьма стабильна.
Такая конформация полипептидных цепей называется бета-конформацией, а структура в целом — складчатым слоем. Фиброин обладает высокой прочностью на разрыв и не поддается растяжению, но подобная организация полипептидных цепей делает шелк очень гибким. В глобулярных белках полипептидная цепь может складываться на себя, и тогда в этих точках глобулы возникают участки, имеющие структуру складчатого слоя.
Еще один способ организации полипептидных цепей мы находим у фибриллярного белка коллагена. Это тоже структурный белок, обладающий подобно кератину и фиброину высокой прочностью на разрыв. У коллагена три полипептидные цепи свиты вместе, как пряди в канате, образуя тройную спираль. В каждой полипептидной цепи этой сложной спирали, называемой тропоколлагеном, содержится около 1000 аминокислотных остатков. Отдельная полипептидная цепь представляет собой свободно свернутую спираль (но не а-спираль;).
Три цепи удерживаются вместе водородными связями. Из многих тройных спиралей, располагающихся параллельно друг другу и удерживаемых вместе ковалентными связями между соседними цепями, образуются фибриллы. Они в свою очередь объединяются в волокна. Структура коллагена формируется, таким образом, поэтапно — на нескольких уровнях — подобно структуре целлюлозы. Коллаген также невозможно растянуть, и это его свойство существенно для той функции, которую он выполняет, например, в сухожилиях, костях и других видах соединительной ткани.
Белки, существующие только в полностью спирализованной форме, подобно кератину и коллагену, представляют собой исключение среди прочих белков.
Вторичная структура белков
Содержание
Регулярные вторичные структуры белка
Вторичные структуры отличаются регулярной, периодической формой (конформацией) главной цепи, при разнообразии конформаций боковых групп.
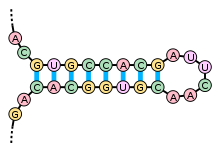
Вторичная структура РНК
Примерами вторичной структуры могут служить стебель-петля и псевдоузел [3]
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от стебля-петли, расположенной в 3′ нетранслируемой области. Псевдоузлы служат для программированного изменения рамки считывания генов.
В вирусных мРНК сложные вторичные структуры (IRES) направляют трансляцию, не зависящую от узнавания кэпа и факторов инициации трансляции (см. «Инициация трансляции»).
См. также
Примечания
Полезное
Смотреть что такое «Вторичная структура белков» в других словарях:
Вторичная структура — Вторичная структура конформационное расположение главной цепи (англ. backbone) макромолекулы (например, полипептидная цепь белка), независимо от конформации боковых цепей или отношения к другим сегментам [1]. В описании вторичной… … Википедия
вторичная структура белка — – пространственная конфигурация полипептидной цепи, формируемая в результате нековалентных взаимодействий между функциональными группами аминокислотных остатков (α и β структуры белков) … Краткий словарь биохимических терминов
Третичная структура белков — Разные способы изображения трёхмерной структуры белка на примере фермента триозофосфатизомеразы. Слева «палочковая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине изображены структурные мотивы … Википедия
Третичная структура — Разные способы изображения трёхмерной структуры белка на примере фермента триозофосфатизомеразы. Слева «палочковая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине изображены структурные мотивы … Википедия
Шпилечная структура — * шпількавая структура * hairpin structure or stemand loop s. вторичная структура в молекуле нуклеиновой кислоты, в которой комплементарные последовательности в пределах одной и той же нити соединяются, образуя двунитчатый стебель, в то время как … Генетика. Энциклопедический словарь
Белка структура — основными структурными единицами (мономерами) белков являются остатки аминокислот, соединенные друг с другом пептидными связями в длинные цепи. Отдельные цепи могут притягиваться друг к другу или образовывать петли и загибаться назад, так что… … Начала современного естествознания
Полимер — (Polymer) Определение полимера, виды полимеризации, синтетические полимеры Информация об определении полимера, виды полимеризации, синтетические полимеры Содержание Содержание Определение Историческая справка Наука о Полимеризация Виды… … Энциклопедия инвестора
ПОЛИМЕРЫ БИОЛОГИЧЕСКИЕ — (биополимеры) природные макромолекулы, играющие осн. роль в биол. процессах. К П. б. относятся белки, нуклеиновые кислоты (НК) и полисахариды. П. б. образуют структурную основу всех живых организмов; все процессы в клетке связаны с… … Физическая энциклопедия
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
Протеин — Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка. Белки (протеины,… … Википедия