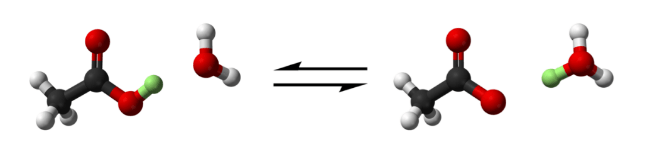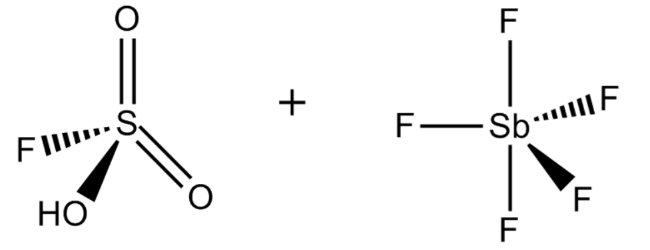Что значит стабильные кислоты
Что значит стабильные кислоты
Кислоты – это сложные вещества, состоящие из катионов водорода и анионов кислотных остатков.
1. По числу атомов водорода, способных замещаться на атомы металлов кислоты разделяют на одноосновные, двухосновные и трёхосновные.
2. По наличию или отсутствию атомов кислорода в молекуле различают бескислородные и кислородсодержащие кислоты.
Существуют и другие способы классификации кислот.
По силе (по степени диссоциации)
1. Сильные ( α =100 %) 2. Слабые ( α
1. Растворимые 2. Нерастворимые
1. Стабильные 2. Нестабильны е
1. Галоген + водород = галогеноводород (растворением галогеноводорода в воде получают соответственную галогеноводородную кислоту.)
H2 +Cl2 = 2HCl
3. Кислота + соль = другая кислота + другая соль (для этой реакции используют более сильную кислоту)
AgNO3 + HCl = AgCl + HNO3
BaCl2 + H2SO4 = BaSO4 + 2HCl
1.Реакция нейтрализации: кислота + основание = соль + вода
H 2 SO 4 + 2 NaOH = Na 2 SO 4 + 2 H 2 O
При неполной нейтрализации многоосновной кислоты основанием получают кислую соль:
H 2 SO 4 + NaOH = NaHSO 4 + H 2 O
При неполной нейтрализации многокислотного основания кислотой получают основную соль:
Zn ( OH )2 + HCl = ZnOHCl + H 2 O
2. Кислота + металл = соль + водород (кислоты кроме HNO 3 и H 2 SO 4(конц.); металлы кроме стоящих в электрохимическом ряду напряжений металлов правее водорода)
Zn + 2 HCl = ZnCl 2 + H 2↑
4. Кислота + соль = другая кислота + другая соль (для этой реакции используют более сильную кислоту)
AgNO3 + HCl = AgCl + HNO3
BaCl 2 + H 2 SO 4 = BaSO 4 + 2 HCl
5. Кислоты (благодаря диссоциации на ионы) изменяют окраску индикаторов:
Лакмус: синий → розовый;
Метилоранж оранжевый → красный
1. Реакции азотной кислоты и концентрированной серной кислоты с металлами.
А l*; Zn; Fe*; Ni; Ti; Cr; Sn; Pb
и др. стоящие в электрохимическом ряду напряжений до водорода
Au; Pt; Ta
Не реагируют
NO; NO2 ;N2 ; NH3( NH4NO3 )
в зависимости от концентрации кислоты
Не реагируют
Fe*, А l* с концентрированной азотной кислотой и холодной концентрированной серной кислотой не реагируют, поэтому данные кислоты можно перевозить в алюминиевых и стальных цистернах..
б) с концентрированной серной кислотой
в) смесь, состоящая из одной части концентрированной азотной кислоты и трёх частей концентрированной азотной кислоты растворяет золото. Такая смесь называется царской водкой.
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
2. Азотная кислота и концентрированная серная кислота как сильные окислители могут реагировать с неметаллами.
3. Специфические свойства кислот зависят от входящего в состав кислоты аниона.
Задание 1. Из приведённого перечня выберите кислоты, назовите их, определите тип.
1) HNO2 2) Li2O 3) H2S 4) CuSO4 5) P2O5 6) Al(OH)3 7) HCl 8) H2SO4
Задание 2. С какими из перечисленных веществ может реагировать а) HCl б) H 2 SO 4(раствор)
1)Na2O 2)SO3 3)H2O 4) AgNO3 5)HNO3 6)Na2SO4 7)BaCl2 8)Mg 9)Cu 10) NaOH
Презентация на тему Кислоты, их классификация и свойства
Описание презентации по отдельным слайдам:
Кислоты — это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
Кислоты (по виду кислотного остатка)
Кислоты (по виду кислотного остатка) м кислотный остаток не содержит кислорода бескислородные
Кислоты (по виду кислотного остатка) м кислотный остаток не содержит кислорода бескислородные м кислородосодержащие кислотный остаток содержит кислород
Кислоты (по виду кислотного остатка) м кислотный остаток не содержит кислорода бескислородные м кислородосодержащие кислотный остаток содержит кислород HCl – хлороводородная кислота, соляная кислота, HI – йодоводородная кислота, H2S – сероводородная кислота, HBr – бромоводородная кислота, HF – фтороводородная кислота.
Кислоты (по виду кислотного остатка) м кислотный остаток не содержит кислорода бескислородные м кислородосодержащие кислотный остаток содержит кислород HCl – хлороводородная кислота, соляная кислота, HI – йодоводородная кислота, H2S – сероводородная кислота, HBr – бромоводородная кислота, HF – фтороводородная кислота. HNO3 – азотная кислота, HNO2 – азотистая кислота, H2SO4 – серная кислота, H2SO3 – сернистая кислота, H2CO3 – угольная кислота, H2SiO3 – кремниевая кислота, H3PO4 – фосфорная кислота.
Кислоты (по заряду кислотных остатков)
одноосновные Кислоты (по заряду кислотных остатков)
одноосновные двухосновные Кислоты (по заряду кислотных остатков)
одноосновные двухосновные трёхосновные Кислоты (по заряду кислотных остатков)
Кислоты (по растворимости в воде)
растворимые Кислоты (по растворимости в воде)
растворимые нерастворимые Кислоты (по растворимости в воде)
растворимые нерастворимые Кислоты (по растворимости в воде) Сернистая кислота (H2SO3) и угольная кислота (H2CO3) существуют только в водных растворах.
Растворимые кислоты: H2SO4 — серная кислота, H2S — сероводородная кислота, HNO3 — азотная кислота. Кислоты (по растворимости в воде)
Растворимые кислоты: H2SO4 — серная кислота, H2S — сероводородная кислота, HNO3 — азотная кислота. Кислоты (по растворимости в воде) Нерастворимые: H2SiO3 — кремниевая кислота.
Кислоты (летучесть) летучие
Кислоты (летучесть) летучие нелетучие
Кислоты (летучесть) летучие нелетучие H2S — сероводородная кислота, HCl — хлороводородная кислота, соляная кислота, HNO3 — азотная кислота.
Кислоты (летучесть) летучие нелетучие H2S — сероводородная кислота, HCl — хлороводородная кислота, соляная кислота, HNO3 — азотная кислота. H2SO4 — серная кислота, H2SiO3 — кремниевая кислота, H3PO4 — фосфорная кислота.
Кислоты (по степени электролитической диссоциации )
Кислоты (по степени электролитической диссоциации ) сильные
Кислоты (по степени электролитической диссоциации ) сильные слабые
Кислоты (по степени электролитической диссоциации ) сильные слабые H2SO4 — серная кислота, HCl — хлороводородная кислота, соляная кислота, HNO3 — азотная кислота.
Кислоты (по степени электролитической диссоциации ) сильные слабые H2SO4 — серная кислота, HCl — хлороводородная кислота, соляная кислота, HNO3 — азотная кислота. H2S — сероводородная кислота, H2SO3 — сернистая кислота, H2CO3 — угольная кислота.
Стабильность кислоты — это степень устойчивости её состава при обычных условиях.
Кислоты (по стабильности )
Кислоты (по стабильности ) стабильные
Кислоты (по стабильности ) стабильные нестабильные
Кислоты (по стабильности ) стабильные нестабильные H2SO4 — серная кислота, H3PO4 — фосфорная кислота, HCl — хлороводородная кислота, соляная кислота.
Кислоты (по стабильности ) стабильные нестабильные H2SO4 — серная кислота, H3PO4 — фосфорная кислота, HCl — хлороводородная кислота, соляная кислота. H2SO3 — сернистая кислота, H2CO3 — угольная кислота, H2SiO3 — кремниевая кислота.
Кислоты (по агрегатному состоянию) твёрдые кремниевая кислота (H2SiO3) Майя Пчёлка
Кислоты (по агрегатному состоянию) твёрдые кремниевая кислота (H2SiO3) Майя Пчёлка жидкие серная кислота (H2SO4)
Кислоты (по агрегатному состоянию) твёрдые кремниевая кислота (H2SiO3) Майя Пчёлка жидкие серная кислота (H2SO4) хлороводородная кислота (HCl) газообразные
Газообразные кислоты (HCl, HBr, H2S) при обычных условиях могут существовать в водных растворах.
Слабые кислоты (H2SO3, H2CO3 ) легко разлагаются на газ и воду, существуют только в водных растворах. молекула угольной кислоты
Летучесть — это способность кислоты испаряться при обычных условиях, не распадаясь на отдельные новые молекулы. H2SiO3 → H2О + SiO2
Большинство кислот не имеют окраски. Только хромовая кислота (H2CrO4) имеет жёлтую окраску, а марганцевая (HMnO4) — малиновую.
Кислоты классифицируются в зависимости от их свойств, но все они объединены общими признаками: наличием атомов водорода и кислотных остатков. Катионы водорода, входящие в кислоты, обуславливают их общие свойства: кислый вкус, изменение окраски индикаторов и взаимодействие с другими веществами.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-1512554
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Большинство родителей в России удовлетворены качеством образования в детсадах
Время чтения: 2 минуты
Поставщики интернета для школ будут работать с российским оборудованием
Время чтения: 1 минута
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В МГУ заработала университетская квантовая сеть
Время чтения: 1 минута
В Москве новогодние каникулы в школах могут начаться с 27 декабря
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Химические свойства кислот
8 класс, 9 класс, ЕГЭ/ОГЭ
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
На холоду — пассивация
На холоду — пассивация
Реакция не проходит
На холоду — пассивация
На холоду — пассивация
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
Соляная кислота вступает в реакцию с каждым из двух веществ:
Почему кремниевая кислота является нестабильной?
Ирина Андреевна, каждое вещество стабильно или нестабильно при каких-то определенных условиях. Согласитесь, что серная кислота при комнатной температуры в чистом виде намного стабильнее, чем кремниевая.
Далее. Быстро разрушаются на исходные вещества. Исходные это какие? В каждом случае исходные вещества свои.
При каких условиях серная кислота разлагается на SO3 и воду? Серный ангидрид, чтобы стать кислотой, найдет воду даже там, где ее нет ))
Кремний очень любит существовать в таких веществах, где он окружен четырьмя атомами кислорода. Если у соединения кремния есть возможность стать таким веществом, оно это сделает. Не всегда самопроизвольно, но если чуть подразнить температурой или подходящей средой — то превратится.
Если убрать из вышеприведённого описания телеологический жаргон, то — да, надо говорить о стабильности при заданных условиях (T, p, растворителе).
При комнатной температуре (с.у.) «кремниевая кислота» в водном растворе существует в виде конденсирующейся коллоидной фазы переменного состава:
H2SiO3 — это просто условный состав золя над осадком поликремниевых кислот в водном растворе.
Задайте свой вопрос по химии
профессионалам
Другие вопросы на эту тему:
Задача по химии
Катализаторы
Первая реакция является экзотермической и проходит без катализаторов. Но какой тогда катализатор должен быть во второй реакции? И получается вторая реакция эндотермическая?
8 сильнейших кислот, известных нам
Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka.
Чем сильнее кислота, тем ниже значения pKa.
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)
Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
8. Серная кислота
Серная кислота (98%) на листе бумаги
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты. Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
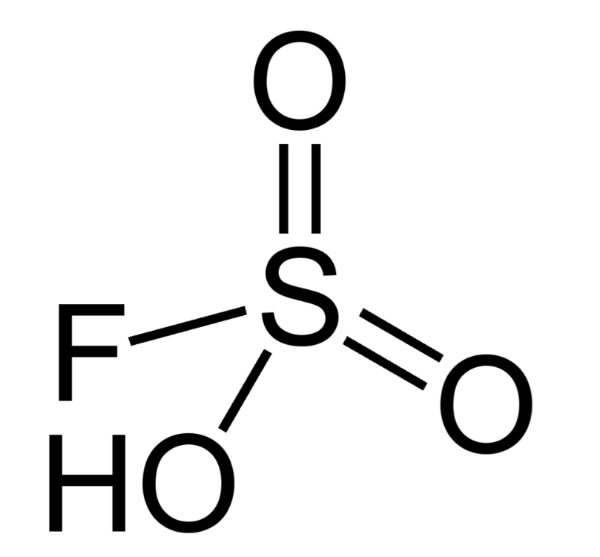
5. Фторсульфоновая кислота
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
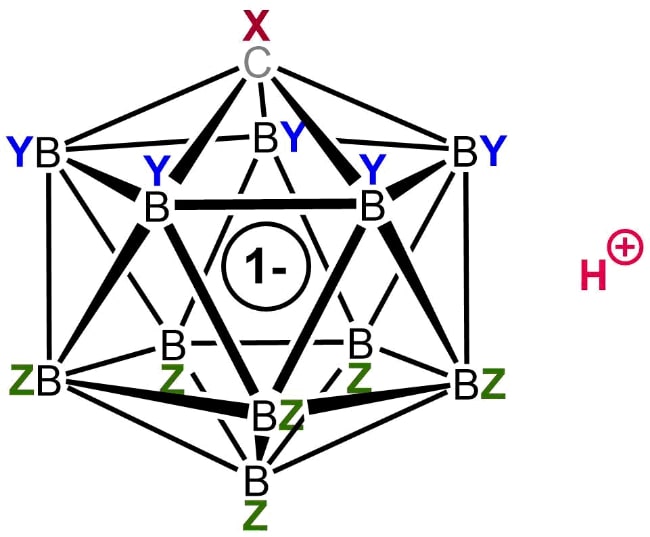
3. Фторированная карборановая кислота
Общая структура карбоновой кислоты
Одним из таких членов этой группы является фторированная карборановая кислота. Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом. В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота
FSO 3 H · SbF 5, наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1. Эта сверхкислотная система была впервые разработана в 1966 году исследователями из лаборатории Джорджа Олаха, Университета Case Western Reserve в Огайо.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
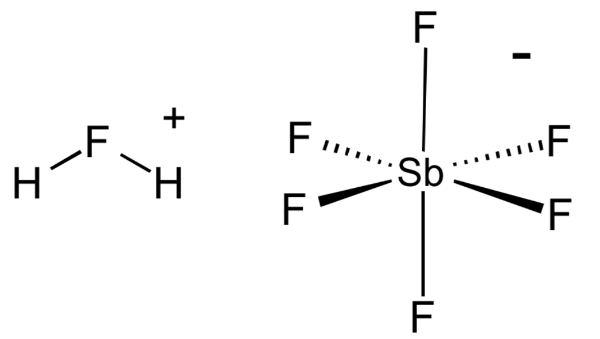
1. Фтороантимоновая кислота
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире». Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).