Что значит сильная кислота и слабая кислота
Сильные, слабые кислоты и основания. Свойства
Сильные кислоты. Основания и свойства
Все кислоты, их свойства и основания делятся на сильные и слабые. Но не смейте путать такие понятия как «сильная кислота» или «сильное основание» с их концентрацией. Например, нельзя сделать концентрированный раствор слабой кислоты или разбавленный раствор сильного основания. Например, соляная кислота, когда растворяется в воде то отдает каждой из двух молекул воды по одному своему протону.
Когда происходит химическая реакция в ионе гидроксония ион водорода очень прочно связывается с молекулой воды. Сама реакция будет происходит до тех пор, пока полностью не исчерпаются ее реагенты. Наша вода в этом случае играет роль основания, так как получает протон от соляной кислоты. Кислоты, которые диссоциируются нацело в водных растворах, называются сильными.
Когда нам известно самая начальная концентрация сильной кислоты, то в данном случае не составляет труда подсчитать какая концентрация ионов гидроксония и хлорид-ионов в растворе. Например, если вы возьмете и в 1 литр воды растворите 0,2 моля газообразной соляной кислоты, концентрация ионов после диссоциации будет точно такой же.
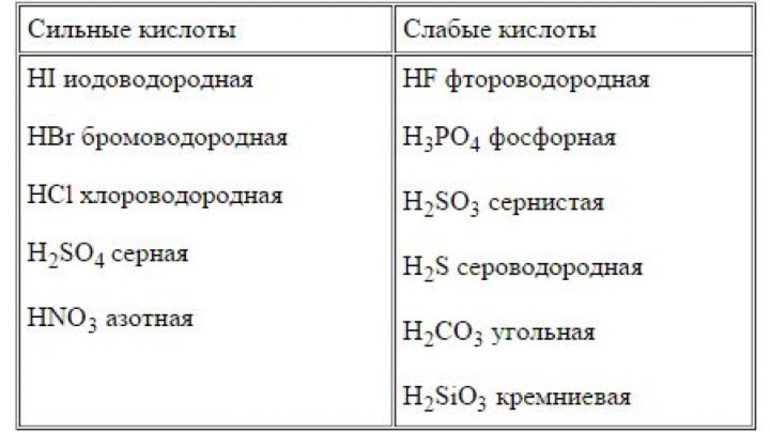
Примеры сильных кислот:
1) HCl — соляная кислота;
2) HBr — бромводород;
3) HI — йодоводород;
4) HNO3 — азотная кислота;
5) HClO4 — хлорная кислота;
6) H2SO4 — серная кислота.
Все известные кислоты (за исключением серной кислоты), представлены в списке выше и являются монопротоновыми, так как их атомы отдают по одному протону; молекулы серной кислоты могут с легкостью отдавать два своих протона, именно поэтому серная кислота является дипротоновой.
К сильным основаниям относятся электролиты, они полностью диссоциируются в водных растворах с образованием гидроксид-иона.
Аналогично с кислотами, вычислить концентрацию гидроксид-иона очень просто, если вы узнаете исходную концентрацию раствора. Например, раствор NaOH с концентрацией 2 моль/л диссоциирует на такую же концентрацию ионов.
Слабые кислоты. Основания и свойства
Что касается слабых кислот, то они диссоциируются не полностью, то есть частично. Различать сильные и слабые кислоты очень просто: если в справочной таблице рядом с названием кислоты показана ее константа то эта кислота является слабой; если же константа не приведена то данная кислота является сильной.
Слабые основания также хорошо реагируют с водой с образованием равновесной системы. Слабые кислоты также характеризуются константой диссоциации К.
Сильная и слабая кислота 2021
Что такое сильная кислота?
Говорят, что кислота является сильной, если она диссоциирует или ионизируется полностью в растворе. Это означает, что он может давать наибольшее количество ионов Н + или протонов при смешивании в растворе. Эти ионы представляют собой заряженные частицы. Поскольку сильная кислота подавляет большее количество ионов при ее разрушении или ионизации, это означает, что сильная кислота является проводником электричества.
Такие химические реакции можно почтить, но в немногих случаях кислота выделяет H + ион довольно легко, и реакция выглядит как односторонняя. И кислота полностью диссоциирована.
Например, когда хлористый водород растворяется в H2O, чтобы сделать HCl, так мало реакции обратного, что мы можем написать:
Когда-нибудь будет проведена стопроцентная виртуальная реакция, в которой хлористый водород будет демонстрировать реакцию с H3O + (Ион гидроксида) и Cl – ионов. Здесь сильной кислотой является хлористый водород.
Что такое слабая кислота?
Говорят, что кислота является слабой, если она частично или частично ионизирует, выделяя в раствор лишь некоторые из ее атомов водорода. Следовательно, он менее эффективен по сравнению с сильной кислотой при выделении протонов. Слабые кислоты имеют более высокую рКа, чем сильные кислоты.
Этановая кислота является хорошим примером слабой кислоты. Он показывает реакцию с H2O для получения H3O + (Ионы гидроксида) и СН3СООН (ионы этаноата), но обратная реакция показывает больший успех, чем передний. Молекулы реагируют довольно легко, чтобы улучшить кислоту, и H2О.
Разница между сильной кислотой и слабой кислотой
Определение
Сильная кислота
Сильная кислота представляет собой кислоту, полностью ионизирующуюся в водном растворе. Сильная кислота всегда теряет протон (A H +), когда растворяется в H2О. Другими словами, сильная кислота всегда находится на цыпочках и достаточно эффективна в подаче протонов.
Слабая кислота
Слабой кислотой является та, которая частично ионизируется в растворе. Он выделяет лишь небольшое количество атомов водорода в раствор. Следовательно, он менее способен, чем сильная кислота.
Электрическая проводимость
Сильная кислота
Сильные кислоты всегда проявляют сильную проводимость. Сильные кислоты обычно пропускают больше тока по сравнению со слабыми кислотами при одинаковом напряжении и концентрации.
Слабая кислота
Слабые кислоты имеют низкую проводимость. Они плохие проводники и показывают низкое значение для текущего прохождения
Скорость реакции
Сильная кислота
Скорость реакции быстрее в сильных кислотах
Слабая кислота
Скорость реакции медленнее в слабых кислотах
Примеры
Сильная кислота
Соляная кислота (HCl), азотная кислота (HNO3), Перхлорной кислоты (HClO4), Серной кислоты (H2ТАК4), Гидроокиси кислота (HI), гидробромовая кислота (HBr), хлорная кислота (HClO3).
Слабая кислота
Серная кислота (H2ТАК3), Уксусная кислота (CH3COOH), фосфорной кислоты (H3ПО4), Бензойной кислоты (C6ЧАС5COOH), фтористоводородную кислоту (HF), муравьиную кислоту (HCOOH), азотную кислоту (HNO2).
Сильная кислота
В сильной кислоте рН ниже, чем обычно 3. Сильные кислоты обладают очень высокой концентрацией ионов H + (кислота с рН 3 имеет 0,001 моль на литр ионов водорода).
Слабая кислота
Слабая кислота имеет рН от 3 до 7.
Значение pKa
Сильная кислота
В сильной кислоте величина pKa довольно низкая.
Слабая кислота
В слабой кислоте значение рКа довольно велико.
диссоциация
Сильная кислота
HCl (g) + H2O (l) ≈ H3О + (aq) + Cl − (Водно)
Слабая кислота
Резюме Сильной кислоты Vs. Слабая кислота
Различия между сильными и слабыми кислотами приведены ниже: Сравнительная таблица
Разница между сильными и слабыми кислотами
Содержание:
Ключевые области покрыты
1. Что такое сильная кислота
— определение, свойства, примеры
2. Что такое слабая кислота
— определение, свойства, примеры
3. В чем разница между сильной кислотой и слабой кислотой
— Сравнение основных различий
Ключевые слова: кислота, константа диссоциации кислоты, депротонирование, рН, полярность, протон, сильная кислота, слабая кислота
Что такое сильная кислота
Чем сильнее кислота, тем легче она теряет протоны. Эти протоны легко высвобождаются благодаря высокой полярности связи между атомом Н и остальной частью молекулы. это полярность определяется электроотрицательностью двух атомов, участвующих в этой связи. депротонирования (удаление протона) сильной кислоты зависит от полярности и размера аниона, к которому присоединен протон.
В качестве примера, если рассматривается кислота под названием H-A, диссоциация кислоты HA может быть представлена как
Но если молекула кислоты имеет больше чем один протон, который может быть выпущен, это может быть показано как ниже. Приведенный ниже пример показывает диссоциацию дипротоновой кислоты. Это означает, что он может выпустить два протона.
С другой стороны, сильные кислоты сильно влияют на pH раствора, поскольку сильные кислоты выделяют в раствор ионы H +. PH зависит от концентрации H +. Соотношение между концентрацией H + и pH может быть указано ниже.
Примеры сильных кислот
Что такое слабая кислота
Например, диссоциация этановой кислоты может быть показана, как показано ниже.
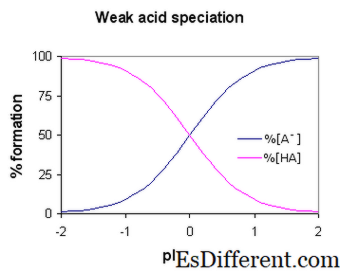
Рисунок 1: Диссоциация этановой кислоты
При написании диссоциации слабых кислот следует использовать двойные стрелки вместо одной стрелки. Это показывает, что реакция является равновесной реакцией.
Примеры слабых кислот
Разница между сильными и слабыми кислотами
Определение
Сильная кислота: PH раствора сильной кислоты очень низкий (около pH = 1).
Слабая кислота: РН раствора слабой кислоты составляет около 3-5.
Константа диссоциации кислоты
Сильная кислота: Константа диссоциации кислоты K более высокое значение для сильных кислот.
Слабая кислота: Константа диссоциации кислоты K является более низким значением для сильных кислот.
Количество выпущенных ионов H +
Сильная кислота: Сильные кислоты выделяют всю Н + ионы это может выпустить в раствор.
Слабая кислота: Слабые кислоты не выделяют все Н + ионов.
Заключение
Сила кислоты определяется полярностью и атомными размерами молекулы кислоты. В зависимости от того, как молекулы кислоты диссоциируют в воде, существует два типа кислот: сильные и слабые кислоты. Основное различие между сильными и слабыми кислотами состоит в том, что сильные кислоты полностью диссоциируют в водных растворах, тогда как слабые кислоты частично диссоциируют в водных растворах.
Рекомендации:
1. «Сильные и слабые кислоты». Сильные и слабые кислоты. Н.п., н.д. Web.
На сильные и слабые эти субстанции подразделяются в зависимости от возможности отдавать ионы водорода во время взаимодействия с металлами.
Общие свойства
Все кислоты содержат атомы водорода, которые способны вступать в реакцию. Таким образом, кислота представляет собой сложное вещество, молекулы которого состоят из разного количества атомов водорода и кислотного остатка. Эти соединения обладают кислым и зачастую слегка металлическим вкусом. При контакте с ними индикаторы приобретают другой оттенок вплоть до кардинальной смены цвета.
Химические свойства, являющиеся общими для всех кислот:
Физические свойства веществ могут кардинально отличаться. Например, одни из них имеют запах, у других он отсутствует совершенно.
Кислоты могут быть жидкими, газообразными и твёрдыми. К твёрдым соединениям относятся, например, C2H204 и H3BO3.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Основная классификация
Чаще всего кислые вещества разделяют на кислородосодержащие и бескислородные. Состав последних соединений отличается тем, что в них нет кислорода, но есть водород. В связи с этим их названия всегда дополнены словом «водородная». Например, хлороводородная, сероводородная.
Кроме того, кислоты имеют классификацию по количеству атомов водорода.
Так, они подразделяются на следующие типы:
Но также существуют органические кислоты, то есть органические вещества, которые проявляют свойства, присущие кислотным соединениям. Из них наиболее известны уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная.
Все кислые вещества и основания подразделяются на сильные и слабые. Но необходимо понять, что эти понятия никак не связаны с концентрацией соединений. Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Так, вещество считается сильным, если этот процесс проходит легко.
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.
Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
|---|---|---|---|
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| H2SO4 серная | H2SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Химические реакции
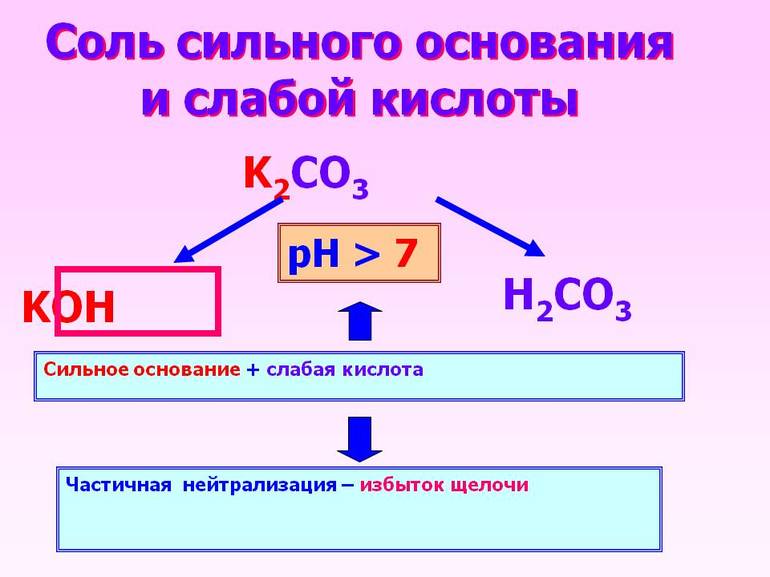
При соединении сильной кислоты с таким же основанием получится нейтральный раствор. Произошедшая в этом случае химическая реакция называется нейтрализацией. Если же заменить основание на слабое, то полностью диссоциирует только кислое вещество.
Второй компонент не распадается на ионы полностью.
Слабое основание лишь незначительно вступает в реакцию со слабой кислотой.
Когда кислотное соединение реагирует с сильным основанием, то первый реагент проходит частичную диссоциацию, второй же полностью диссоциирует.
Полученный в результате раствор обладает слабыми свойствами основания.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.
При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
Самые опасные кислотные соединения
На сегодняшний день самой сильной кислотой в мире считается пентафторид сурьмы фтористоводородной кислоты. Её химическая формула — HFSbF5. Не существует точных данных об активности этого соединения, но установлено, что его 55-процентный раствор почти в миллион раз сильнее концентрированной серной кислоты.
Следующим по силе является карборановое кислотное соединение. Это вещество разрешается хранить только в специальной ёмкости. Она также во много раз опаснее серной и растворяет даже стекло.
Ещё одной суперкислотой является плавиковая. Она не имеет цвета и, подобно предыдущему веществу, способна разъедать стекло. Для перевозки этого едкого соединения применяют полиэтилен. Вещество прекрасно вступает в реакцию с большинством металлов, но не взаимодействует с парафином. Соединение токсично, даже его пары опасны для здоровья. Кислота обладает эффектом наркотика.
Самое известное сильное вещество — серная кислота. Из-за больших производственных объёмов некоторые химики считают именно её самой опасной в мире. По мере того как увеличивается концентрация реагента, растёт и его опасность для здоровья человека, хотя даже растворы серного кислотного соединения могут нанести серьёзный вред. Это вещество окисляет металлы и является крайне едким, даже пары реагента очень опасны. При контакте происходит поражение кожи и слизистых оболочек, органов дыхания, а также внутренних органов человека.
Часто используемая в быту муравьиная кислота тоже относится к ядовитым химикатам. Эта ситуация объясняется тем, что опасность возникает только при высокой концентрации вещества. В обычных условиях оно бесцветно, легко образует водные растворы, а также успешно растворяется в ацетоне.
При концентрации меньше 10% реагент вызывает только раздражение. Если же этот показатель повышен, то соединение может разъесть ткани и множество других веществ. Его пары повреждают глаза, слизистые оболочки и дыхательные пути. При попадании внутрь организма наступает серьёзное отравление. Но в минимальных концентрациях реагент успешно перерабатывается и выводится из организма. В небольших дозах оно присутствует во фруктах, выделениях насекомых, крапиве.
Мощным ядом является азотная кислота. В разных пропорциях она прекрасно смешивается с водой. Реагент крайне опасен для человека. Его пары наносят серьёзный вред органам дыхания и слизистым оболочкам. Кожный покров при попадании кислоты становится жёлтым, на нём остаются язвы. Пострадавшие места требуют длительного восстановительного процесса.
При воздействии высокой температуры или света азотная кислота распадается, превращаясь в довольно токсичный газ. У вещества не возникает химической реакции со стеклом, а потому этот материал применяют для хранения реагента. Создателем ядовитого соединения является алхимик Джабир.
Кривые титрования
Кривые титрования представляют собой график зависимости параметра вещества, который связан с концентрацией реагента, подвергающегося титрованию, титранта или продукта химической реакции, от степени протекания процесса. Если проходит кислотно-основная реакция, то показателем концентрации каждого её участка является уровень рН.
Существуют теоретические и экспериментальные кривые. Теоретические используются для того, чтобы обосновать выбор индикатора. Их расчёт осуществляется по уравнению реакции и данным об исходной концентрации соединений, вступающих в реакцию. Экспериментальные кривые позволяют определить точки эквивалентности. Их получают путём измерения одного из свойств системы в процессе титрования.
Протекание и результат химических реакций, в которые вступает любая кислота, напрямую зависят от того, является это вещество сильным или слабым. В специальных химических таблицах приведены наименования самых распространённых соединений, что позволяет безошибочно определить силу реагента.
Кислоты и основания
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Свойства кислот и оснований
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Сильные и слабые кислоты и основания
Сильные кислоты
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
Слабые кислоты
Растворяются в воде только частично, например, HF:
Сильные основания полностью диссоциируют в воде:
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
Слабые основания
Список слабых оснований
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и основания, результирующий раствор будет нейтральным.
Слабое основание и слабая кислота
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
Диссоциация воды
Способы определения pH
Инструментальный метод
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть: