Что значит полная диссоциация
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
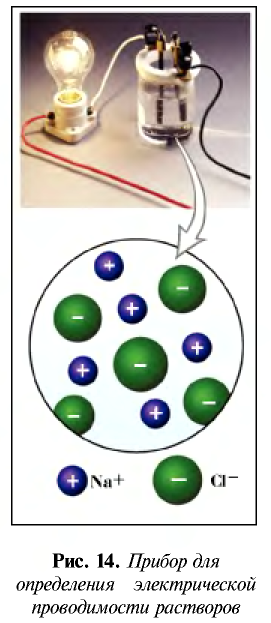
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Электролитическая диссоциация
Материалы портала onx.distant.ru
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
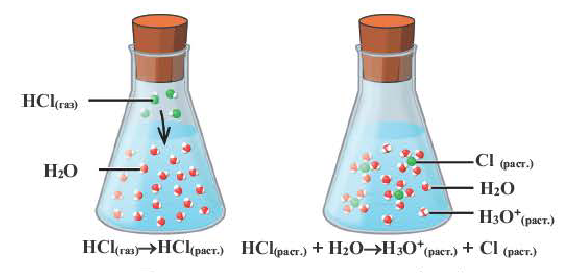
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Ассоциированные электролиты подразделяются на три типа:
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура t, о С | Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H + + Cl —
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na + + OH —
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na + + HSO3 —
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3 — → H + + SO3 2-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH + + Cl —
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH + → Mg 2+ + OH —
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6] 3- → Fe 3+ + 6CN —
Константа диссоциации
При растворении слабого электролита К А в растворе установится равновесие:
КА ↔ К + + А —
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации :
Kд = [К + ] · [А — ] /[КА] (2)
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α 2· с)/(1-α) (3)
Для практических расчетов при условии, что α
Кд = α 2· с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT 0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
Следовательно, концентрации ионов К + и РО4 3- равны соответственно 0,075М и 0,025М.
Решение. Уравнение диссоциации электролита:
Kд = αС · αС /(1 — αС)
Кд ≈ α 2 С
α = √( Кд / С) = √(1,76× 10 — 5 / 0,03 ) = 0,024 или 2,4 %
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
α = [Н + ] / Сисх(CH3CОOH)
Kд = [Н + ] 2 / Сисх(CH3CОOH)
Решение.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н + и СООН — в водном растворе приведены ниже:
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT 0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT 0 /RT= — 21500/(8,31 298) = — 8,68
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
13.2. К слабым электролитам в водных растворах относятся:
3. Определите концентрацию ионов NH4 + в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
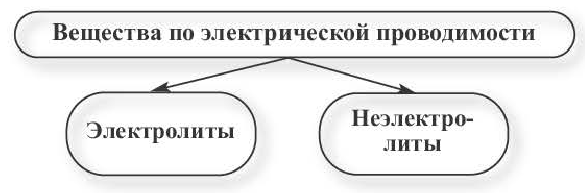
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
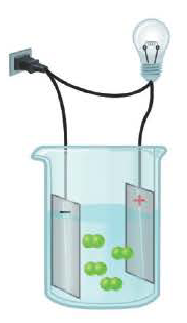
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
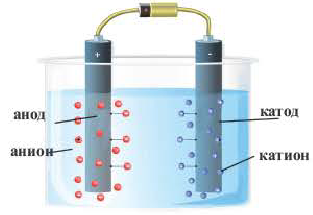
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
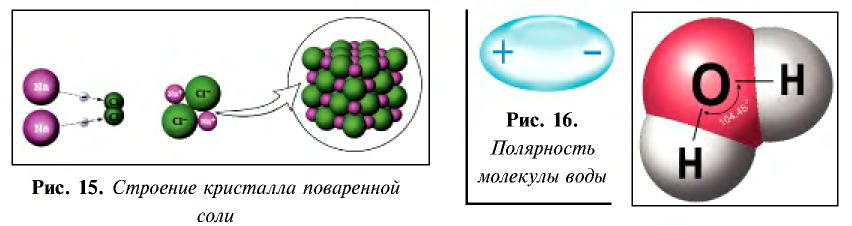
NaCl = Na + + Cl –
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
Содержание:
Электролитическая диссоциация:
По электрической проводимости вещества делятся на две группы.
Вещества, водные растворы и расплавы которых проводят электрический ток, называются электролитами.
Вещества, водные растворы и расплавы которых не проводят электрический ток, называются неэлектролитами. Нерастворимые в воде неорганические вещества (H2SiO3, SiO2, AgCl, CaSO4 и др.), чистая вода, большинство органических веществ неэлектролиты.
Процесс распада электролитов на ионы при растворении их в воде или расплавлении называется электролитической диссоциацией.
Основные теоретические положения электролитической диссоциации дал в 1887 году шведский ученый Сванте Аррениус. Современная теория электролитической диссоциации состоит из трех основных положений:
1) Электролиты в растворе и в расплаве распадаются (диссоциируют) на ионы, обладающие положительным или отрицательным зарядом
HNO3 

Ионы в растворе находятся в беспорядочном движении в разных направлениях.
Ионы и нейтральные атомы отличаются друг от друга как по строению, так и по свойствам. Например:
| 11Na 0 l s 2 ∕2s 2 2p 6 ∕3s 1 Электронная формула атома натрия | 11Na + ls 2 ∕2s 2 2p 6 / Электронная формула иона натрия |
| 11Na 0 l)2e 2)8e 3)1е Схема строения атома натрия | 11Na + l)2e 2)8е Схема строения иона натрия |
| Восстановитель | Окислитель |
Несмотря на все это, С.Аррениус не смог полностью раскрыть сущность процесса электролитической диссоциации. Он не учитывал роль молекул растворителя и полагал, что в водном растворе находятся свободные ионы. При диссоциации электролитов в растворе образуются положительно и отрицательно заряженные частицы, состоящие из одного или нескольких атомов.
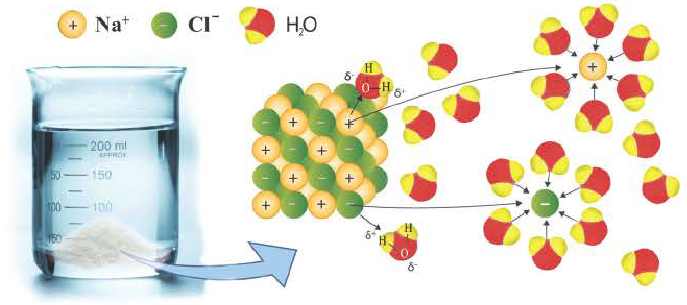
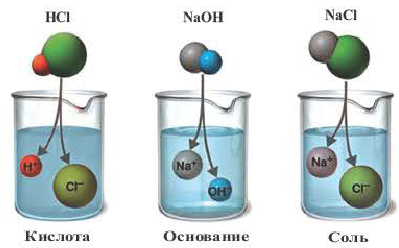
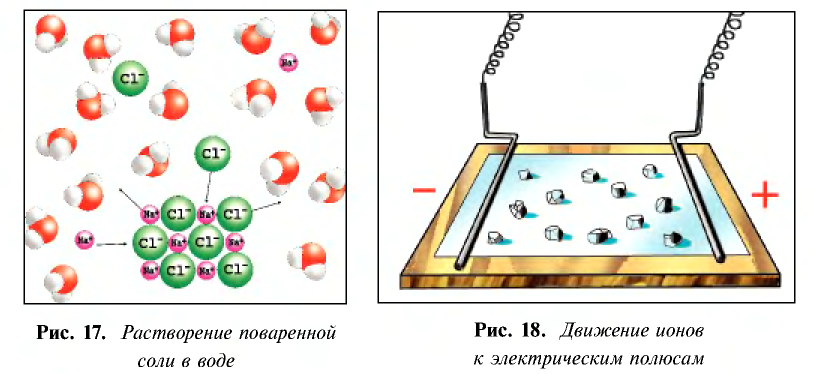
Диссоциация водного раствора хлорида натрия
Наряду с веществами, кристаллическая решетка которых имеет ионное строение, молекулы с полярной ковалентной связью также в воде распадаются на ионы. При растворении в воде хлорида водорода (хлороводорода) с полярно-ковалентной связью под действием полярных молекул воды связь между атомами разрывается. Молекула хлорида водорода распадается на два гидратированных иона. Электронная пара переходит к атому хлора, в результате полярная ковалентная связь превращается в ионную связь.
Диссоциация молекулы хлороводорода
Процесс диссоциации характеризуется степенью диссоциации.
Отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе, называется степенью диссоциации и обозначается знаком а (альфа).
Здесь а показывает степень диссоциации,n число диссоциированных молекул, N— общее число растворенных молекул.
Величина а принимает значения между 0÷1, при выражении в процентах между 0÷100%.
Если α=0, значит, диссоциация не произошла.
Если α=1 или а= 100%, значит, электролит полностью диссоциировал на ионы.
Величина n может принимать разные значения от 0 до N.
По значению степени диссоциации электролиты делят на три группы.
| Сильные Электролиты | Электролиты средней силы | Слабые электролиты |
| a ≥ 30% | a=3 ÷ 30% (или 0,03 ÷ 0,3) | a 3% 3% (или a  0,03) 0,03) |
| Щелочи: LiOH, NaOH, КОН, RbOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 Растворимые в воде соли, сильные кислоты | Mg(OH)2, H3PO4, H2C2O4 (щавелевая кислота) | NH4OH, H2CO3, H2S, HCN, H2O, CH3COOH и другие органические кислоты |
Электролиты, которые при растворении в воде или расплаве полностью диссоциируются на ионы, называются сильными электролитами.
Электролиты, которые при растворении в воде или расплавлении частично диссоциируются на ионы, называются слабыми электролитами.
Факторы, влияющие на степень диссоциации
Значение степени диссоциации зависит от ряда факторов.
Природа электролита (характер связи в молекуле электролита). Слабые и средней силы электролиты диссоциируют в растворе частично, а сильные электролиты полностью.
Природа растворителя
Диэлектрическая постоянная показывает, во сколько раз сила взаимодействия между двумя электрическими зарядами, находящимися в определенной среде, меньше по отношению к вакууму. Поскольку диэлектрическая постоянная воды (проникающая способность) при 20 o C высокая, способность ионизации также сравнительно высокая. Численное значение ее диэлектрической постоянной (81) показывает, что сила взаимодействия между ионами в растворе с водной средой в 81 раз слабее по сравнению с их силой взаимодействия в кристалле. Если в растворе, приготовленном с одинаковой концентрацией, в качестве среды берется вода, то степень диссоциации бывает сравнительно больше по отношению к растворителям.
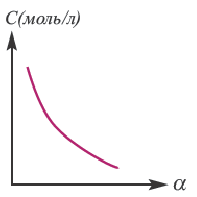
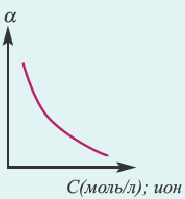
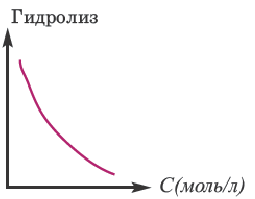
Концентрация раствора электролита. При уменьшении концентрации раствора (т.е. разбавлении раствора), вероятность встречи ионов уменьшается и равновесие смещается в сторону ионизации (степень диссоциации повышается). При уменьшении числа столкновений между ионами в разбавленных растворах в заметной степени снижается и скорость образования молекул. Это, в свою очередь, способствует смещению равновесия в сторону диссоциации и повышению степени диссоциации. Значит, степень диссоциации находится в обратной зависимости от концентрации электролита.
Влияние температуры
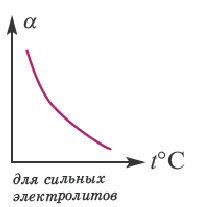
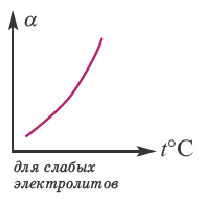
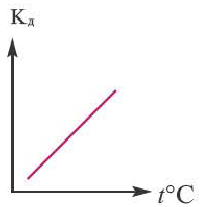
В процессе диссоциации электролитов в небольшом количестве поглощается или выделяется тепло. Обычно нагревание раствора на IoC усиливает процесс диссоциации большинства электролитов на 0,05%. При повышении температуры усиливается и электрическая проводимость электролита. Однако это связано как с понижением степени гидратации ионов и вязкости среды, так и с повышением скорости движения ионов. В этом отношении вода занимает особое место. Диссоциация воды эндотермический процесс, который протекает с затратой 57,3 кДж теплоты. Вот почему с повышением температуры повышается и степень диссоциации воды. При нагревании раствора сильных электролитов степень диссоциации понижается, а при нагревании слабых электролитов степень диссоциации повышается.
Влияние концентрации ионов. Повышением или понижением концентрации ионов, образованных в результате диссоциации, можно сместить равновесие. Например, NH4OH диссоциирует на ионы в воде по следующему
уравнению:
NH4OH
При добавлении в раствор немного NH4CI концентрация иона NH 
Постоянная диссоциации (Кд). Поскольку значение степени диссоциации зависит от концентрации электролита использование 
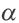
Постоянная диссоциации равна отношению произведения концентраций ионов на концентрацию молекул, не разложившихся на ионы.
Например, формула вычисления постоянной диссоциации для уксусной кислоты следующая:
Поскольку Кд не зависит от концентрации, это постоянная величина. Значение Кд зависит от природы /электролита и растворителя и температуры. Чем больше значение Ka, тем больше диссоциирует электролит.
Электрическая проводимость бывает более высокой в том из растворов с одинаковым мольным количеством растворенных в них различных электролитов, в котором образуется наибольшее количество ионов. В ряду NaCl, FeCl2, AlCl3 в
водном растворе каждого из них электрическая проводимость повышается.
Диссоциация кислот, оснований и солей
Все растворимые кислоты в водных растворах диссоциируют на ионы водорода и кислотных остатков. C точки зрения теории электролитической диссоциации кислотам можно дать такое определение:
Кислоты это сложные вещества, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
Диссоциация кислот
Свойства кислот (кислый вкус, воздействие на индикаторы и т.д.) связаны с наличием в растворе гидратированных ионов водорода (Н3О + ). Следовательно, общим для кислот является ион водорода H+ (или Н3О + ). Отсюда становится ясно, что цвет индикатора меняет ион H+ (или Н3О + ).
Одноосновные кислоты диссоциируют одноступенчато, двухосновные кислоты двуступенчато, а трехосновные кислоты (Н3РО4) грехступенчаго. Диссоциация двух- и трехосновных кислот в основном происходит в первой стадии (ступени). При ступенчатой диссоциации каждая последующая ступень протекает более слабо (т.е. при ступенчатой диссоциации процесс диссоциации протекает все медленнее). Основность кислот определяется количеством катионов водорода, образованных в процессе полной диссоциации.
| Диссоциация одноосновных кислот | Диссоциация двухосновных кислот | Диссоциация трехосновных кислот |
I. H2SO4  H + + H HSO H + + H HSO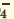 II. HSO4  H + + SO H + + SO | I. H3PO4 H + +H2PO H + +H2PO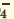 II. H2PO4  H + +HPO H + +HPO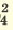 III.HPO 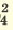  H+HPO H+HPO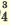 | |
I. H3PO3  H + + H2PO H + + H2PO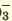 II. H2PO 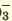  H + + HPО H + + HPО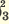 |
Знак обратимости  в процессе диссоциации указывает, что образовавшиеся ионы могут соединяться и образовывать исходные вещества и одновременно исходные ионы второй (или третьей) ступени. в процессе диссоциации указывает, что образовавшиеся ионы могут соединяться и образовывать исходные вещества и одновременно исходные ионы второй (или третьей) ступени. Если скорость распада на ионы больше, чем скорость образования исходных ионов, процесс диссоциации смещается вправо, если меньше то влево. |
Диссоциация оснований
Электролиты, при диссоциации которых в качестве анионов образуются только гидроксоионы, называются основаниями.
Растворимые в воде основания называют щелочами. Как известно, кислотность оснований определяется количеством гидроксильных ионов (ОН ) в их молекуле. Количество гидроксильных групп показывает кислотность основания. Однокислотные щелочи диссоциируют одноступенчато, двукислотные щелочи двуступенчаго. Цвет индикагора также меняется под действием гидроксильного иона (ОН ).
| Диссоциация однокислотных щелочей | Диссоциация двукислотных щелочей |
NaOH  Na + + ОН Na + + ОН KOH  K + + ОН K + + ОН NH4OH  NH NH 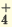 + ОН + ОН | I. Ca(OH)2 CaOH + + ОН CaOH + + ОН II. CaOH +  Ca 2+ + ОН Ca 2+ + ОН |
2OH + Zn 2+ 
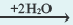
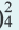
Диссоциация солей
Вещества, образующие в процессе диссоциации катион металла (или аммония) и анион кислотного остатка, называются солями.
В зависимости от вида, соли диссоциируют по-разному. Нормальные, двойные и смешанные соли диссоциируют одноступенчато.
Кислые соли диссоциируют ступенчато. Гидросоли диссоциируют двуступенчато, а дигидросоли трехступенчаго. Процесс диссоциации постепенно, поступенчато, слабеет.
| Диссоциация гидросолей | Диссоциация дигидросолей |
I. NaHSO4  Na + + HSO Na + + HSO II. HSO   H + + SO H + + SO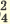 | I. KH2PO4  K + + H2PO K + + H2PO II. H2PO   H + + PO H + + PO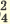 III. HPO 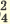  H + + PO H + + PO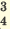 |
Основные соли также диссоциируют ступенчато: гидроксосоли диссоциируют двуступенчато, дигидроксосоли трехступенчато.
Реакции ионного обмена
Реакции обмена, протекающие между водными растворами электролитов, в прошлых разделах мы показывали молекулярными уравнениями. В действительности же, в этих реакциях участвуют не молекулы электролитов, а их диссоциированные ионы.
Взаимодействие водных растворов электролитов называют ионными реакциями, а уравнения таких реакций ионными уравнениями. Уравнение, полученное при сокращении ионов, не участвующих в реакции, называется сокращенным ионным уравнением.
Чтобы понять условия протекания реакций ионного обмена, нужно знать их важнейшие свойства.
Свойства ионов
Вам уже известно, что ионы отличаются от атомов строением и свойствами. Некоторые ионы бесцветны, а другие имеют определенный цвет. Для каждого из них характерны специфические химические свойства.
При составлении ионных уравнений соблюдаются следующие правила:
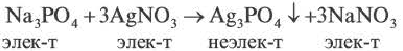
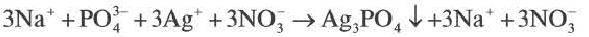
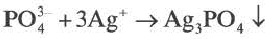
Если при реакциях заряды ионов не меняются, такие реакции называются реакциями ионного обмена.
Реакции ионного обмена протекают до конца в трех случаях:
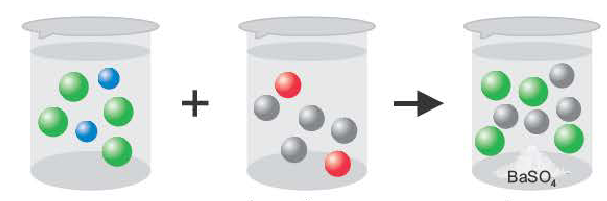
Если образуется осадок.
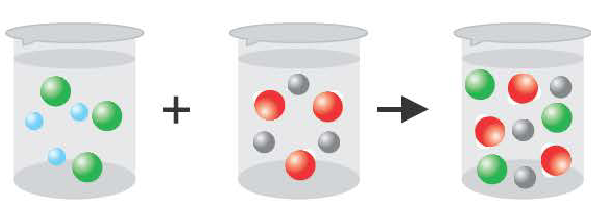
BaCI2 + Na2SO4 = BaSO4↓ + 2NaCI
Ba 2+ +2CI + 2Na + +SO 
Ba 2+ +SO 
Если получается слабодиссоциирующее вещество (например: вода)
H + +CI +Na + +OH = Na + + Cl + H2O
H + +ОН =H2O
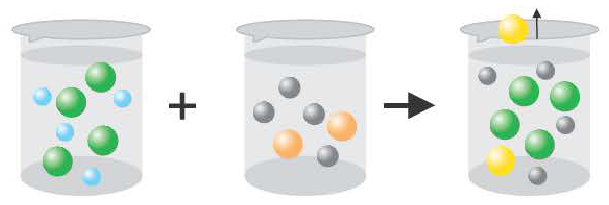
Если получается газообразное вещество.

2H + +2CI + 2Na + +S 2 = H2S↑ + 2Na + + 2CI
2H + +S 2 =H2S↑
Полное ионное уравнение и сокращенное ионное уравнение реакций, протекающих с участием или с образованием двух и более неэлектролитов, бывают одинаковыми.
Реакции ионного обмена используются для определения того или иного вещества или иона.
Обменные реакции в растворах электролитов протекают только тогда, когда хотя бы одно из образованных в результате этих реакций веществ является малодиссоциирующим, или нерастворимым (осадком), или же находится в газообразном состоянии.
Сумма коэффициентов сокращенного ионного уравнения реакций, протекающих с образованием лишь одного неэлектролита (осадка или мало диссоциирующего вещества) всегда на 1 единицу бывает больше суммы ионов, образующих этот неэлектролит.
| Слабые электролиты и неэлектролиты | Сумма коэффиниентов сокращенного ионного уравнения его образования |
| СаСО3, MgCO3, ВаСО3, CaSO4, BaSO4, PbSO4, SrSO4, ZnCO3, CuS, PbS, ZnS, CdS, AgCl, Н2О, HCOOH, CH3COOH и др. | 3 |
| Be(OH)2, Mg(OH)2, Zn(OH)2, Fe(OH)2, Cr(OH)2, Cu(OH)2, PbCl2, Mn(OH)2, MgF2 и др. | 4 |
| Al(OH)3, Fe(OH)3, Cr(OH)3, Ag3PO4 и др. | 5 |
| Ca3(PO4)2, Ba3(PO4)2 и др. | 6 |













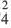
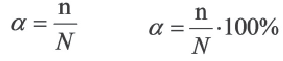
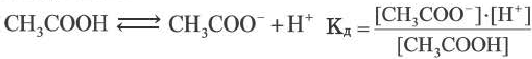

 2Na+Cl2
2Na+Cl2  2Na + Cl2
2Na + Cl2

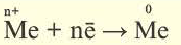
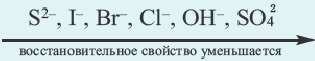
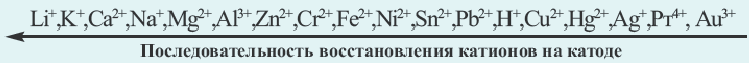
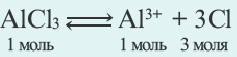
 N(OH ) среда кислая; при N (H + )
N(OH ) среда кислая; при N (H + )  Cl, Br, I, Me
Cl, Br, I, Me  + H2O
+ H2O
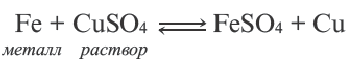
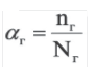 или
или 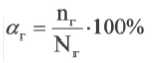
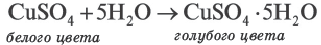
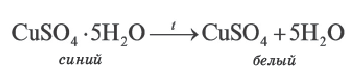
 ∙(n-1)H2O
∙(n-1)H2O


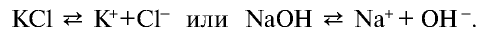
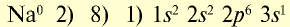
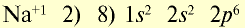
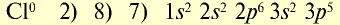
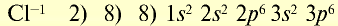
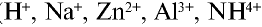 ).
).
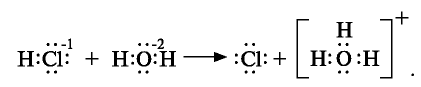
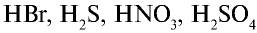 и других кислот образуется ион
и других кислот образуется ион 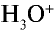 (гидроксоний). Ион гидроксония образует ионы воды и водорода:
(гидроксоний). Ион гидроксония образует ионы воды и водорода: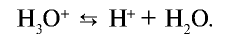
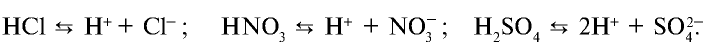


 ) и анионы гидроксида (
) и анионы гидроксида (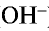 ):
):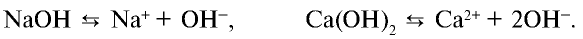
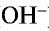 , образующихся при их диссоциации.
, образующихся при их диссоциации.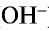 ).
).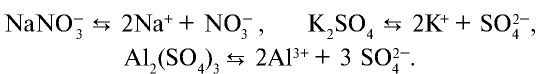
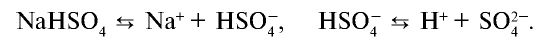
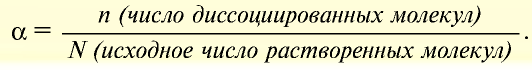
 ), кислот (
), кислот (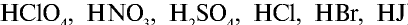 ) и щелочей (
) и щелочей (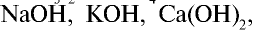
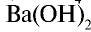 ) считаются сильными электролитами.
) считаются сильными электролитами.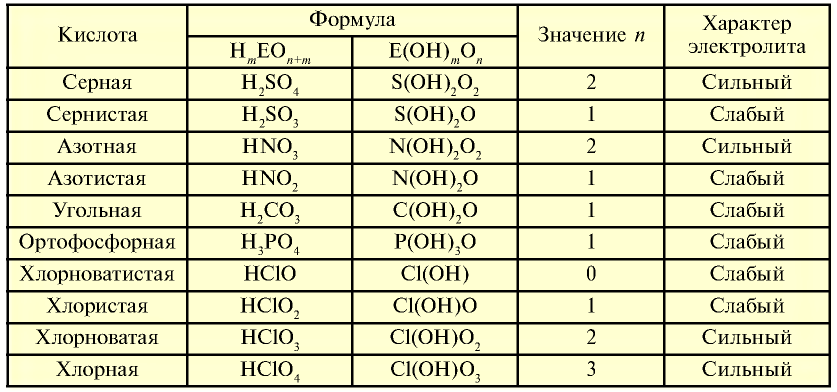
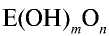 можно определить их характер. При n
можно определить их характер. При n