Что значит отклонение в пцр тесте
ПЦР-тестирование: как работает метод ПЦР в диагностике
ПЦР – высокоточный метод диагностики и одно из самых главных открытий в области биологии за последние десятилетия. ПЦР-анализ применяется уже почти 40 лет и считается наиболее точным и чувствительным способом диагностики инфекционных заболеваний.
ПЦР – уникальный и универсальный метод, тест используется не только в клинической лабораторной диагностике, но также в биологии, криминалистике, археологии и многих других научных областях. Все, что нужно для проведения анализа – небольшое количество любого биоматериала пациента.
Суть метода ПЦР
ПЦР – полимеразная цепная реакция. Метод основан на обнаружении даже небольших концентраций искомого элемента диагностики. Для определения изначально крайне малых концентраций РНК или ДНК, которые необходимо определить в процессе проведения основного этапа исследования, используется метод искусственного увеличения количества РНК или ДНК. А поскольку они специфичны и строго индивидуальны для каждого микроорганизма или живого существа за счет уникальности последовательности нуклеотидов во фрагментах, ошибка в определении целевого ДНК или РНК исключена.
Генетическая информация любого живого организма записывается в ДНК. Эта молекула состоит из двух цепочек, сплетающихся в единую спираль. Некоторые вирусы (например, COVID-19) хранят свой код в РНК – одной нити нуклеотидов.
Для каждого организма, включая вирусы, бактерии и грибки, последовательность нуклеотидов уникальна. Ее можно сравнить с отпечатком пальца или сканом сетчатки глаза человека. Укороченные последовательности нуклеотидов, характерные для каждого вида патогена (возбудителя опасных заболеваний), хранятся в базах научных лабораторий в виде праймеров – отдельных участков ДНК, типичных для только конкретного возбудителя. Эти участки значительно короче любой молекулы ДНК. Такие праймеры присоединяются к ДНК возбудителя в пробе и под действием катализаторов многократно воспроизводят свои дубли. Этот процесс называются «репликация» – многократное увеличение, дублирование искомого участка до тех пор, пока он не станет доступен для определения. Процесс репликации возможен только при наличии в пробе ДНК возбудителя.
Преимущества метода ПЦР
Какие есть недостатки
Показания к проведению ПЦР-анализа
Подготовка к проведению ПЦР-теста
Как проводится ПЦР-анализ
Результаты ПЦР-теста
Результаты анализов, проведенных методом ПЦР, известны уже через один день. Иногда возможно проведение экстренного теста – его часто используют при оказании срочной медицинской помощи при госпитализации. Тогда срок готовности результата сокращается до считанных часов.
Результаты ПЦР-теста дадут точную информацию о том, какая инфекция была обнаружена. При количественном тестировании анализ определит также вирусную или бактериальную нагрузку на организм. В этом случае в результатах будет значиться титр обнаруженного патогена (его количество в одном миллилитре пробы). Количественный анализ особенно важен при диагностике заболеваний, спровоцированных условно-патогенными микроорганизмами, которые присутствуют в норме практически у каждого человека. Такие микроорганизмы представляют угрозу только при большой численности, а в остальных случаях мирно сосуществуют с носителем.
Вирусная нагрузка. Что это за показатель и как правильно его интерпретировать.

Современные возможности ПЦР диагностики COVID-19 в лаборатории ДИЛА позволяют ответить на несколько действительно важных вопросов:
От показателя ВН (высокая, средняя, низкая) напрямую зависит заразность инфицированного человека для окружающих.
Интенсивнее всего вирус размножается за 1-3 дня до появления симптомов и в первые 5-7 дней после первых проявлений. В этот период количество вирусов в 1 мл выделений из носоглотки может составлять сотни тысяч и миллионы частиц, что соответствует среднему и высокому показателю вирусной нагрузки и делает пациента максимально заразным для окружающих. Затем количество вирусов, выделяемых человеком начинает снижаться. Обычно начиная с 7-10 дня от начала клинических проявлений человек перестает быть заразным, что соответствует снижению показателей вирусной нагрузки. В этот период вирусная РНК в анализе еще может выявляться (ПЦР позитивный с низким уровнем ВН), однако большинство исследований показывает, что после 10 дня клинических проявлений вирус теряет свою способность к репликации (размножению), а значит, и способность заражать других людей.
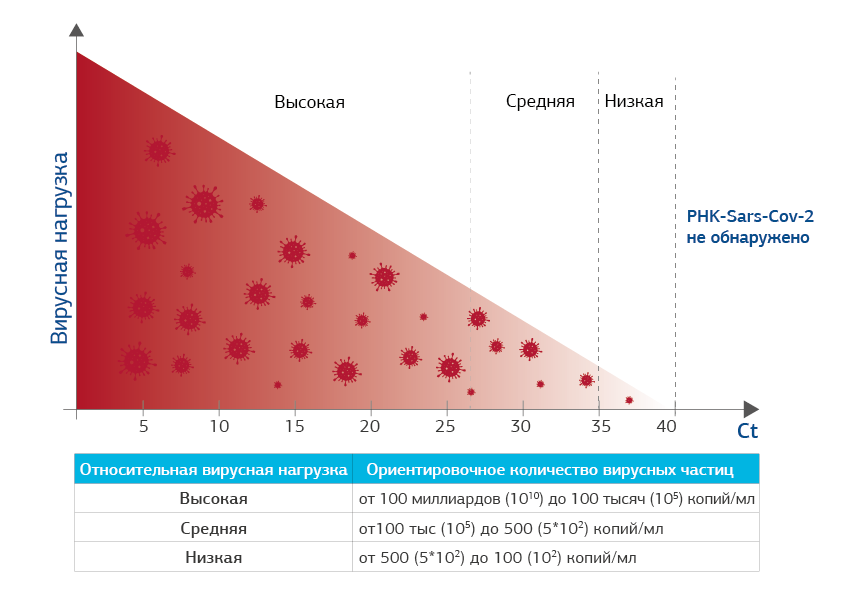
Как определяется ВН и что значит показатель Сt*
Как понимать полученный результат исследования
Если значение Ct низкое (5-15), это говорит о том, что вирусная нагрузка высокая и вирус SARS COV-2 передает свою генетическую информацию и размножается очень активно, образуя новые вирусные РНК в большом количестве и тем заразнее человек.
Если вирусных частичек мало, для их выявления нужно большее количество циклов. Чем выше значение порогового цикла (Ct=30-35-40), тем меньше вирусных частиц находится в образце.
Результат ПЦР отрицательный в том случае, если РНК вируса выявить не удается даже при самом высоком пороговом цикле чувствительности прибора – более 40 циклов амплификации (Сt больше 40: РНК SARS COV-2 не выявлена).
Сt 5-27.
Высокая ВН
Сt 28-34.
Средняя ВН
Человек болен COVID-19, есть риск заражения окружающих.
Рекомендуется:
Человек заражен COVID-19, есть риск заражения окружающих.
Рекомендуется:
Ct 35-40.
Низкая ВН
Человек болен COVID-19, риск заражения окружающих сохраняется, но он вероятно низок. Возможно самое начало заболевания.
Рекомендуется:
Человек заражен COVID-19. Чаще всего это может быть в период выздоровления (выведения вируса).
Рекомендуется (если был контакт с больным COVID-19):
Риск заражения окружающих отсутствует.
Возможно:
Для уточнения диагноза рекомендуется:
Риск заражения окружающих отсутствует.
Тест на імуноглобуліни класу G допоможе уточнити, чи перехворіли ви на коронавірусну інфекцію раніше.
При обнаружении любого из определяемых генов коронавируса результат теста является положительным, что означает присутствие вируса в организме.
Важно помнить, что клинические проявления заболевания могут отсутствовать при любом уровне вирусной нагрузки. При положительном результате ПЦР с высоким уровнем вирусной нагрузки и отсутствии симптомов заболевания (бессимптомном течении) вы высоко заразны для окружающих, поскольку из носоглотки выделяется много вирусов при дыхании, разговоре. Для контроля снижения заразности можно провести повторное ПЦР-тестирование с определением уровня вирусной нагрузки через 7-10 дней
PCR Как избежать ошибок?
Real-Time PCR: Как избежать ошибок
Ключевые факторы, оценка значения CT, применение на практике
ПЦР в реальном времени (также известна как количественная ПЦР, real-time PCR, или qPCR) является простой и эффективной методикой количественного определения целевой последовательности ДНК в образцах. Зачастую, по причине крайней простоты освоения и выполнения данной методики, некоторые факторы, оказывающие критическое влияние на успешность метода, остаются без внимания. В этом обзоре мы рассмотрим ключевые факторы, которые необходимо учитывать при подготовке и интерпретации результатов real-time PCR.
Факторы, влияющие на CT
CT-величина (англ. Threshold cycle – пороговый цикл) – это значение количества циклов реакции, при котором кривая амплификации и прямая порога чувствительности прибора пересекаются (рис. 1B). Это значение является относительным показателем содержания ДНК-матрицы в образце, так как различия в количестве молекул матрицы в начале реакции влияют на количество циклов, необходимых для поднятия уровня флуоресценции выше уровня шума. Кроме того, на абсолютное значение CT влияет множество других факторов, которые не зависят от изначального количества ДНК-матрицы в реакции. В данной статье мы обсудим самые часто встречаемые факторы, влияющие на значение CT и выясним, как правильно оценивать эффективность прохождения real-time PCR.
На рисунке 1 изображены некоторые параметры кривой амплификации. Экспоненциальная фаза на рисунке 1B соответствует линейной фазе кривой на рисунке 1C. На рисунке 1C пороговое значение должно пересекать линейный участок кривой амплификации. Значение CT обратно пропорционально количеству ДНК-матрицы в реакции, то есть чем меньшее количество ДНК-матрицы находится в реакционной смеси, тем большее количество циклов необходимо для достижения порогового количества продукта амплификации. Однако любые изменения в составе реакционной смеси или настройках детектора флуоресценции могут оказывать влияние на значение CT. Соответственно, значение CT для реакций, которые были проведены при разных условиях или в которых были использованы разные реактивы, не могут быть непосредственно сравнены друг с другом.

Рисунок 1: A: Значение Rn представляет собой отношение интенсивности флуоресценции репортерного красителя к интенсивности флуоресценции референтного красителя. Другими словами, Rn – это репортерный сигнал, нормализованный к сигналу ROXÔ. На этом рисунке ось X отображает номер цикла ПЦР, ось Y – значение Rn.
B: Значение ΔRn представляет собой разницу значений Rn и базовой линии. На этом рисунке ось X отображает номер цикла ПЦР, ось Y – значение ΔRn.
C: График кривой амплификации представлен в виде логарифмической функции Log(ΔRn) от номера цикла.
Влияние компонентов реакционной смеси
Интенсивность флуоресценции каждой молекулы зависит от внешних факторов, к ним относятся, например, pH или концентрации солей в реакционной смеси. На рисунке 2 изображён график флуоресценции зонда TaqMan® в двух различных реакционных смесях. Обратите внимание, что интенсивность флуоресценции в реакционной смеси A выше, несмотря на одинаковую концентрацию ДНК-матрицы, зонда и красителя ROX™ в обеих смесях.

Рисунок 2: Пики флуоресценции, полученные при анализе двух разных реакционных смесей с одинаковым количеством ROX™. Различия в значении сигналов обусловлено составом реакционных смесей. На этом рисунке ось X отображает длину волны флуоресценции, ось Y – интенсивность свечения флуорофора.
В результате, значение ΔRn будет различным, это отображено на рисунке 3. Обратите внимание, что базовые линии для двух реакционных смесей различны (рисунок 3А). Различие в значении CT не отображает общую производительность реакционной системы (рисунок 3B). Реакционные смеси с эквивалентными показателями чувствительности могут иметь различные абсолютные значения CT.

На рисунке 3 в реакционных смесях A и B была проведена амплификация гена РНКазы P человека. В обеих образцах было использовано одинаковое количество геномной ДНК. На рисунке 3A показана зависимость Rn от номера цикла и базовые линии для обеих реакций. На рисунке 3B показана зависимость значения Log (ΔRn) от номера цикла. Значение порога чувствительности (зеленая прямая) одинаково для обеих реакций. Пороговый цикл CT для реакционной смеси B (CTB) наступает раньше, чем для реакционной смеси A (CTA) при одинаковом количестве ДНК-матрицы в обеих образцах.
Пассивный референтный краситель ROX™
Величина Rn представляет собой отношение интенсивности флуоресценции красителя FAMÔ к флуоресценции красителя ROX. Таким образом, если концентрация красителя ROX будет меньше, а концентрация FAM останется неизменной, величина Rn будет выше. Это приведет к тому, что значение базовой линии станет выше, и вследствие этого, ΔRn будет меньше, что в конечном итоге приведет к другому значению CT. Различие в значениях CT при уменьшенных концентрациях ROX не является показателем увеличения чувствительности реакции, при этом могут появиться другие нежелательные последствия. Низкая концентрация ROX в реакционной смеси может привести к увеличению стандартного отклонения значения CT, как показано на рисунке 4. Чем больше стандартное отклонение, тем менее достоверны данные, особенно если есть необходимость детектировать небольшие различия концентрации целевой последовательности ДНК. (Более подробно это описано в разделе Точность).

На Рисунке 4. В трех реакционных смесях с различным содержанием ROX™ была проведена амплификация Трансформирующего ростового фактора бета (TGF beta). На рисунке 4A изображено значение CT, на рисунке 4B изображено стандартное (среднеквадратическое) отклонение. Чем меньше концентрация ROX, тем раньше наступает пороговый цикл, но это увеличивает стандартное отклонение.
Эффективность ПЦР
Степень эффективности полимеразной цепной реакции тоже влияет на величину CT. Сравнивая серии разведений, амплифицированых в условиях низкой и высокой эффективности реакции, мы обнаружим, что кривые амплификации имеют разный угол наклона. На рисунке 5, два образца (X и Y), амплифицированые в условиях низкой и высокой эффективности реакции, показывают различные значения CT при одной и той же концентрации ДНК-матрицы. В этом примере, кривая амплификации при высокой эффективности реакции (синий график на рисунке 5) дает более низкое значение CT при высокой концентрации ДНК-матрицы, хотя она имеет более высокую чувствительность при низкой концентрации ДНК-матрицы.

Эффективность ПЦР зависит от типа анализа, качества реакционной смеси и качества ДНК в образце. Как правило, эффективность реакции 90-110% считается приемлемой.
Различие в значении CT для двух образцов может достоверно свидетельствовать о различной концентрации ДНК-матрицы в этих образцах только при условии одинаковых настройках оборудования, реактивов и типа анализа. Однако, если анализ был проведен на разном оборудовании, были использованы разные реактивы, праймеры или зонды, либо реакции проводились в разных объемах – различия в значениях CT не дадут нам достоверной информации. Следовательно, абсолютные значения CT имеет смысл сравнивать только в том случае, если все условия реакции были абсолютно одинаковыми.
Как оценить эффективность ПЦР в реальном времени
В случае, если какие-либо условия эксперимента были изменены (например, анализ проводился на разном оборудовании или в разных реакционных смесях), необходимо учитывать следующие параметры.
Динамический диапазон

На Рисунке 6 точный расчет эффективности реакции, сделанный на основе серии разведений ДНК-матрицы. Для двукратного разведения на 5 точках (оранжевый) потенциальный разброс значений выше, чем для десятикратного разведения на 5 точках (синий).
Значение R 2
Еще одним параметром, без которого невозможно точно рассчитать эффективность реакции, является коэффициент детерминации (R 2 ). В математической статистике этот параметр показывает, насколько точно мы можем спрогнозировать значение некой величины, зная другую. Если R 2 =1, тогда можно точно установить корреляцию величины X (количество ДНК-матрицы) к Y (значению CT) (рисунок 7A). Если R 2 =0, тогда невозможно определить корреляцию величины X к величине Y (рисунок 7B). Значение R 2 >0,99, в целом, обеспечивает достаточную точность определения корреляции.

На Рисунке 7 пример расчета R 2 для двух прямых. A: между x и y нет прямой корреляции. B: между x и y есть прямая корреляция.
Точность
Наиболее используемым способом расчета точности метода является вычисление стандартного отклонения (квадратный корень из вариансы). Если множество результатов имеют небольшой разброс относительно средней величины, тогда стандартное отклонение имеет малое значение, если же разброс велик, то стандартное отклонение больше.
На практике, большая выборка представляет собой распределение, близкое к нормальному. Это следствие центральной предельной теоремы, она гласит, что суммы многих независимых, одинаково распределенных случайных величин стремятся к нормальному распределению как к пределу. На рисунке 8А значения распределены таким образом, что 68% из них находятся в пределах одного стандартного отклонения, 95% – в пределах 2 стандартных отклонений, и 99,7% находится в пределах 3 стандартных отклонений.
Если эффективность ПЦР составляет 100%, то есть одно значение CT, которое находится в пределах средних значений двукратного разведения (рисунок 8B). Для того чтобы определить количество ДНК-матрицы в диапазоне двукратных разведений в 99,7% случаев, стандартное отклонение должно быть ≤0,167. Чем больше стандартное отклонение, тем меньше вероятность достоверно найти разницу между образцами. Чтобы найти разницу между образцами в диапазоне двукратных разведений в 95% случаев, стандартное отклонение должно быть ≤0,250 (рисунок 8C).

На Рисунке 8 нормальное распределение и стандартное отклонение. На рисунке (A) показано нормальное распределение результатов анализа. Если эффективность ПЦР составляет 100%, то есть одно значение CT, которое находится в пределах средних значений двукратного разведения (образцы X и Y). Для того, чтобы точно определить значение CT для обоих образцов в 99,7% случаев, стандартное отклонение должно быть 1 CT, деленное на 6 стандартных отклонений (1/6=0.167), как показано на рисунке (B). Для того, чтобы точно определить значение CT для обоих образцов в 95% случаев, стандартное отклонение должно быть 1 CT, деленное на 4 стандартных отклонений (1/4=0.25), как показано на рисунке (C).
Чувствительность
Любая из современных систем ПЦР в реальном времени достигла такого уровня чувствительности, что стало возможно детектировать единичную копию ДНК-матрицы в образце. Чувствительность не зависит от абсолютного значения CT.
Как было сказано ранее, ключевым фактором для расчета чувствительности метода является эффективность реакции (рисунок 5). Другим важным моментом, связанным с детекцией малого количества копий ДНК является то, что распределение ДНК-матрицы будет отличаться от нормального. Вместо этого, оно будет стремиться к распределению Пуассона: то есть, если мы имеем большую выборку повторений, в каждом из которых, в среднем, по одной копии ДНК-матрицы, то, согласно распределению, в 37% образцов не будет ни одной копии, 37% будут иметь одну копию, а 18% – по две копии ДНК-матрицы (см. рисунок 9). Следовательно, для того, чтобы обеспечить достаточную достоверность детекции малого количества ДНК, необходимо проводить достаточное количество повторений, для того, чтобы обойти ограничения, связанные с распределением Пуассона.

Вывод
Вместе с тем, дополнительные виды контроля, такие как NTC (отрицательный контроль), no RT-контроль (контроль без обратной транскрипции) и контроль качества ДНК должны быть проведены для каждого анализа.
«Вероятность обнаружить вирус снижается». Когда нужно сдавать ПЦР-тест
В Роспотребнадзоре объяснили ложноотрицательные ПЦР-тесты при COVID-19
Ложноотрицательный результат теста на коронавирус может происходить из-за того, что инфицированный человек сдает анализ на поздних стадиях болезни. Такое мнение выразили в Роспотребнадзоре. Там подчеркнули, что вырастает шанс получить такой результат у больного COVID-19 после четвертого-пятого дня болезни.
При заражении COVID-19 у больного отсутствуют специфические признаки, которые характерны только для этой инфекции. Наиболее часто заразившийся сталкивается с респираторными симптомами, что может говорить не только о коронавирусе, но и ряде других заболеваний, включая грипп и ОРВИ.
По этой причине единственным способом диагностики коронавируса остается ПЦР-тестирование. Впрочем, в довольно большой доле случаев они оказываются недостоверными, о чем еще год назад говорили специалисты Минздрава, указывая на то, что 30-40% тестов дают ложноотрицательный результат. В частности, тогда считалось, что в большей части случаев на это влияют ошибки при заборе материала и качество самого теста.
Тем не менее существует и другое обоснование. По словам заместителя директора по клинико-аналитической работе ЦНИИ эпидемиологии Роспотребнадзора профессора Натальи Пшеничной, на результате анализа сказывается период заболевания, в который заболевший сдает ПЦР-тест. На ранних стадиях болезни получить положительный результат значительно выше.
«После четвертого-пятого дня болезни вероятность обнаружить вирус в носоглотке снижается, а респираторные симптомы могут быть в это время в самом разгаре. Если проводить тестирование в эти сроки, то можно получить отрицательный результат», — приводит слова специалиста РИА «Новости».
Общую картину по тестированию на COVID-19 также дополняет тот факт, что среди новых заболевших появляются и вакцинированные люди, но они при этом выделяют вирус в меньшем количестве и не такое продолжительное время, констатировала замдиректора Московского научно-исследовательского института эпидемиологии и микробиологии имени Г. Н. Габричевского Татьяна Руженцова.
Однако сомнительный или ложный результат может давать любая тестовая система. Эксперты неоднократно выражали мнение, что ложные результаты на коронавирус связаны связаны как с ошибками медработников, так и пациентов. Иными словами, речь идет о несоблюдении правил и рекомендаций по тестированию.
Еще одну версию выдвигал директор Института медицинской паразитологии, тропических и трансмиссивных заболеваний Сеченовского университета Александр Лукашев. Газете «Известия» он рассказывал, что COVID-19 — специфический вирус в том плане, что его можно не обнаружить в доступном биоматериале. Если другие коронавирусы размножаются в носоглотке и ротоглотке, где их можно легко найти, то SARS-CoV-2 у значительной части больных присутствует только в бронхах.
Согласно данным Всемирной организации здравоохранения, точность ПЦР-тестов на коронавирус, несмотря на их неоднозначную оценку, составляет 95%.
Вместе с этим в ВОЗ подчеркивают, что на результаты тестирования влияет очень много факторов. Это касается и процесса забора материала, и транспортировки, и хранения биоматериалов. Важно и то, правильно ли подготовлен пациент к сдаче анализа и проверена ли тест-система в конкретной лаборатории.
NAME] => URL исходной статьи [
Ссылка на публикацию: rambler.ru
Код вставки на сайт
«Вероятность обнаружить вирус снижается». Когда нужно сдавать ПЦР-тест
В Роспотребнадзоре объяснили ложноотрицательные ПЦР-тесты при COVID-19
Ложноотрицательный результат теста на коронавирус может происходить из-за того, что инфицированный человек сдает анализ на поздних стадиях болезни. Такое мнение выразили в Роспотребнадзоре. Там подчеркнули, что вырастает шанс получить такой результат у больного COVID-19 после четвертого-пятого дня болезни.
При заражении COVID-19 у больного отсутствуют специфические признаки, которые характерны только для этой инфекции. Наиболее часто заразившийся сталкивается с респираторными симптомами, что может говорить не только о коронавирусе, но и ряде других заболеваний, включая грипп и ОРВИ.
По этой причине единственным способом диагностики коронавируса остается ПЦР-тестирование. Впрочем, в довольно большой доле случаев они оказываются недостоверными, о чем еще год назад говорили специалисты Минздрава, указывая на то, что 30-40% тестов дают ложноотрицательный результат. В частности, тогда считалось, что в большей части случаев на это влияют ошибки при заборе материала и качество самого теста.
Тем не менее существует и другое обоснование. По словам заместителя директора по клинико-аналитической работе ЦНИИ эпидемиологии Роспотребнадзора профессора Натальи Пшеничной, на результате анализа сказывается период заболевания, в который заболевший сдает ПЦР-тест. На ранних стадиях болезни получить положительный результат значительно выше.
«После четвертого-пятого дня болезни вероятность обнаружить вирус в носоглотке снижается, а респираторные симптомы могут быть в это время в самом разгаре. Если проводить тестирование в эти сроки, то можно получить отрицательный результат», — приводит слова специалиста РИА «Новости».
Общую картину по тестированию на COVID-19 также дополняет тот факт, что среди новых заболевших появляются и вакцинированные люди, но они при этом выделяют вирус в меньшем количестве и не такое продолжительное время, констатировала замдиректора Московского научно-исследовательского института эпидемиологии и микробиологии имени Г. Н. Габричевского Татьяна Руженцова.
Однако сомнительный или ложный результат может давать любая тестовая система. Эксперты неоднократно выражали мнение, что ложные результаты на коронавирус связаны связаны как с ошибками медработников, так и пациентов. Иными словами, речь идет о несоблюдении правил и рекомендаций по тестированию.
Еще одну версию выдвигал директор Института медицинской паразитологии, тропических и трансмиссивных заболеваний Сеченовского университета Александр Лукашев. Газете «Известия» он рассказывал, что COVID-19 — специфический вирус в том плане, что его можно не обнаружить в доступном биоматериале. Если другие коронавирусы размножаются в носоглотке и ротоглотке, где их можно легко найти, то SARS-CoV-2 у значительной части больных присутствует только в бронхах.
Согласно данным Всемирной организации здравоохранения, точность ПЦР-тестов на коронавирус, несмотря на их неоднозначную оценку, составляет 95%.
Вместе с этим в ВОЗ подчеркивают, что на результаты тестирования влияет очень много факторов. Это касается и процесса забора материала, и транспортировки, и хранения биоматериалов. Важно и то, правильно ли подготовлен пациент к сдаче анализа и проверена ли тест-система в конкретной лаборатории.