Что значит обобществленные электроны
Обобществление электронов в кристалле



В твердом теле расстояния между атомами настолько малы, что каждый из них оказывается в потенциальном поле остальных атомов, которое нельзя игнорировать.
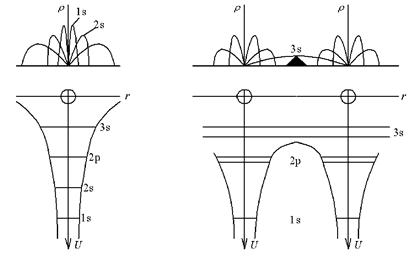
Вначале проведем качественное рассмотрение последствий объединения атомов в кристалл. Для этого сравним состояние изолированного атома, когда расстояние до другого атома r>>а – порядка кристаллической решетки (рис. 4.1, а). Для простоты возьмем атом натрия, имеющий энергетические уровни 1s, 2s, 2p, 3s. Уровни 1s, 2s, 2p заполнены, уровень 3s содержит один электрон, более высокие уровни пусты. Атомы отделены друг от друга потенциальными барьерами, и переход электрона между 3s уровнями отдельных атомов уже на расстоянии более
2 нм практически невозможен.
В верхней части рисунка показана картина распределения плотности вероятности ρ=4πτ 2 ψψ * обнаружения электрона на расстоянии r от ядра.
Теперь подвергнем атомы медленному сближению так, чтобы образовался кристалл. По мере сближения атомов взаимодействие между ними растет. На рис. 4.1, б приведены два втома натрия.
Рис. 4.1. Атомы натрия: а – удаленный атом, τ>>a; б – два атома, τ>>a
Сближение атомов вызывает уменьшение высоты и толщины потенциальных барьеров, разделяющих атомы. Так, для электронов 3s высота уровня оказывается выше потенциального барьера, и уровень оказывается общим для всех атомов. Это подтверждается и перекрытием функции ρ для 3s уровня. Иными словами происходит обобществление валентных 3s электронов.
В кристалле на этом уровне должно разместиться N одинаковых электронов. Однако, согласно принципу Паули, это запрещено, и 3s уровень расщепляется на N подуровней. В итоге формируется энергетическая зона, где могут находиться свободные электроны, называемые электронным газом.
Вернемся к 3s зоне и рассмотрим ее структуру. Мы уже говорили, что зона состоит из N подуровней. Такое состояние называют N – кратно вырожденным, а расщепление уровня на подуровни – снятием вырождения. Так выглядит ситуация, если мы имеем дело с S уровнем (l=0). В общем случае кратность вырождения определяется знакомым нам соотношением n=2l+1 (п. 2.7). Число электронов, которое может размещаться в зоне, определяется выражением (2l+1)n.
Изучение нового материала по теме «Металлическая химическая связь»
Презентация к уроку
Тип урока: Изучение нового материала.
Цель урока: Сформировать представления о металлической связи.
1. Организационный этап
Приветствие учащихся. Проверка готовности к занятию. Организация внимания.
Теперь давайте выполним следующие упражнения.
1. Между атомами каких химических элементов химическая связь будет иметь ионный характер:
2. Только ковалентная связь наблюдается в соединении с формулой:
3. Неполярная ковалентная связь наблюдается в веществе:
4. Химическая связь наиболее прочна в молекуле:
5. В молекуле какого вещества содержится ковалентная неполярная связь:
3. Изучение нового материала
Вы знаете, как взаимодействуют между собой атомы металлов и неметаллов, а также атомы неметаллов между собой.
Сегодня мы рассмотрим, как будут взаимодействовать атомы металлов между собой. Почему металлы существуют в виде слитка, куска или металлического изделия?
Что удерживает атомы металла в единое целое?
Какими свойствами обладают металлы и от чего они зависят – мы с вами должны ответить на этом уроке.
В таблице Дмитрия Ивановича Менделеева более 90 химических элементов представлены металлами. Почти все эти вещества (за исключением ртути) – твердые вещества с кристаллической решеткой.
Ученые давно установили, что именно в таких соединениях связь намного прочнее.
Она получила название металлической химической связи.
Металлическая связь – это связь в металлах и сплавах между атом-ионами посредством обобществленных электронов.
Что же такое обобществленные электроны? И почему атомы в металлах были названы атом-ионами?
Чаще всего атомы элементов металлов содержат на внешнем энергетическом уровне от одного 1 до трех 3 электронов. И эти электроны легко отрываются и попадают на энергетические уровни таких же атомов металлов. Таким образом, все электроны на внешних уровнях атомов металлов обобществленные, то есть принадлежат всем атомам вещества. Электроны выполняют роль цемента, удерживая катионы (положительно заряженные ядра с электронами внутренних энергетических уровней) в узлах кристаллической решетки. В свою очередь, катионы удерживают электроны в пределах кристаллической решетки.
Разобраться в том, какой электрон принадлежал какому атому, просто невозможно, так как все оторвавшиеся электроны становятся общими, соединяясь с ионами. Эти электроны временно образуют атомы, потом снова отрываются и соединяются с другим ионом. Этот процесс продолжается бесконечно. Таким образом, в металлических соединениях атомы непрерывно превращаются в ионы и наоборот.
атомы ионы металла металла
Этот процесс схематично можно изобразить так: постоянно отдавая и одновременно получая электроны, атом металла не является атомом и в тоже время не ион. Поэтому атомы в металлах и называются атом-ионами. Например, схематическое строение фрагмента металла алюминия. Каждый атом алюминия окружен восемью соседними атомами. Всего вокруг ядра атома алюминия располагается тринадцать электронов, но на внешнем энергетическом уровне только три. Они и будут участвовать в образовании металлической связи. Свободно отрываясь и двигаясь по внешних орбиталях всех соседних атомов, они склеивают ионный остов алюминия в твердый металлический кристалл. Металлическая связь, как и ковалентная, основана на объединении электронов соседних атомов. Но если при ковалентной связи один атом связан общими электронами только с соседним, то при металлической связи общие электроны есть со всеми соседними атомами.
Вещества с металлической связью часто сочетают прочность с пластичностью, так как при смещении атомов относительно друг друга не происходит разрыва связей. Металлы отражают световые волны, поэтому имеют металлический блеск и непрозрачны. Свободно движущиеся электроны обуславливают электропроводность и теплопроводность металлов и сплавов.
В парообразном состоянии атомы металлов связаны ковалентной связью. Металлическая связь характерна для чистых металлов и сплавов металлов в твердом и жидком состояниях.
На рисунке схематически изображено строение фрагмента металла натрия. При этом небольшое число обобществленных электронов связывает большое число ионов и атомов.
Схема металлической связи
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобществлении внешних электронов. Однако при ковалентной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов –сплавов, находящихся в твердом и жидком состояниях.
Вывод: Все виды связей основаны на особенностях строения атомов химических элементов, и их изучение является одним из центральных вопросов в химии.
4. Закрепление материала:
Теперь давайте выполним следующие упражнения.
1. Из приведённых ниже формул веществ выпишите формулы веществ с металлической связью:
2. Из приведённых ниже формул веществ выпишите формулы металлов:
3. Верны ли следующие суждения?
А). Химический элемент кальций образует вещества, в которых наблюдаются все типы химических связей.
Б). Вещество кальций Са и нитрид кальция Ca3N2 образованы соответственно с помощью металлической и ковалентной неполярной связей.
Большая Энциклопедия Нефти и Газа
Обобществленный электрон
В действительности, однако, обобществленный электрон отнюдь не гостит поочередно вблизи разных узлов решетки. В кристалле с идеальной решеткой ( отсутствуют примесные атомы и какие-либо нарушения периодической структуры) обобществленный электрон движется, не замечая ионов решетки. Захват электрона примесным атомом есть не что иное, как акт локализации микрообъекта, который до этого был делокализован и мог быть обнаружен с равной вероятностью вблизи любого узла кристаллической решетки. [24]
При этом сравнительно небольшое число обобществленных электронов связывает большое число ионов. [25]
В зависимости от ориентации спинов обобществленных электронов обменное взаимодействие может проявляться в возникновении сил притяжения или отталкивания между сближающимися атомами. [26]
В зависимости от ориентации спинов обобществленных электронов обменное взаимодействие может приводить к образованию либо сил притяжения, либо сил отталкивания. Если спины параллельны, то между сближающимися атомами возникают силы отталкивания, и молекула не образуется. [27]
Природа металлической связи также электростатическая; обобществленные электроны могут находиться около двух или более положительных ядер одновременно. Атомы лития легко отдают свой валентный электрон в общее пользование, превращаясь в положительный ион с электронной конфигурацией гелия. Свободные электроны, благодаря наличию большого числа свободных орбиталей, могут перемещаться в кристалле таким образом, что взаимодействуют с ядрами двух атомов и более. В кристалле лития каждый атом окружен восемью ближайшими атомами. [29]
Природа металлической связи также электростатическая; обобществленные электроны могут находиться около двух или более положительных ядер одновременно. [30]
Химическая связь. Ионная, металлическая, водородная связь
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Химическая связь и строение молекул
4.1. Определение химической связи.
Свойства веществ зависят от их состава, строения, от типа химической связи между атомами в веществе. Химическая связь имеет электрическую природу. Под химической связью понимают вид взаимодействия между частицами в веществе (или характер распределения электронной плотности).
Современная теория химической связи была предложена в 1916 г. американским ученым Льюисом и одновременно с ‘ним немецким ученым Косселем. В дальнейшем эти теории были дополнены, углублены, но являются основополагающими.
В образовании химических связей участвуют не все электроны атома, а только электроны внешнего уровня (у s- и p-элементов, т.е. у элементов главных подгрупп периодической системы) или электроны внешнего и недостроенного предвнешнего уровня (у d-элементов, т.е. у элементов побочных подгрупп). Электроны, способные к образованию химических связей, называются валентными. В зависимости от того, сколько электронов приняло участие в образовании химических связей, элемент может находиться в том или ином валентном состоянии (т.е. проявить определенную валентность).
Прежде валентностью элемента называли его способность присоединять или замещать определенное число атомов других элементов. В настоящее время понятие валентности связывают с определенным типом химической связи в веществе.
Соединение атомов в молекулы – энергетически выгодный процесс и всегда сопровождается выделением энергии, величина которой соответствует прочности (энергии) возникшей химической связи:
Теория строения атома объяснила причину объединения атомов в молекулы как стремление к устойчивой двух- или восьмиэлектронной внешней оболочке. Образование устойчивой электронной конфигурации может достигаться различными способами: отдачей, присоединением, обобществлением электронов. Таким образом, под химической связью понимаются различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и иных веществ. К основным чертам химической связи можно отнести:
а) снижение общей энергии двух- или многоатомной системы по
сравнению с суммарной энергией изолированных частиц, из которых
эта система образована;
б) перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом.
Существует несколько типов химической связи, из которых важнейшими являются ионная, ковалентная, металлическая связь.
4.2. Ионная связь.
При образовании любой молекулы, атомы этой молекулы «связываются» друг с другом. Причина образования молекул состоит в том, что между атомами в молекуле действуют электростатические силы. Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное.
Если на внешнем уровне содержится максимальное число электронов, которое атом может вместить, то такой уровень называется завершенным. Завершенные уровни характеризуются большой прочностью. Такие уровни имеют атомы инертных газов. Это и служит причиной того, что инертные газы при обычных условиях не вступают в химические реакции с другими элементами. Атомы других элементов имеют незавершенные энергетические уровни. В процессе химического взаимодействия они их завершают, т. е. приобретают структуру инертных газов.
Ионный тип связи возможен только у элементов, атомы которых резко отличаются по относительной электроотрицательности (см. раздел 3.3.), т.е. способности атомов смещать электронную плотность в молекуле к себе.
Рассмотрим электронное строение атомов некоторых металлов. неметаллов и инертного газа неона.
Электронная формула атома
натрия Is 2 2s 2 2p 6 3s 1 или [Ne] 3s 1
кальция Is 2 2s 2 2p 6 3s 2 3p 6 4s 2 или [Ar] 4s 2
хлора Is 2 2s 2 2p 6 3s 2 3p 5 или [Ne] Зs 2 3p 5
кислорода Is 2 2s 2 p 4 или [He ]2s 2 2p 4
неона Is 2 s 2 p 6
Как видно из электронного строения, атом неона имеет завершенный внешний энергетический уровень, состоящий из восьми электронов, а атомы металлов (натрия и кальция) и неметаллов (хлора и кислорода) — незавершенные энергетические уровни. В процессе химических реакций они стремятся завершить их, т. е. принять конфигурацию инертных газов.
Для завершения энергетических уровней атомам натрия и кальция легче отдать один и два электрона, а атомам хлора и кислорода легче принять один или два электрона. Это и происходит при образовании молекул.
Образование молекул хлорида натрия (NaCI) и оксида кальция (СаО) происходит по схеме:
Атом натрия теряет электрон и превращается в ион натрия, который приобретает конфигурацию инертного газа (Ne), а атом хлора присоединяет электрон, превращается в ион хлора, приобретая конфигурацию инертного газа аргона (Аг).
Аналогично происходит и образование молекулы оксида кальция
Ионы, вследствие сил электростатического притяжения, образуют молекулы. Соединения, которые образовались путем притяжения ионов, называются ионными.
Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной связью. Ионных соединений сравнительно немного. Современная теория связи объясняет возникновение ионной связи из ковалентной предельной односторонней поляризацией (смещением) общей электронной пары, когда последняя переходит во владения одного из соединяющихся атомов, т. е. ионная связь — крайний случай ковалентной связи.
Таким образом, нет принципиального различия в механизме возникновения неполярной ковалентной, полярной ковалентной и ионной связей. Они различаются лишь степенью поляризации молекулярного электронного облака. Природа химической связи едина.
Для соединений с ионной связью характерны высокая температура кипения и плавления, электропроводностью обладают только в расплавленном состоянии, в воде легко диссоциируют на ионы.
Ионная связь характеризуется ненаправленностью и ненасыщаемостью.
Ненаправленность ионной связи. Ионы можно представить как заряженные шары, силовые поля которых равномерно распределены во всех направлениях в пространстве. Поэтому каждый ион может притянуть к себе ионы противоположного знака в любом направлении (рис. 5).
Ненасыщаемость ионной связи. Взаимодействие двух ионов противоположного знака друг с другом не может привести к полной взаимной компенсации их силовых полей. В силу этого, у них сохраняется способность притягивать ноны противоположного знака и по другим направлениям (рис. 6).
4.6. Металлическая связь.
Само название говорит, что речь пойдет о внутренней структуре металлов. Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов. Так, по одному электрону содержат 16 элементов, по два — 56, по три — 4 элемента и ноль — только один Pd. В то же время на внешних уровнях атомов металлов много свободных орбиталей, что позволяет электронам близко подходить к положительным ядрам в любой части кристалла.
Из-за низкой энергии ионизации электроны в металле утрачивают связь с отдельными атомами, легко обобществляются, образуя электронный газ — совокупность свободных электронов. И самое главное состоит в том, что электроны в металле подвижны, легко перемещаются. Это подвижные, или нелокализованные, электроны.
Теперь можно представить металл как плотно упакованную структуру положительных ионов, связанных друг с другом электронным газом. При этом сравнительно небольшое число обобществленных электронов связывает большое число ионов.
Химическая связь, образующаяся в результате электрического притяжения между ионами металла и обобществленными электронами (электронным газом), называется металлической связью. Она характерна для металлов, сплавов и интерметаллических соединений. Природа связи — электрическая.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобщении валентных электронов. Однако при ковалентной связи обобщены валентные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической — пластичны; в последнем случае возможно взаимное смещение ионов без нарушения связи. Это говорит о нелокализованности (отсутствии направленности) металлической связи. Для повышения твердости металлов в них вводят такие элементы, которые благоприятствуют образованию направленных – ковалентных – связей.
Таким образом, металлическая связь—это сильно нелокализованная химическая связь, возникающая в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, а валентные электроны из-за малой энергии ионизации слабо удерживаются ядром. Ею объясняются физические свойства металлов.
4.7. Водородная связь.
Водородная связь — это своеобразная химическая связь. Она возникает между молекулами, в состав которых входит водород и сильно электроотрицательный элемент. Такими элементами являются фтор, кислород, азот, хлор и др.
Природу водородной связи объясняли по-разному. Наибольшее распространение получило электростатическое взаимодействие.
Механизм водородной связи рассмотрим на примере молекулы воды. При образовании полярной ковалентной связи между атомами водорода и атомом кислорода электроны, первоначально принадлежащие атому водорода, сильно смещаются в сторону кислорода. В результате атом кислорода приобретает значительный эффективный отрицательный заряд, а ядро атома водорода с внешней по отношению к атому кислорода стороны почти лишается электронного облака. Между протоном атома водорода и отрицательно заряженным атомом кислорода соседней молекулы воды возникает электростатическое притяжение, что и приводит к образованию водородной связи.
Более правильным следует считать, что в образовании водородной связи принимает участие и донорно-акцепторное взаимодействие. Ведь для этой связи характерны направленность в пространстве и насыщаемость. На это впервые указал Н. Д. Соколов, разработавший квантово-механическую теорию водородной связи.
Согласно донорно-акцепторной теории, водородная связь начинается с электростатического взаимодействия, в результате которого электронная пара атомов водорода еще больше смещается в сторону кислорода, благодаря чему атом водорода как бы «оголяется», другими словами s-орбнталь атома водорода «высвобождается» и становится способной принять неподеленную электронную пару атома кислорода другой молекулы. Поле протона велико и притяжение им электронной пары атома кислорода весьма эффективно, в то время других своих электронов около протона нет, поэтому отталкивание другой молекулы воды в области атома водорода сильно понижается.
Этот механизм объясняет, почему только водород способен образовывать водородную связь. У всякого другого атома при освобождении орбитали ядро не «оголяется» и внутренние оболочки обеспечивают отталкивание от электронных оболочек второй молекулы.
Рассмотренный механизм образования водородной связи требует, чтобы атом элемента, соединяясь с водородом, обладал высокой относительной электроотрицательностью и имел в наличии неподеленную электронную пару. Только при этом условии электронное облако атома водорода достаточно сильно сместится в сторону атома партнера. Таким образом, химическая связь, образованная положительно поляризованным водородом молекулы А—Н (или полярной группы—А-Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью.
Обычно водородную связь обозначают точками и этим указывают, что она слабее ковалентной связи (примерно в 15—20 раз). Тем не менее она ответственна за ассоциацию молекул. Например, образование димеров уксусной кислоты можно представить схемой агрегаций молекул за счет водородных связей:
1.Образование зигзагообразных цепей в жидком фтороводороде HF:
2. Образование гидрата аммиака NН3 ∙ Н2О при растворении аммиака в воде:
Что такое Обобществленные электроны
Что такое Обобществленные электроны
Мы были вынуждены ввести еще один термин. Это «обобществленные электроны». Он «родился» при очередном обсуждении результатов исследований в Институте общей физики им. А.М. Прохорова РАН. И связано это было с тем, что водородный показатель (рН) и окислительно-восстановительный потенциал (ОВП), призванные характеризовать соответственно активность ионов водорода в воде и активность электронов в окислительно-восстановительных реакциях, в пограничной воде частично утрачивали свой физический смысл. А именно, можно получить пограничную воду с рН порядка 5,5-6,0, но с электрон-донорными свойствами. Химики вначале не верили, что это возможно, пока не убедились путем непосредственного измерения указанных параметров.
Поэтому возникла насущная потребность в количественном определении доступности электронов в живом организме и в пограничной воде без использования значений рН и ОВП. Это было важно еще и потому, что эти два параметра, характеризующие воду, не могли должным образом характеризовать пограничную воду с точки зрения ее биологической активности (см. раздел Пограничная вода и окислительно-восстановительный потенциал).
Был предложен термин «обобществленные электроны», призванный самостоятельно характеризовать доступность электронов в воде, пограничной воде, в живом организме, в органическом и неорганическом веществе.
Этот термин характеризует физическое состояние электронов не только с точки зрения участия в окислительно-восстановительных реакциях. Он более общий. С его помощью, например, можно характеризовать состояние нервных волокон, состояние мышечной ткани, вещества головного мозга, организма в целом и т.д.
Термин «Обобществленные электроны» имеет количественную характеристику. В настоящее время количественно определяется методом газоразрядной визуализации (ГРВ).
Это происходит следующим образом: изучаемый объект (вода, пограничная вода, живой организм) помещается в электрическое поле. Электроны, вылетающие из объекта под его действием, инициируют в газе коронный разряд, интенсивность которого регистрируется.
Таким образом, выбрав эталон, можно сравнивать между собой изучаемые объекты, так как чем больше электронов участвует в развитии коронного разряда, тем интенсивнее свечение. Этот метод хорошо известен, разработан и доведен с физической точки зрения как метод измерения профессором К.Г. Коротковым.
Здесь хочу обратить внимание, что мы в своих исследованиях используем только физическую составляющую метода ГРВ, а именно количественное измерение интенсивности свечения коронного разряда. И сравнение изучаемых объектов производим только по этому параметру.
Термин «обобществленные электроны» оказался с хорошим физическим смыслом, очень емким, свободным от внутренних процессов, происходящих в изучаемом объекте, его структуры и т.д.
Таким образом, в наших руках оказался инструмент, с помощью которого можно физически регистрировать состояние электронов, характеризовать изучаемые объекты или их части. Инструмент, с помощью которого можно изучать состояние живой и неживой материи, живого организма и эффективность воздействий на него, например, с помощью пограничной воды.