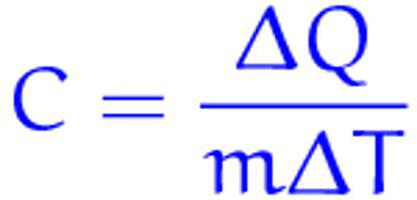Что значит числовое значение удельной теплоемкости
Таблицы удельной теплоемкости веществ (газов, жидкостей и др.)
Представлены таблицы удельной теплоемкости веществ: газов, металлов, жидкостей, строительных и теплоизоляционных материалов, а также пищевых продуктов — более 400 веществ и материалов.
Удельной теплоемкостью вещества называется отношение количества тепла, сообщенного единице массы этого вещества в каком-либо процессе, к соответствующему изменению его температуры.
Удельная теплоемкость веществ зависит от их химического состава, термодинамического состояния и способа сообщения им тепла. В Международной системе единиц эта величина измеряется в Дж/(кг·К).
Необходимо отметить, что экспериментальное определение удельной теплоемкости жидкостей и газов производится при постоянном давлении или при постоянном объеме. В первом случае удельная теплоемкость обозначается Cp, во втором — Cv. Для жидкостей и газов наиболее часто применяется удельная теплоемкость при постоянном давлении Cp.
Для твердых веществ теплоемкости Cp и Cv не различаются. Кроме того, по отношению к твердым телам, помимо удельной массовой теплоемкости применяются также удельная атомная и молярная теплоемкости.
Таблица удельной теплоемкости газов
В таблице приведена удельная теплоемкость газов Cp при температуре 20°С и нормальном атмосферном давлении (101325 Па).
| Газы | Cp, Дж/(кг·К) |
|---|---|
| Азот N2 | 1051 |
| Аммиак NH3 | 2244 |
| Аргон Ar | 523 |
| Ацетилен C2H2 | 1683 |
| Водород H2 | 14270 |
| Воздух | 1005 |
| Гелий He | 5296 |
| Кислород O2 | 913 |
| Криптон Kr | 251 |
| Ксенон Xe | 159 |
| Метан CH4 | 2483 |
| Неон Ne | 1038 |
| Оксид азота N2O | 913 |
| Оксид азота NO | 976 |
| Оксид серы SO2 | 625 |
| Оксид углерода CO | 1043 |
| Пропан C3H8 | 1863 |
| Сероводород H2S | 1026 |
| Углекислый газ CO2 | 837 |
| Хлор Cl | 520 |
| Этан C2H6 | 1729 |
| Этилен C2H4 | 1528 |
Таблица удельной теплоемкости некоторых металлов и сплавов
В таблице даны значения удельной теплоемкости некоторых распространенных металлов и сплавов при температуре 20°С. Значения теплоемкости большинства металлов при других температурах вы можете найти в этой таблице.
| Металлы и сплавы | C, Дж/(кг·К) |
|---|---|
| Алюминий Al | 897 |
| Бронза алюминиевая | 420 |
| Бронза оловянистая | 380 |
| Вольфрам W | 134 |
| Дюралюминий | 880 |
| Железо Fe | 452 |
| Золото Au | 129 |
| Константан | 410 |
| Латунь | 378 |
| Манганин | 420 |
| Медь Cu | 383 |
| Никель Ni | 443 |
| Нихром | 460 |
| Олово Sn | 228 |
| Платина Pt | 133 |
| Ртуть Hg | 139 |
| Свинец Pb | 128 |
| Серебро Ag | 235 |
| Сталь стержневая арматурная | 482 |
| Сталь углеродистая | 468 |
| Сталь хромистая | 460 |
| Титан Ti | 520 |
| Уран U | 116 |
| Цинк Zn | 385 |
| Чугун белый | 540 |
| Чугун серый | 470 |
Таблица удельной теплоемкости жидкостей
В таблице представлены значения удельной теплоемкости Cp распространенных жидкостей при температуре 10…25°С и нормальном атмосферном давлении.
| Жидкости | Cp, Дж/(кг·К) |
|---|---|
| Азотная кислота (100%-ная) NH3 | 1720 |
| Анилин C6H5NH2 | 2641 |
| Антифриз (тосол) | 2990 |
| Ацетон C3H6O | 2160 |
| Бензин | 2090 |
| Бензин авиационный Б-70 | 2050 |
| Бензол C6H6 | 1050 |
| Вода H2O | 4182 |
| Вода морская | 3936 |
| Вода тяжелая D2O | 4208 |
| Водка (40% об.) | 3965 |
| Водный раствор хлорида натрия (25%-ный) | 3300 |
| Газойль | 1900 |
| Гидроксид аммония | 4610 |
| Глицерин C3H5(OH)3 | 2430 |
| Даутерм | 1590 |
| Карборан C2H12B10 | 1720 |
| Керосин | 2085…2220 |
| Кефир | 3770 |
| Мазут | 2180 |
| Масло АМГ-10 | 1840 |
| Масло ВМ-4 | 1480 |
| Масло касторовое | 2219 |
| Масло кукурузное | 1733 |
| Масло МС-20 | 2030 |
| Масло подсолнечное рафинированное | 1775 |
| Масло ТМ-1 | 1640 |
| Масло трансформаторное | 1680 |
| Масло хлопковое рафинированное | 1737 |
| Масло ХФ-22 | 1640 |
| Молоко сгущенное с сахаром | 3936 |
| Молоко цельное | 3906 |
| Нефть | 2100 |
| Парафин жидкий (при 50С) | 3000 |
| Пиво | 3940 |
| Серная кислота (100%-ная) H2SO4 | 1380 |
| Сероуглерод CS2 | 1000 |
| Силикон | 2060 |
| Скипидар | 1800 |
| Сливки (35% жирности) | 3517 |
| Сок виноградный | 2800…3690 |
| Спирт метиловый (метанол) CH3OH | 2470 |
| Спирт этиловый (этанол) C2H5OH | 2470 |
| Сыворотка молочная | 4082 |
| Толуол C7H8 | 1130 |
| Топливо дизельное (солярка) | 2010 |
| Топливо реактивное | 2005 |
| Уротропин C6H12N4 | 1470 |
| Фреон-12 CCl2F2 | 840 |
| Эфир этиловый C4H10O | 2340 |
Таблица удельной теплоемкости твердых веществ
В таблице дана удельная теплоемкость твердых веществ: стройматериалов (песка, асфальта и т.д.), теплоизоляции различных типов и других распространенных материалов в интервале температуры от 0 до 50°С при нормальном атмосферном давлении.
Таблица удельной теплоемкости пищевых продуктов
В таблице приведены значения средней удельной теплоемкости пищевых продуктов (овощей, фруктов, мяса, рыбы, хлеба, вина и т. д.) в диапазоне температуры 5…20°С и нормальном атмосферном давлении.
Кроме таблиц удельной теплоемкости, вы также можете ознакомиться с подробнейшей таблицей плотности веществ и материалов, которая содержит данные по величине плотности более 500 веществ (металлов, пластика, резины, продуктов, стекла и др.).
Удельная теплоемкость вещества
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат
(в правом нижнем углу экрана).
Нагревание и охлаждение
Эти два процесса знакомы каждому. Вот нам захотелось чайку, и мы ставим чайник, чтобы нагреть воду. Или ставим газировку в холодильник, чтобы охладить.
Логично предположить, что нагревание — это увеличение температуры, а охлаждение — ее уменьшение. Все, процесс понятен, едем дальше.
Но не тут-то было: температура меняется не «с потолка». Все завязано на таком понятии, как количество теплоты. При нагревании тело получает количество теплоты, а при нагревании — отдает.
В процессах нагревания и охлаждения формулы для количества теплоты выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
В этих формулах фигурирует и изменение температуры, о котором мы сказали выше, и удельная теплоемкость, речь о которой пойдет дальше.
А вот теперь поговорим о видах теплопередачи.
Виды теплопередачи
Здесь все совсем несложно, их всего три: теплопроводность, конвекция и излучение.
Теплопроводность
Тот вид теплопередачи, который можно охарактеризовать, как способность тел проводить энергию от более нагретого тела к менее нагретому.
Речь о том, чтобы передать тепло с помощью соприкосновения. Признавайтесь, грелись же когда-нибудь возле батареи. Если вы сидели к ней вплотную, то согрелись вы благодаря теплопроводности. Обниматься с котиком, у которого горячее пузо, тоже эффективно.
Порой мы немного перебарщиваем с возможностями этого эффекта, когда на пляже ложимся на горячий песок. Эффект есть, только не очень приятный. Ну а ледяная грелка на лбу дает обратный эффект — ваш лоб отдает тепло грелке.
Конвекция
Когда мы говорили о теплопроводности, мы приводили в пример батарею. Теплопроводность — это когда мы получаем тепло, прикоснувшись к батарее. Но все вещи в комнате к батарее не прикасаются, а комната греется. Здесь вступает конвекция.
Дело в том, что холодный воздух тяжелее горячего (холодный просто плотнее). Когда батарея нагревает некий объем воздуха, он тут же поднимается наверх, проходит вдоль потолка, успевает остыть и спуститься обратно вниз — к батарее, где снова нагревается. Таким образом, вся комната равномерно прогревается, потому что все более горячие потоки сменяют все менее холодные.
Излучение
Пляж мы уже упоминали, но речь шла только о горячем песочке. А вот тепло от солнышка — это излучение. В этом случае тепло передается через волны.
Обоими способами. То тепло, которое мы ощущаем непосредственно от камина (когда лицу горячо, если вы расположились слишком близко к камину) — это излучение. А вот прогревание комнаты в целом — это конвекция.
Удельная теплоемкость: понятие и формула для расчета
Формулы количества теплоты для нагревания и охлаждения мы уже разбирали, но давайте еще раз:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
В этих формулах фигурирует такая величина, как удельная теплоемкость. По сути своей — это способность материала получать или отдавать тепло.
С точки зрения математики удельная теплоемкость вещества — это количество теплоты, которое надо к нему подвести, чтобы изменить температуру 1 кг вещества на 1 градус Цельсия:
Удельная теплоемкость вещества
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Также ее можно рассчитать через теплоемкость вещества:
Удельная теплоемкость вещества
c — удельная теплоемкость вещества [Дж/кг*˚C]
C — теплоемкость вещества [Дж/˚C]
Величины теплоемкость и удельная теплоемкость означают практически одно и то же. Отличие в том, что теплоемкость — это способность всего вещества к передаче тепла. То есть формулу количества теплоты для нагревания тела можно записать в таком виде:
Количество теплоты, необходимое для нагревания тела
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Онлайн-курсы физики в Skysmart не менее увлекательны, чем наши статьи!
Таблица удельных теплоемкостей
Удельная теплоемкость — табличная величина. Часто ее указывают в условии задачи, но при отсутствии в условии — можно и нужно воспользоваться таблицей. Ниже приведена таблица удельных теплоемкостей для некоторых (многих) веществ.
Удельная теплоемкость: для чего она нужна и в чем ее смысл?
Однако толкованию слова «удельный» обычно уделяется недостаточно внимания. Учащиеся просто запоминают его как данность. А что оно значит?
Если заглянуть в словарь Ожегова, то можно прочесть, что такая величина определяется как отношение. Причем оно может быть выполнено к массе, объему или энергии. Все эти величины обязательно полагается брать равными единице. Отношение к чему задается в удельной теплоемкости?
К произведению массы и температуры. Причем их значения обязательно должны быть равными единице. То есть в делителе будет стоять число 1, но его размерность будет сочетать килограмм и градус Цельсия. Это обязательно учитывается при формулировке определения удельной теплоемкости, которое дано немного ниже. Там же находится формула, из которой видно, что в знаменателе стоят именно эти две величины.
Что это такое?
Удельная теплоемкость вещества вводится в тот момент, когда рассматривается ситуация с его нагреванием. Без него невозможно узнать, какое количество теплоты (или энергии) потребуется затратить на этот процесс. А также вычислить ее значение при охлаждении тела. Кстати, эти два количества теплоты равны друг другу по модулю. Но имеют разные знаки. Так, в первом случае она положительная, потому что энергию нужно затратить и она передается телу. Вторая ситуация с охлаждением дает отрицательное число, потому что тепло выделяется, и внутренняя энергия тела уменьшается.
Обозначается эта физическая величина латинской буквой c. Определяется она как некоторое количество теплоты, необходимое для нагревания одного килограмма вещества на один градус. В курсе школьной физики в качестве этого градуса выступает тот, что берется по шкале Цельсия.
Как ее сосчитать?
Если требуется узнать, чему равна удельная теплоемкость, формула выглядит так:
с = Q / (m * (t2 – t1)), где Q — количество теплоты, m — масса вещества, t2 – температура, которую тело приобрело в результате теплообмена, t1 — начальная температура вещества. Это формула № 1.
Исходя из этой формулы, единица измерения этой величины в международной системе единиц (СИ) оказывается Дж/(кг*ºС).
Как найти другие величины из этого равенства?
Во-первых, количество теплоты. Формула будет выглядеть таким образом: Q = с * m * (t2 – t1). Только в нее необходимо подставлять величины в единицах, входящих в СИ. То есть масса в килограммах, температура — в градусах Цельсия. Это формула № 2.
Во-вторых, массу вещества, которое остывает или нагревается. Формула для нее будет такой: m = Q / (c * (t2 – t1)). Это формула под № 3.
В-третьих, изменение температуры Δt = t2 – t1 = (Q / c * m). Знак «Δ» читается как «дельта» и обозначает изменение величины, в данном случае температуры. Формула № 4.
Какие значения она может иметь?
Экспериментальным путем установлено, какие она имеет значения у каждого конкретного вещества. Поэтому создана специальная таблица удельной теплоемкости. Чаще всего в ней даны данные, которые справедливы при нормальных условиях.
| Вещество | Удельная теплоемкость, Дж/(кг * ºС) |
| алюминий | 920 |
| вода | 4200 |
| графит | 750 |
| железо | 460 |
| золото | 130 |
| латунь | 400 |
| лед | 2100 |
| медь | 400 |
| олово | 230 |
| свинец | 140 |
| сталь | 500 |
| стекло лабораторное | 840 |
| чугун | 540 |
В чем заключается лабораторная работа по измерению удельной теплоемкости?
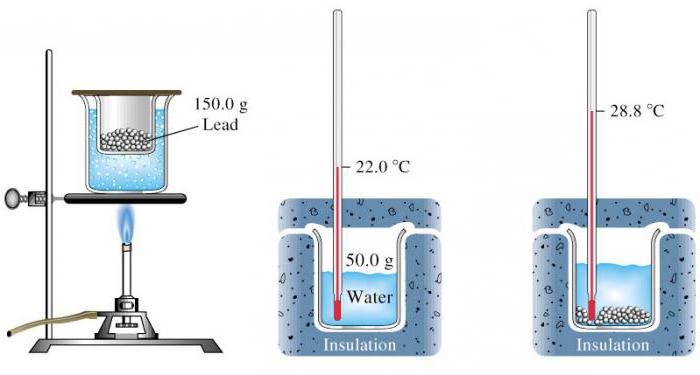
В школьном курсе физики ее определяют для твердого тела. Причем его теплоемкость высчитывается благодаря сравнению с той, которая известна. Проще всего это реализуется с водой.
В процессе выполнения работы требуется измерить начальные температуры воды и нагретого твердого тела. Потом опустить его в жидкость и дождаться теплового равновесия. Весь эксперимент проводится в калориметре, поэтому потерями энергии можно пренебречь.
Потом требуется записать формулу количества теплоты, которое получает вода при нагревании от твердого тела. Второе выражение описывает энергию, которую отдает тело при остывании. Эти два значения равны. Путем математических вычислений остается определить удельную теплоемкость вещества, из которого состоит твердое тело.
Чаще всего ее предлагается сравнить с табличными значениями, чтобы попытаться угадать, из какого вещества сделано изучаемое тело.
Задача № 1
Условие. Температура металла изменяется от 20 до 24 градусов Цельсия. При этом его внутренняя энергия увеличилась на 152 Дж. Чему равна удельная теплоемкость металла, если его масса равна 100 граммам?
Решение. Для нахождения ответа потребуется воспользоваться формулой, записанной под номером 1. Все величины, необходимые для расчетов, есть. Только сначала необходимо перевести массу в килограммы, иначе ответ получится неправильный. Потому что все величины должны быть такими, которые приняты в СИ.
В одном килограмме 1000 граммов. Значит, 100 граммов нужно разделить на 1000, получится 0,1 килограмма.
Подстановка всех величин дает такое выражение: с = 152 / (0,1 * (24 – 20)). Вычисления не представляют особой трудности. Результатом всех действий является число 380.
Ответ: с = 380 Дж/(кг * ºС).
Задача № 2
Условие. Определить конечную температуру, до которой остынет вода объемом 5 литров, если она была взята при 100 ºС и выделила в окружающую среду 1680 кДж тепла.
Решение. Начать стоит с того, что энергия дана в несистемной единице. Килоджоули нужно перевести в джоули: 1680 кДж = 1680000 Дж.
Подстановка значений в формулу массы дает такое выражение: 1000 * 0,005 = 5 кг. Удельную теплоемкость потребуется посмотреть в таблице. Теперь можно переходить к формуле 8: t2 = 100 + (1680000 / 4200 * 5).
Задача № 3
Условие. Имеется химический стакан массой 100 г. В него налито 50 г воды. Начальная температура воды со стаканом равна 0 градусам Цельсия. Какое количество теплоты потребуется для того, чтобы довести воду до кипения?
Решение. Начать стоит с того, чтобы ввести подходящее обозначение. Пусть данные, относящиеся к стакану, будут иметь индекс 1, а к воде — индекс 2. В таблице необходимо найти удельные теплоемкости. Химический стакан сделан из лабораторного стекла, поэтому его значение с1 = 840 Дж/ (кг * ºС). Данные для воды такие: с2 = 4200 Дж/ (кг * ºС).
Их массы даны в граммах. Требуется перевести их в килограммы. Массы этих веществ будут обозначены так: m1 = 0,1 кг, m2 = 0,05 кг.
Начальная температура дана: t1 = 0 ºС. О конечной известно, что она соответствует той, при которой вода кипит. Это t2 = 100 ºС.
Поскольку стакан нагревается вместе с водой, то искомое количество теплоты будет складываться из двух. Первой, которая требуется для нагревания стекла (Q1), и второй, идущей на нагревание воды (Q2). Для их выражения потребуется вторая формула. Ее необходимо записать два раза с разными индексами, а потом составить их сумму.
Получается, что Q = с1 * m1 * (t2 – t1) + с2 * m2 * (t2 – t1). Общий множитель (t2 – t1) можно вынести за скобку, чтобы было удобнее считать. Тогда формула, которая потребуется для расчета количества теплоты, примет такой вид: Q = (с1 * m1 + с2 * m2) * (t2 – t1). Теперь можно подставить известные в задаче величины и сосчитать результат.
Q = (840 * 0,1 + 4200 * 0,05) * (100 – 0) = (84 + 210) * 100 = 294 * 100 = 29400 (Дж).
Удельная теплоемкость
Содержание
Вам уже известно, что количество теплоты зависит от массы вещества, разности температур и рода вещества. Количество теплоты ($Q$) в СИ измеряется в джоулях ($Дж$).
В данном уроке мы рассмотрим это новое для нас определение, узнаем его физическое значение, познакомимся с удельной теплоемкостью различных веществ.
Удельная теплоемкость вещества
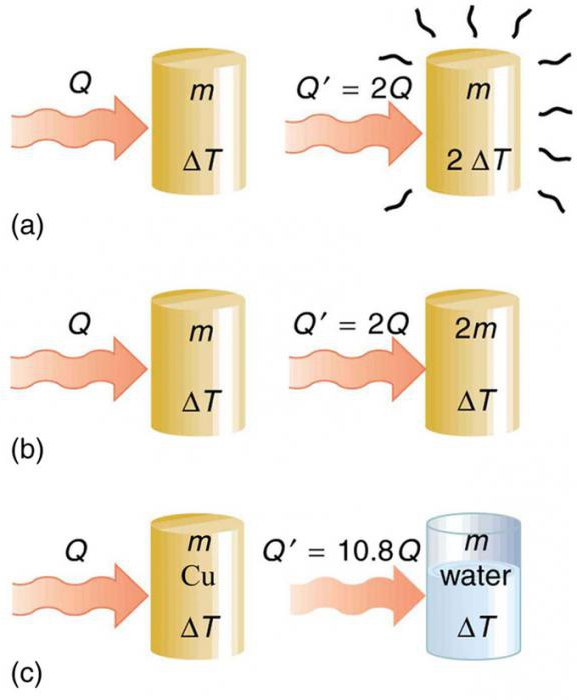
Рассмотрим на примерах, как удельная теплоемкость характеризует вещество.
Единица измерения удельной теплоемкости
Удельная теплоемкость обозначается буквой $c$.
Измеряется удельная теплоемкость вещества в $\frac<Дж><кг \cdot \degree C>$.
Из этого значения мы можем сказать, что:
Табличные значения удельной теплоемкости
Существуют уже известные значения удельной теплоемкости различных веществ. Они представлены таблице 1.
| Вещество | $c, \frac<Дж><кг \cdot \degree C>$ | Вещество | $c, \frac<Дж><кг \cdot \degree C>$ |
| Золото | 130 | Песок | 820 |
| Ртуть | 140 | Стекло | 840 |
| Свинец | 140 | Кирпич | 880 |
| Олово | 230 | Алюминий | 920 |
| Серебро | 250 | Масло подсолнечное | 1700 |
| Медь | 400 | Лед | 2100 |
| Цинк | 400 | Керосин | 2100 |
| Латунь | 400 | Эфир | 2350 |
| Железо | 460 | Дерево (дуб) | 2400 |
| Сталь | 500 | Спирт | 2500 |
| Чугун | 540 | Вода | 4200 |
| Графит | 750 | Гелий | 5200 |
Таблица 1. Удельные теплоемкости некоторых веществ.
Удельная теплоемкость и агрегатные состояния вещества
Давайте взглянем в таблицу 1 и сравним значения удельной теплоемкости льда и воды.
Удельная теплоемкость вещества, находящегося в различных агрегатных состояниях, различна.