Что такое sscc в маркировке лекарственных средств
Структура номера SSCC
| Идентификатор применения | Цифра расширения | GSP (префикс компании GS1) | Серийный ссылочный номер | Контрольное число |
|---|---|---|---|---|
| 00 | N1 | N2N3N4N5N6N7N8N9N10 | N11N12N13N14N15N16N17 | N18 |
Идентификатор применения 00 показывает, что поле данных содержит номер SSCC.
Цифра расширения используется для увеличения емкости Серийного ссылочного номера в SSCC. Она присваивается компанией, создающей номер SSCC. Цифра расширения может быть от 0 до 9.
Номер SSCC наносится на логистическую единицу с помощью логистической этикетки.
Примечание 1: идентификатор применения 00 печатается на штрих-коде, но не является частью SSCC и не передается в МДЛП. Размер типа данных для передачи в МДЛП составляет 18 знаков
Примечание 2: в подписи под штрих-кодом, дублирующей в письменном виде его значение, некоторые компании пишут идентификатор применения со скобочками. Несмотря на это, скобочки в сам штрих-код не входят и входить не должны и служат лишь для удобства чтения подписи.
При написании данного теста были использованы официальные источники:
Идентификационные ключи Cистемы GS1
Расчёт контрольной цифры
Документация на официальном сайте МДЛП
Что такое SGTIN и SSCC коды?
С октября 2019 года нанесение идентификации на фармпродукцию станет обязательным для ЛП из перечня высокозатратных нозологий. Все субъекты рынка будут обязаны использовать контрольные идентификационные знаки – специальные идентификаторы, которые помогут отслеживать передвижение фармацевтической продукции. Со временем маркировка станет обязательной и для других лекарственных средств.
В целях автоматической идентификации были разработаны SGTIN и SSCC коды. Уникальное кодовое значение позволяет идентифицировать продукцию и отличать один маркированный продукт от другого. Целью внедрения системы маркировки ЛПКИС является усиление эффективности надзорных функций государства, в частности противодействие незаконному производству и обороту ЛП на территории РФ.
Значение SGTIN и SSCC штрих-кода
SGTIN – это уникальная идентификационная кодовая информация вторичной потребительской упаковки. GTIN помогает шифровать только тип продукции, а вот SGTIN позволяет сформировать индивидуальные идентификаторы для каждой единицы фармпродукции. Он представляет собой уникальную комбинацию GTIN и дополнительного серийного номера. Дает возможность отслеживать передвижение каждой единицы товара в отдельности от производителя до конечного покупателя в сфере фармацевтики.
SSCC код – это серийная кодовая информация транспортной упаковки. Благодаря ей происходит идентификация не отдельного товара, а всей отправленной партии. Представленный код используется при сериализации ящиков, паллет, контейнеров. Благодаря ему можно отслеживать движение партии фармацевтической продукции на стадии складирования и транспортировки. По сути, он необходим для автоматизации логистических операций. Состоит код из трех секций. Верхняя включает в себя информацию от производителя, средняя – текстовая расшифровка зашифрованных сведений, нижняя – штрих-коды. SSCC печатается последним.
Важное отличие GTIN от SSCC на лекарствах заключается в том, что последний не несет никакой значимой информации о фармацевтической продукции. Однако благодаря электронным системам учета, обеспечиваемым прослеживаемость передвижения товара, фармпродукция может быть ассоциирована с соответствующими товарными единицами. Это содействует ускорению процесса приемки, сортировки, а также оформления бумаг для последующего отпуска продукции в оборот.
Назначение SGTIN кода
Все это необходимо в целях противодействия незаконному обороту фармацевтической продукции на территории РФ и противодействия недобросовестной конкуренции. Внедрение соответствующих кодов помогает автоматизировать процесс стандартизации и унификации процедур учета поставок и распределения ЛС.
Преимущества использования SGTIN кодов
Цель внедрения соответствующих кодов – это обеспечение прозрачности движения ЛП и противодействие производству и обороту контрафакта.
Назначение SSCC
Изначально SSCC предполагалось применять в первую очередь для транспортных логистических служб. Однако со временем стало ясно, что он необходим и для участников рынка, так как значительно ускоряет товарообработку. К примеру, если фармацевтическая компания получает невскрытый паллет, то отпадает необходимость вскрывать, разбирать его и определять, сколько в нем находится наименований, поскольку в зашифрованном коде есть все данные. По оценке экспертов скорость приемки благодаря данному коду увеличивается в 15-25 раз. Теперь мы знаем, что это такое SSCC код на паллетах и каково его предназначение.
Польза от использования SSCC кодов
Внедрение нового уникального кодового значения позволяет улучшить товарообработку без привлечения дополнительного количества сотрудников. Благодаря тому, что эта кодовая информация наносится на третичную упаковку лекарственных средств каждый субъект рынка может с легкостью обращаться к конкретным транспортным единицам. Все участники фармрынка могут осуществлять работу со складом с использованием SSCC кода, наносимого на третичную упаковку. Его внедрение позволяет произвести блокировку, отбор конкретных паллет, ящиков, например, при фиксации брака или иных форс-мажорных обстоятельствах.

Генерируя соответствующие коды, холдинговая компания не только облегчает и упрощает складские мероприятия, но и улучшает взаимодействие между собственными различными подразделениями. Теперь инвентаризация одного паллета может осуществляться всего в одно сканирование без необходимости внесения соответствующих данных вручную.
Как генерируются SGTIN коды?
В соответствии с данными регулятора закона SGTIN содержит две группы, а именно сам код GTIN фармпродукции и индивидуальную серийную информацию. Первая состоит из 14-ти символов, а индивидуальный серийный номер из 13-ти символов. Все они используются для кодирования и занесения данных в единую базу. Для того чтобы получить соответствующий код, необходимо успешно пройти регистрацию на ГС1 РУС. После внесения описания товара выдается номер GTIN, затем происходит оформление заказа и оплата услуг Госзнаку за изготовление записи кода, далее Госзнак выдает и фиксирует у себя SGTIN. Все номера данных берутся обычно из базы фискальной службы.
При проверке инспектором фармацевтической компании сотрудник надзорной службы просканирует сначала все коды SGTIN, а затем запросит базу данных из ФНС и сравнит полученные данные. Несоответствие представленных сведений может привести к штрафным санкциям и даже приостановлению деятельности. Поэтому SGTIN необходимо получать через официальный ресурс ГС1 РУС.
Генерация SSCC кода в 1С

Следует отметить, что в качестве идентификатора в основном используют тринадцатизначный глобальный номер (GLN) или же девятизначный глобальный префикс (GS1). Порядковый номер логистической единицы присваивает производственное объединение-отправитель. Если при формировании кода соответствующего количества знаков не хватает, используются дополнительные буквы и цифры для порядкового номера.
На сегодняшний день сформировать SSCC код можно как с использованием инструментов 1С, так и с помощью различных бесплатных онлайн-сервисов. Мы рассмотрели, как формируется SSCC код в 1С. Он состоит из префикса (1 цифры), префикса компании GS1 (от 7 до 10 цифр), серийного номера (от 6 до 9 цифр) и контрольной цифры. Для того, чтобы получить корректный штрих-код SSCC, обычно необходимо ввести идентификатор приложения, префикс компании, серийный номер и контрольную цифру. Это позволит получить SSCC код для паллетов.
Внедрение соответствующего кода помогает упростить таможенные формальности, значительно ускоряет своевременность поставки фармацевтической продукции между различными странами. Сформированный SSCC код может содержать данные о количестве единиц товара, сроке годности, артикуле и иные сведения. С их помощью можно точнее отслеживать товары, они значительно облегчают работу с номенклатурной документацией.
Важные нюансы применения SSCC кода
Серийный код третичной упаковки содержит зашифрованную информацию для каждого участника поставки. При работе поставщик загружает коробы, формирует уникальные SSCC код и отправляет данные в единую систему. Однако внедрение данных идентификаторов приносит пользу только тогда, когда им пользуются все субъекты рынка с применением онлайн-ресурса. Если кто-то из участников не подключен к единой базе или же не имеет доступа к данным о логистической единице, это может значительно усложнять процедуру отслеживания движения продукции.
Следует отметить, что использовать в течение одного года один и тот же порядковый номер для двух разных логистических единиц регулятором закона запрещено. Дополнительно необходимо подчеркнуть, что если при форс-мажорных обстоятельствах паллет как-то пострадал и требуется переупаковка, то нужно будет создавать новый идентификатор. На сегодняшний день есть специализированные сервисы, используя которые можно получить соответствующие коды без каких-либо сложностей.
Маркировка товаров в фармотрасли: что нового
Остается менее полугода до официального запуска проекта обязательной маркировки лекарственных препаратов в РФ, и с каждым днем все больше участников рынка участвуют в эксперименте.
Они накапливают огромный опыт решения задач и обнаруживают подводные камни, с которыми в перспективе столкнется большинство фармпроизводителей. О некоторых из них, возникающих на разных этапах логистического процесса, рассказал Василий Савин, директор по консалтингу компании Utrace, партнера Navicon по внедрению систем маркировки.
Проблема 1. Упаковка SSCC
С начала эксперимента система мониторинга движения лекарственных препаратов (МДЛП) оперировала понятием SSCC – серийный код транспортной упаковки (serial shipping container code). Такой код предусмотрен в международном стандарте GS1 и согласуется со спецификой фармотрасли: вторичные упаковки лекарственных препаратов отгружаются с завода-изготовителя в стандартных заводских коробах на паллетах (прямоугольные поддоны, предназначенные для перевозки грузов). Кодировка при помощи SSCC коробов и паллет должна упростить публикацию сообщений о транспортируемом грузе в МДЛП.
В теории работа с SSCC не должна была доставить никаких проблем, тем более мировые лидеры в Track&Trace системах, Tracelink и SAP (в SAP ATTP), адаптировали к ней свои ИТ-продукты. Но на текущий момент отечественная система МДЛП – самая сложная система отслеживания лекарственных препаратов в мире. Одна из ее особенностей – необходимость подтверждения получение товара в МДЛП. Для этого на складах требуется отсканировать SSCC-код каждой принятой паллеты, причем неважно, по прямой схеме акцептования, или по обратной – сканировать все равно нужно.
На этом этапе оказалось, что код на паллетах не один: многие отечественные и международные транспортные компании используют штрихкодирование грузов для идентификации компании-отправителя. В результате сотрудник приемки склада нередко попросту не знает, какой штрих-код ему сканировать для МДЛП. И если по прямой схеме акцептования из системы мониторинга хотя бы приходит перечень плановых SSCC и кладовщик может найти этот код визуально, то в случае обратного акцепта не приходит ничего. В результате кладовщик, случайно отсканировав не тот код, оказывается в ситуации, когда МДЛП по неизвестной ему причине отказывается принимать сообщение о приемке товара. И это еще не все: при импортной обратной схеме акцептования держатель регистрационного удостоверения даже не знает, что у импортера возникли какие-то сложности. В результате поставка останавливается, а импортеру приходится методом перебора каждого штрих-кода пытаться опубликовать данные в МДЛП. Очевидно, такой процесс негативно влияет на скорость и качество бизнес-процессов и, как следствие, на показатели компании. Отдельный вопрос, на который пока нет ответа, – кто в этом случае нарушил срок публикации данных в МДЛП, и с кого можно взыскать штраф.
Решение
Одно из решений этой проблемы – создание специализированных этикеток с кодами SSCC, на которых была бы надпись «Для МДЛП», или же использование для них цветного фона вместо белого, чтобы визуально отделить SSCC, зарегистрированный в МДЛП, от других. Однако это потребует дополнительных бюджетов и долгих процессов согласований и стандартизации новой нормы: если каждый производитель будет маркировать штрих-код для МДЛП собственным цветом, неразбериха только вырастет.
Проблема 2. Складская логистика для МДЛП
После приемки паллеты на складе начинаются трудности, связанные с хранением продуктов. Чтобы полностью отследить продукцию, логистическому оператору или производителю важно сначала зафиксировать факт получения товара, а затем – его агрегации для дальнейшей транспортировки или «оседания» на складах. Обычно используется один из следующих подходов для отражений агрегаций и де-агрегаций в процессе хранения:
Решение
Каждый из подходов к формированию агрегационных сообщений опробован на практике и имеет право на существование. Выбор всегда остается за фармацевтической компанией, которая руководствуется принятыми бизнес-процессами и выбранной стратегией маркировки.
Проблема 3. Отгрузка товаров
Сложности с транспортной упаковкой возникают и при отгрузке товаров. Например, при самовывозе продукта с холодным температурным режимом клиенты часто присылают грузовик без холодильника, но с термокоробами. И если товар на складе был агрегирован до паллеты, экспедитор физически не может уместить полную паллету в термокороб – не хватит объема. Тогда он рвет упаковку SSCC, теряя при этом как зарегистрированный номер, так и целостность самой паллеты. Однако и зарегистрировать де-агрегацию в момент погрузки товара в машину у экспедитора не получится. В результате на склад клиента товар прибывает в термокоробах, а в МДЛП эта поставка все еще оформлена в паллетах.
Отдельная проблема – отклейка или загрязнение SSCC-кода паллеты при транспортировке. В таком случае понять, какой номер SSCC был у паллеты, можно только методом исключения: нужно сравнивать уведомления о поставке из МДЛП и фактически принятые паллеты. Отдельно стоит упомянуть отгрузку товаров в аптечные сети: небольшие аптеки заказывают лекарственные препараты в штуках и, получая товар в коробах с SSCC-номером, не могут подтвердить приемку без вскрытия короба.
Решение
Если при транспортировке товара используются возвратные термокороба, то холодный товар вообще не нужно агрегировать до паллет и отгружать заводскими упаковками. А если термокороба невозвратные, то можно рассматривать их как еще один уровень агрегации и упаковывать именно в термокороба уже в процессе комплектации, присваивая каждому из них свой SSCC.
В целом, конечно, стоит также начать более активное обсуждение, в каких агрегационных единицах оформлять отгрузки между участниками фармацевтического рынка, чтобы соблюсти интересы всех сторон. На рынке сейчас наблюдается тенденция, когда производителям удобно оперировать в паллетах, дистрибуторам в заводских коробах и заводских паллетах, а аптекам в штуках, и это серьезно усложняет процесс маркировки. Сейчас дискуссии о едином стандарте ведутся, но пока не приходят ни к какому более-менее адекватному выводу. И это проблема, с которой производителям и регуляторным инстанциям придется столкнуться уже в ближайший год.
Итак, каждая фармацевтическая компания готовится к 2020 г. по-своему: кто-то формирует большой safetystock, запасы растаможенной немаркированной продукции, кто-то переносит производство на российские СМО. Но одно остается неизменным практически для всех: большинство компаний пересматривает свои бизнес-процессы в сторону упрощения, согласуя их с возможностями ИТ-системы для маркировки продукции. В этот период времени гибкость выбранного Track&Trace решения выходит на первый план. Особую важность приобретают: возможность публикации данных из разных личных кабинетов МДЛП; автоматическое формирование логических документов; охват публикуемых сообщений, а также хранение всей истории движения товара. Все это нужно для того, чтобы получить ценность от анализа информации о продуктах в будущем.
Код транспортной упаковки (SSCC)
Серийный код транспортной упаковки (SSCC)
Серийный код транспортной упаковки может использоваться для идентификации логистических единиц, которые могут быть, в свою очередь, любой комбинацией предметов торговли, упакованных вместе, для транспортировки и/или хранения (например, паллета).
Кто должен формировать SSCC
Согласно Постановления Правительства РФ от 5 июля 2019 г. № 860, часть VII, а именно: «Код идентификации транспортной упаковки обувных товаров представляется в виде одномерного штрихового кода, соответствующего международному стандарту GS1-128. Состав кода идентификации транспортной упаковки обувных товаров определяется участником оборота обувных товаров, осуществляющим агрегацию обувных товаров в транспортную упаковку.», коды транспортных упаковок SSCC нужно делать их самостоятельно, а не заказывать в Честном знаке.
Что должно содержаться в SSCC
Создание SSCC регламентируется компанией GS1.
Структура этого кода, следующая:
Идентификатор применения (00) показывает, что поле данных содержит номер SSCC.
Пример кода SSCC
Пример кода транспортной упаковки для компании с префиксом GLN 460123456:
(00) 0 460123456 0000001 0
Затем всё это кодируется в штрихкод формата GS1-128 (раньше назывался EAN-128):
Пример генерации SSCC можно посмотреть в публикации по ссылке.
Что такое sscc в маркировке лекарственных средств
Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу выдаются удостоверения установленного образца.
Программа разработана совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.

Методические рекомендации по работе с маркированными лекарственными препаратами. Версия 1.1
История изменений
1. Термины и сокращения
2. Назначение документа
| Любые физические действия, осуществляемые с лекарственными препаратами субъектами обращения лекарственных средств на всех этапах товаропроводящей цепи, должны быть отражены в ФГИС МДЛП. |
|---|
3. Общая информация
3.1. Описание кода DataMatrix. Нанесение на упаковку. Считывание кода
Код DataMatrix в общем случае представляет собой двумерный матричный штрихкод, представляющий собой чёрно-белые элементы или элементы нескольких различных степеней яркости, обычно в форме квадрата, размещённые в прямоугольной или квадратной группе. Матричный штрихкод предназначен для кодирования текста или данных других типов.
Код DataMatrix лекарственного препарата содержит в себе криптозащищенный код маркировки и визуально представляет собой двухмерный матричный код, разделенный на 4 одинаковые зоны.
Отличительными чертами кода DataMatrix от привычного QR-кода является отсутствие 3-х квадратов по углам изображения и наличие L-линии по правой и нижней границам. Пример для сравнения представлен на рисунке (Рисунок 1).
Код DataMatrix, нанесенный на упаковку лекарственного препарата имеет размерность 36х36 модулей и содержит в себе информацию об коде маркировки лекарственного препарата, и включает 4 группы данных:
Важно помнить, что на рынке могут встречаться лекарственные препараты имеющие на своей упаковке различные виды кодов DataMatrix, нанесенные до ввода обязательной маркировки лекарственных препаратов.
Такими кодам DataMatrix могут быть:
— коды маркировки других стран (без криптозащиты);
— коды Data Matrix, содержащие коды маркировки Российской Федерации, но выпущенные в момент проведения эксперимента по маркировке лекарственных препаратов средствами идентификации, проводимого с 1 февраля 2017 г. по 31 декабря 2019 г.:
— другие коды DataMatrix, наносимые производителями в маркетинговых и иных целях.
3.2. Примеры кодов DataMatrix и их основные отличия
— DataMatrix без криптозащиты имеет размерность 26х26 модулей (Рисунок 2) и менее и не имеет разделения на 4 зоны (другие страны и DataMatrix, наносимые в маркетинговых целях).
— DataMatrix с криптозащитой 88 символов имеет размерность 44х44 модуля (Рисунок 3) и более (лекарственные препараты с такими кодами выпускались в рамках эксперимента по маркировке лекарственных препаратов с 1 февраля 2017 г. по 31 декабря 2019 г.).
Лекарственные препараты с такими кодами могут беспрепятственно обращаться на рынке до истечения их срока годности.
Статус кода маркировки можно определить посредством сканирования кода DataMatrix мобильным приложением «Честный знак» или формированием запроса в систему ФГИС МДЛП.
Используя код DataMatrix, субъект обращения лекарственных средств в рамках осуществления операций с лекарственными препаратами имеет возможность осуществлять приемку, перемещение и передачу лекарственных препаратов, вывод из оборота и другие операции с лекарственными препаратами для медицинского применения, обеспечивая прослеживаемость движения лекарственного препарата по всей товаропроводящей цепи. Подробнее о процессах приема-передачи товара участниками оборота описано в разделе: Процессы движения товара между контрагентами.
3.3. Описание кода SSCC. Нанесение на упаковку. Считывание кода
Код SSCC наносится производителем или поставщиком лекарственных препаратов на транспортную упаковку. Транспортной упаковкой может служить заводской короб или паллета.
Используя код SSCC, участник оборота товаров имеет возможность осуществлять приемку и передачу лекарственных препаратов, в рамках взаимодействия с другими контрагентами. Подробнее о процессах приема-передачи товара участниками оборота описано в разделе: Процессы движения товара между контрагентами.
Описание процессов агрегирования (объединения) и разагрегирования (расформирования) транспортной упаковки представлено в следующем разделе.
При нанесении субъектом обращения лекарственных средств кода SSCC на транспортную упаковку (короб и (или) паллету) для удобства его последующего поиска другими субъектами обращения лекарственных средств, рекомендуется помечать наклейку с кодом SSCC дополнительным идентификатором (например, изображением кода DataMatrix) или текстом («Маркировка» или «МДЛП»).
Для снижения времени поиска и удобства считывания на короб (паллету) рекомендуется наносить две этикетки с кодом SSCC на соседние вертикальные стороны. Помещать короб на паллете следует так, чтобы код SSCC располагался на наружной стороне, допуская его считывание.
Также, во избежание совершения ошибок при считывании, не рекомендуется наносить другие виды логистических кодов, на те же стенки короба (паллеты), что и коды SSCC или в их непосредственной близости.
3.4. Агрегирование и разагрегирование транспортной упаковки
Агрегирование предполагает возможность наличия любого уровня вложенности упаковок:
Агрегирование может выполняться субъектом обращения лекарственных средств на различных этапах производственного цикла и оборота лекарственных препаратов.
Для агрегирования участнику оборота необходимо выполнить следующие действия:
1. Удостовериться в том, что упаковки лекарственных препаратов, содержащие уникальные идентификаторы SGTIN, которые участник оборота планирует агрегировать, находятся по данным ФГИС МДЛП у него на балансе.
2. Агрегировать упаковки лекарственных препаратов в транспортную упаковку и зарегистрировать в ФГИС МДЛП сведения об агрегировании упаковок лекарственных препаратов в третичную (транспортную) упаковку (схема 911*(1) логической модели файлов обмена ФГИС МДЛП), используя для передачи информации документ в формате xml. В поле «SSCC» xml-документа должен быть указан код SSCC транспортной упаковки. В поле «SGTIN» xml-документа необходимо перечислить все уникальные идентификаторы упаковок лекарственных препаратов, которые были агрегированы в транспортную упаковку.
3. Агрегировать во множество транспортных упаковок и зарегистрировать в ФГИС МДЛП сведения об агрегировании во множество третичных (транспортных) упаковок (схема 915 логической модели файлов обмена ФГИС МДЛП), используя для передачи информации документ в формате xml. В поле «SSCC» xml-документа необходимо указать коды SSCC всех транспортных упаковок. В поле «SGTIN» xml-документа необходимо перечислить все уникальные идентификаторы упаковок лекарственных препаратов, которые были агрегированы в каждую транспортную упаковку.
4. Для агрегирования третичной упаковки первого уровня в третичную упаковку второго уровня и выше необходимо произвести аналогичные действия с указанием перечня агрегируемых упаковок SSCC.
Допускается дополнительное вложение потребительских упаковок лекарственных препаратов в третичную упаковку. Данная операция применяется как в случае доукомплектования третичной упаковки вторичными (потребительскими) и третичными упаковками лекарственных препаратов, так и в случае перемещения упаковок лекарственного препарата из одной третичной упаковки в другую.
Вложение упаковки лекарственного препарата может выполняться субъектом обращения лекарственных средств на различных этапах оборота лекарственных препаратов.
Для дополнительного вложения упаковок участнику оборота необходимо выполнить следующие действия:
1. Удостовериться в том, что упаковки лекарственных препаратов, содержащие уникальные идентификаторы SGTIN, которые участник оборота планирует вложить в транспортную упаковку, находятся по данным ФГИС МДЛП у него на балансе.
2. Доукомплектовать транспортную упаковку и зарегистрировать в ФГИС МДЛП сведения о дополнительном вложении упаковок в третичную (транспортную) упаковку (схема 914 логической модели файлов обмена ФГИС МДЛП), используя для передачи информации документ в формате xml. В поле «SSCC» xml-документа необходимо указать коды SSCC транспортной упаковки, в которую произошло вложение. В поле «SGTIN» xml-документа необходимо перечислить все уникальные идентификаторы упаковок лекарственных препаратов, которые были вложены в транспортную упаковку.
3. Для добавления третичной упаковки первого уровня в третичную упаковку второго уровня и выше необходимо произвести аналогичные действия с указанием перечня упаковок SSCC.
Изъятие упаковок лекарственных препаратов из третичной упаковки может выполняться субъектом обращения лекарственных средств на различных этапах оборота лекарственных препаратов.
Для изъятия упаковок лекарственных препаратов участнику оборота необходимо выполнить следующие действия:
1. Удостовериться в том, упаковки лекарственных препаратов, содержащие уникальные идентификаторы SGTIN, которые участник оборота планирует изъять из транспортной упаковки, находятся по данным ФГИС МДЛП у него на балансе.
2. Изъять упаковки лекарственных препаратов из транспортной упаковки и зарегистрировать в ФГИС МДЛП сведения об изъятии (схема 913 логической модели файлов обмена ФГИС МДЛП), используя для передачи информации документ в формате xml. В поле «SGTIN» xml-документа необходимо перечислить все уникальные идентификаторы упаковок лекарственных препаратов, которые были изъяты из транспортной упаковки.
3. Для изъятия третичной упаковки первого уровня из третичной упаковки второго уровня необходимо произвести аналогичные действия с указанием упаковки вышестоящей SSCC.
При наличии нескольких уровней вложенности транспортной упаковки изъятие упаковок ЛП необходимо осуществлять последовательно, для каждого из уровней, отражая каждую операцию в ФГИС МДЛП.
Запрещается отправлять в ФГИС МДЛП информацию об извлечении упаковок разной степени вложенности, используя один и тот же xml-документ, (например, xml-документ, содержащий объединенную информацию об упаковках лекарственных препаратов, извлекаемых из коробки и паллеты).
В рамках выполнения одной операции нельзя извлекать SGTIN из разных групповых упаковок одного уровня, т.е. нельзя изъять SGTIN 1 из короба 1 и SGTIN 2 из короба 2 одной операцией.
Расформирование (уничтожение) третичных упаковок может выполняться участником оборота на различных этапах оборота товара.
Для расформирования транспортных упаковок участнику оборота необходимо выполнить следующие действия:
1. Удостовериться в том, что упаковки лекарственных препаратов, содержащие уникальные идентификаторы SGTIN, и помещенные в транспортную упаковку, которую участник оборота планирует расформировать, находятся по данным ФГИС МДЛП у него на балансе.
2. Расформировать третичную упаковку и зарегистрировать в ФГИС МДЛП сведения о расформировании (схема 912 логической модели файлов обмена ФГИС МДЛП), используя для передачи информации документ в формате xml. В поле «SSCC» xml-документа необходимо указать код SSCC транспортной упаковки, которую требуется разагрегировать.
При наличии нескольких уровней вложенности транспортной упаковки допускается осуществлять расформирование от вышестоящего уровня к нижестоящему, отражая операцию для каждого из уровней в ФГИС МДЛП или, указав соответствующий тип расформирования в схеме 912 логической модели файлов обмена ФГИС МДЛП, сразу расформировать паллету до вторичной упаковки.
После успешного расформирования третичной упаковки ее номер (код SSCC) становится «свободным», то есть доступным для последующего использования.
| После операции расформирования получить информацию о содержимом третичной упаковки с использованием SSCC кода становится невозможным. |
|---|
В случае необходимости проверки содержимого третичной упаковки необходимо использовать схему 210 логической модели файлов обмена ФГИС МДЛП. Xml-документ, направленный по данной схеме в ФГИС МДЛП, позволяет получить подробную информацию о SGTIN или SSCC. По результатам успешной обработки запроса, ФГИС МДЛП возвращает участнику оборота xml-документ с ответом о результатах обработки сведений по запрашиваемому SGTIN/SSCC, подготовленный по схеме 211 логической модели файлов обмена ФГИС МДЛП.
Сроки передачи информации в ФГИС МДЛП: при расформировании третичной упаковки лекарственного препарата, изъятии лекарственных препаратов из третичной (транспортной) упаковки лекарственного препарата, дополнительном вложении лекарственных препаратов в третичную (транспортную) упаковку лекарственного препарата для лекарственных препаратов, находящихся на территории Российской Федерации, в течение 5 рабочих дней
или для лекарственных препаратов, находящихся за пределами территории Российской Федерации, в течение 20 рабочих дней с даты соответствующей операции с лекарственными препаратами или третичной (транспортной) упаковкой лекарственного препарата.
3.5. Товарно-учетные системы участников оборота
По результатам доработки ТУС в части реализации интеграционного взаимодействия с ФГИС МДЛП участник оборота имеет возможность подать заявку на прохождение тестирования. Заявка подается в произвольной форме и носит уведомительный характер.
Тестирование интеграционного взаимодействия проводится на тестовом контуре ФГИС МДЛП и осуществляется участником оборота самостоятельно, либо с привлечением поставщика ИТ-услуг участника оборота.
Факт успешного тестирования интеграционного взаимодействия подтверждается самостоятельным проведением приемо-сдаточных испытаний участником оборота с использованием рекомендованного ООО «Оператор-ЦРПТ» чек-листа, опубликованного на сайте ЧестныйЗнак.
3.6. Оборудование для работы с ФГИС МДЛП
Для работы с маркированными лекарственными препаратами необходимо использовать следующее оборудование:
— для осуществления приемки и розничной продажи лекарственных препаратов должен использоваться 2D сканер штрих-кодов;
— для вывода из оборота лекарственных препаратов в рамках отпуска по льготному рецепту или для медицинского применения должен использоваться регистратор выбытия*(2).
3.6.1. Описание 2D сканера штрихкодов
2D-сканер приобретается участником оборота самостоятельно. Перечень протестированных устройств размещен в разделе «Проверка сканера» на сайте «Честный Знак».
При наличии сканера у участника оборота, его работоспособность необходимо проверить на предмет корректного считывания кода маркировки. Соответствующая инструкция размещена в разделе «Проверка сканера» на сайте «Честный Знак».
3.6.2. Описание регистратора выбытия
Регистратор выбытия применяется в следующих процессах вывода из оборота лекарственных препаратов:
— при отпуске ЛП по льготному рецепту в аптечной организации;
— при отпуске ЛП для оказания медицинской помощи в медицинских организациях.
Важно! При осуществлении розничной продажи лекарственных препаратов регистратор выбытия не требуется.
Регистратор выбытия поставляется в двух вариантах исполнения (Рисунок 7), при этом техническое и функциональное наполнение устройств идентично.
3.6.2.1. Возможные режимы работы регистратора выбытия:
Взаимодействие пользователя (сотрудника организации) и товарно-учетной системы организации в части работы с регистратором выбытия может быть реализовано, в том числе и с использованием веб-клиента (веб-браузера).
Решение о применении технологии использования веб-клиента принимается организацией самостоятельно.
Ссылка на раздел сайта, в котором содержится вся необходимая информация о режимах работы и способах подключения регистраторов выбытия: https://честныйзнак.рф/business/projects/medicines/retirement_recorders/.
Интеграция устройства с ТУС осуществляется субъектом обращения лекарственных средств самостоятельно либо с привлечением поставщика ИТ-услуг. При разработке интеграционного взаимодействия необходимо руководствоваться технической документацией, размещенной на сайте ЧестныйЗнак, в разделе «Выдержка из технической спецификации на поставку регистратора выбытия».
Руководства пользователя к устройству размещены в разделе «Регистраторы выбытия» на сайте «Честный Знак».
3.6.2.2. Обеспечение участником регистратором выбытия
Устройство предоставляется оператором системы мониторинга на основании типового договора по представлению регистратора выбытия лекарственных препаратов субъектам обращения лекарственных средств на безвозмездной основе, форма которого утверждена приказом Минпромторга России от 13.08.2019 N 2973.
Инструкция по получению регистратора выбытия приведена в Приложении 2 настоящих методических рекомендаций.
4. Процессы движения товара между контрагентами
4.1. Прямая и обратные схемы акцептования
В рамках гражданско-правовых отношений между контрагентами допускается использование одного из следующих вариантов поставки лекарственных препаратов:
1. Прямой порядок акцептования, при котором в ФГИС МДЛП отправителем регистрируются сведения об отгрузке покупателю лекарственных препаратов, а получателем осуществляется подтверждение в ФГИС МДЛП зарегистрированных отправителем сведений об отгрузке лекарственных препаратов.
2. Обратный порядок акцептования, при котором в ФГИС МДЛП получателем регистрируются сведения о приемке лекарственных препаратов на склад, а отправителем осуществляется подтверждение сведений о приемке на склад покупателя.
Регистрация в ФГИС МДЛП сведений о приемке лекарственных препаратов может осуществляться как вручную, так и с использованием товарно-учетных систем участников, интегрированных с ФГИС МДЛП.
При прямом порядке акцептования получателю лекарственных препаратов в случае отсутствия ТУС необходимо:
1. Отсканировать поступившие вторичные или третичные упаковки (в случае, если вторичные упаковки вложены в третичную), при помощи 2D сканера или терминала сбора данных. В случае отсутствия сканера следует внести вручную человеко-читаемую информацию о SGTIN и серийном номере, нанесенных на упаковку лекарственного препарата и\или SSCC, нанесенный на короб или паллету, в xml-документ, и затем загрузить его в ФГИС МДЛП с использованием Личного кабинета участника оборота.
3. При отсутствии расхождений и претензий к поставленному товару, осуществить приёмку лекарственных препаратов и зарегистрировать в ФГИС МДЛП сведения о принятом товаре, используя для передачи информации документ в формате xml, с помощью Личного кабинета участника оборота (схема 701 логической модели файлов обмена ФГИС МДЛП). В xml-документе необходимо указать идентификаторы мест деятельности отправителя и получателя, а также отсканированные коды SGTIN или SSCC, согласно пункту 1.
При обратном порядке акцептования получателю лекарственных препаратов в случае отсутствия ТУС необходимо:
1. Отсканировать поступившие вторичные или третичные упаковки (в случае, если вторичные упаковки вложены в третичную), при помощи 2D сканера или терминала сбора данных. В случае отсутствия сканера следует внести вручную человеко-читаемую информацию о SGTIN и серийном номере, нанесенных на упаковку лекарственного препарата и\или SSCC, нанесенный на короб или паллету, в xml-документ, и затем загрузить его в ФГИС МДЛП с использованием Личного кабинета участника оборота.
2. Пройти авторизацию в Личном кабинете участника оборота, перейти в раздел «Реестр документов» и осуществить загрузку xml-документа, содержащего сведения о SGTIN поступивших упаковок лекарственных препаратов и\или SSCC (схема 416 логической модели файлов обмена ФГИС МДЛП).
3. Дождаться от поставщика лекарственных препаратов уведомления, подтверждающего факт отгрузки лекарственных препаратов (схема 607 логической модели файлов обмена ФГИС МДЛП).
При наличии товарно-учетной системы, интегрированной с ФГИС МДПЛ, для выполнения операций акцептования лекарственных препаратов необходимо обратится к руководству пользователя системы, разработанному поставщиком ИТ-услуг для субъекта обращения лекарственных средств.
В рамках оборота лекарственных препаратов между контрагентами допускается отмена следующих операций:
Для удобства пользования в ФГИС МДЛП предусмотрена возможность регистрации сведений о частичном приеме лекарственных препаратов. Для этого получателю необходимо отразить в соответствующих полях «SSCC» или «SGTIN» xml-документа только те сведения, которые соответствуют фактически принятым упаковкам лекарственных препаратов (схема 701 логической модели файлов обмена ФГИС МДЛП).
Например, в случае получения от поставщика xml-документа с указанием кодов SSCC для короба N 1 и короба N 2 (схема 415 логической модели файлов обмена ФГИС МДЛП), получатель в ответ может сформировать xml-документ, содержащий информацию о приемке короба N 1 и отказе от приемки короба N 2 (схема 252 логической модели файлов обмена ФГИС МДЛП).
Также допускаются варианты регистрации в ФГИС МДЛП сведений о частичном отказе от приемки упаковок лекарственных препаратов, в том случае если в составе поставки получены лекарственные препараты, агрегированные в короб, и лекарственные препараты, в отношение которых агрегация не применялась. В данном случае участник оборота также вправе сформировать отказ от приема части неагрегированных лекарственных препаратов, сформировав и отправив в ФГИС МДЛП соответствующий xml-документ.
Допускаются сценарии отгрузки лекарственных препаратов от поставщика получателю, при которой покупателем выступает третья сторона (т.е. данной организации (ИП) переходит право собственности). В данном случае в ФГИС МДЛП регистрируется только операция передачи от поставщика фактическому грузополучателю лекарственных препаратов. Операция передачи права собственности от грузополучателя к юридическому владельцу при этом не регистрируется.
При осуществлении процедур приема-передачи лекарственных препаратов передача сведений во ФГИС МДЛП производится участниками на основании одного типа документа (товарная накладная ТОРГ-12), с указанием номера и даты накладной.
Регистрация в ФГИС МДЛП сведений об акцептовании лекарственных препаратов осуществляется в соответствии регламентными сроками, определенными постановлением Правительства РФ от 14 декабря 2018 г. N 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения». Регистрация сведений об акцептовании поставки должна осуществляться субъектом обращения вне зависимости от текущего статуса подписания сопроводительных финансовых документов поставки (товарные накладные, универсальные передаточные документы) субъектами обращения лекарственных средств.
4.2. Перемещение между местами деятельности участника оборота
ФГИС МДЛП обеспечивает возможность регистрации сведений о перемещении лекарственных препаратов между различными местами осуществления деятельности (согласно лицензии) внутри субъекта обращения лекарственных средств без перехода права собственности, а также перемещение с места осуществления деятельности на место ответственного хранения и обратно.
Для отражения в ФГИС МДЛП факта перемещения лекарственных препаратов необходимо выполнить следующие действия:
1. Удостовериться в том, упаковки лекарственных препаратов, содержащие уникальные идентификаторы SGTIN, которые участник оборота планирует переместить в другое место осуществления деятельности, находятся по данным ФГИС МДЛП у него на балансе.
2. Субъектом обращения лекарственных средств в Личном кабинете ФГИС МДЛП должно быть зарегистрировано минимум 2 места осуществления деятельности.
3. Осуществить перемещение лекарственных препаратов и зарегистрировать в ФГИС МДЛП сведения о перемещении (схема 431 логической модели файлов обмена ФГИС МДЛП), используя для передачи информации документ в формате xml. В полях «SSCC» и «SGTIN» xml-документа необходимо указать все коды и уникальные идентификаторы упаковок лекарственных препаратов, которые были перемещены на другое место деятельности.
Сведения о внутреннем перемещении лекарственных препаратов между адресами мест осуществления деятельности согласно лицензии (с учетом таких видов деятельности, как производство лекарственных средств и фармацевтическая деятельность) регистрируется в ФГИС МДЛП в течение 5 рабочих дней с фактической даты перемещения лекарственных препаратов до представления сведений о дальнейших операциях с такими лекарственными препаратами.
5. Вывод лекарственных препаратов из оборота
Сроки передачи информации в ФГИС МДЛП: Субъект обращения лекарственных средств, осуществляющий вывод из оборота лекарственных препаратов (за исключением вывода из оборота лекарственных препаратов путем отбора образцов, вывоза ранее ввезенных в Российскую Федерации лекарственных препаратов или передачи на уничтожение), в течение 5 рабочих дней с даты соответствующей операции представляет в систему мониторинга сведения.
В ФГИС МДЛП реализованы следующие виды вывода лекарственных препаратов из оборота:
— льготный отпуск лекарственных препаратов;
— вывод из оборота для оказания медицинской помощи;
— вывод из оборота по иным причинам.
5.1. Розничная продажа лекарственных препаратов
Для вывода из оборота лекарственных препаратов в рамках розничной продажи участник оборота должен иметь актуальное кассовое программное обеспечение, ККТ и сканер, обеспечивающий считывание 2D кода маркировки.
Кассовое программное обеспечение дорабатывается поставщиком ИТ-услуг в соответствии с требованиями к маркировке лекарственных препаратов. При отсутствии сканера, способного считывать 2D код, участнику оборота необходимо его приобрести за собственный счет. С перечнем протестированного оборудования можно ознакомиться на сайте «Честный Знак».
ОФД, на безвозмездной основе, обеспечивает передачу сведений в ФГИС МДЛП о выводе из оборота лекарственных препаратов участником оборота. Процесс передачи сведений состоит из следующих шагов:
1. При осуществлении расчёта с покупателем формируется кассовый чек и фискальный документ.
3. После подтверждения операции в ФНС, документ передается из ОФД в ФГИС МДЛП (схема 10511 логической модели файлов обмена ФГИС МДЛП).
При отсутствии сведений о выбытии в Личном кабинете участника оборота, в первую очередь, рекомендуется проверить наличие кассового чека в Личном кабинете ОФД (при наличии). В случае отсутствия такой возможности участнику оборота необходимо обратиться в службу технической поддержки ФГИС МДЛП.
Последовательность выполнения действий сотрудника аптечной организации при розничной продаже лекарственного препарата:
1. Получить запрос от пациента.
2. Осуществить фармацевтическое консультирование.
3. Подобрать необходимые лекарственные препараты.
4. Получить согласие пациента на приобретение лекарственных препаратов.
5. Поочерёдно считать коды маркировки DataMatrix 2D-сканером с каждой упаковки лекарственных препаратов.
6. Удостовериться, что коды маркировки считались корректно.
7. Получить оплату за лекарственный препарат и пробить кассовый чек.
8. Выдать пациенту лекарственный препарат, сдачу (при необходимости) и кассовый чек.
В рамках розничной продажи допускается отпуск доли из разукомплектованной упаковки лекарственного препарата, т.е. частичное выбытие вторичной упаковки. Вторичная упаковка лекарственного препарата должна сохраняться до момента отпуска последней доли вторичной упаковки. Для осуществления частичного выбытия в кассовом программном обеспечении субъекта обращения лекарственных средств необходимо ввести количество проданных первичных упаковок и общее количество первичных упаковок во вторичной упаковке. Кассовое ПО должно обеспечивать проверку количества ранее выведенных из оборота долей и блокировать выбытие «излишков», выводя соответствующее уведомление.
В случае обнаружения попытки осуществить вывод из оборота «излишка» ФГИС МДЛП осуществит вывод лекарственного препарата из оборота, при этом будет зафиксировано нарушение, и соответствующая информация будет направлена в надзорный орган (Росздравнадзор).
В случае отпуска лекарственных препаратов физическому лицу, застрахованному в рамках добровольного медицинского страхования, сведения в ФГИС МДЛП подаются участником оборота по схеме 511 логической модели файлов обмена ФГИС МДЛП» с указанием «нулевой» цены упаковки, а также указание в схеме вида документа (бланка строгой отчетности или «прочее»). Дополнительных сведений в ФГИС МДЛП субъектом обращения лекарственных средств не подается.
Субъекты обращения лекарственных средств, занимающиеся розничной продажей лекарственных препаратов, могут осуществлять отпуск лекарственных препаратов только физическим лицам с использованием контрольно-кассовой техники.
Розничный продавец лекарственных препаратов, не имея лицензию на фармацевтическую деятельность с указанием вида работ (услуг) «Оптовая торговля лекарственными средствами для медицинского применения», не вправе осуществлять оптовую торговлю лекарственными средствами.
Для участников оборотов не допускается приобретение лекарственных препаратов у аптечных организаций и дистрибьюторов, которые не имеют лицензии на оптовую продажу.
Дополнительные разъяснения, касающиеся реализации лекарственных препаратов, приведены в письме Росздравнадзора от 16.01.2020 N 01и-71/20 «О розничной и оптовой торговле лекарственными препаратами»*(3).
В ситуациях, когда маркированный лекарственный препарат был «пробит» на кассе в аптеке, но, по тем или иным причинам не был отпущен покупателю (отказ по инициативе покупателя, отсутствие необходимой суммы денежных средств на оплату и т.д.), такой чек не закрывается и должен быть аннулирован посредством штатного кассового программного обеспечения. Информация, содержащаяся в таком чеке, в ОФД не передается и соответственно, сведения о выводе лекарственного препарата из оборота в ФГИС МДЛП не фиксируются. В случае аннулирования кассового чека информация о таком лекарственном препарате в ФГИС МДЛП сохраняется в статусе «В обороте». Дополнительных действий участнику оборота совершать не требуется.
Важно! В переходный период до старта обязательной маркировки лекарственных препаратов с 1 июля 2020 года, при осуществлении розничной продажи лекарственных препаратов (за исключением лекарственных препаратов, относящихся к категории 7ВЗН), считывание кода маркировки и регистрации операции вывода из оборота в ФГИС МДЛП не является обязательной процедурой. При этом регулятор в лице Росздравнадзора и Оператор системы маркировки, в целях тестирования товаропроводящей цепи и обеспечения готовности субъектов обращения лекарственных средств к старту обязательной маркировки, рекомендует фиксировать все операции, совершаемые с лекарственными препаратами в ФГИС МДЛП, согласно действующим бизнес-процессам.
5.2. Льготный отпуск лекарственных препаратов
В ФГИС МДЛП реализованы следующие виды льготного отпуска лекарственных препаратов:
— вывод из оборота по 100% льготе;
— вывод из оборота по льготе со скидкой.
5.2.1. Вывод из оборота по 100% льготе
Также допускается отпуск лекарственных препаратов по 100% льготе через ККТ с передачей документа, подготовленного по схеме 10511 в ФГИС МДЛП посредством указания цены за единицу «0 руб.». Исключением является отпуск лекарственных препаратов, осуществляемый в рамках договора комиссии между аптечной организацией и уполномоченной фармацевтической организацией. В данном случае отпуск должен осуществляться с использованием регистратора выбытия.
Алгоритм действий сотрудника аптечной организации
1. Получатель ЛП предоставляет сотруднику (первостольнику) льготный рецепт.
2. Сотрудник подбирает препараты в соответствии с полученным рецептом, при этом сканирует коды маркировки на них. Важно: отсканирована должна быть каждая упаковка. При повторном сканировании упаковки регистратор выбытия не добавит ее в список для вывода из оборота, а сообщит пользователю об ошибочном сканировании.
3. Сотрудник вводит дату, серию и номер рецепта (на регистраторе выбытия или в товарно-учетной системе) и выбирает действие «Зарегистрировать выбытие». После появления на дисплее регистратора выбытия сообщения о том, что запрос отправлен, выдает ЛП получателю. Важно: ожидать ответ ФГИС МДЛП о результатах попытки вывода ЛП из оборота в момент отпуска ЛП не нужно.
4. В случае частичного выбытия вторичной упаковки из оборота, соответствующая информация о количестве долей лекарственного препарата указывается в регистраторе выбытия или в товаро-учетной системе участника. При этом вторичная упаковка сохраняется до момента выбытия последней первичной упаковки.
5.2.2. Вывод из оборота по льготе со скидкой
Отпуск лекарственного препарата с частичным дотированием осуществляется через контрольно-кассовую технику, с передачей в ФГИС МДЛП соответствующего xml-документа (схема 10511 логической модели файлов обмена ФГИС МДЛП).
В рамках льготного отпуска допускается частичное выбытие лекарственного препарата. Для осуществления частичного выбытия через кассовое программное обеспечение субъекта обращения лекарственных средств необходимо ввести долю упаковки лекарственного препарата. Кассовое программное обеспечение должно обеспечивать проверку количества ранее выведенных из оборота долей и блокировать выбытие «излишков», выводя соответствующее уведомление. Вторичная упаковка ЛП сохраняется до момента выбытия последней доли вторичной упаковки.
В случае обнаружения попытки осуществить вывод из оборота «излишка», ФГИС МДЛП осуществит вывод лекарственного препарата из оборота, при этом будет зафиксировано нарушение, и соответствующая информация будет направлена в надзорный орган (Росздравнадзор).
Алгоритм действий сотрудника аптечной организации
1. Получатель лекарственного препарата предоставляет сотруднику аптечной организации льготный рецепт.
2. Сотрудник подбирает препараты в соответствии с полученным рецептом, при этом сканирует коды маркировки DataMatrix на них.
Важно: отсканирована должна быть каждая упаковка. При повторном сканировании упаковки регистратор выбытия не добавит ее в список для вывода из оборота, а сообщит пользователю об ошибочном сканировании.
3. Сотрудник вводит дату, серию и номер рецепта (на регистраторе выбытия или в товарно-учетной системе) и выбирает действие «Зарегистрировать выбытие». После появления на дисплее регистратора выбытия сообщения о том, что запрос отправлен, отпускает лекарственный препарат получателю.
Важно: ожидать ответ ФГИС МДЛП о результатах попытки вывода ЛП из оборота в момент отпуска ЛП не нужно.
Важно! В переходный период до старта обязательной маркировки лекарственных препаратов с 1 июля 2020 года, при осуществлении отпуска лекарственного препарата по 100% льготе либо со скидкой (за исключением лекарственных препаратов, относящихся к категории 7 ВЗН), считывание кода маркировки и регистрации операции вывода из оборота в ФГИС МДЛП не является обязательной процедурой. При этом регулятор в лице Росздравнадзора и Оператор системы маркировки, в целях тестирования товаропроводящей цепи и обеспечения готовности субъектов обращения лекарственных средств к старту обязательной маркировки, рекомендует фиксировать все операции, совершаемые с лекарственными препаратами в ФГИС МДЛП, согласно действующим бизнес-процессам.
5.2.3. Вывод из оборота для оказания медицинской помощи
Вывод из оборота лекарственных препаратов для оказания медицинской помощи осуществляется с использованием регистратора выбытия.
Информация о выводе из оборота таких лекарственных препаратов поступает в ФГИС МДЛП в автоматическом режиме посредством функционала регистратора выбытия (схема 10531 логической модели файлов обмена ФГИС МДЛП).
Для осуществления частичного выбытия лекарственных препаратов для оказания медицинской помощи в товарно-учетной системе (при использовании регистратора выбытия в «сетевом режиме») субъекта обращения лекарственных средств или в регистраторе выбытия (при использовании регистратора выбытия в «автономном» режиме) необходимо ввести долю упаковки лекарственного препарата. Вторичная упаковка лекарственного препарата сохраняется до момента отпуска последней доли вторичной упаковки. Товарно-учетная система (или регистратор выбытия) должны обеспечивать проверку количества ранее выведенных из оборота долей и блокировать выбытие «излишков», выводя соответствующее уведомление.
В случае обнаружения попытки осуществить вывод из оборота «излишка», ФГИС МДЛП осуществит вывод ЛП из оборота, при этом будет зафиксировано нарушение, и соответствующая информация будет направлена в надзорный орган (Росздравнадзор).
Алгоритм действий сотрудника медицинской организации при использовании им регистратора выбытия всегда одинаков и не зависит от способа его подключения.
1. Сотрудник получает или создает документ-основание для регистрации вывода лекарственного препарата из оборота. Это может быть требование-накладная, акт списания при использовании для оказания медицинской помощи или любой другой документ в соответствии с внутренней учетной политикой участника оборота.
2. Сотрудник подбирает упаковки препаратов в соответствии с документом-основанием и сканирует коды маркировки DataMatrix. Если при этом используется товарно-учетная система, интегрированная с ФГИС МДЛП и регистратором выбытия, то сотрудник может сразу видеть на экране компьютера информацию о данном лекарственном препарате и о том, может ли данный препарат быть выведен из оборота. Регистратор выбытия при сканировании кодов маркировки DataMatrix при успешном распознавании кода маркировки, нанесенного на упаковку лекарственного препарата, выводит на экран наименование лекарственного препарата.
3. Завершив подбор, сотрудник выбирает действие «Зарегистрировать выбытие» на регистраторе выбытия. Если не используется товарно-учетная система, на дисплее устройства будет выведено сообщение о необходимости ввода номера и даты документа-основания перед отправкой сведений.
4. В случае частичного выбытия вторичной упаковки из оборота, соответствующая информация о количестве долей лекарственного препарата указывается в регистраторе выбытия или в товаро-учетной системе участника. При этом вторичная упаковка сохраняется до момента выбытия последней первичной упаковки.
Важно! В переходный период до старта обязательной маркировки лекарственных препаратов с 1 июля 2020 года, при оказании медицинской помощи, считывание кода маркировки и регистрации операции вывода из оборота в ФГИС МДЛП не является обязательной процедурой. При этом регулятор в лице Росздравнадзора и Оператор системы маркировки, в целях тестирования товаропроводящей цепи и обеспечения готовности субъектов обращения лекарственных средств к старту обязательной маркировки, рекомендует фиксировать все операции, совершаемые с лекарственными препаратами в ФГИС МДЛП, согласно действующим бизнес-процессам.
5.2.4. Вывод из оборота по иным причинам
Вывод ЛП из оборота может осуществляться участниками оборота с учетом различных типов совершаемых операций, в том числе:
— отбор образцов таможенными органами;
— отбор образцов в рамках выборочного контроля;
— отбор образцов в рамках федерального надзора;
— отбор образцов для фармацевтической экспертизы;
— передача демонстрационных образцов;
— списание без передачи на уничтожение;
— вывод из оборота SSCC/SGTIN, накопленных в рамках эксперимента;
— списание разукомплектованной вторичной упаковки;
— списание производственного брака;
— производство медицинских изделий;
— производство лекарственных препаратов;
— отбор контрольных образцов;
— отбор архивных образцов
— передача ЛП на уничтожение.
5.3. Вывод из оборота лекарственных препаратов при неработоспособности регистратора выбытия
В случае неработоспособности регистратора выбытия участнику оборота необходимо ознакомиться с соответствующей инструкцией*(4).
5.4. Особенности вывода из оборота для отдельных категорий участников
5.4.1. Вывод из оборота из труднодоступных и отдаленных от сети и связи мест осуществления деятельности
1. Организации и индивидуальные предприниматели, находящиеся в труднодоступной местности, а также имеющие места осуществления деятельности, расположенные в труднодоступной местности, но имеющие возможность передачи данных через сеть Интернет, должны передавать сведения об операциях с лекарственными препаратами в ФГИС МДЛП согласно текущим бизнес-процессам движения лекарственных препаратов, опубликованным на сайте ЧестныйЗнак.
2. Организации и индивидуальные предприниматели, имеющие в своем составе места осуществления деятельности, находящиеся в труднодоступной местности и не имеющие доступа к сети Интернет:
— Передача сведений в ФГИС МДЛП осуществляется через головную организацию, в составе которой осуществляет деятельность обособленное подразделение медицинской организации или филиал аптечной сети.
— Если место осуществления деятельности не является структурным подразделением вышестоящей организации (то есть является самостоятельным юридическим лицом или индивидуальным предпринимателем), в таком случае участнику оборота необходимо загрузить xml-документ о выводе лекарственного препарата в ФГИС МДЛП через Личный кабинет из места, где есть доступ к сети Интернет. Сроки на передачу сведений составляют 5 дней.
5.4.2. Вывод из оборота фельдшерско-акушерскими пунктами
Медицинская организация, в составе которой находится ФАП, осуществляет передачу лекарственных препаратов на место осуществления деятельности ФАП и фиксирует соответствующую отгрузку направлением сведений в ФГИС МДЛП.
Обособленные подразделения медицинской организации (ФАП, ФП), оказывающие первичную медико-санитарную помощь, осуществляют вывод лекарственных препаратов из оборота с использованием регистратора выбытия.
5.4.3. Вывод из оборота организациями, осуществляющими наряду с основной (уставной) деятельностью медицинскую деятельность (образовательные организации, учреждения науки, учреждения социального обслуживания и иные организации)
Организациям и индивидуальным предпринимателям, осуществляющим наряду с основной (уставной) деятельностью медицинскую деятельность, необходимо отражать в ФГИС МДЛП сведения обо всех операциях с лекарственными препаратами. Алгоритм действий таких субъектов обращения лекарственных средств по внесению информации в ФГИС МДЛП аналогичен алгоритму, приведенному в пункте 5.2.3.
6. Отдельные процессы
6.1. Рекомендации по ведению товарной номенклатуры участника оборота
Для получения и учета кода ЕСКЛП в ТУС участника оборота необходимо использовать метод API 8.5.1 «Метод для получения информации из реестра производимых организаций лекарственных препаратов». Список методов API опубликованы на сайте Честный Знак в документе «ИС «Маркировка». МДЛП. Протокол обмена интерфейсного уровня_v3.04″ в разделе «Документы для работы в МДЛП».
6.2. Инвентаризация остатков. Учет и списание лекарственных препаратов
На дату старта обязательной маркировки лекарственных препаратов с 1 июля 2020 года у участников оборота на балансе в ФГИС МДЛП могут быть накоплены остатки маркированных лекарственных препаратов, подлежащих списанию в ФГИС МДЛП.
Выделяются следующие категории маркированных лекарственных препаратов, которые могут быть списаны в ФГИС МДЛП до 1 июля 2020 г.:
1. лекарственные препараты, маркированные «экспериментальными» кодами DataMatrix без криптозащиты в рамках проведения эксперимента по маркировке контрольными (идентификационными) знаками с 1 февраля 2017 г. по 31 декабря 2019 г.
2. лекарственные препараты, маркированные кодами DataMatrix с криптозащитой длиной 88 символов и дополнительными полями в коде маркировки (срок годности, номер серии), и криптозащитой длиной 44 символа в период с 14 декабря 2018 г. по 30 июня 2020 г.
Всем участникам оборота, имеющим на своем балансе в ФГИС МДЛП остатки маркированных лекарственных препаратов, перечисленных выше, рекомендуется произвести процедуру списания таких остатков (за исключением лекарственных препаратов, относящихся к 7ВЗН, закупленных на средства федерального бюджета), с использованием схемы 552 логической модели файлов обмена ФГИС МДЛП с указанием типа вывода из оборота «Вывод из оборота КИЗ, накопленных в рамках эксперимента».
Рекомендуемые сроки проведения операций списания субъектами обращения лекарственных средств с 1 июня 2020 г. по 30 июня 2020 г.
Кроме того в переходный период до 1 июля 2020 г. в ФГИС МДЛП может отсутствовать информация о перемещении маркированных лекарственных препаратов, уже поставленных по схемам прямого или обратного акцептования (отсутствует подтверждение грузополучателей о принятии на свой баланс лекарственных препаратов в рамках прямого акцептования или отсутствует подтверждение грузоотправителя о поставке лекарственных препаратов в рамках обратного акцептования), а фактически поставленный товар будет продолжать числиться в ФГИС МДЛП на балансе грузоотправителя.
При наличии в ФГИС МДЛП сведений о лекарственных препаратах, поставленных грузоотправителем по схеме прямого акцептования и не принятых грузополучателем на свой баланс в ФГИС МДЛП по истечении 5 дней с даты получения товара (лекарственные препараты по данным ФГИС МДЛП находятся в реестре ожидания), текущему владельцу товара (грузоотправителю) необходимо отозвать отгрузку, используя схему 251 логической модели файлов обмена ФГИС МДЛП, и затем списать данные лекарственные препараты согласно приведенной выше инструкции.
В случае если в рамках обратного акцептования грузоотправитель не подтвердил прием грузополучателем лекарственных препаратов в ФГИС МДЛП в течение 5 дней с даты отправки сообщения о получении товара, грузополучатель может посредством Личного кабинета участника оборота направить в арбитраж в адрес поставщика запрос на списание им в ФГИС МДЛП поставленных лекарственных препаратов. После отправки такого запроса ответственность за последующее списание ложится на грузоотправителя, на балансе которого в ФГИС МДЛП продолжают числиться поставленные лекарственные препараты.
При фактическом выводе ЛП из оборота, в случае проверки покупателем лекарственного препарата, списанного вышеописанными способами, в мобильном приложении будет указана информация о списании такого лекарственного препарата в рамках эксперимента.
6.3. Рекомендации по расчету суммы НДС
В соответствии с требованиями интеграционного взаимодействия с ФГИС МДЛП участнику оборота необходимо вносить сведения о стоимости упаковки лекарственного препарата, рассчитанной исходя из общей суммы поставленных лекарственных препаратов и их количества, и сумме НДС для каждой упаковки.
В рамках прямого порядка акцептования сведения фиксируются поставщиком (грузоотправителем). В случае обратного акцепта сведения фиксируются грузополучателем. Во избежание расхождения значений ставки НДС участникам оборота рекомендуется использовать единый алгоритм расчета суммы НДС по формуле: Сумма НДС = Стоимость упаковки ЛП (без НДС) * Ставка НДС / 100.
Для округления суммы НДС по двух знаков после запятой необходимо пользоваться арифметическими правилами округления.
6.4. Порядок смены держателя регистрационного удостоверения лекарственного препарата
Ниже в таблице (Таблица 1) приведен перечень действий субъекта обращения лекарственных средств для смены держателя регистрационного удостоверения на лекарственный препарат для медицинского применения в системе ФГИС МДЛП.
6.5. Порядок отражения операций в ФГИС МДЛП при осуществлении оптовой продажи за наличный и безналичный расчет
При осуществлении оптовой торговли лекарственными препаратами за наличный или безналичный расчет в фискальном документе в обязательном порядке необходимо указывать ИНН грузополучателя. В таком случае вывод из оборота лекарственных препаратов в ФГИС МДЛП не произойдет. Далее контрагентам необходимо выполнить операции приема-передачи.
*(1) Здесь и далее по тексту приведены номера схем, использующиеся для подготовки xml-документов, участвующих в процессе обмена информацией товарно-учетных систем участников оборота и ФГИС МДЛП. Полный перечнем схем, а также их наименования, приведены в Приложении 1 настоящих Методических рекомендаций
*(2) Инструкция по получению регистратора выбытия приведена в Приложении 2 настоящих Методических рекомендаций
*(3) Письмо приведено в Приложении 4 настоящих Методических рекомендаций
*(4) Инструкция размещена в Приложении 5 настоящих Методических рекомендаций
Перечень схем логической модели файлов обмена ФГИС МДЛП
| N XSD-схемы | Краткое название операции |
|---|---|
| 10300 | Эмиссия кодов маркировки |
| 10311 | Завершение упаковки (регистратор эмиссии) |
| 10319 | Выпуск ЛП за пределами РФ (регистратор эмиссии) |
| 10511 | Розничная продажа с использованием ККТ |
| 10521 | Отпуск по льготному рецепту (регистратор выбытия) |
| 10522 | Отпуск по льготному рецепту с использованием ККТ |
| 10531 | Выдача для оказания медицинской помощи (регистратор выбытия) |
| 250 | Отмена операции |
| 251 | Отзыв части товара Отправителем |
| 252 | Отказ от приемки части товара Покупателем |
| 253 | Корректировка ранее направленных реквизитов |
| 311 | Завершение упаковки |
| 313 | Выпуск ЛП |
| 314 | Отгрузка ЛП собственнику для выпуска готовой продукции |
| 321 | Выпуск ЛП (иностранный держатель РУ) |
| 331 | Отгрузка ЛП в РФ |
| 332 | Ввоз ЛП в РФ |
| 333 | Ввоз ЛП в РФ по консигнации |
| 334 | Перемещение в зоне таможенного контроля |
| 335 | Выпуск для внутреннего потребления Оформление экспорта Отказ в пользу государства в ЗТК Оформление реэкспорта Передача на уничтожение из ЗТК Таможенное оформление |
| 341 | Приемка на склад из ЗТК |
| 342 | Ввод ЛП в оборот на территории РФ |
| 351 | Смена собственника ЛП |
| 360 | Ввоз собственных ЛП из ЕАЭС |
| 361 | Отгрузка ЛП в РФ из ЕАЭС |
| 362 | Ввоз ЛП в РФ из ЕАЭС |
| 363 | Ввод ЛП из ЕАЭС в оборот на территории РФ |
| 381 | Отгрузка ЛП собственнику |
| 391 | Повторный ввод в оборот |
| 415 | Отгрузка ЛП со склада |
| 416 | Приемка ЛП на склад |
| 417 | Возврат приостановленных лекарственных препаратов |
| 431 | Перемещение |
| 441 | Отгрузка ЛП на незарегистрированное место деятельности |
| 442 | Приемка на склад ЛП, ранее отгруженных на незарегистрированное место деятельности |
| 461 | Отгрузка ЛП в ЕАЭС |
| 470 | Перемещение ЛП в рамках государственного лекарственного обеспечения |
| 471 | Передача новому владельцу |
| 472 | Отгрузка ЛП по агентскому договору |
| 511 | Розничная продажа |
| 521 | Отпуск по льготному рецепту |
| 531 | Выдача для оказания медицинской помощи |
| 541 | Передача на уничтожение |
| 542 | Уничтожение |
| 552 | Вывод из оборота |
| 701 | Подтверждение отгрузки/приемки |
| 811 | Переупаковка и перемаркировка |
| 911 | Агрегирование |
| 912 | Расформирование групповой упаковки |
| 913 | Изъятие из групповой упаковки |
| 914 | Включение в групповую упаковку |
| 915 | Групповое агрегирование |
Краткая инструкция по получению регистратора выбытия
Краткая инструкция по шагам
— Шаг 2. Заполнить и направить заявление о присоединении к Договорам Оператору
— Шаг 3. Подписать со своей стороны Договор безвозмездного пользования движимым имуществом (регистратор выбытия)
— Шаг 4. Заполнить и направить анкету на получение регистратора выбытия Оператору
— Шаг 5. Подписать со своей стороны Заявку на предоставление Регистратора Выбытия.
— Шаг 6. Осуществить приемку регистратора выбытия и подписать акт приема-передачи (Акт о получении регистратора выбытия)
1 Заполнение заявлений о присоединении к Договорам
В ИС МДЛП Участник может отправить одно из следующих заявлений о присоединении к Договорам:
— Заявление на формирование Договора на оказание услуг по предоставлению кодов маркировки;
— Заявление на формирование Договора по предоставлению регистратора выбытия;
— Заявление на формирование Договора по предоставлению устройства регистрации эмиссии путем предоставления удаленного доступа;
— Заявление на формирование Договора по предоставлению устройства регистрации эмиссии.
В личном кабинете перейти на вкладку «Профиль», «Анкеты и договора», «Заполнение заявлений». Нажать кнопку «+Оформить заявление» (Рисунок 8).
1. После нажатия на кнопку «Оформить заявление» откроется окно «Оформление заявления» (Рисунок 9).
2. В окне «Оформление заявления» требуется выбрать нужный тип заявления в выпадающем списке (Рисунок 10).
3. После выбора нужного типа заявления требуется заполнить обязательные поля (Рисунок 10) и нажать кнопку «Продолжить».
4. Далее заполните данные заявителя (Рисунок 11). Нажмите кнопку «Выбрать представителя из списка пользователей» (Рисунок 12), заполнить все данные помеченные (Рисунок 13). Нажать кнопку «Продолжить».
5. Заполните банковские реквизиты (Рисунок 15) и нажмите кнопку «Продолжить»;
6. Укажите какое оборудование и в каких условиях разместить, выбрав значения «да» или «нет», нажатием на необходимое поле (Рисунок 16). Нажмите кнопку «Продолжить». Аналогично заполните следующие страницы заявления (Рисунок 17) (Рисунок 18). Нажмите кнопку «Сохранить»;
После заполнения заявления нужно нажать кнопку «Сохранить» и заявление будет сохранено и доступно для просмотра на вкладке «Заполнение заявлений» в статусе «Заполнено» (Рисунок 19).
2 Просмотр, редактирование и удаление заявлений
Кнопки для действий с заявлениями расположены в крайней правой колонке (Рисунок 20).
С заявлениями в статусе «Заполнено» доступны следующие действия:
С заявлениями в статусе «Отправлено» доступны следующие действия:
3 Отправка заявлений о присоединении к Договорам Оператору
Отметить заявление в статусе «Заполнено» галочкой и нажать кнопку Отправить заявления. Кнопка становится доступной после выбора заявления (Рисунок 21).
По результатам отправки заявлений появится соответствующее уведомление (Рисунок 22).
4 Договор. Переход к подписи Документов
На основании заполненного и отправленного Оператору заявления в течение одного рабочего дня будет сформирован договор на предоставление регистратора выбытия в соответствии с утвержденной Минпромторгом России типовой формой.
Для перехода к подписи подготовленного Оператором договора требуется перейти на страницу «Договоры» (Рисунок 23).
При входе в раздел Договоры всплывает блокирующее окно, требующее подписать документы (Рисунок 24). Система требует подписать договора типа:
— предоставления кодов маркировки;
— предоставления устройства регистрации эмиссии;
— предоставления устройства регистрации эмиссии путем предоставления удаленного доступа;
После перехода будет доступен перечень подготовленных документов для ознакомления и подписи. (Рисунок 25).
Статусы подписания договора:
Скачать и просмотреть договор перед его подписанием возможно в окне подписания, которое открывается при нажатии статуса Требует подписания (кнопка «Скачайте и ознакомьтесь с приложенными документами»).
Скачать и посмотреть договор с оттисками подписантов после подписания со стороны ООО «ЦРПТ» возможно выбрав Договор в списке документов (Рисунок 26).
5 Заполнение Анкет на оснащение регистратором выбытия
После подписания договора по предоставлению Регистратора выбытия со стороны участника (статус договора «На проверке») необходимо сразу переходить к заполнению и отправке Анкеты на оснащение регистратором выбытия.
5.1 Перед заполнением анкеты необходимо добавить места деятельности в ЛК ИС МДЛП, выполнив следующие действия:
1. В Главном меню выбрать раздел «Профиль», «Адреса», «Места деятельности» (Рисунок 27).
Добавление нескольких мест деятельности юридического лица, расположенных по одному адресу описано в Приложении.
5.2 Заполнение анкет на РВ
На странице «Заполнение анкет на РВ» выбрать необходимое для оснащения регистратором выбытия место деятельности и нажать на кнопку в крайней правой колонке таблицы (Рисунок 29).
После нажатия на кнопку откроется окно для заполнения анкеты на оснащение регистратором выбытия выбранного места деятельности (Рисунок 30).
Заполнить анкету и нажать кнопку «Сохранить».
После сохранения анкета становится доступна в статусе «Заполнено» (Рисунок 33).
На странице «Анкеты» кнопки для действий с Анкетами расположены в крайней правой колонке (Рисунок 34).
С анкетами в статусе «Заполнено» доступны следующие действия:
С анкетами в статусе «Отправлено» доступны следующие действия:
5.2 Отправка Анкет на оснащение регистратором выбытия Оператору
Отметить анкеты в статусе «Заполнено» галочкой и нажать кнопку «Оформить заявку на оснащение оборудованием».
Кнопка становится доступной после выбора анкет из списка (Рисунок 35).
После нажатия на кнопку «Оформить заявку на оснащение оборудованием» откроется окно для ввода дополнительных данных для оформления Заявки на оснащение оборудованием (Рисунок 36).
После ввода данных нажать на кнопку «Отправить».
После нажатия на кнопку «Отправить» анкеты переходят в статус «Отправлено» и будут направлены Оператору для дальнейшей обработки. После обработки переданных данных будут сформированы документы, которые будут размещены в разделе Договоры.
5.3 Подписание анкеты.
В течение 1-2 рабочих дней анкета будет проверена со стороны ООО «ЦРПТ», в разделе «Договоры» будет сформирована «Заявка Участника о предоставлении оборудования РВ» в статусе «Требует подписи». Участнику необходимо подписать заявку.
После подписания заявка переходит в статус «На проверке». После проверки заявки на стороне ООО «ЦРПТ» в течение 1-2 рабочих дней заявка переходит в статус «Подписан сторонами».
6 Акты о получении регистратора выбытия. Переход к подписи Документов
После подписания «Заявки участника о предоставлении оборудования РВ» со стороны ООО «ЦРПТ» в разделе Договоры формируется «Акт приема-передачи оборудования» в статусе «Требует подписи».
Акт подписывается по факту получения регистратора выбытия.
Для перехода к подписи подготовленных документов требуется перейти на страницу «Договоры» (Рисунок 38).
После перехода будет доступен перечень подготовленных документов для ознакомления и подписи. (Рисунок 39). Далее необходимо выбрать из перечня документов Акт о получении регистратора выбытия и подписать его УКЭП организации.
Перед подписанием Акт можно скачать и просмотреть. После подписания акта со стороны Участника он переходит в статус «На проверке». После проверки акта на стороне ООО «ЦРПТ» в течение 1-2 рабочих дней акт переходит в статус «Подписан сторонами» и может быть скачан с подписями сторон.
Добавление нескольких мест деятельности юридического лица, расположенных по одному адресу
1. Присвоить уникальный номер адреса объекта адресации в федеральной информационной адресной службе для каждой аптеки. Для этого необходимо обратиться в местные органы самоуправления для добавления адреса с указанием номера помещений согласно количеству аптек, находящиеся в одном здании.
2. Проверить в сервисе ФИАС https://fias.nalog.ru/ наличие уникального адреса с добавленным номером помещения.
3. Обратиться в Росздравнадзор, в лицензии для каждой из аптек внести новый адрес с добавлением номера помещения.
4. Росздравнадзор после внесения изменений, направит информацию в ИС МДЛП.
5. В ИС МДЛП произвести регистрацию места осуществления деятельности для каждой аптеки в соответствии с полученными уникальными ФИАС по помещениям.
Письмо с разъяснениями Росздравнадзора об отпуске лекарственных препаратов
Письмо Федеральной службы по надзору в сфере здравоохранения от 16 января 2020 г. N 01И-71/20
«О розничной и оптовой торговле лекарственными препаратами»
Инструкция пользователя при неработоспособности регистратора выбытия
1. Позвонить в службу технической поддержки «Оператор-ЦРПТ» по номеру 8-800-222 1523 или подать обращение на адрес электронной почты support@crpt.ru.
В обращении необходимо сообщить следующую информацию:
— Идентификатор места осуществления деятельности в МДЛП
— Адрес места установки РВ
— Описание возникшей проблемы РВ
2. Техническая поддержка регистрирует обращение и направляет информацию о неработоспособности сервисным инженерам.
3. Сервисные инженеры связываются с субъектом обращения лекарственных средств с целью устранения возникшей проблемы удаленно.
4. В случае, если возникшую проблему не удается решить удаленно, инженер фиксирует и направляет информацию в МДЛП.
5. В период неработоспособности РВ имеется возможность осуществлять загрузку отчетов о выбытии посредством Личного кабинета Участника оборота МДЛП. В Приложении представлена соответствующая инструкция.
— Приложение А. Инструкция по формированию и загрузке xml-документа вручную пользователем.
— Приложение Б. Шаблон документа «Регистрация в ИС «Маркировка» сведений об отпуске лекарственного препарата по льготному рецепту (521-recipe)».
— Приложение В. Шаблон документа «Регистрация в ИС «Маркировка» сведений о выдаче лекарственного препарата для оказания медицинской помощи (531-health_care)».
Инструкция по формированию и загрузке xml-документа вручную пользователем
В случае отсутствия возможности осуществить регистрацию выбытия штатными средствами (используя устройство РВ) пользователь имеет возможность осуществить загрузку документов вручную, используя функциональность Личного кабинета Участника оборота.
Размер загружаемого файла через личный кабинет ФГИС МДЛП не должен превышать более 1 мб.
После авторизации в Личном кабинете пользователю необходимо перейти на вкладку «Отправленные» раздела «Реестр документов». В правом верхнем углу отображается кнопка «Загрузить XML», обеспечивающая возможность загрузки документа вручную (Рисунок 40).
Для подготовки файла пользователю необходимо вручную сформировать XML-документ по одному из необходимых форматов:
1. Открыть шаблон XML-документа с наименованием 521-recipe (см. приложение) в текстовом редакторе* и вручную заполнить переменные значения (выделены желтым цветом в шаблоне).
2. Порядок заполнения переменных значений представлен в таблице (Таблица 2).
3. Атрибуты xml-документа, не указанные в таблице, не подлежат изменению.
Таблица 2. Атрибуты схемы данных 521-recipe
1. Открыть шаблон XML-документа с наименованием 531-health_care (см. приложение) в текстовом редакторе и вручную заполнить переменные значения (выделены желтым цветом в шаблоне).
2. Порядок заполнения переменных значений представлен в таблице (Таблица 3).
3. Атрибуты xml-документа, не указанные в таблице, не подлежат изменению.
Таблица 3. Атрибуты схемы данных 531-health_care
По результатам заполнения требуемого шаблона пользователю необходимо:
1. Сохранить документ с расширением «.xml» на локальном диске компьютера (наименование документа может быть произвольным).
2. Загрузить документ в Личном кабинете, нажав на кнопку «Загрузить XML» (Рисунок 41).
3. Подтвердить операцию загрузки, нажав на кнопку «Да» в появившемся диалоговом окне (Рисунок 42).
4. В появившемся окне нажать на кнопку «Подписать и отправить» (Рисунок 43).
* Рекомендуется использовать один из следующих редакторов: WordPad, Блокнот (штатные средства Windows), бесплатный редактор Notepad++ и т.д.
Шаблон документа «Регистрация в ИС «Маркировка» сведений об отпуске лекарственного препарата по льготному рецепту (521-recipe)»
Шаблон документа «Регистрация в ИС «Маркировка» сведений о выдаче лекарственного препарата для оказания медицинской помощи (531-health_care)»
Обзор документа
Вышла новая версия методических рекомендаций по работе с маркированными лекарственными препаратами.
Актуализирован раздел терминов и сокращений. Добавлены разъяснения по смене держателя регистрационного удостоверения препарата. Разобраны нюансы осуществления оптовой торговли за наличный и безналичный расчет.
© ООО «НПП «ГАРАНТ-СЕРВИС», 2021. Система ГАРАНТ выпускается с 1990 года. Компания «Гарант» и ее партнеры являются участниками Российской ассоциации правовой информации ГАРАНТ.
Все права на материалы сайта ГАРАНТ.РУ принадлежат ООО «НПП «ГАРАНТ-СЕРВИС». Полное или частичное воспроизведение материалов возможно только по письменному разрешению правообладателя. Правила использования портала.
Портал ГАРАНТ.РУ зарегистрирован в качестве сетевого издания Федеральной службой по надзору в сфере связи,
информационных технологий и массовых коммуникаций (Роскомнадзором), Эл № ФС77-58365 от 18 июня 2014 года.
ООО «НПП «ГАРАНТ-СЕРВИС», 119234, г. Москва, ул. Ленинские горы, д. 1, стр. 77, info@garant.ru.
8-800-200-88-88
(бесплатный междугородный звонок)
Редакция: +7 (495) 647-62-38 (доб. 3145), editor@garant.ru
Отдел рекламы: +7 (495) 647-62-38 (доб. 3136), adv@garant.ru. Реклама на портале. Медиакит
Если вы заметили опечатку в тексте,
выделите ее и нажмите Ctrl+Enter

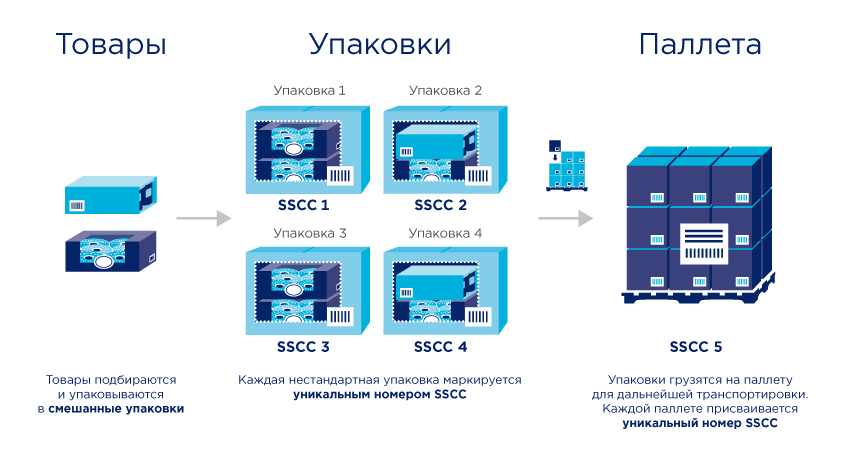


(1).jpg)
