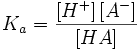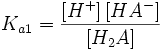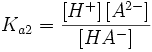Что такое pka в химии
Константа кислотности
Константа диссоциации кислоты (Ka) — константа равновесия реакции диссоциации кислоты на ион водорода и анион кислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как Ka1, Ka2 и т. д.
Содержание
Примеры расчета
(A — условное обозначение аниона кислоты, [HA] — равновесная концентрация в растворе частицы НА):
Одноосновная кислота
HA = H + + A −
Двухосновная кислота
H2A = H + + HA −
HA − = H + + A 2 −
Следует понимать, что фигурирующая в выражениях концентрация HA — это равновесная концентрация недиссоциировавшей кислоты, а не изначальная концентрация кислоты до её диссоциации.
Величина pK
См. также
Полезное
Смотреть что такое «Константа кислотности» в других словарях:
константа кислотности — (константа диссоциации кислоты) – константа равновесия Ка, характеризующая степень переноса протона от кислоты к воде как к растворителю. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
константа кислотности — rūgštingumo konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Rūgšties protolizės pusiausvyros konstanta. atitikmenys: angl. acidity constant vok. Aziditätskonstante, f rus. константа кислотности, f pranc. constante d’acidité … Penkiakalbis aiškinamasis metrologijos terminų žodynas
константа кислотности — rūgštingumo konstanta statusas T sritis chemija apibrėžtis Rūgšties protolizės pusiausvyros konstanta. atitikmenys: angl. acidity constant rus. константа кислотности … Chemijos terminų aiškinamasis žodynas
константа диссоциации кислоты — см. константа кислотности … Химические термины
Уровень кислотности — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
ФУНКЦИИ КИСЛОТНОСТИ — определяют протонирую щую способность р ров к т. Если протонируется нейтральная молекула В, Ф. к. обозначают H0, если анион или катион H или … Химическая энциклопедия
Угольная кислота — Угольная кислота … Википедия
КИСЛОТЫ И ОСНОВАНИЯ — Термины кислоты и основания вполне сформировались в 17 в. Их содержание неоднократно пересматривалось и дополнялось. Этот процесс происходил и происходит в острых столкновениях представителей разных взглядов на природу К. и о. Развитие взглядов… … Химическая энциклопедия
Десорбционные методы ионизации в масс-спектрометрии — Десорбционные методы ионизации в масс спектрометрии группа методов ионизации в масс спектрометрии, для которых процессы десорбции твердого анализируемого вещества и его ионизации практически неотделимы во времени. Наиболее полное развитие… … Википедия
Уравнение Бренстеда — Уравнение Бренстеда уравнение, количественно описывающее зависимость скорости катализируемых кислотами или основаниями реакций от природы кислоты. Впервые предложено в 1924 г. Бренстедом и Педерсеном. Для кислотного катализа уравнение… … Википедия
Кислотность и основность разбавленных растворов кислот и оснований
Мерой силы кислоты или основания, согласно теории Брёнстеда – Лоури является константа кислотности или основности соответственно. Поскольку наиболее распространенным растворителем является вода, измерения проводят обычно в воде. Кислота в воде отдает ей свой протон:
НХ + Н2 O ↔ Н3 O + + X –
Применяя закон действующих масс, получим:
В разбавленных растворах [Н2 O ] = const (=55,5 моль/л), поэтому можно записать
Применяя аналогичный вывод для основания, получим:
Величина Кв называется константой основности и является мерой основности относительно стандарта (в данном случае Н2O ). Аналогично величине pH константы кислотности и основности можно выразить в логарифмической форме:
Константы кислотности и основности связаны соотношением:
где Kw — константа автопротолиза растворителя (для воды — ионное произведение). Принимая во внимание ( 75 ), получаем уравнение ( 76 ) в виде:
pKw=pKa +pKв ( 77)
рКа = 14 – рКв (78)
Константы кислотности слабых кислот, нерастворимых в воде, определяют в других растворителях относительно друг друга, выстраивая таким образом единую шкалу кислотности. Полученные значения рКа носят приблизительный характер и могут быть использованы только для качественных оценок, например, данные таблицы 6-4 по константам кислотности относительно воды некоторых кислот Бренстеда.
Согласно табл. 6-4, в воде кислотами являются HCIO4, СН3СООН, основаниями — С2Н5ОН, С2Н2, NH3, С2Н4, С2Н6; в аммиаке кислоты — HCIO4, СН3СООН, С2Н5ОН, С2Н2, основания — С2Н4 и С2Н6.
Разница между рКа и рН
В физической химии pKa и pH являются двумя терминами, связанными с кислотностью системы. Это логарифмические значения. Самый простой способ выразить и сравнить очень большие или очень маленькие суммы
Содержание:
Ключевые области покрыты
1. Что такое рКа
— определение, ценности, отношения
2. Что такое рН
— определение, ценности, отношения
3. В чем разница между рКа и рН
– Сравнение ключевых различий
Ключевые термины: Кислотность, Константа диссоциации кислоты, Основность, pH, pKa
Что такое рКа
Константа диссоциации кислоты этого равновесия равна
[A – ] = Концентрация сопряженного основания
[ЧАС + ] = Концентрация ионов H +
[HA] = концентрация присутствующей кислоты
Тогда значение pKa константы диссоциации кислоты может быть указано, как показано ниже.
Рассматривая значение pKa, мы можем определить, является ли кислота сильной кислотой или слабой кислотой. Если значение рКа высокое, кислота слабая. Это связано с тем, что более высокое значение pKa указывает на то, что Ka является низким. Для того чтобы значение Ка было низким, [ – ][ЧАС + ] значение должно быть ниже, чем значение [HA]. Это означает, что кислота была диссоциирована частично. Но если значение [ – ][ЧАС + ] выше, чем [HA], тогда Ka будет высоким, а pKa будет низким соответственно. Это указывает на то, что это сильная кислота.
Что такое рН
В аналитической химии показатели pH используются для определения конечной точки определенной реакции. Эти индикаторы очень чувствительны к изменениям рН и показывают разные цвета для разных значений рН в водных растворах.
Тем не менее, значение рН является хорошим показателем кислотности или щелочности в водоеме. рН-метры могут быть использованы для измерения рН воды или любого другого раствора.
Разница между рКа и рН
Определение
Индикация кислотности
рКа: pKa указывает, является ли кислота сильной кислотой или слабой кислотой.
pH: pH показывает, является ли система кислотной или щелочной.
Подробности даны
рКа: рКа дает подробную информацию о диссоциации кислоты в водном растворе.
pH: pH дает подробную информацию о концентрации H + ионы в системе.
Ценности
рКа: Если pKa кислоты высокое, это слабая кислота, а если pKa кислоты низкое, это сильная кислота.
pH: Если pH системы высокий, система является щелочной, но если pH низкий, эта система является кислой.
Влияние других параметров
pH: рН зависит от Н + концентрация.
Заключение
Как pKa, так и pH являются очень важными параметрами в лабораторных условиях. Основное различие между pKa и pH заключается в том, что pKa указывает на диссоциацию кислоты, тогда как pH указывает на кислотность или щелочность системы.
Разница между pKa и pKb
Содержание:
Что такое pKa?
Чем ниже pKa vlaue, тем сильнее кислота. Аналогично, чем выше значение pKa, тем слабее кислота. Глядя на значения pKa различных кислот, можно сравнить относительные силы кислот. Вместо использования значений Ka обычно используются значения pKa, поскольку это упрощает работу с очень большими или очень маленькими числами с маленькими десятичными знаками.
Помимо сравнения силы кислоты, значения pKa также используются для выбора подходящих буферов. Согласно уравнению Хендерсона-Хассельбаха существует взаимосвязь между pH и pKa системы.
pH = pKа + журнал10([A – ] / [AH])
для диссоциации ГК кислоты. Это уравнение можно переписать, как показано ниже.
Kа/[ЧАС + ] = [A – ] / [AH]
Что такое pKb?
«P» в pKb означает «отрицательный логарифм». Поскольку большинство значений Kb очень большие или очень маленькие, для упрощения работы используются отрицательные логарифмы этих значений. Следовательно, большое значение Kb можно охарактеризовать небольшим значением pKb с маленькими десятичными знаками.
Какая связь между pKa и pKb?
Отношения между Ka и Kb приведены ниже.
Kw = Ka.Kb
Тогда связь между pKa и pKb определяется как, (при 25 о C)
рКа + рКб = 14
В чем разница между pKa и pKb?
pKa против pKb
Скачать PDF-файл pKa vs pKb
Вы можете загрузить PDF-версию этой статьи и использовать ее в автономных целях в соответствии с примечанием к цитированию. Пожалуйста, скачайте PDF-версию здесь: Разница между pKa и pKb
Ионные равновесия в водных растворах. Количественное определение кислотности водных растворов. Понятие pH и pK. Гидролиз солей. Буферные растворы. Произведение растворимости.
Благодаря теории электролитической диссоциации удалось определить, что такое кислота и что такое основание, а также количественно рассчитать степень кислотности растворов.
HClO3 + H2O
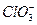
Отсюда следует, что в зависимости от того, что преобладает в растворе ионы гидроксония или ионы гидроксила раствор будет кислотой или щелочью соответственно.
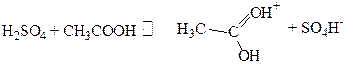
Из реакции (5.в) очевидна относительность понятия кислоты и основания. В реакции (5.в) CH3 COOHявляется основанием, а при взаимодействии с водой CH3COOHбудет кислотой.
Из вышеизложенного видно, что необходима количественная характеристика силы кислоты и основания. Для получения этих характеристик рассмотрим для примера только водные растворы.
Запишем реакцию диссоциации воды:
Применяя к этому уравнению закон действующих масс, можно записать:
Kd= 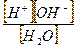
Константа Kив носит название ионное произведение воды.
Считая, что 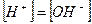
В 1920 г. Я. Соренсен ввёл понятие pH
Учитывая уравнения (5.2) и (5.3), получаем при равенстве концентраций ионов водорода и гидроксила, что pH = 7.
Аналогично pH можно ввести понятие pOH:
Тогда очевидно, что:
Для кислой среды pH 7, а в нейтральной среде pH = 7.
Для диссоциации кислоты можно записать аналогичное соотношение. Запишем его в общем виде:
Для данного уравнения запишем закон действующих масс:
Ka= 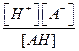
где Ка– константа диссоциации кислоты.
Значения pKа некоторых кислот
Рассмотрим поведение слабых кислот 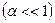



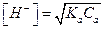
Из (5.8) следует, что кислотность слабых кислот связана с константами их диссоциации. Учитывая уравнение (5.3), можно записать, что для слабой кислоты:
аналогично для слабого основания с учетом (5.5):
Kа, Kb, Ca, Cb – константы диссоциации и концентрации кислот и оснований соответственно.
Гидролиз солей.
Рассмотрим вначале процесс гидролиза хлорида аммония. При этом учтём, что все соли диссоциируют полностью, а вода является слабым электролитом.
NH4Cl 
NH4Cl + H2O 
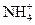
H2O 
CH3 COO Na + H2O 
(малодиссоциирующее соединение) (избыток ионов гидроксила)
То есть соль слабой кислоты и сильного основания всегда будет давать при растворении щелочную реакцию.
Соль же сильной кислоты и сильного основания, слабой кислоты и слабого основания при своём растворении будет давать среду, зависящую от соотношения силы кислоты и силы основания.
pH при гидролизе можно рассчитать для:
соли сильной кислоты и слабого основания
соли слабой кислоты и сильного основания
соли слабой кислоты и слабого основания
где Cab концентрация растворенной соли.
Согласно (5.13) pHпри гидролизе соли слабой кислоты и слабого основания зависит только от константы диссоциации (ионизации) кислоты и основания, и не зависит от концентрации соли.
Буферные растворы.
Рассмотрим смесь слабой кислоты и ее соли, образованной сильным основанием. Например, смесь водных растворов уксусной кислотыи ацетата натрия. Запишем реакцию диссоциации кислоты:
Тогда 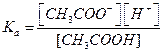
откуда 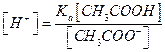
Обозначим: 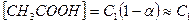
Дата добавления: 2017-01-29 ; просмотров: 2722 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ