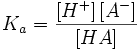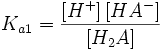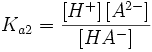Что такое pka кислоты
Разница между pKa и pKb
Содержание:
Что такое pKa?
Чем ниже pKa vlaue, тем сильнее кислота. Аналогично, чем выше значение pKa, тем слабее кислота. Глядя на значения pKa различных кислот, можно сравнить относительные силы кислот. Вместо использования значений Ka обычно используются значения pKa, поскольку это упрощает работу с очень большими или очень маленькими числами с маленькими десятичными знаками.
Помимо сравнения силы кислоты, значения pKa также используются для выбора подходящих буферов. Согласно уравнению Хендерсона-Хассельбаха существует взаимосвязь между pH и pKa системы.
pH = pKа + журнал10([A – ] / [AH])
для диссоциации ГК кислоты. Это уравнение можно переписать, как показано ниже.
Kа/[ЧАС + ] = [A – ] / [AH]
Что такое pKb?
«P» в pKb означает «отрицательный логарифм». Поскольку большинство значений Kb очень большие или очень маленькие, для упрощения работы используются отрицательные логарифмы этих значений. Следовательно, большое значение Kb можно охарактеризовать небольшим значением pKb с маленькими десятичными знаками.
Какая связь между pKa и pKb?
Отношения между Ka и Kb приведены ниже.
Kw = Ka.Kb
Тогда связь между pKa и pKb определяется как, (при 25 о C)
рКа + рКб = 14
В чем разница между pKa и pKb?
pKa против pKb
Скачать PDF-файл pKa vs pKb
Вы можете загрузить PDF-версию этой статьи и использовать ее в автономных целях в соответствии с примечанием к цитированию. Пожалуйста, скачайте PDF-версию здесь: Разница между pKa и pKb
Кислотность и основность разбавленных растворов кислот и оснований
Мерой силы кислоты или основания, согласно теории Брёнстеда – Лоури является константа кислотности или основности соответственно. Поскольку наиболее распространенным растворителем является вода, измерения проводят обычно в воде. Кислота в воде отдает ей свой протон:
НХ + Н2 O ↔ Н3 O + + X –
Применяя закон действующих масс, получим:
В разбавленных растворах [Н2 O ] = const (=55,5 моль/л), поэтому можно записать
Применяя аналогичный вывод для основания, получим:
Величина Кв называется константой основности и является мерой основности относительно стандарта (в данном случае Н2O ). Аналогично величине pH константы кислотности и основности можно выразить в логарифмической форме:
Константы кислотности и основности связаны соотношением:
где Kw — константа автопротолиза растворителя (для воды — ионное произведение). Принимая во внимание ( 75 ), получаем уравнение ( 76 ) в виде:
pKw=pKa +pKв ( 77)
рКа = 14 – рКв (78)
Константы кислотности слабых кислот, нерастворимых в воде, определяют в других растворителях относительно друг друга, выстраивая таким образом единую шкалу кислотности. Полученные значения рКа носят приблизительный характер и могут быть использованы только для качественных оценок, например, данные таблицы 6-4 по константам кислотности относительно воды некоторых кислот Бренстеда.
Согласно табл. 6-4, в воде кислотами являются HCIO4, СН3СООН, основаниями — С2Н5ОН, С2Н2, NH3, С2Н4, С2Н6; в аммиаке кислоты — HCIO4, СН3СООН, С2Н5ОН, С2Н2, основания — С2Н4 и С2Н6.
Константа кислотности
Константа диссоциации кислоты (Ka) — константа равновесия реакции диссоциации кислоты на ион водорода и анион кислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как Ka1, Ka2 и т. д.
Содержание
Примеры расчета
(A — условное обозначение аниона кислоты, [HA] — равновесная концентрация в растворе частицы НА):
Одноосновная кислота
HA = H + + A −
Двухосновная кислота
H2A = H + + HA −
HA − = H + + A 2 −
Следует понимать, что фигурирующая в выражениях концентрация HA — это равновесная концентрация недиссоциировавшей кислоты, а не изначальная концентрация кислоты до её диссоциации.
Величина pK
См. также
Полезное
Смотреть что такое «Константа кислотности» в других словарях:
константа кислотности — (константа диссоциации кислоты) – константа равновесия Ка, характеризующая степень переноса протона от кислоты к воде как к растворителю. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
константа кислотности — rūgštingumo konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Rūgšties protolizės pusiausvyros konstanta. atitikmenys: angl. acidity constant vok. Aziditätskonstante, f rus. константа кислотности, f pranc. constante d’acidité … Penkiakalbis aiškinamasis metrologijos terminų žodynas
константа кислотности — rūgštingumo konstanta statusas T sritis chemija apibrėžtis Rūgšties protolizės pusiausvyros konstanta. atitikmenys: angl. acidity constant rus. константа кислотности … Chemijos terminų aiškinamasis žodynas
константа диссоциации кислоты — см. константа кислотности … Химические термины
Уровень кислотности — Водородный показатель, pH (произносится «пэ аш»), это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным… … Википедия
ФУНКЦИИ КИСЛОТНОСТИ — определяют протонирую щую способность р ров к т. Если протонируется нейтральная молекула В, Ф. к. обозначают H0, если анион или катион H или … Химическая энциклопедия
Угольная кислота — Угольная кислота … Википедия
КИСЛОТЫ И ОСНОВАНИЯ — Термины кислоты и основания вполне сформировались в 17 в. Их содержание неоднократно пересматривалось и дополнялось. Этот процесс происходил и происходит в острых столкновениях представителей разных взглядов на природу К. и о. Развитие взглядов… … Химическая энциклопедия
Десорбционные методы ионизации в масс-спектрометрии — Десорбционные методы ионизации в масс спектрометрии группа методов ионизации в масс спектрометрии, для которых процессы десорбции твердого анализируемого вещества и его ионизации практически неотделимы во времени. Наиболее полное развитие… … Википедия
Уравнение Бренстеда — Уравнение Бренстеда уравнение, количественно описывающее зависимость скорости катализируемых кислотами или основаниями реакций от природы кислоты. Впервые предложено в 1924 г. Бренстедом и Педерсеном. Для кислотного катализа уравнение… … Википедия
Что такое pka кислоты
5. КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
В настоящее время для оценки кислотности и основности соединений, в том числе и органических, применяют две теории: теория Бренстеда и теория Льюиса. Теория Бренстеда (1923 г.) является протолитической или протонной теорией кислот и оснований, а теория Льюиса (1925 г.) – апротонной или электронной теорией кислот и оснований.
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ПО БРЕНСТЕДУ
Согласно теории Бренстеда, кислотой называют соединение, способное отдавать протон, т. е. кислота – донор протона, а основание – соединение, способное присоединять протон, т. е. основание является акцептором протона.
Теория Бренстеда называется протонной или протолитической теорией кислот и оснований, так как определения кислота и основание взаимосвязаны между собой процессом присоединения и отщепления протона.
Кислотно-основный процесс, согласно теории Бренстеда, может быть представлен следующей схемой:
Кислота А–Н, теряя протон, превращается при этом в основание АӨ, которое называется сопряженным основанием данной кислоты. Основание же В, присоединяя протон за счет неподеленной пары электронов, превращается в кислоту ВН+, которая является сопряженной данному основанию.
Таким образом, кислота А–Н и сопряженное основание АӨ, основание В и сопряженная кислота ВН+ образуют две сопряженные кислотно-основные пары.
Кислотность и основность соединений – понятия относительные. Эти два свойства неразрывно связаны между собой и проявляются одновременно, т. е. если одно соединение в данной реакции выступает в роли кислоты, то другое обязательно – в роли основания. Определенное соединение может быть кислотой по отношению к одному веществу и основанием по отношению к другому. Относительность этих понятии становится очевидной при рассмотрении конкретного примера.
Уксусная кислота, которая в воде проявляет кислотные свойства, в безводной серной кислоте ведет себя как основание.
Количественно силу кислот и оснований можно выразить с помощью константы равновесия данной реакции. Величину константы равновесия чаше всего определяют в водной среде. Для реакции:
Учитывая то, что вода в данной реакции выступает в роли растворителя, т. е. концентрация ее практически не изменяется (55,6 моль·л-1), концентрацией воды можно пренебречь. В данном случае константу равновесия называют константой кислотности или константой диссоциации К и выражают формулой:
Любая протолитическая реакция обратима и характеризуется константой диссоциации.
Большинство органических соединений, проявляющих кислотные свойства, в водной среде являются слабыми кислотами, константы которых выражаются малыми величинами. Например, Кa уксусной кислоты при 25°С равна 1,76·10-5. Оперировать такими малыми величинами в практической работе не удобно, поэтому используют значения рКa – показатель константы – отрицательный логарифм константы диссоциации: рКa = – lgKa (например: рКa для СН3СООН равняется 4,75).
Рассматривая зависимость между значениями величин Кa, рКa и силой кислоты, следует отметить одну закономерность: чем больше величина Кa (константа кислотности), тем сильнее кислота, чем больше величина рКa, тем кислота слабее.
Подобно кислотам силу оснований иногда выражают величиной Кb (константа основности), характеризующей легкость, с которой основание отрывает протон от воды:
Для удобства пользуются величиной рКb
При этом, чем меньше рКb, тем сильнее соответствующее основание. Однако намного удобнее выражать степень ионизации кислот и оснований в одной шкале (в шкале рКb) подобно тому, как значение рН одинаково хорошо характеризует и кислотность, и основность. Для основания величина рКa обычно означает кислотность сопряженной кислоты – протонной формы основания рК+вн. Сопряженная кислота в виде R–NH3 отдавая протон, превращается в основание R–NH4+.
Типы органических кислот
В зависимости от природы элемента, который связан с атомом водорода, кислоты разделяют на четыре основные группы:
Наряду с указанными типами кислот известны кислоты: Si-H, Р–Н, As–H, т. е. кислотой может быть любое соединение, содержащее связь А–Н и способное к отщеплению протона. Теория Бренстеда применима к любым типам кислот, способным к диссоциации с разрывом связи элемент–водород.
Кислотность соединений в основном определяется устойчивостью образующегося аниона, которая обусловлена делокализацией (распределением) отрицательного заряда.
Чем устойчивее сопряженное основание, тем сильнее кислота. Устойчивость аниона определяется следующими факторами: природой атома, связанного с атомом водорода (реакционный и кислотный центр); электронодонорными или электроноакцепторными свойствами заместителя, связанного с реакционным центром, и природой растворителя.
При равных других факторах устойчивость анионов, а следовательно, и кислотность возрастают с увеличением электроотрицательности и поляризуемости атомов кислотного центра. С увеличением электроотрицательности увеличивается сила, с которой атом может удержать пару электронов после отщепления водорода. Поскольку в пределах периода периодической системы электроотрицательность атомов возрастает слева направо (поляризуемость не меняется), то ОН-кислоты сильнее соответствующих NH-кислот, а те, в свою очередь, сильнее СН-кислот, например:
В пределах группы периодической системы электроотрицательность атомов уменьшается сверху вниз, но увеличивается их объем, а следовательно, возрастает поляризуемость, т. е. возможность делокализации внешнего электронного облака. Это способствует повышению стабильности аниона и приводит к возрастанию кислотности. Поэтому SH-кислоты обладают большей кислотностью, чем ОН-кислоты, например:
Наряду с природой кислотного центра и строением радикала, значительное влияние на проявление кислотных свойств оказывает растворитель. Наиболее эффективным растворителем является вода, она имеет высокую диэлектрическую постоянную и способна связывать катионы и анионы за счет сольватации. Эффект сольватации приводит к устойчивости образовавшегося аниона, а следовательно, кислотность соединений возрастает.
Типы органических оснований
Согласно теории Бренстеда, любое соединение, способное присоединять протон, может выступать в роли основания; это могут быть как нейтральные молекулы, так и заряженные частицы. В нейтральных молекулах для проявления основных свойств необходимо наличие атома с неподеленной парой электронов или наличие кратной связи. Основаниями могут быть анионы: алкоксид-ион ROӨ; алкилмеркаптид-ион RSӨ, карбанион R3CӨ (триалкилметанид-ион) и другие.
В n-основаниях центром основности, или центром протонирования (местом присоединения протона), чаше всего выступают такие элементы, как азот, кислород, сера. В зависимости от центра основности ониевые основания делятся на три основные группы:
Основность органических соединений в основном определяется устойчивостью образовавшегося катиона, которая обусловлена делокализацией положительного заряда.
На основность значительное влияние оказывает электроотрицательность и поляризуемость элементов, составляющих центр основности, электронодонорное или электроноакцепторное влияние радикала, связанного с центром основности, и природа растворителя.
Большая электроотрицательность атомов основного центра способствует более прочному удержанию им неподеленнои электронной пары, что характеризует меньшую основность соединения, иначе говоря. чем больше электроотрицательность атома, тем меньше основность. Таким образом, аммониевые основания проявляют более сильные основные свойства по сравнению с оксониевыми. Увеличение же поляризуемости атома приводит к уменьшению основности сопряженного основания и увеличению кислотности сопряженной кислоты. Поэтому сульфониевые основания слабее оксониевых.
Существенную роль в проявлении основных свойств играет растворитель. Эффект сольватации способствует устойчивости образовавшегося катиона, а следовательно, приводит к повышению основности.
КИСЛОТЫ И ОСНОВАНИЯ ЛЬЮИСА
Теория кислот и оснований Льюиса, в отличие от теории Бренстеда, является более обшей. Согласно этой теории основанием считается любая частица (атом, молекула или анион), способная отдавать электронную пару для образования ковалентной связи, а кислотой – любая частица (атом, молекула, катион), способная принимать пару электронов с образованием ковалентной связи.
То есть, по Льюису, основание является донором, а кислота – акцептором пары электронов. Из приведенного определения видно, что основания Льюиса тождественны основаниям Бренстеда. Однако кислоты Льюиса охватывают более широкий круг соединений.
Кислотой Льюиса считается любая частица, имеющая вакантную орбиталь.
Согласно теории Льюиса, к кислотам относятся не только соединения, отщепляющие протон (протонные кислоты), но и другие вещества, имеющие вакантную орбиталь и способные принимать пару электронов (апротонные кислоты). Кислотами Льюиса, например, являются такие соединения, как BF4, AlC13, FeCl3, SbCl3, ZnCl2, HgCl3 и др.
Кислотно-основный процесс по Льюису состоит в образовании ковалентнои связи между основанием и кислотой за счет электронной пары основания и вакантной орбитали кислоты. Так, основания Льюиса, имеющие неподеленные пары электронов, образуют с кислотами Льюиса n-комплексы:
Легкость протекания кислотно-основного взаимодействия по Льюису определяется силой кислоты и основания.
Как определить pH по pKa
Рецензент: Лана Бандойм, B.. Вы, несомненно, слышали о шкале pH, которая используется для измерения кислотности раствора (например, уксуса или отбеливателя). Вы, вероятно, думаете о кислотах как о ки
Содержание
Вы, несомненно, слышали о шкале pH, которая используется для измерения кислотности раствора (например, уксуса или отбеливателя). Вы, вероятно, думаете о кислотах как о кислых (например, лимонная кислота является обычным ингредиентом кислых конфет) и временами опасными (большинство людей учатся ассоциировать слово «кислота» с «потенциальным повреждением кожи» еще до достижения взрослого возраста, даже если только из голливудских фильмов или мрачных новостных репортажей).
Но что такое кислота с химической точки зрения? И существуют ли индивидуальные свойства различных кислот, которые облегчают определение pH раствора, если вам известна молярная концентрация кислоты, растворенной в этом растворе? Эта «фирменная» черта называется константа диссоциации кислотыKа. Иногда неформально обозначаемый как ka, вы можете вычислить pH математически простым способом.
Кислоты в растворе
Пример: Угольная кислота (ЧАС2CO3) отдает протон в водном растворе в H + (часто обозначается как H3О + ) и бикарбонат (HCO3 − ).
Сильные кислоты, такие как соляная кислота (HCl), более «охотно» отдают протоны, чем гораздо более многочисленные слабые кислоты, что означает, что они могут выгружать протоны даже в среде с низким pH, то есть в среде, которая уже богата протонами и, следовательно, сама не «рвется». «брать больше. Слабые кислоты стремятся отдать свои протоны только при высоком pH окружающей среды, то есть при относительно низкой концентрации протонов.
Что такое шкала pH?
Выше вы читали, что низкий pH подразумевает среду с большим количеством протонов, освобожденных от их родительских кислот. Как правило, шкала pH представляет собой логарифмическую или «логарифмическую» шкалу, которая для практических целей составляет от 1 до 14, от наиболее до наименее кислой. Уравнение для pH:
Пример: Какой pH у 0,025 М раствора протонов?
pH = −log10[0,025 моль / л] = 1,602
Константа ионизации кислоты Ka
Каждая кислота имеет свою собственную константу ионизации, определяемую следующим образом:
Здесь − ], [H3О + ] и [НА] представляют собой равновесные концентрации ионизированной кислоты, протонов и неионизированной (т.е. «интактной») кислоты соответственно. Kа таким образом, предлагает меру «энтузиазма» кислоты разгрузить протоны и, следовательно, ее силу; чем сильнее диссоциирует кислота в состоянии равновесия, тем выше числитель по отношению к знаменателю в этом уравнении и тем выше Kа.
Расчет pH по pKa: уравнение Хендерсона-Хассельбаха
Вывод задействован, но Уравнение Хендерсона-Хассельбаха связывает эти количества следующим образом:
pH = pKa + log_ <10>dfrac <[A ^ <]>
pH = 4,75 + log10 (0.1) = 4.75 + (−1) = 3.75