Что такое nmda рецепторы
NMDA-рецептор
NMDA-рецептор (NMDAR; НМДА-рецептор) — ионотропный рецептор глутамата, селективно связывающий N-метил-D-аспартат (NMDA).
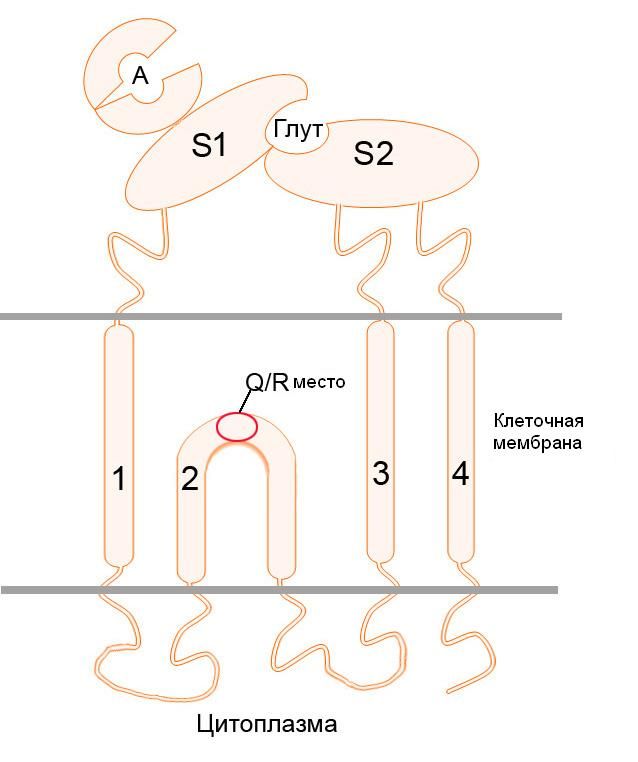
Структурно NMDA-рецептор представляет собой гетеротетрамер двух субъединиц — NR1 и NR2. В неактивированной форме канал рецептора закрыт ионом магния.
Этот процесс играет ключевую роль в синаптической пластичности, а следовательно и в процессах обучения и памяти. В отличие от других рецепторов, NMDAR одновременно восприимчив к лигандам и к изменению мембранного потенциала (англ. voltage-dependent ).
Альтернативный сплайсинг порождает множественные изоформы NR1, что вкупе с неоднородной экспрессией NR2 обуславливает различную структуру рецепторов в разных областях нервной системы.
В период эмбрионального и постнатального развития мозга отмечается изменение конструкции рецептора, в нём снижается число субъединиц NR2B, NR2D, NR3A, растёт число единиц NR2A и NR2C. Эти изменения различаются в разных областях мозга и подтипах нейронов, и происходят под действием разных факторов: так, в гранулярных клетках мозжечка замена NR2B на NR2C предположительно происходит под воздействием нейрегулинов. Множество работ посвящено возрастной смене преобладания NR2B на NR2A при созревании возбуждающих синапсов. [1] :163 Возможно, это изменение связано с действием рилина. [2] [3] [4]
NMDA рецептор в нейропсихиатрии
Некоторые нейротрансмиттеры связаны с развитием психотических симптомов, причем дофамин и серотонин являются наиболее изученными из-за лечебного эффекта блокирования определенных подтипов этих рецепторов антипсихотиками. К сожалению, длительное лечение типичными или атипичными антипсихотиками ограничено из-за профиля побочных эффектов и высокой частоты прекращения лечения со стороны пациента. NMDA рецепторы также участвуют в развитии психотических симптомов и являются потенциальной мишенью для разработки новых методов лечения в будущем.
Известно, что NMDA-рецептор играет важную роль в регуляции передачи сигнала во многих областях мозга. Соответственно, любая гомеостатическая дисфункция активности рецептора NMDA может привести к различным патологиям. Отметим, что исследователи обнаружили особенно высокую концентрацию постсинаптических NMDA-рецепторов в лимбических структурах.
Антагонисты N- метил- d- аспартатного рецептора представляют категорию соединений, которые функционально ингибируют или дезактивируют активность рецептора NMDA. Они могут действовать широко или специфически на различные сайты рецептора NMDA, включая агонист-связывающие домены, аллостерические сайты и поры ионных каналов. Эта категория соединений ( препаратов) иожет применяться при любом заболевании, которое возникает в результате вызванной глутаматом эксайтотоксичности, от церебральной ишемии и эпилепсии до нейродегенеративных расстройств и невропатической боли. Более поздние разработки сосредоточены на уже субъединичных специфических соединениях, включая NR2B-селективные антагонисты, которые привели к минимизации побочных эффектов с повышенной терапевтической эффективностью. Агонисты NMDA-рецепторов, с другой стороны, относятся к категории соединений, нацеленных на NMDA-рецепторы, которые могут усиливать рецепторную активность. Интересно отметить, что некоторые психические расстройства можно лечить как антагонистами, так и агонистами NMDA-рецепторов. Эти двухфазные нарушения в отношении активности рецептора NMDA могут требовать индивидуальных протоколов лечения в зависимости от стадии заболевания.
Шизофрения
Первоначальные данные в поддержку более новой гипотезы о гипофункции глутамата при шизофрении были получены из сообщений о низких уровнях глутамата в спинномозговой жидкости у пациентов с шизофренией. Дальнейшие исследования подтверждают эту теорию и показывают, что введение антагонистов NMDA-рецепторов, включая фенциклидин (PCP) и кетамин, пациентам с шизофренией приводило к усилению психотических симптомов. Дополнительные исследования показывают, что введение подобных антагонистов здоровым пациентам продуцирует симптомы шизофрении, включая позитивные, негативные и когнитивные симптомы. Основываясь на этих данных, более современные фармакологические подходы, направленные на лечение шизофрении, фокусируются на использовании агонистов NMDA-рецепторов. Однако, прямая активация рецептора и сообщаемая эксайтотоксичность предполагают необходимость более конкретно исследовать сайт связывания глицина как потенциально более безопасную косвенную мишень для лечения нарушений гипофункции глутамата. Ряд исследований в настоящее время изучают этот механизм как средство лечения симптомов с минимальными побочными эффектами.
Аффективные расстройства
Болезнь Хантингтона
Химические модуляторы памяти
Гиппокамп — одна из ключевых структур мозга, отвечающих за работу памяти. На рисунке — срез гиппокампа кролика (вид под микроскопом): показаны пирамидные клетки. Автор рисунка — нобелевский лауреат 1906 года Камилло Гольджи.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Нейробиологи и фармакологи давно работают над созданием веществ, способных оказывать влияние на память. В статье рассмотрены представители некоторых известных на сегодня классов позитивных и негативных химических модуляторов памяти, изменяющих долговременную потенциацию пирамидных клеток гиппокампа. Приводится механизм их действия, область применения и классификация.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Зачем нужно изменять память?
Вся человеческая деятельность основана на способности мозга хранить однажды полученную информацию, т.е. на памяти. Интересно поразмышлять, насколько далеко шагнул бы прогресс, если бы после сна все наши воспоминания стирались. К счастью, этого не происходит, так как мозг умеет успешно переводить информацию из кратковременной памяти в долговременную. Полагают, что эту функцию осуществляет гиппокамп — небольшое, но очень древнее в эволюционном плане образование, которое имеется в каждом из двух полушарий. В ответ на информационный стимул происходит возбуждение некоторого числа пирамидных клеток гиппокампа, которое далее передаётся в кору, где и хранится, ожидая своего часа [1].
Но раз память — одно из важнейших свойств нашего мозга, необходимое для нормального функционирования, значит, любое влияние, которое она будет испытывать, должно самым существенным образом сказываться на нашей обыденной жизни. Увы, избежать многих негативных влияний невозможно: травмы, болезни (например, болезнь Альцгеймера), не всегда здоровый образ жизни, старость — всё это медленно, но верно ослабляет память и ухудшает нашу адаптацию к существующим условиям, поэтому вполне закономерной является задача противостоять этим влияниям и не давать памяти ослабнуть. Правда, некоторые воспоминания, связанные с неприятными, порой угрожающими жизни событиями, являются для психики травмирующими, и их хочется поскорее забыть.
Позитивная и негативная модуляция памяти объективно необходимы для продолжения нормальной жизнедеятельности, в том числе при многих заболеваниях. Рассмотрим, какими химическими средствами можно модифицировать память и каким образом эти средства действуют.
Как работает долговременная потенциация
В основе памяти лежит физиологическое явление, которое носит название долговременной потенциации (ДП). ДП — это явление, при котором проведение нервного импульса между нейронами приводит к резкому усилению проведения последующих импульсов в образованном ими синапсе [2]. Основным игроком этого процесса, протекающего в гиппокампе (а также в других частях мозга), является пирамидная клетка, на мембране которой находится две разновидности глутаматных рецепторов: AMPA- и NMDA-рецепторы.
При развитии ДП происходят следующие события (рис. 1):
Поступающие внутрь пирамидной клетки ионы кальция вызывают в ней изменения, которые приводят к ещё большему увеличению проводимости синапса за счёт усиления активности существующих рецепторов, увеличения количества AMPA-рецепторов и увеличения площади самого синапса.
Рисунок 1. Механизм развития долговременной потенциации (high frequency stimulation producing LTP)
Каким же образом ДП обеспечивает запоминание? ДП упрочняет связи между нейронами и ускоряет проведение нервного импульса по цепочкам нейронов, принявших совместное участие в передаче информации. В дальнейшем проведение нервного импульса по этим цепочкам будет происходить с меньшим количеством задержек и ошибок, т.е., к примеру, однажды воспроизведённая информация может быть повторена c большей лёгкостью.
Много не значит хорошо
Казалось бы, нет ничего проще, чем усилить ДП, а значит и память, путём непосредственной стимуляции AMPA- и NMDA-рецепторов. Однако по двум причинам такой подход используется ограниченно.
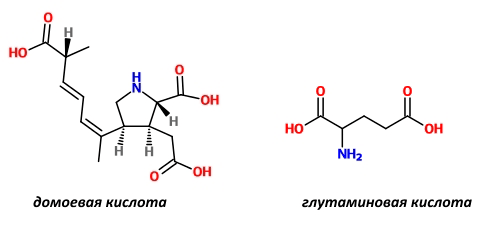
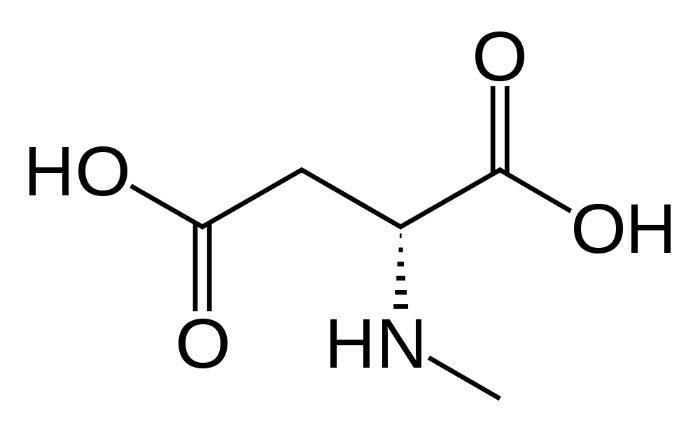
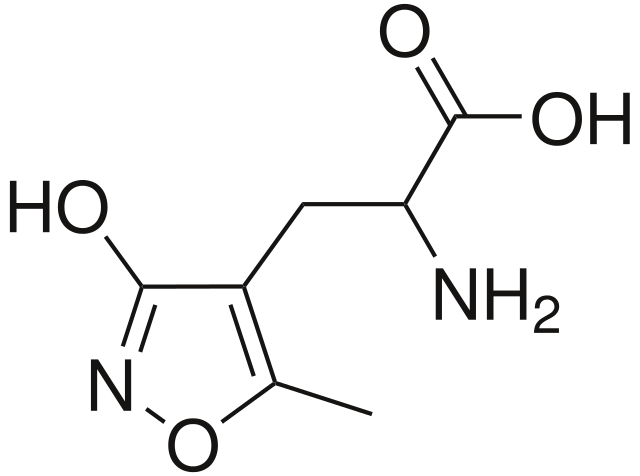
Во-первых, чрезмерная стимуляция AMPA- и NMDA-рецепторов может привести к неконтролируемому всплеску активности нейронов, а это чревато развитием судорог. Таким влиянием обладают некоторые токсины водорослей, например, домоевая кислота, имеющая высокое сродство к AMPA-рецепторам [3] (рис.2).
Рисунок 2. Домоевая и глутаминовая кислоты
Во-вторых, избыточная активация NMDA-рецепторов вызывает поступление в пирамидные клетки слишком большого количества ионов кальция, что для них весьма губительно. Явление гибели нейронов под действием избытка ионов кальция получило название «эксайтотоксичность» (от англ. to excite — возбуждать).
Тем не менее, вещества, так или иначе способствующие деполяризации пирамидных клеток, будут усиливать ДП, а соединения, приводящие к их гиперполяризации — наоборот, будут её ослаблять.
Модуляторы памяти, действующие на рецепторы гамма-аминомасляной кислоты и глутамата
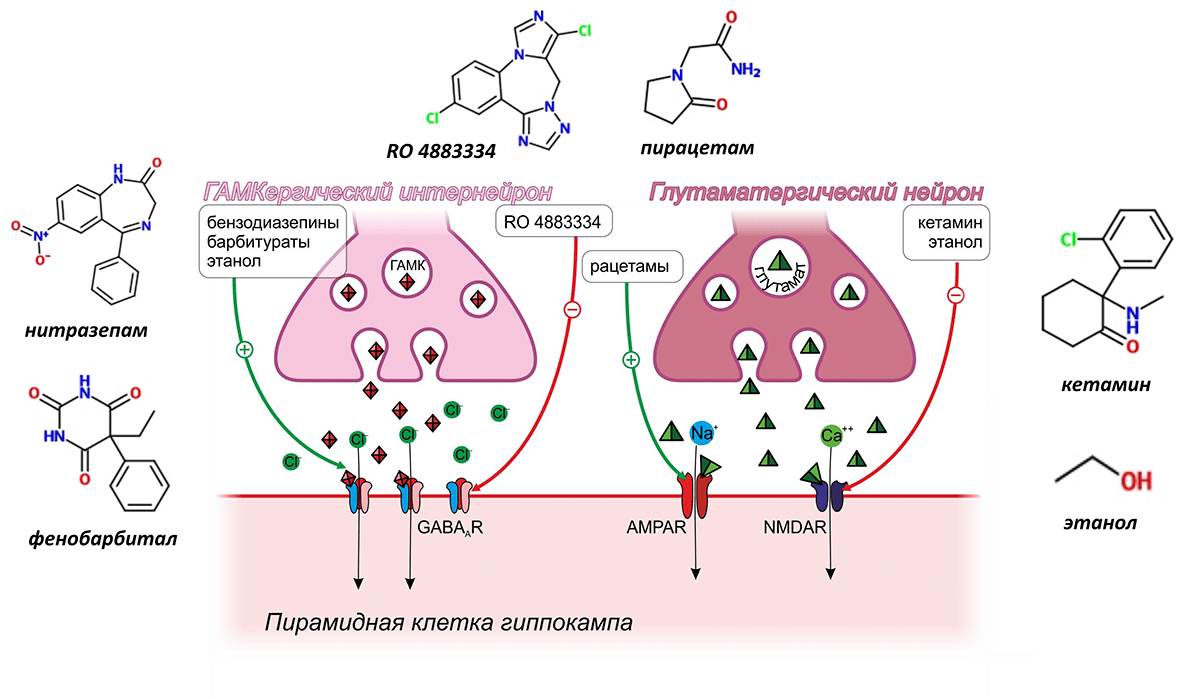
Действие всех модуляторов памяти так или иначе затрагивает проведение импульса пирамидной клеткой. Подробнее рассмотрим ту группу веществ, которые оказывают непосредственное влияние на рецепторы глутамата и γ-аминомасляной кислоты (ГАМК) (рис. 3).
Рисунок 3. Модуляторы памяти, действующие на рецепторы ГАМК и глутамата
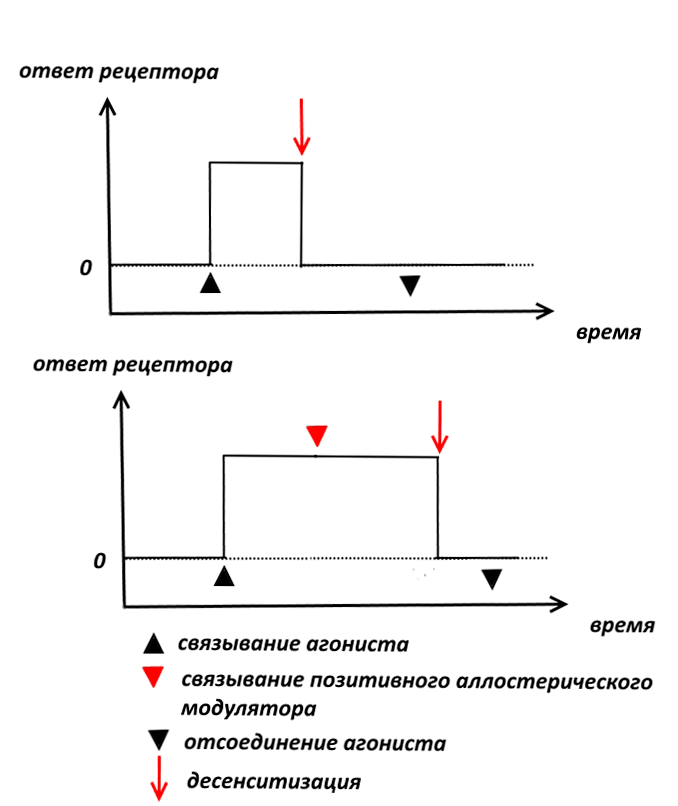
Наиболее известными специфическими позитивными модуляторами памяти являются рацетамы, родоначальник которых, пирацетам, разработан бельгийской компанией UCB в конце 60-х годов прошлого века [4]. Механизм действия рацетамов связан с аллостерической модуляцией AMPA-рецепторов, в результате которой уменьшается время, в течение которого рецептор находится в десенситизированном (от лат. sensus — чувство, ощущение) состоянии (рис. 4).
Рисунок 4. Позитивные аллостерические модуляторы рецепторов могут замедлять наступление десенситизации и отсоединение агониста
Если связь рецептора с агонистом, т.е. веществом, которое приводит его в активное состояние, длится достаточно долго, то рецептор переходит в неактивное, так называемое десенситизированное состояние. Десенситизация рецепторов призвана защитить нервную систему от перевозбуждения.
Физиологически активному веществу не обязательно присоединяться к рецептору в том же самом месте, в котором действует агонист. В данном случае присоединение пирацетама и родственных соединений к AMPA-рецепторам происходит в аллостерическом центре (от греч. allos — другой), что затрудняет десенситизацию, в результате чего рецептор дольше находится в активном состоянии [5].
Рацетамы применяются главным образом в Европе и в бывших странах СССР для лечения различных форм деменций, в том числе начальных стадий болезни Альцгеймера, однако существенного замедления развития болезни они не вызывают и используются в основном как вспомогательные препараты [4].
Широкое применение, но уже в качестве негативного модулятора памяти, вызывающего амнезию, нашёл антагонист NMDA-рецепторов кетамин, используемый в качестве средства для наркоза при хирургических вмешательствах [6]. Кетамин встраивается в ионный канал NMDA-рецептора, не давая ионам кальция пройти внутрь пирамидной клетки, делая ДП невозможной.
Пирамидные нейроны гиппокампа интегрируют сигналы, которые являются не только возбуждающими, но и тормозящими. Тормозящие сигналы исходят от вставочных нейронов, выделяющих в синаптическую щель ингибиторный нейромедиатор — ГАМК. И если возбуждающий нейромедиатор вызывает приток в нервную клетку положительно заряженных ионов, то ГАМК через соответствующие ГАМКергические рецепторы открывает путь отрицательно заряженным хлорид-ионам. Их поступление затрудняет последующее возбуждение нейрона и проведение нервного импульса.
К группе негативных модуляторов памяти, которые влияют на рецепторы ГАМК, относятся бензодиазепины (например, нитразепам) и барбитураты (например, фенобарбитал). Как первые, так и вторые являются позитивными аллостерическими модуляторами рецепторов ГАМК, усиливающими за счёт поступления хлорид-ионов гиперполяризацию пирамидных клеток гиппокампа. Производимый этим веществами эффект настолько силён, что они могут вызывать не просто нарушения памяти, а потерю сознания и сон, и поэтому находят широкое применение в медицине в качестве анестезиологического пособия и снотворных препаратов [6]. Позитивным аллостерическим модулятором рецепторов ГАМК является и уже упомянутый этанол, входящий в состав алкогольных напитков [8].
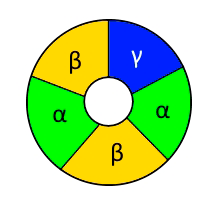
Рисунок 5. Схематическое изображение рецептора ГАМК, состоящего из двух α-, двух β- и одной γ-субъединицы. В центре — канал для хлорид-ионов.
Попытки усилить ДП, а значит, и память путём подавления ГАМКергической передачи начали предприниматься относительно недавно. Причина этого связана с тем, что ингибирование рецепторов ГАМК может запросто привести к таким опасным побочным эффектам как судороги из-за нарушения процессов торможения.
Рецепторы ГАМК, как и рецепторы многих других нейромедиаторов, являются белками с четвертичной структурой и состоят из нескольких различных субъединиц, которые могут варьировать от рецептора к рецептору (рис. 5) [9]. Оказалось, что память и другие когнитивные процессы контролируются преимущественно теми рецепторами ГАМК, которые состоят из α5, β и γ2 субъединиц. Опыты на животных показали, что если избирательно заблокировать их, то судороги развиваться не будут, а память улучшится. Однако такие селективные блокаторы (например, вещество RO 4882224 [10]) пока не вышли за пределы исследовательских лабораторий.
Модуляторы памяти, действующие косвенным способом
По причинам, изложенным выше, активно продолжают разрабатываться те модуляторы памяти, которые непосредственно не связываются с глутаматными рецепторами или рецепторами ГАМК. Такие модуляторы памяти можно классифицировать в зависимости от того, на какие другие рецепторы центральной нервной системы или ионные каналы они действуют.
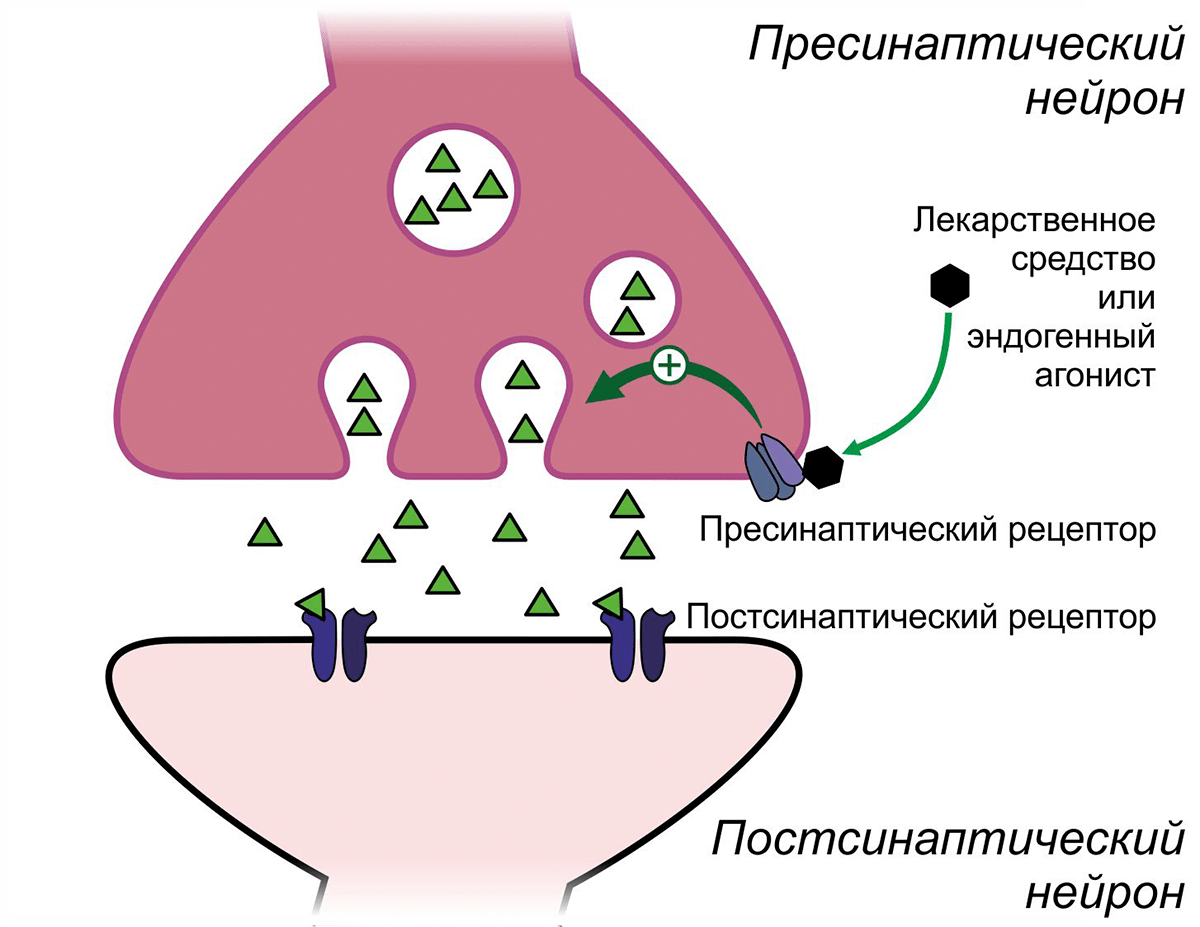
На мембране многих пресинаптических нейронов, передающих нервный импульс другим нейронам, расположены рецепторы, которые регулируют высвобождение нейромедиатора. Путём воздействия на эти пресинаптические рецепторы можно добиться как усиления, так и ослабления этого процесса (рис. 6).
Рисунок 6. Регуляция высвобождения нейромедиатора пресинаптическими рецепторами
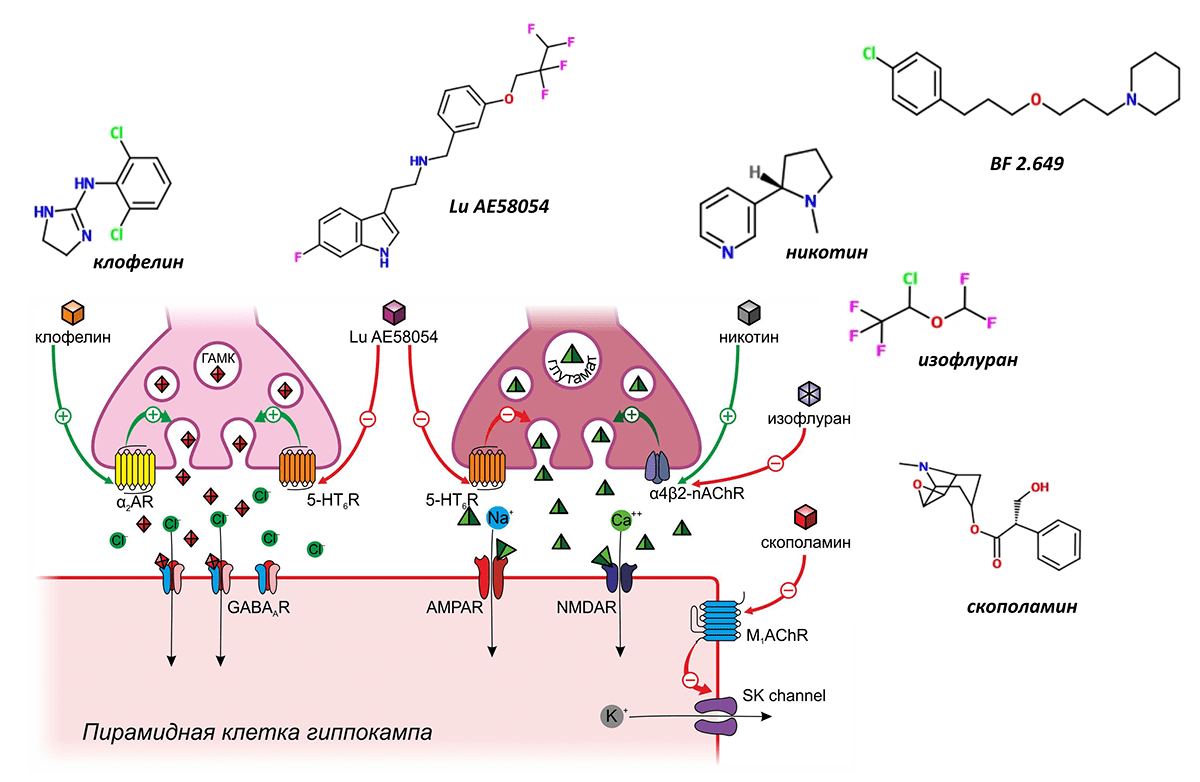
Широко известным негативным модулятором памяти, опосредующим свои эффекты через α2-адренергические рецепторы, является клофелин — герой многочисленных криминальных эпизодов. Этот препарат, созданный для снижения артериального давления, активируя пресинаптические α2-адренергичекие рецепторы ГАМКергических вставочных нейронов, способствует выделению ГАМК, что подавляет активность пирамидных нейронов, вызывая тем самым амнезию (рис. 7) [11]. В настоящее время рассматривается возможность применения клофелина для подавления негативных воспоминаний при посттравматических расстройствах [12].
Рисунок 7. Модуляторы памяти, действующие косвенным способом
Второй мишенью, регулирующей, как полагают, одновременно выделение тормозных и возбуждающих нейромедиаторов, являются серотониновые 5-HT6-рецепторы. Считается, что стимуляция этих пресинаптических рецепторов стимулирует выброс ГАМК и одновременно предотвращает выброс глутамата в синаптическую щель, что в конечном итоге приводит к торможению ДП. В настоящее время проводятся многочисленные клинические испытания блокаторов серотониновых 5-HT6-рецепторов для лечения когнитивного дефицита при болезни Альцгеймера и шизофрении. В наиболее продвинутой III фазе таких испытаний находится вещество Lu AE58054 (рис. 7) [13], [14].
Тем не менее известный противоаллергический препарат димебон, также обладающий способностью блокировать серотониновые 5-HT6-рецепторы (а также α-адренорецепторы, H1-гистаминвые рецепторы и некоторые другие), в подобных клинических исследованиях потерпел фиаско [15].
Как-то мы писали об исследовании, в котором продемонстрирована когнитивная роль никотина, позволяющая людям лучше сконцентрироваться на решении различных задач: «Спасибо, дорогой Минздрав, что предупредил!» [24]. — Ред.
Многогранно влияние на ДП и, следовательно, память, веществ, вмешивающихся в работу гистаминовых рецепторов [20]. Наибольшее внимание в качестве модуляторов памяти привлекают антагонисты H3-гистаминовых рецепторов. H3-гистаминовые рецепторы расположены пресинаптически и регулируют высвобождение многих других нейромедиаторов, оказывающих влияние на долговременную потенциацию, в том числе глутамата, ГАМК и ацетилхолина. И хотя точный механизм позитивного влияния антагонистов H3-гистаминовых рецепторов на память остаётся неизвестным, это не мешает им успешно продвигаться в клинических испытаниях. Так, например, препарат BF 2.649 в настоящее время находится в III фазе испытаний в качестве лекарственного средства при шизофрении и болезни Паркинсона [21] (рис. 7).
Мембрана нервных клеток содержит большое количество ионных каналов, не являющихся частью рецепторов. Регулируя их работу, можно также управлять памятью. В качестве примера такого регулятора можно привести скополамин — алкалоид, встречающийся в растениях семейства паслёновых и хорошо знакомый исследователям, изучающим память. Скополамин часто используют для моделирования нарушений памяти у лабораторных животных, однако механизм его действия был раскрыт не так давно (рис. 7). Мембрана пирамидных клеток содержит кальций-зависимые калиевые каналы малой проводимости (КЗКМП), которые активируются ионами кальция при связывании их с внутриклеточными доменами каналов. Активация КЗКМП вызывает утечку ионов калия, создающих необходимый для поддержания ДП трансмембранный потенциал, и поэтому ослабляет память. КЗКМП находятся под контролем мускариновых ацетилхолиновых рецепторов. Посредством G-белков мускариновые рецепторы активируют протеинкиназу, фосфорилирующую внутриклеточный домен каналов, что блокирует связывание кальция и мешает пропускать ионы калия. Скополамин ингибирует мускариновые рецепторы, фосфорилирование внутриклеточного домена прекращается, КЗКМП начинают интенсивно работать, выкачивают из клетки калий, чем затрудняют ДП и вызывают нарушение памяти [22].
Заключение
Таким образом, в зависимости от того, какой эффект (усиление или ослабление) оказывает то или иное соединение на память, все химические модификаторы могут быть разделены на позитивные и негативные. Изменение ГАМКергической и глутаматергической передач, регулирующих ДП, под действием модуляторов памяти может осуществляться как непосредственным связыванием с соответствующими рецепторами, так и косвенным способом. В последнем случае модуляция может осуществляться двумя путями:
Нерешённые проблемы
Как следует из обзора, в настоящее время известно большое количество модуляторов памяти, которые могут единообразно воздействовать на многие биологические мишени. Но можно ли считать достигнутый на сегодня результат удовлетворительным? Едва ли. Перечислю круг тех проблем, которые ещё предстоит решить тем, кто разрабатывает модуляторы памяти.
Во-первых, вещества, усиливающие память и применяемые при нейродегенеративных заболеваниях, в подавляющем большинстве не устраняют главную их причину — гибель нервных клеток. Эффективность таких препаратов не может быть высокой, так как при уменьшении числа нейронов ниже критического уровня исчезают и мишени этих лекарственных средств.
Во-вторых, очень актуальна проблема позитивной модуляции памяти здоровых лиц, которые хотят расширить свои возможности при решении профессиональных задач. Большинство улучшающих память препаратов изучается на животных, у которых смоделирована та или иная болезнь, а также на пациентах в ходе клинических испытаний. Но до сих пор отсутствуют подходы к созданию веществ, которые могут повышать «базовый» уровень памяти у людей, не отягощённых заболеваниями.
В-третьих, пока не разработан способ избирательного стирания конкретных воспоминаний.
Надеюсь, что мой обзор подвигнет молодых читателей на решение связанных с модуляцией памяти вопросов и, быть может, станет отправной точкой для их будущих исследований.
Глутаматные рецепторы
Глутамат натрия владеет умами
Как много сплелось в этом слове для нашего человека! Одни боятся «страшного и ядовитого глутамата натрия» как огня, другие же являются ценителями вкуса “умами”. Автор даже слышал истории о том, как некоторые счастливчики смогли выкрасть с работы в колбасном цеху целый килограмм глутамата!
Глутамат (он же глутаминовая кислота) впервые был открыт немецким химиком Карлом Генрихом Раттгаузеном в 1866 году. Он изучал продукты взаимодействия глютена (смеси белков, получаемых из злаковых растений) с серной кислотой. В 1907 году японец Икэда Кикунаэ, изучая состав водорослей комбу и их применение в пищевой промышленности, решил попробовать на вкус кристаллы, оставшиеся после выпаривания бульона из водорослей. К его удивлению, вкус оказался таким же, как и у цельных кусков комбу, используемых в кулинарии. Позднее, идентифицировав состав осадка, Икэда понял, что выделил глутамат. Позднее он улучшил и запатентовал свой метод получения глутамата из водорослей (именно тогда при очистке сырья глутамат начали переводить в форму натриевой соли). Этот метод интересен также и тем, что был применён в первом производстве бульонных кубиков в Японии. Японцы, кстати говоря, очень высоко оценили такой вкус и даже придумали для него слово “умами”, дословно – приятный вкус.
Впервые глутамат был обнаружен в организме животных в 1940-х годах. В 50-х было установлено, что наибольшие его концентрации отмечаются в органах, составляющих нервную систему. В конце 50-х годов группа учёных под руководством Дэвида Кёртиса и Джефри Уоткинса установила, что глутамат может выполнять роль нейротрансмиттера в нервной системе. В своих опытах на изолированном спинном мозге жабы учёные впервые наблюдали эффекты глутамата in vivo: в концентрациях 10-2 – 10-4 М вещество сначала возбуждало нейроны, а затем, подобно открытой и описанной ранее ГАМК, проявляло тормозящие свойства. В дальнейшем те же учёные провели опыт на изолированных клетках Реншоу – вставочных нейронах спинного мозга, регулирующих мышечный тонус путём выброса глицина, тормозного нейромедиатора. Эти клетки к тому времени были достаточно хорошо изучены: о них уже было известно то, что они являются тормозными нейронами и что их активность избирательно стимулируется ацетилхолином. В процессе опытов in vitro выяснилось, что они, как оказалось, могут также быть активированы и глутаматом в достаточных концентрациях! Интересно, что была проведена серия опытов не только с L-глутаматом, который и присутствует в нервной системе в нормальных условиях, но и с его D-изомером. Также были опыты с L- и D-изомерами аспартата, который структурно схож с глутаматом. Таким образом, изначально глутамат и близкие к нему по структуре соединения получили название «возбуждающие аминокислоты» (excitatory amino acids). В 70-х годах было выдвинуто предположение о разделении рецепторов возбуждающих аминокислот на NMDA и не-NMDA. Данное предположение было основано на опытах с единичными нейронами из разных отделов нервной системы: N-метил-D-аспартат в тех же концентрациях, что и глутамат, возбуждал нейроны спинного мозга сильнее, нежели чем нейроны мозга головного. Также выяснилась интересная вещь: избирательные блокаторы NMDA-рецепторов блокировали только их, в то же время неизбирательные блокаторы рецепторов возбуждающих аминокислот подавляли активность нейронов как в спинном, так и в головном мозге. При скрининге активности производных различных аминокислот среди NMDA-рецепторов были выделены ещё два класса – каинатные рецепторы (возбуждаются каиновой кислотой) и АМРА-рецепторы (возбуждаются альфа-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислотой). В начале 80-х годов выявлена роль глутаматных рецепторов в феномене долговременной потенциации (LTP), когда при повторяющемся выбросе нейромедиаторов с пресинаптического нейрона на постсинаптический он начинает возбуждаться при меньших концентрациях нейромедиатора. Этот эффект лежит в основе явления синаптической пластичности и может быть описан правилом Хэбба: «Если аксон клетки А расположен достаточно близко к клетке Б, чтобы возбуждать её, и постоянно участвует в её активации, то в одной или обеих клетках происходят такие метаболические изменения или процессы роста, что эффективность А как одной из клеток, активирующих Б, повышается». Таким образом, глутаматергические нейроны являются одним из главных звеньев процессов обучения и запоминания. В 90-х, благодаря применению молекулярно-биологических методов изучения работы рецепторов глутамата, они были разделены на ионотропные (iGlu) и метаботропные (mGlu). К ионотропным (т.е. представляющим собой ионный канал) рецепторам отнесли NMDA, AMPA и каинатные. К метаботропным – все остальные, которые разделили на 3 группы в зависимости от наблюдаемых при возбуждении эффектов.
NMDA-рецепторы
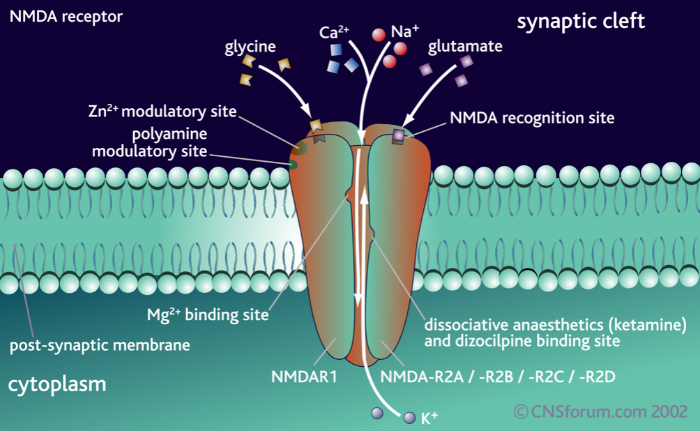
Данный тип рецепторов глутамата представляет собой одновременно потенциал-зависимый и лиганд-зависимый ионный канал, избирательно пропускающий положительно заряженные ионы. Исключение составляют ионы магния и цинка, которые, находясь вне клетки, выступают в качестве блокаторов. Таким образом, основную часть ионного тока составляют ионы кальция и натрия – их данный ионный канал пропускает внутрь клетки, и ионы калия – их он из клетки выпускает. Стоит отметить интересную особенность NMDA-рецептора: он не может быть активирован лишь одной молекулой лиганда. Для открытия ионного канала необходимо два лиганда на разных субъединицах. Лигандами могут быть только D-изомеры аминокислот-нейромедиаторов.
Структурно NMDA-рецептор состоит из четырёх субъединиц, две из которых являются представителями класса NR1, и две другие – представителями класса NR2. В середине нулевых также был выделен новый класс субъединиц – NR3, о нём мы поговорим отдельно.
На внеклеточной части рецептора расположены сайты связывания различных модуляторов и агонистов. Здесь у субъединиц NR2 расположен сайт связывания глутамата, аспартата и собственно N-метил-D-аспартата, а у субъединиц NR1 – сайт связывания ко-агониста – глицина или серина.
Трансмембранная часть формирует ионный канал, и также стоит отметить, что именно эта часть рецепторного белка богата сайтами связывания различных агонистов – от всем известных анестетика кетамина и диссоциатива PCP (фенциклидин) до модельных NMDA-блокаторов, таких как MK810, который часто используют в фармакологических исследованиях. Наконец, внутриклеточная часть NMDA-рецептора: она является регуляторной и может взаимодействовать с различными киназами и фосфатазами, которые путём фосфорилирования или дефосфорилирования влияют на активность ионного канала.
С этим типом субъединиц связан интересный феномен. В мозге новорождённых и молодых млекопитающих в составе NMDA-рецепторов преобладает NR2B-субъединица. При активации рецепторов, которые содержат эту субъединицу, соответствующие каналы остаются в открытом положении гораздо дольше. Кроме того, нейроны с такими рецепторами быстрее развивали долговременную потенциацию. Однако с возрастом большая часть NR2B-субъединиц в рецепторных комплексах заменяется на NR2C и NR2A. Это отчасти объясняет снижение с возрастом способностей к обучению, так как долговременная потенциация является одним из ключевых механизмов в процессе запоминания. Не стоит думать, что такая «замена» направлена исключительно во вред организму – в опытах in vivo и in vitro установлено, что клетки с NR2B-субъединицами не имеют никакой защиты от эксайтотоксичности, в то время как преобладание рецепторной субъединицы NR2A значительно повышало порог, при котором наступала клеточная гибель.
GluN3, он же NR3 – это относительно недавно открытая группа белков, существующих в вариантах NR3A и NR3B и являющихся субъединицами NMDA-рецептора. У генов белков субъединиц третьей группы наблюдается наименьшая гомология с остальными генами субъединиц не только NMDA-рецептора, но и других глутаматных ионотропных рецепторов. Интересно также, что гомология между генами белков этой группы меньше, чем гомология внутри остальных групп. Однако, как и во второй группе, соотношение различных вариантов субъединиц также изменяется с возрастом.
Относительное изменение количества различных вариантов NR3-субъединицы с возрастом.
Как видно из вышеприведенных абзацев, NMDA-рецепторы со временем изменяют свой состав и комбинации субъединиц. Это нормальное явление, наблюдаемое не только у человека, но и у других позвоночных. К сожалению, конкретный механизм такой замены ещё не до конца ясен, а самое главное – пока что не выявлены эпигенетические механизмы, лежащие в основе таких изменений.
Лиганды NMDA-рецепторов
Помимо этих известных препаратов, в клиническом использовании до сих пор находятся флупиртин (анальгетик) и мемантин (используется для лечения деменций различного генеза). Интересно также, что в опытах на животных NMDA-антагонисты эффективно предотвращали гибель нейронов от эксайтотоксичности, однако при длительном и частом введении в больших количествах они вызывали специфическое поражение ЦНС, названное лезиями Олни (в честь учёного, впервые их описавшего – Джона Олни). В отдельных публикациях были описаны т.н. пограничные морфологические состояния. Например, у крыс после длительной анестезии оксидом азота (I) наблюдалась вакуолизация цитоплазмы нейронов – обычно после данного процесса происходит гибель нейронов путем некроза или апоптоза.
Агонисты NMDA-рецепторов в клинике практически не используются. В 2015 году был зарегистрирован препарат небогламин. В опытах на животных он показал способность ускорять обучение и процессы запоминания. Также в процессе испытаний была выявлена способность небогламина избавлять от кокаиновой зависимости.
Рецепторы, содержащие в своём составе GluR1-субъединицу, обнаруживаются чаще всего в гранулярных и пирамидальных клетках гиппокампа.
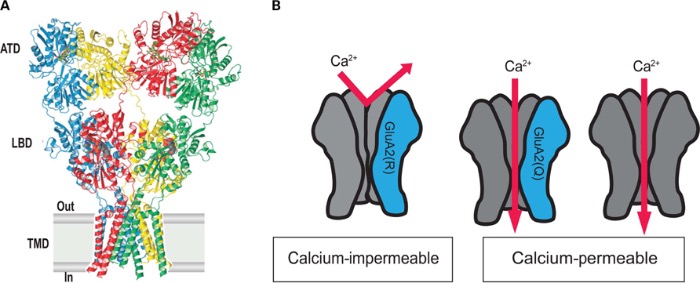
Субъединица GluR2 является необходимой для группы АМРА-рецепторов, которые не пропускают ионы кальция. Интересно, что перед началом трансляции мРНК гена данной субъединицы взаимодействует с белком ADAR (аденозилдезаминаза РНК), который заменяет триплет CAG на CIG (аденозин заменяется на инозин). Соответствующие изменения наступают и в структуре белка – глутамин в 607-й позиции заменяется на аргинин, также, в 764 позиции аргинин заменяется на глицин. В опытах на трансгенных мышах, у которых данный процесс редактирования мРНК был нарушен и АМРА-рецепторы с GluR2-субъединицей были проницаемы для ионов кальция, у животных наблюдались симптомы, схожие с амиотрофическим боковым склерозом. Данная замена аминокислот затрагивает структуру самого ионного канала, а точнее – сайта, ответственного за пропуск ионов с зарядом 2+. Таким образом, нейроны с дефектной GluR2-субъединицей, пропускавшей ионы кальция, были подвержены «физиологической» эксайтотоксичности вследствие повышенной концентрации глутамата в синапсе, которая в нормальных условиях не возникала благодаря избирательной блокаде входа кальция в клетку через конкретно этот тип каналов. Интересно, что при полном выключении редактирования мРНК GluR2, когда не происходило замен глутамин-аргинин и аргинин-глицин, трансгенные мыши умирали в младенчестве от судорог. Такая же замена была обнаружена и при изучении синтеза субъединиц каинатных рецепторов GluR5 и GluR6, однако у них данная замена, наоборот, увеличивает пропускную способность ионного канала в отношении Ca2+. Антитела к GluR2 также используются при иммуногистохимическом выявлении солитарной фиброзной опухоли (SFT) и выбухающей дерматофибросаркомы (DFSP).
Структура AMPA-рецептора, Q/R – название места замены глутамина на аргинин.
Рецепторы с GluR2, прошедшим на уровне мРНК правильную обработку, непроницаемы для ионов кальция.
GluR3-субъединица.
Эта субъединица, как и GluR2, проходит редактирование на уровне мРНК. Замена в данном случае также происходит благодаря ферментам группы ADAR. В данном случае – ADAR3, который находится исключительно в тканях нервной системы. Однако здесь замена носит необязательный характер – лишь в 80% случаев мРНК субъединиц GluR2 проходят соответствующее редактирование. Разница между отредактированными и неотредактированными субъединицами никак не отражается на выживаемости клетки: у рецепторов с отредактированными субъединицами состояние десенсибилизации длится короче.
GluR4-субъединица.
Специфических отличий от GluR2 и GluR3 субъединиц нет. У GluR4 обнаружена высокая гомология с генами этих субъединиц. Так же, как и GluR3, может встречаться в редактированном и неотредактированном варианте, в обоих случаях влияния на выживаемость нейрона не обнаружено. Согласно исследованиям японских генетиков, у гена субъединицы GluR4 существует 6 SNP-мутаций, которые повышают риск развития шизофрении.
АМРА, наряду с NMDA-рецепторами, является одним из главных звеньев в механизме долговременной потенциации, а значит, и в механизме запоминания. Долговременная потенциация (LTP) выражается в увеличении возбуждающего постсинаптического потенциала в ответ на какой-либо повторяющийся стимул. Согласно современным теориям, LTP в первую очередь связывают с апрегуляцией (увеличением плотности) АМРА-рецепторов на мембране постсинаптического нейрона.
Упрощённо механизм апрегуляции выглядит примерно так: на постсинаптическом нейроне находятся NMDA и АМРА-рецепторы и глутамат возбуждает АМРА-рецептор (NMDA в это время остаётся закрытым благодаря иону магния в ионном канале), и в клетку устремляются ионы натрия, что вызывает деполяризацию. Деполяризация мембраны как бы выталкивает магний из ионного канала в NMDA-рецепторе, таким образом открывая его для кальция. Кальций, входя в клетку, запускает каскад реакций, ведущий к увеличению плотности АМРА-рецепторов на мембране. Кроме того, кальций запускает работу киназы CaMKII, которая путём фосфорилирования регуляторных участков уже существующих АМРА-рецепторов увеличивает их проводимость.
Установлено, что АМРА-рецепторы, наряду с каинатными, являются также и ключевым звеном, задействованным в патогенезе судорожного синдрома. В настоящее время ведутся разработки новых противоэпилептических препаратов, избирательно блокирующих активность АМРА-рецепторов.
Как и NMDA, и АМРА-рецепторы, каинатный рецептор также является ионотропным. Своё название он получил благодаря каиновой кислоте, которая является первым открытым избирательным агонистом рецепторов данной подгруппы.
Каинатный рецептор состоит четырёх субъединиц, так же как и NMDA и АМРА. Однако не всё так просто – этих субъединиц на самом деле пять, но они могут быть совмещены в тетрамерных комплексах различного состава и по определённым правилам. Каинатный рецептор формирует ионный канал, проницаемый для натрия и кальция.
Стоит отметить, что после 2009 года произошло переименование субъединиц:
Теперь о правилах компоновки – Glu1-3 могут формировать гомотетрамеры, т.е. рецепторы, состоящие, например, только из GluK2 субъединиц. Однако GluK4 и GluK5 такой способности лишены и могут присутствовать лишь в составе гетеротетрамеров (одна GluK4 и три GluK3, например).
GluK1
GluK2
GluK3
Эта субъединица изучена чуть меньше, однако уже известны мутации (замена серина в 310 позиции на аланин), которые повышают риск развития белой горячки после запоев и шизофрении. Также описан случай, когда при генетическом обследовании пациента с отставанием в развитии обнаружилась микроделеция 1p34.3 (регион 34.3, малого плеча 1-й хромосомы), включающий в себя и ген этой субъединицы. Так как в указанном регионе находился только один ген, чьё участие в процессах, происходящих в нервной системе, не подвергается сомнению, то причину отставания в развитии связали именно с его отсутствием.
GluK4
Эта субъединица изучена больше в силу исторических причин – она долгое время считалась первой истинно-каинатной. Таким образом, функции этой субъединицы наиболее изучены клиницистами. Например, выявлены мутации гена этой субъединицы, которые влияют на восприимчивость пациента к циталопраму. Как уже упоминалось выше, каинатные рецепторы являются ключевым звеном патогенеза судорог, но в целом на выживаемость нейрона при эксайтотоксичности не влияют. Так вот эта субъединица является исключением – при избыточной активации рецепторов, её содержащих, эксайтотоксичность наступает. Это было подтверждено опытами на мышах (забавный факт – избирательных блокаторов GluK4 на момент проведения опыта в 2009 году не существовало, исследователи пользовались моноклональными антителами к данной субъединице) – при выключении этой субъединицы нейроны дольше выживали в условиях индуцированной эксайтотоксичности.
GluK5
Я, признаться, был несколько удивлён – несмотря на то, что данная субъединица была открыта еще в 1995 году, по ней крайне мало информации. О клиническом значении этой субъединицы существует лишь одна публикация, и то – с отрицательными результатами исследований корреляции различных SNP в её гене с риском психических и неврологических заболеваний. Однако, существует публикация 2013 года, за авторством учёных из Университета Бордо. Они показали, что фосфорилирование GluK5 с помощью уже упомянутой ранее киназы CaMKII регулирует плотность рецепторов на постсинаптической мембране.
Касательно каинатных рецепторов, для того, чтобы ещё раз подчеркнуть их важность и функции, следует упомянуть такой нейротоксин, как домоевая кислота. Это соединение является сильным агонистом ионотропных глутаматных рецепторов, в основном связывается с каинатными рецепторами гиппокампа, вызывая избыточную активацию этих самых рецепторов и, таким образом, оказывая эксайтотоксическое действие. Помимо общей неврологической симптоматики, частым симптомом отравления является временная антероградная амнезия – неспособность запоминать новую информацию. Механизм действия этого токсина прекрасно подтверждает как роль гиппокампа в процессах запоминания, так и роль глутаматных рецепторов в процессе установления долговременной потенциации.
Про ионотропные глутаматные рецепторы, в целом следует также рассказать о «молчащих синапсах». Это «несозревшие» синапсы, которые содержат NMDA-рецепторы, однако практически лишены АМРА-рецепторов. В таких случаях, даже если глутамат и ко-активатор связываются с NMDA-рецептором, он остаётся закрытым, ионный канал для кальция заблокирован ионом магния – который может отсоединиться лишь в случае смены потенциала благодаря работе АМРА-рецепторов, которых в данном случае нет. Именно поэтому такой синапс и называется «молчащим». Такие синапсы постепенно могут перейти в нормальное активное состояние – достаточно вызвать сильную деполяризацию мембраны, чтобы освободить ионный канал в NMDA-рецепторе для кальция, который затем активирует CaMKII и кальмодулин. А они уже через цепь посредников запустят процесс экзоцитоза везикул с AMPA-рецепторами, в результате которого эти рецепторы будут выставлены на постсинаптической мембране, делая синапс полноценным.
И ещё – среди ионотропных рецепторов глутамата выделено два рецептора-сироты – GluD1 и GluD2. Эндогенные лиганды этих рецепторов ещё не найдены, глутаматом они не активируются, а в эту группу отнесены были лишь по доброте душевной и высокой гомологии. С помощью синтетических лигандов даже выяснена их роль – они отвечают за развитие синаптических связей в мозжечке, главным образом находясь в клетках Пуркинье. В опытах на животных мыши с определённым мутантным вариантом этого рецептора умирали вскоре после рождения – при исследовании мозга было обнаружено значительное уменьшение объёма заднего мозга. Люди добрые, не проходите мимо! Помогите этим рецепторам найти свои эндогенные лиганды!
Метаботропные рецепторы разделены на три группы в зависимости от их механизма работы, гомологии структуры и перечня селективных лигандов. Всего существует три группы:
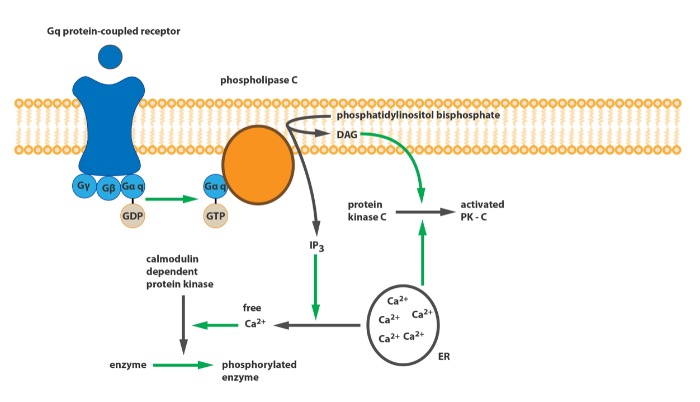
Во-первых, группы рецепторов различаются по механизму действия. Рецепторы первой группы связаны с Gq-белком. При активации тот запускает фермент фосфолипазу С (PLC), который осуществляет расщепление фосфатидилинозитол-4,5-фосфата (PIP2) на диацилглицерол (DAG) и инозитол-1,4,5-трифосфат (IP3). DAG в свою очередь активирует протеинкиназу С (PKC), которая осуществляет фосфорилирование других белков; а IP3 служит агонистом IP3-рецепторов, которые запускают высвобождение кальция из эндоплазматического ретикулума, таким образом, ионы кальция активируют кальмодулин-зависимые протеинкиназы, также участвующие в фосфорилировании белков.
Принципиальная схема работы Gq-связанного рецептора
Остальные группы глутаматных рецепторов, вторая и третья, осуществляют своё действие через Gi-белок. Это означает, что при активации этих рецепторов блокируется работа аденилатциклазы, которая в активном состоянии превращает АТФ в цАМФ. Следовательно, останавливается работа цАМФ-зависимой протеинкиназы (второе название – протеинкиназа А, PKA), и каскад реакций фосфорилирования, изменяющих гомеостаз кальция, не запускается. Исходя из вышеизложенного, можно уяснить различия в эффектах этих рецепторов: при активации рецепторов 1 группы активность NMDA и АМРА-рецепторов увеличивается (в т.ч. за счёт повышения синаптической плотности), но также увеличивается восприимчивость к эксайтотоксичности; при активации рецепторов 2 и 3 групп, наоборот, активность и плотность ионотропных рецепторов уменьшается, также уменьшается вероятность возникновения эксайтотоксического возбуждения.
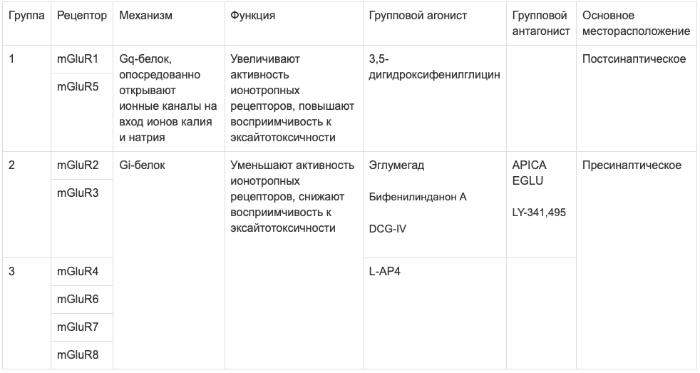
Можно заключить всё в небольшую таблицу.
Касательно групповых агонистов стоит сделать ещё небольшую заметку. Агонисты рецепторов 2 группы в основном проявили себя как антипсихотики – например, бифенилинданон А (BINA) даже смог купировать модельный психоз, вызванный ДОБом, DCG-IV показал себя как антиконвульсант. Однако, оба эти вещества нарушали процессы запоминания. Причём, в отличие от домоевой кислоты, чьё амнестическое действие возникает из-за прямой индукции эксайтотоксичности в нейронах гиппокампа, агонисты метаботропных рецепторов 2 группы лишь блокировали «молекулярный субстрат», необходимый для возникновения долговременной потенциации. Таким образом, можно разделить метаботропные рецепторы на возбуждающие и тормозные, хотя такое разделение лишь условно.
Говорить об отдельных рецепторах можно и вне контекста группы, однако отдельные особенности рассмотреть однозначно стоит.
1 группа
mGluR1
Находится на адренергических нейронах и является положительным модулятором активности соответствующих рецепторов – селективные антагонисты mGluR1 оказывают адренолитическое действие. В исследованиях на мышах, лишённых гена данного рецептора, выявлено отсутствие каких-либо макро- и микроскопических патологий. Однако в тестах на координацию движений и запоминание мыши без этого рецептора показали худшие результаты по сравнению с контрольной группой. Интересно, что имеются сообщения о случаях, когда при болезни Ходжкина организм пациента вырабатывал аутоантитела к mGluR1, что выражалось в виде паранеопластической атаксии. Мутации гена этого рецептора также могут быть причиной рецессивной спиноцеребеллярной атаксии.
mGluR5
Этот метаботропный рецептор интересен тем, что является одной из мишеней лития в организме. Литий (в форме кислых органических солей или карбоната) применяется в медицине в качестве нормотимика. На рецепторе имеется три сайта связывания – один для глутамата, а два других – для модуляторов и экзогенных лигандов, что делает mGluR5 перспективной мишенью для разработки нормотимиков, антидепрессантов и транквилизаторов. Например, лиганды этого рецептора, лишённые способности проникать через ГЭБ, исследуются в качестве средств, влияющих на тонус мочевого пузыря. Однако клиническое использование антагонистов и негативных модуляторов mGluR5 скорее всего будет ограниченным, так как уже в исследованиях на крысах данный класс соединений наряду со способностью снимать тревогу показал негативный побочный эффект – нарушения памяти. Агонисты mGluR5 исследуются в качестве средств против деменции и для восстановления после травм, уже опубликованы положительные результаты с 2-хлоро-5-гидроксифенилглицином в качестве перспективного агониста.
2 группа
mGluR2
mGluR3
Мутации гена этого рецептора повышают риск развития биполярного расстройства, шизофрении и склонности к зависимостям. Соответственно, как и mGluR2, данный рецептор также является мишенью для различных экспериментальных препаратов. Более того, благодаря высокой гомологии (в т.ч. и сайта связывания) в научной литературе некоторые групповые лиганды обозначаются как mGluR2/3-агонисты (или антагонисты). Также мутации в гене этого рецептора могут влиять на риск развития меланомы – в 16,3% случаев меланомы, у пациента обнаруживается мутация mGluR3, выражающаяся в замене глутамина в 870 позиции на лизин.
3 группа
mGluR4
Этот рецептор интересен тем, что помимо ЦНС находится также и… на языке! Да, именно благодаря нему человек способен чувствовать тот самый вкус «умами», благодаря которому и началась история глутамата. Также, помимо обычных для таких рецепторов функций (LTP, участие в процессах запоминания и координации движений), mGluR4 обнаружен и в иммунных клетках – Т-хелперах. При активации этих рецепторов Т-хелпер снижает продукцию интерлейкина-17. Мыши, лишённые этого рецептора, были более восприимчивы к экспериментальным формам энцефаломиелита и рассеянного склероза.
mGluR6
Данный подвид глутаматного рецептора найден в больших количествах в сетчатке. Клетки, имеющие этот рецептор (в большинстве своём – ON-подтип биполярных клеток, у них рецептор располагается постсинаптически), участвуют в регуляции силы восприятия светового раздражителя. Некоторые мутации гена этого рецептора ведут к никталопии (народное название – «куриная слепота»), нарушению сумеречного зрения.
mGluR7
mGluR8
Об этом рецепторе известно мало. Однако, исходя из его близкого расположения к региону 7-й хромосомы, который подвергается делеции при синдроме Смита-Лемли-Опица, высказаны предположения о том, что его отсутствие влияет на неврологический статус пациента, в т.ч. обуславливая умственную отсталость, наблюдаемую при этом заболевании.
Как вы могли уже выяснить из прочтённого, рецепторы глутамата играют огромную роль в регуляции функционирования и развития нервной системы. Например, глутамат играет роль в гибели нейронов в условиях гипоксии – в таких условиях транспортёр глутамата (EAAT) просто не способен осуществлять обратный захват нейромедиатора в клетку. Таким образом, при массовой гибели нервных клеток количество высвободившегося глутамата растёт в геометрической прогрессии, вызывая эксайтотоксичное возбуждение в ещё живых нейронах, которые тоже могут умереть из-за этого.
Стоит рассказать об отечественных наркологах Крупицком и Гриненко и их изобретении – кетаминовой терапии алкоголизма. Само название звучит довольно интересно. Это в прямом смысле шоковая терапия – согласно теории авторов, после сильного психоэмоционального переживания, связанного с алкоголем, у пациента пропадёт тяга к алкоголю. Терапия проводится в три этапа:
В качестве заключения могу сказать, что глутаматэргическая система мозга – это одна из самых широкоспециализированных сигнальных систем в нашем мозге и нервной системе, и её роль действительно сложно переоценить.