Что такое mns в химии
Что такое mns в химии
MnS(к,ж). Термодинамические свойства кристаллического и жидкого сульфида марганца в стандартном состоянии при температурах 100 – 4000 К приведены в табл. MnS_1. Значения постоянных, принятые для расчета термодинамических функций MnS(к,ж), приведены в табл. Mn.1.
За стандартное состояние MnS (к, минерал алабандин) в интервале 0 – 1803 К принята кубическая (зеленая) модификация (структурный тип NaCl). При низких температурах MnS является антиферромагнетиком. Температура Нееля MnS по определениям в различных работах составляет 139 – 165 К. Наиболее точное значение измерено в работе [ 77HEI/WIE] 147.6 ± 0.1 К. В этой же работе [ 77HEI/WIE] был найден фазовый переход при 131 К, который не сопровождается заметным тепловым эффектом. У сульфида марганца существуют также две метастабильные модификации – кубическая красная (структурный тип ZnS, сфалерит) и гексагональная розовая (структурный тип ZnS, вюртцит).
При Т>298.15 K для теплоемкости MnS принято пятичленное уравнение, выведенное методом Шомейта по результатам измерений инкрементов энтальпии в работе Кафлина [ 50COU] (411 – 1814 K). При этом не учитывался результат измерения при 1760 К, который превышал сглаженную кривую на 2%, возможно из-за эффекта предплавления. Результаты остальных 26 измерений аппроксимировались принятым уравнением (см. табл. Mn.1.) c максимальным отклонением 0.7 %.
Термохимические величины для MnS(к).
В настоящем издании принимается значение энтальпии образования кристаллического моносульфида марганца
Принятое значение основано на прецизионных измерениях энтальпий растворения в соляной кислоте препаратов MnO(к) и MnS(к), выполненных в работе [ 64ADA/KIN]. Измерения были выполнены для трех реакций:
MnO(к)+2Н + (раствор)=Mn ++ (раствор)+H2O(раствор) (1)
7 измерений; D rH°(реакция 1, 303.15 K) = ‑27.790 ± 0.050 ккал × моль ‑1 ;
«много» измерений в лаборатории, где выполнялась работа;
D rH°(реакция 2, 303.15 K) = ‑0.080 ± 0.010 ккал × моль ‑1 и
MnS(к)+2Н + (раствор)=Mn ++ (раствор)+H2S(г) (3)
7 измерений; D rH°(реакция 3, 303.15 K) = ‑5.260 ± 0.110 ккал × моль ‑1 ;
В работе [ 54JEF/RIC] были выполнены измерения, аналогичные измерениям [ 64ADA/KIN], но для растворения в плавиковой кислоте. Измерения были выполнены для реакций (1) и (3); получено:
4 измерения; D rH°(реакция 1, 298.15 K) = ‑30.400 ± 0.250 ккал × моль ‑1 и
Эти значения привели авторов к величине:
Эта величина, по-видимому, должна быть слегка исправлена с учетом того, что значение энтальпии реакции (2) не равно нулю; приняв эту величину равной той величине, которая была получена в [ 64ADA/KIN], а именно:
Еще бóльшее отличие получено в работе [ 39КАП/КОР], в которой был проведен синтез MnS в калориметрической микробомбе. Полученное в работе значение энтальпии образования (среднее из семи определений) составило:
По-видимому, основная причина несогласия в этом случае состоит в использовании препарата Mn с большим содержанием примесей (содержание Mn в препарате составляло 96.53%).
Принятому значению соответствует величина:


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Сульфид марганца(II)
| Сульфид марганца(II) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Сульфид марганца(II) |
| Традиционные названия | Сернистый марганец |
| Химическая формула | MnS |
| Физические свойства | |
| Состояние (ст. усл.) | зелёные или красновато-бурые кристаллы |
| Молярная масса | 87,00 г/моль |
| Плотность | 3,99 г/см³ |
| Твёрдость | 3,5-4 (по шкале Мооса) |
| Термические свойства | |
| Температура плавления | 1615 °C |
| Химические свойства | |
| Растворимость в воде | 0,00047 г/100 мл |
| Классификация | |
| Рег. номер CAS | 18820-29-6 |
| Рег. номер PubChem | 87809 |
Сульфид марганца(II) — неорганическое соединение, соль металла марганца и сероводородной кислоты с формулой MnS, зелёные или красновато-бурые кристаллы, не растворимые в воде, образует кристаллогидрат, характеризуется полиморфизмом.
Содержание
Получение
Физические свойства
Сульфид марганца(II) образует кристаллы трёх модификаций:
β-MnS и γ-MnS модификации являются метастабильными и при нагревании до 200-300°С переходят в α-MnS фазу.
Образует кристаллогидрат состава 3MnS•H2O, серо-розовые кристаллы.
Химические свойства
Литература
Полезное
Смотреть что такое «Сульфид марганца(II)» в других словарях:
Сульфид марганца(IV) — Общие Систематическое наименование Сульфид марганца(IV) Традиционные названия Сернистый марганец Химическая формула MnS2 Физические свойства … Википедия
МАРГАНЦА СЕМЕЙСТВО — ПОДГРУППА VIIB. СЕМЕЙСТВО МАРГАНЦА МАРГАНЕЦ, ТЕХНЕЦИЙ, РЕНИЙ Электронная конфигурация этих элементов марганца Mn, технеция Tc, рения Re характерна для переходных металлов. Каждый элемент имеет наполовину заполненную внутреннюю d оболочку, т.е.… … Энциклопедия Кольера
марганца(II) сульфид — mangano(II) sulfidas statusas T sritis chemija formulė MnS atitikmenys: angl. manganese(II) sulfide rus. марганец сернистый; марганца(II) сульфид … Chemijos terminų aiškinamasis žodynas
МАРГАНЦА ОКСИДЫ — MnО, Mn2 О 3, MnО 2, Mn3 О 4, Mn2 О 7, Mn5 О 8. Кроме Mn2 О 7, все оксиды кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется О 2 и образуются низшие оксиды: При выдерживании на воздухе или в атмосфере О 2 выше 300 °С MnО и Mn2… … Химическая энциклопедия
Борид марганца — Общие Систематическое наименование Борид марганца Традиционные названия Бористый марганец Химическая формула MnB Физические свойства Состояние ( … Википедия
Диборид марганца — Общие Систематическое наименование Диборид марганца Традиционные названия Бористый марганец Химическая формула MnB2 Физические свойства Состояние … Википедия
Оксид марганца(II) — Общие … Википедия
Оксид марганца(IV) — Общие … Википедия
Гидроксид марганца(II) — Общие Систематическое наименование Гидроксид марганца(II) Традиционные названия Гидроокись марганца Химическая формула Mn(OH)2 Физические свойства … Википедия
Оксиды марганца — Оксиды марганца химические соединения марганца и кислорода с общей формулой MnxOy (кроме пероксидов марганца). Существуют следующие оксиды марганца: Название Формула Температура плавления Температура кипения Цвет Оксид марганца(II) MnO… … Википедия
Сульфид марганца II
| Сульфид марганца II | |
|---|---|
| Систематическое наименование | Сульфид марганца II |
| Традиционные названия | Сернистый марганец |
| Хим. формула | MnS |
| Состояние | зелёные или красновато-бурые кристаллы |
| Молярная масса | 87,00 г/моль |
| Плотность | 3,99 г/см³ |
| Твёрдость | 3,5-4 (по шкале Мооса) |
| Температура | |
| • плавления | 1615 °C |
| Растворимость | |
| • в воде | 0,00047 г/100 мл |
| Рег. номер CAS | 18820-29-6 |
| PubChem | 87809 |
| Рег. номер EINECS | 242-599-3 |
| SMILES | |
| ChemSpider | 79220 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфид марганца II — неорганическое соединение, соль металла марганца и сероводородной кислоты с формулой MnS, розовые или красновато-бурые кристаллы, не растворимые в воде, образует кристаллогидрат, характеризуется полиморфизмом.
Содержание
Получение
Физические свойства
Сульфид марганца II образует кристаллы трёх модификаций:
β-MnS и γ-MnS модификации являются метастабильными и при нагревании до 200-300°С переходят в α-MnS фазу.
Образует кристаллогидрат состава 3MnS•H2O, серо-розовые кристаллы.
Марганец, цинк и серебро
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.
Получают марганец алюминотермией, восстановлением коксом, электролизом.
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
При нагревании марганец вытесняет водород из воды.
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
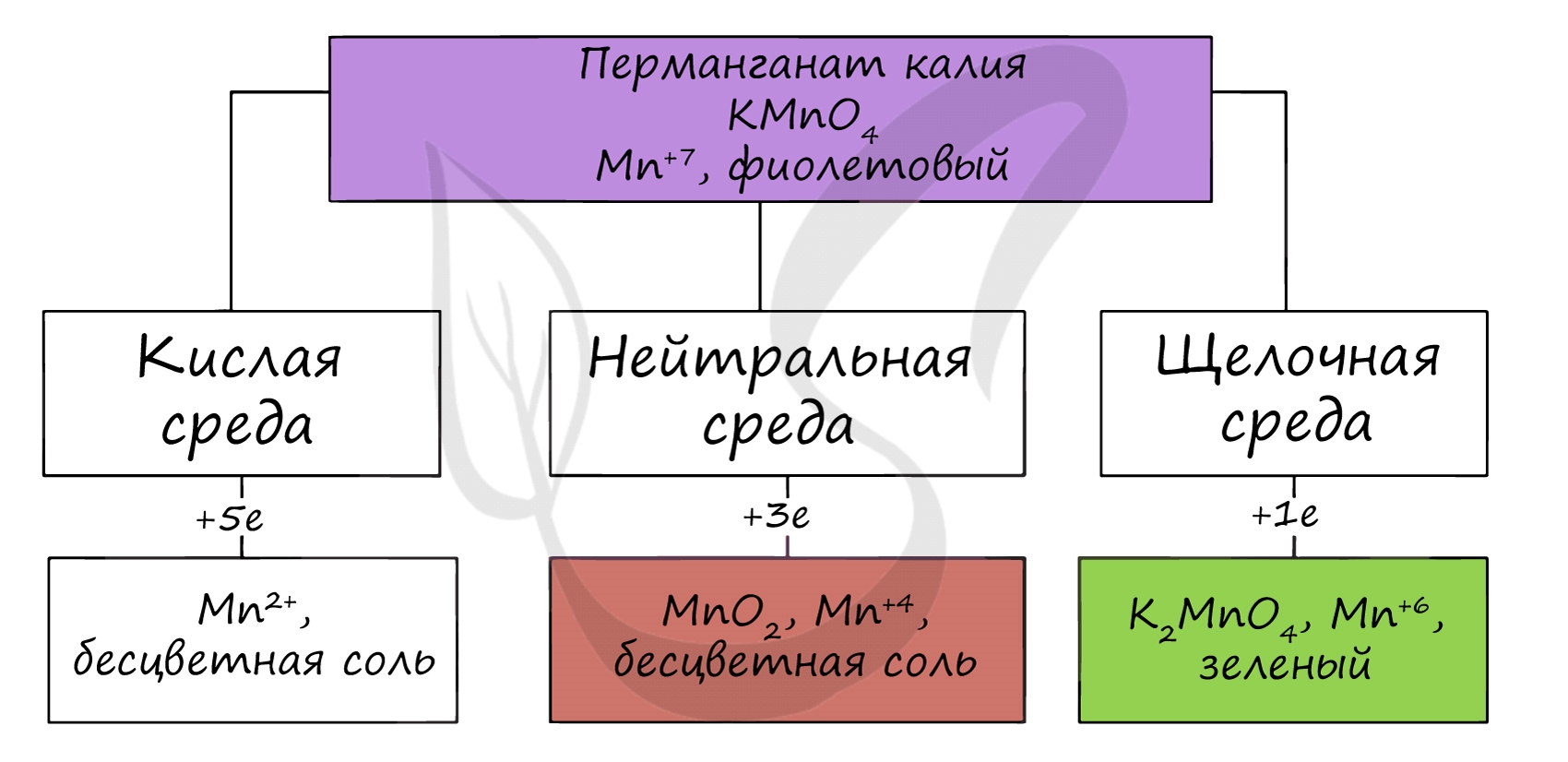
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При стоянии в растворе постепенно разлагается водой.
Для цинка характерна постоянная степень окисления +2.
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + CO = (t) Zn + CO2
Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Марганец, цинк и серебро
Степень окисления в MnS
Общие сведения о сульфиде марганца (II) и степени окисления в MnS
Термически устойчив (температура плавления равна 1615 o С). Брутто-формула – MnS. Молярная масса – 87 г/моль.
Рис. 1. Сульфид марганца (II). Внешний вид.
Не растворяется в холодной воде. Из раствора осаждается кристаллогидрат MnS×nH2O светло-розового (телесного) цвета. Разлагается кислотами, окисляется кислородом.
MnS, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав сульфида марганца (II), сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, указанных со знаком минус. Сульфид-ион – это кислотный остаток сероводородной кислоты, формула которой H2S. В её составе имеется два атома водорода, следовательно, степень окисления серы в сульфид-ионе равна (-2).
Для нахождения степени окисления марганца примем её значение за «х» и определим его при помощи уравнения электронейтральности:
Значит степень окисления марганца в сульфиде марганца (II)равна (+2):
Примеры решения задач
| Задание | Определите степень окисления серы в следующих соединениях: а) H2S, б) Na2SO4; в) Al2(SO4)3. |
| Ответ | а)Степень окисления водорода в составе неорганических кислот всегда равна (+1). Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности: |
б)Натрий проявляет постоянную степень окисления, совпадающую с номером группы в Периодической системе Д.И. Менделеева, в которой он расположен, т.е. равна (+1) (натрий – металл). Степень окисления кислорода в составе неорганических кислот и их остатков всегда равна (-2). Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности:
Степень окисления серы в сульфате натрия равна (+4):Na2S +6 O4.
в)Алюминий проявляет постоянную степень окисления, совпадающую с номером группы в Периодической системе Д.И. Менделеева, в которой он расположен, т.е. равна (+3) (алюминий – металл). Степень окисления кислорода в составе неорганических кислот и их остатков всегда равна (-2). Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности:
Степень окисления серы в сульфате алюминия равна (+6):Al2(S +6 O4)3.
а) Степень окисления водорода равна (+1), брома – (-1). Примем за «х» и «у» значения степеней окисления азота в указанных соединениях: