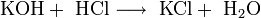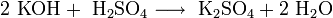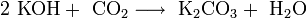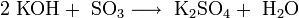Что такое koh в химии соль кислота
Гидроксид калия: способы получения и химические свойства
Гидроксид калия KOH — неорганическое соединение. Белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 56,11; относительная плотность для тв. и ж. состояния d = 2, 044; tпл = 404º C; tкип = 1324º C
Способы получения
1. Гидроксид калия получают электролизом раствора хлорида калия :
2KCl + 2H2O → 2KOH + H2 + Cl2
2. При взаимодействии калия, оксида калия, гидрида калия и пероксида калия с водой также образуется гидроксид калия:
2K + 2H2O → 2KOH + H2
2KH + 2H2O → 2KOH + H2
3. Карбонат калия при взаимодействии с гидроксидом кальция образует гидроксид калия:
Качественная реакция
Химические свойства
1. Гидроксид калия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид калия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид калия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и выделяется водород:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида калия:
Сера взаимодействует с гидроксидом калия только при нагревании:
В растворе образуются комплексная соль и водород:
2KOH + 2Al + 6Н2О = 2K[Al(OH)4] + 3Н2
Хлорид меди (II) реагирует с гидроксидом калия с образованием хлорида калия и осадка гидроксида меди (II):
2KOH + CuCl2 = Cu(OH)2↓+ 2KCl
NH4Cl + KOH = NH3 + H2O + KCl
KOH ↔ K + + OH —
4KOH → 4K + O2 + 2H2O
Гидроксид калия
Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия. Водные растворы КОН имеют сильнощелочную реакцию. Получают электролизом растворов KCl, применяют в производстве жидких мыл, для получения различных соединений калия.
Содержание
Химические свойства
Также гидроксид калия получают электролизом растворов KCl, обычно с применением ртутных катодов, что дает продукт высокой чистоты, не содержащий примеси хлоридов.
Применение
Также используется для получения метана, поглощения кислотных газов и обнаружения некоторых катионов в растворах. Применяют в производстве жидких мыл, как исходный продукт для получения различных солей калия и т. д.
В циркониевом производстве используется для получения обесфторенной гидроокиси циркония.
В сфере промышленной мойки продукты на основе гидроксида калия, нагретые до 50-60 °С, применяются для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
Используется в качестве электролита в щелочных (алкалиновых) батарейках.
Опасность
Действует на кожу и слизистые оболочки прижигающим образом. Особенно опасно попадание даже малейших частиц гидроксида калия в глаза, поэтому все работы с этим веществом должны проводиться в резиновых перчатках и очках. Гидроксид калия разрушает бумагу, кожу и др. материалы органического происхождения.
См. также
Примечания
Прочие: Воск (E900—909) • Глазурь (E910—919) • Восстановитель (E920—929) • Газ для упаковки (E930—949) • Заменители сахара (E950—969) • Вспениватель (E990—999)
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Гидроксид калия» в других словарях:
ГИДРОКСИД КАЛИЯ — (едкое кали, КОН), белое твердое вещество, получаемое в промышленности путем ЭЛЕКТРОЛИЗА ХЛОРИДА КАЛИЯ. Гидроксид калия является сильно щелочным веществом, используемым в производстве мыла и моющих средств. см. также ЩЕЛОЧЬ … Научно-технический энциклопедический словарь
гидроксид калия — сущ., кол во синонимов: 1 • кали (8) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
гидроксид калия — едкое кали — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом Синонимы едкое кали EN potassium hydroxide … Справочник технического переводчика
ГИДРОКСИД КАЛИЯ — едкое кали, КОН бесцветные кристаллы; плотностью 2120 кг/м3; tпл=380°С; растворимость в воде 52,8% при 20° С. Сильная щелочь, вызывающая ожоги на коже человека. Применяют в виде кипящего 30 50% ного водного раствора для очистки от… … Металлургический словарь
Гидроксид калия (едкое кали) — Гидроксид калия обычно получают электролизом растворов природного хлорида калия (товарная позиция 3104), но он может быть получен также каустификацией карбоната калия известковым молоком (образующим известковый поташ ). Чистый гидроксид калия… … Официальная терминология
Калия гидроксид — Гидроксид калия Общие Систематическое наименование Гидроксид калия Традиционные названия … Википедия
Гидроксид алюминия — Гидроксид алюминия, вещество с формулой (а также … Википедия
Гидроксид рубидия — Общие Систематическое наименование Гидроксид рубидия Традиционные названия едкая щёлочь едкий рубит Химическая формула RbOH Физические свойства Молярная масса 102,407 … Википедия
Гидроксид лития — Гидроксид лития … Википедия
Гидроксид железа(II) — У этого термина существуют и другие значения, см. Гидроксиды железа. Гидроксид железа(II) … Википедия
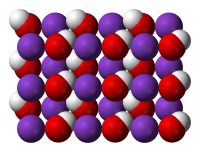
Гидроксид калия ГОСТ 24363-80
| Гидроксид калия | |
|---|---|
 | |
 | |
| Систематическое наименование | Гидроксид калия |
| Традиционные названия | Кали едкое, каустический поташ |
| Хим. формула | KOH |
| Состояние | твёрдое |
| Молярная масса | 56,1056 г/моль |
| Плотность | 2,044−2,12 г/см³ |
| Т. плав. | 380−406 °C |
| Т. кип. | 1327 °C |
| Энтальпия образования | −425,8 кДж/моль |
| Энтальпия плавления | 7,5 кДж/моль |
| Энтальпия кипения | 128,9 кДж/моль |
| Давление пара | 1 ± 1 мм рт.ст. |
| Растворимость в воде | 117,9 г/100 мл |
| Растворимость в спирте | 38,7 (28 °C) |
| Показатель преломления | 1.409 |
| Рег. номер CAS | ГОСТ 24363-80 ГОСТ 9285-78 |
| Рег. номер CAS | 1310-58-3 |
| PubChem | 14797 |
| Рег. номер EINECS | 215-181-3 |
| SMILES | |
| Кодекс Алиментариус | E525 |
| RTECS | TT2100000 |
| ChEBI | 32035 |
| Номер ООН | 1813 |
| ChemSpider | 14113 |
| Пиктограммы СГС |  |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Тривиальные названия: едкое кали, каустический поташ, а также гидрат окиси калия, гидроокись калия, калиевая щёлочь, калиевый щёлок.
Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия. Водные растворы KOH имеют сильнощелочную реакцию. Получают электролизом растворов KCl, применяют в производстве жидких мыл, для получения различных соединений калия.
Содержание
Химические свойства
Гидроксид калия получают электролизом растворов KCl, обычно с применением ртутных катодов, что дает продукт высокой чистоты, не содержащий примеси хлоридов:
2KCl + 2H2O ⟶ 2KOH + H2↑ + Cl2↑
Применение
Гидроксид калия является практически универсальным химическим соединением. Ниже приведены примеры материалов и процессы в которых он используется:
В пищевой промышленности обозначается как пищевая добавка E525. Используется как регулятор кислотности, в качестве осушителя и средства для снятия кожицы с овощей, корнеплодов и фруктов. Он также используется в качестве катализатора в некоторых реакциях.
Также используется для получения метана, поглощения кислотных газов и обнаружения некоторых катионов в растворах.
Популярное средство в производстве косметической продукции, вступая в реакцию с жирными маслами расщепляется и омыливает при этом масла.
В циркониевом производстве используется для получения обесфторенного гидроксида циркония.
В сфере промышленной мойки продукты на основе гидроксида калия, нагретые до 50-60 °С, применяются для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
Используется в качестве электролита в щелочных (алкалиновых) батарейках.
Также применяется в ресомации — альтернативном способе «захоронения» тел.
5 % раствор гидроксида калия используется в медицине для лечения бородавок.
В фотографии используется как компонент проявителей, тонеров, индикаторов тиосульфатов и для удаления эмульсии с фотографических материалов.
Производство
В промышленном масштабе гидроксид калия получают электролизом хлористого калия.
Возможны три варианта проведения электролиза:
В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Мембранный метод производства самый эффективный, но и самый сложный.
В то время как диафрагменный и ртутный методы были известны соответственно с 1885 и 1892 гг., мембранный метод появился сравнительно недавно — в 1970 гг.
Основной тенденцией в мировом производстве гидроксида калия в последние 10 лет является переход производителей на мембранный метод электролиза. Ртутный электролиз является устаревшей, экономически невыгодной и негативно действующей на окружающую среду технологией. Мембранный электролиз полностью исключает использование ртути. Экологическая безопасность мембранного метода заключается в том, что сточные воды после очистки вновь подаются в технологический цикл, а не сбрасываются в канализацию.
При использовании данного метода решаются следующие задачи:
Мировым лидером в области мембранных технологий является японская компания «Асахи Касэй».
В России производство гидроксида калия осуществляется мембранным (ООО «Сода-Хлорат») методом.
Особенностью технологического оформления производства гидроксида калия является тот факт, что на аналогичных установках электролиза можно выпускать как едкое кали, так и каустическую соду. Это позволяет производителям без существенных капиталовложений переходить на производство гидроксида калия взамен каустической соды, производство которой не столь рентабельно, а сбыт в последние годы усложняется. При этом в случае изменений на рынке возможен безболезненный перевод электролизёров на производство ранее выпускавшегося продукта.
Примером перевода части мощностей с производства гидроксида натрия на гидроксид калия может служить ОАО «Завод полимеров КЧХК», начавший промышленный выпуск едкого кали на пяти электролизерах в 2007 году.
Опасность
Очень сильная щёлочь. В чистом виде действует на кожу и слизистые оболочки прижигающим образом. Особенно опасно попадание даже малейших частиц гидроксида калия в глаза, поэтому все работы с этим веществом должны проводиться в резиновых перчатках и очках. Гидроксид калия разрушает бумагу, кожу и др. материалы органического происхождения.
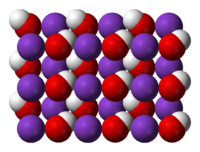
Калия гидроксид
Калия гидроксид
| Гидроксид калия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Гидроксид калия |
| Традиционные названия | Едкое кали, каустический поташ |
| Химическая формула | KOH |
| Эмпирическая формула | KOH |
| Молярная масса | 56,1056 г/моль |
| Физические свойства | |
| Плотность вещества | 2,044 (25°C) г/см³ |
| Состояние (ст. усл.) | твёрдое |
| Термические свойства | |
| Температура плавления | 380 [1] °C |
| Температура кипения | 1327 °C |
| Энтальпия (ст. усл.) | -425,8 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 112,4 (20°C) г/100 мл |
| Классификация | |
| номер CAS | 1310-58-3 |
| Номер UN | 1813 |
| Регистрационный номер EC | 215-181-3 |
| RTECS | TT2100000 |
Тривиальные названия: едкое кали, каустический поташ.
Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия. Водные растворы КОН имеют сильнощелочную реакцию. Получают электролизом растворов KCl, применяют в производстве жидких мыл, для получения различных соединений калия.
Содержание
Химические свойства
Применение
Также используется для получения метана, поглощения кислотных газов и обнаружения некоторых катионов в растворах. Используется в циркониевом производстве для получения обесфторенной гидроокиси циркония
См. также
Примечания
Разное: Воск (E900-909) • Глазурь (E910-919) • Восстановитель (E920-929) • Газ для упаковки (E930-949) • Заменители сахара (E950-969) • Вспениватель (E990-999)
Полезное
Смотреть что такое «Калия гидроксид» в других словарях:
Калия гидроксид — КАЛИЯ ГИДРОКСИД, KOH, кристаллы, tпл 405°C. Сильное основание, относится к щелочам. Применяют калий гидроксид в производстве жидкого мыла, при обработке хлопка, в щелочных аккумуляторах, как поглотитель газов и осушающий агент и др. Вызывает… … Иллюстрированный энциклопедический словарь
КАЛИЯ ГИДРОКСИД — (кали едкое) KOH, сильное основание (щелочь). Бесцветные кристаллы (технический продукт белая непрозрачная масса). На воздухе расплывается, поглощая H2O и CO2. Легко и с сильным разогреванием растворяется в воде. Применяют в производстве жидкого… … Большой Энциклопедический словарь
калия гидроксид — (кали едкое), KOH, сильное основание (щёлочь). Бесцветные кристаллы (технический продукт белая непрозрачная масса). На воздухе расплывается, поглощая Н2О и СО2. Легко и с сильным разогреванием растворяется в воде. Применяют в производстве… … Энциклопедический словарь
КАЛИЯ ГИДРОКСИД — КОН бесцветные кристаллы, плотн. 2120 кг/м3, tпл 405 °С, tкип 1324 °С. В 100 г воды растворяется 112 г КОН (при 20 °С). Сильное основание, разрушает кожу, бумагу, шерсть, вызывает сильные ожоги на коже человека. К. г. получают электролизом р ров… … Большой энциклопедический политехнический словарь
КАЛИЯ ГИДРОКСИД — КОН, бесцв. кристаллы; до 247 °С устойчива моноклинная модификация, выше 247 °С кубическая типа NaCl ( а =0,533 нм, z = 4, пространств. группа Fm3m); DH0 перехода 5,6 кДж/моль; т. кип. 1325°С; плотн. 2,044 г/см 3 (см. также табл.).… … Химическая энциклопедия
КАЛИЯ ГИДРОКСИД — (кали едкое), КОН, сильное основание (щёлочь). Бесцв. кристаллы (техн. продукт белая непрозрачная масса). На воздухе расплывается, поглощая Н2О и СО2. Легко и с сильным разогреванием растворяется в воде. Применяют в произ ве жидкого мыла, в… … Естествознание. Энциклопедический словарь
КАЛИЯ ГИДРОКСИД, KOH — КАЛИЯ ГИДРОКСИД, KOH, кристаллы, tпл 405шC. Сильное основание, относится к щелочам. Применяют калий гидроксид в производстве жидкого мыла, при обработке хлопка, в щелочных аккумуляторах, как поглотитель газов и осушающий агент и др. Вызывает… … Современная энциклопедия
Гидроксид калия — Гидроксид калия … Википедия
Гидроксид алюминия — Гидроксид алюминия, вещество с формулой (а также … Википедия