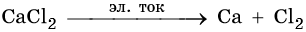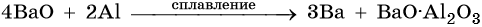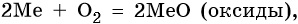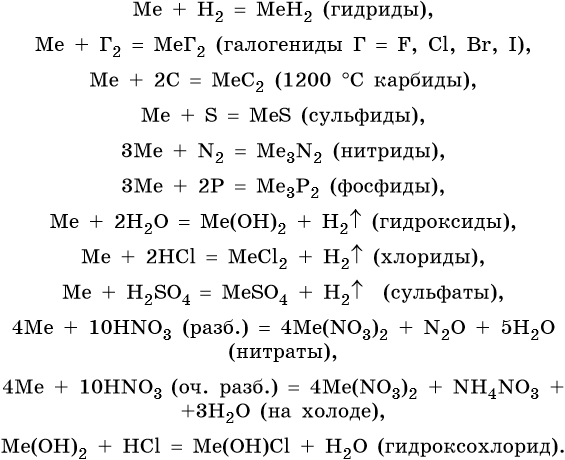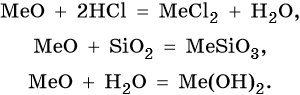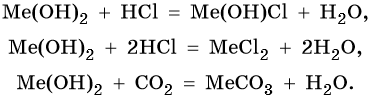Что такое iia в химии
Элементы группы IIA
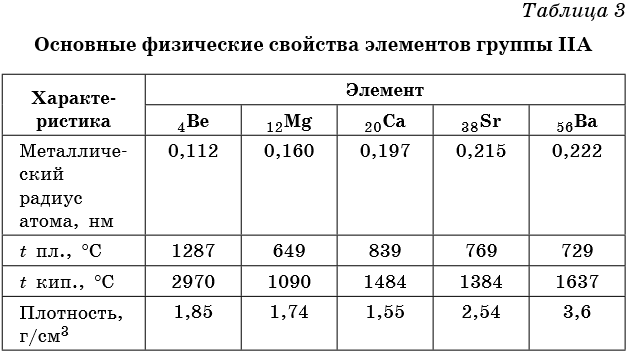
Элементами группы IIА являются бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. Последние три называют элементами подгруппы кальция или щелочноземельными металлами. Некоторые свойства элементов группы IIА приведены в таблице 3.
Свойства бериллия и магния несколько отличаются от свойств, характерных для щелочноземельных металлов. Бериллий по многим свойствам близок к алюминию, а магний — к цинку.
Для щелочноземельных металлов наблюдается общая для Периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства.
Магний и кальций получают электролизом расплавов их хлоридов, например:
Стронций и барий получают восстановлением их оксидов алюминием или кремнием, например:
Щелочноземельные металлы химически активны; они легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +2.
Ниже приведены характерные для щелочноземельных металлов реакции с простыми и сложными веществами (Me = Mg, Ca, Sr, Ba):
Оксиды щелочноземельных металлов представляют собой типичные оснОвные оксиды. Они реагируют с кислотами с образованием солей и воды, с кислотными оксидами с образованием солей. Реакция с водой протекает по-разному. Если оксид бария легко реагирует с водой при комнатной температуре с образованием сильной щелочи Ba(OH)2, то оксид магния может реагировать с водой только при кипячении. Химические свойства оксида магния и оксидов щелочноземельных металлов (Me = Mg, Ca, Sr, Ba):
Гидроксиды щелочноземельных металлов проявляют оснОвные свойства: реагируют с кислотами с образованием оснОвных или средних солей и воды, с кислотными оксидами с образованием солей и воды. Химические свойства гидроксида магния и гидроксидов щелочноземельных металлов (Me = Mg, Ca, Sr, Ba):
Сила оснований увеличивается с увеличением порядкового номера элемента.
Соли кальция окрашивают пламя газовой горелки в коричнево-красный цвет; стронция — в ярко-красный цвет; бария — в желто-зеленый цвет.
Металлы IIA группы
Главную подгруппу II группы составляют бериллий, магний, кальций, стронций, барий и радий. На внешнем электронном слое у них находится по два легко теряемых s-электрона. Во всех соединениях они проявляют степень окисления +2, их активность возрастает с увеличением атомного номера. Все они (за исключением бериллия, проявляющего амфотерные свойства) – металлы, по свойствам близкие к щелочным, их химические связи с неметаллами носят ионный характер. В свободном состоянии это твердые серебристо-белые вещества.
Общая характеристика элементов II а группы
Физические свойства простых веществ
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства
1. Реакция с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием щелочей:
2. Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид – BaO2:
3. С другими неметаллами образуют бинарные соединения:
Ba + S → BaS (сульфиды)
Ca + 2C → CaC2 (карбиды)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
4. Все щелочноземельные металлы растворяются в кислотах:
5. Бериллий растворяется в водных растворах щелочей:
6. Летучие соединения щёлочноземельных металлов придают пламени характерный цвет:
соединения кальция — кирпично-красный, стронция — карминово-красный, а бария — желтовато-зелёный.
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Природные соединения
Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
Химические свойства
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)
Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:
Химические свойства
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
Гидроксиды щелочноземельных металлов
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Химические свойства
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Щелочноземельные металлы
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
Элементы IA группы
В IA группу (главная подгруппа первой группы) таблицы Менделеева входят металлы — литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr. Традиционно, данные элементы называют щелочными металлами (ЩМ), так как их простые вещества образуют при взаимодействии с водой едкие щелочи. Последний из известных представителей группы щелочных металлов (Fr) является радиоактивным элементом, в связи с чем его химические свойства изучены недостаточно: период полураспада его наиболее долгоживущего изотопа 223 Fr составляет всего лишь около 22 мин.
Электронные формулы, а также некоторые свойства щелочных металлов представлены в таблице ниже:
При движении вниз по IA группе возрастает радиус атомов металлов (rмет), что, собственно, характерно для любых элементов всех главных подгрупп. Относительно малое увеличение радиуса при переходе от K к Rb и далее к Cs обусловлено заполнением 3d- и 4d-подуровней соответственно.
Маленький радиус иона Li + и высокая плотность заряда, являются причиной того, что соединения лития оказываются схожими по свойствам аналогичным соединениям магния (диагональное сходство) и в то же время отличаются от соединений остальных ЩМ.
Элементы IIA группы
В IIA группу Периодической системы элементов входят бериллий Ве, магний Мg и четыре щелочноземельных металла (ЩЗМ): кальций Са, стронций Sr, барий Ва и радий Ra, оксиды которых, раньше называемые «землями», при взаимодействии с водой образуют щелочи. Радий — радиоактивный элемент (α-распад, период полураспада примерно 1600 лет).
Электронная конфигурация и некоторые свойства элементов второй группы приведены в таблице ниже:
| Свойство | Be | Mg | Ca | Sr | Ba | Ra |
| Заряд ядра Z | 4 | 12 | 20 | 38 | 56 | 88 |
| Электронная конфигурация в основном состоянии | [He]2s 2 | [Ne]3s 2 | [Ar]4s 2 | [Kr]5s 2 | [Xe]6s 2 | [Rn]7s 2 |
| Металлический радиус rмет, нм | 0,112 | 0,160 | 0,197 | 0,215 | 0,217 | 0,223 |
| Ионный радиус rион*, нм | 0,027 | 0,72 | 0,100 | 0,126 | 0,142 | 0,148 |
| Энергия ионизации, кДж/моль: |
Следует отметить, что в то время как для щелочных металлов характерна значительная разница между I1 и I2 для элементов второй группы подобный скачок наблюдается между I2 и I3. Именно поэтому щелочные металлы в сложных веществах проявляют только степень окисления +1, а элементы второй группы +2. Наличие единственной положительной степени окисления и невозможность восстановления ионов M 2+ в водной среде придает большое сходство всем металлам s-блока.
Щелочноземельные металлы (Са, Sr, Ва, Ra) образуют единое семейство элементов, в пределах которого некоторые свойства (энергия гидратации, растворимость и термическая устойчивость солей) меняются монотонно с увеличением ионного радиуса, а многие их соединения являются изоморфными.
Элементы IIIA группы
Для таллия, свинца, висмута и полония наиболее устойчивы соединения со степенью окисления +1, +2, +3, +4 соответственно.
| Свойство | B | Al | Ga | In | Tl |
| Заряд ядра Z | 5 | 13 | 31 | 49 | 81 |
| Электронная конфигурация в основном состоянии | [He]2s 2 2p 1 | [Ne]3s 2 3p 1 | [Ar]3d 10 4s 2 4p 1 | [Kr]4d 10 5s 2 5p 1 | [Xe]4f 14 5d 10 6s 2 6p 1 |
| Атомный радиус, нм | 0,083 | 0,143 | 0,122 | 0,163 | 0,170 |
| Энергия ионизации, кДж/моль: I1 I2 I3 | 801 2427 3660 | 577 1817 2745 | 579 1979 2963 | 558 1821 2704 | 589 1971 2878 |
| Электроотрицательность | 2,04 | 1,61 | 1,81 | 1,78 | 2,04 |
Для соединений элементов IIIA группы наиболее характерна степень окисления +3. В ряду бор-алюминий-галлий-индий-таллий устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Hal в галогенидах последних при переходе от легких к более тяжелым элементам М уменьшаются, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности, склонность катионов к гидролизу (взаимодействию с водой) ослабевает.
Атомы элементов 2(IIa) группы
| Элемент | Be | Mg | Ca | Sr | Ba | Ra |
|---|---|---|---|---|---|---|
| Порядковый номер | 4 | 12 | 20 | 38 | 56 | 88 |
| Атомная масса (относительная) | 9,01 | 24,30 | 40,08 | 87,62 | 137,33 | 226 |
| Плотность (н.у.), г/см 3 | 1,85 | 1,74 | 1,55 | 2,54 | 3,5 | 5,5 |
| tпл, К | 1551 | 923 | 1112 | 1042 | 1022 | 1233 |
| tкип, К | 3243 | 1363 | 1757 | 1657 | 1910 | 2010 |
| Энергия ионизации, кДж/моль | 899,0 | 737,7 | 589,7 | 549,5 | 502,8 | 509,3 (1-й электрон) 979,0 (2-й) |
| Электронная формула | [He]2s 2 | [Ne]3s 2 | [Ar]4s 2 | [Kr]5s 2 | [Xe]6s 2 | [Rn]7s 2 |
| Электроотрицательность (по Поллингу) | 1,57 | 1,31 | 1,00 | 0,95 | 0,89 | 0,9 |
Электронные формулы инертных газов:
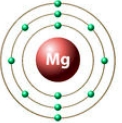
Рис. Строение атома магния.
Наиболее важным элементом подгруппы берилия является кальций, который входит в состав костей всех животных и человека, определяя их прочность. Концентрация ионов кальция и магния в воде определяет ее жесткость.
Элементы 2(IIa) группы в свободном виде в природе не встречаются, но входят в состав многих соединений:
Физические свойства:
Все атомы элементов 2(IIa) группы на внешнем энергетическом уровне имеют по два валентных s-электрона (см. Электронная конфигурация атомов), с которыми в химических соединениях достаточно легко «расстаются», завершая, таким образом, свой внешний энергетический уровень, который становится устойчивым, по аналогии с завершенным энергетическим уровнем инертных газов.
Таким образом, отдавая «ненужные» валентные электроны (см. Валентность), элементы 2(IIa) группы в химических соединениях проявляют степень окисления +2, являясь сильными восстановителями, проявляя при этом высокую реакционную способность.
С ростом порядкового номера химического элемента увеличивается не только общее кол-во электронов (энергетических уровней), но также и радиус атома, что в свою очередь, обуславливает уменьшение энергии ионизации (соответственно усиление металлических свойств элемента) в направлении от бериллия к радию. В этом ряду активность металлов и их восстановительные свойства возрастают.
Химические свойства Mg, Ca
Получение магния и кальция
Применение
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе