Что такое cu no3
Нитрат меди (II)
| Нитрат меди (II) | |
|---|---|
 | |
| Систематическое название | Нитрат меди (II) |
| Другие названия | Медь азотнокислая |
| Химическая формула | Cu(NO3)2 |
| Внешний вид | Бесцветные кристаллы (безводный) Голубые кристаллы (кристаллогидраты) |
| Молярная масса | безводный: 187,57 г/моль; тригидрат: 241.63 г/моль; гексагидрат: 295,69 г/моль |
| Температура плавления | безводный: 255 °C; тригидрат: 114,5 °C; гексагидрат: 24,4 °C |
| Температура разложения | безводный: 170 °C |
| Плотность | безводный: 3,05 г/см³; тригидрат: 2,32 г/см³; гегсагидрат: 2,074 г/см³ |
| Растворимость в воде | 124,7 г/100 мл |
| LD 50 | тригидрат: 940 мг/кг |
| Кристаллическая решётка | безводный: ромбическая; тригидрат: ромбическая; гексагидрат: триклинная; 1,5- и 2,5-гидраты: моноклинная |
| Стандартная энтальпия образования | безводный: −310 кДж/моль; тригидрат: −1217 кДж/моль |
| Стандартная молярная энтропия | +192 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −117 кДж/моль |
| ГОСТ | ГОСТ 4163-68 |
| Регистрационный номер CAS | 10031-43-3 |
| Регистрационный номер EC | 221-838-5 |
| Пиктограммы опасности |  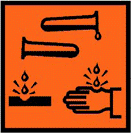  |
| Пиктограммы опасности СГС | 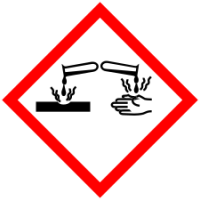  |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Содержание
Нахождение в природе
Нитрат меди (II) (в форме осно́вной соли) встречается в природе в виде минералов герхардтита и руаита. Свойства минералов представлены в таблице:
| Герхардтит | Руаит | |
|---|---|---|
| Состав | Cu2NO3(OH)3 | Cu2NO3(OH)3 |
| Цвет | зелёный | темно-зелёный |
| Сингония | орторомбическая | моноклинная |
| Плотность, г/см³ | 3,40—3,43 | 3,38 |
| Твердость | 2 | 2 |
Физические свойства
Безводный нитрат меди (II) при нормальных условиях — твёрдое кристаллическое вещество белого цвета, хорошо растворимое в воде (124,7 г/100 г H2O при 20 °C; 207,7 г/100 г H2O при 80 °C), этаноле, метаноле, этилацетате, ацетонитриле, ДМСО.
При кристаллизации из водных растворов образует ряд кристаллогидратов: нона-, гекса- и тригидраты. Также известны кристаллогидраты, содержащие 1,5 и 2,5 молекулы H2O. Параметры кристаллической решетки кристаллогидратов:
Гексагидрат разлагается при нагревании до 100 °C в вакууме. Тригидрат разлагается при 120 °C.
Химические свойства
Разложение
Нитрат меди (II) при нагревании разлагается с образованием оксида меди (II) и диоксида азота:
Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты:
Гидролиз
Нитрат меди (II) в водном растворе диссоциирует на ионы с одновременной гидратацией катиона:
Катион тетрааквамеди (II) подвергается обратимому гидролизу:
Cu 2+ + H2O ⇄ CuOH + + H +
Обменные реакции
В водных растворах нитрат меди (II) вступает в реакции ионного обмена, характерные для растворимых солей двухвалентной меди, например:
с щёлочью (выпадает голубой осадок)
с фосфатом натрия (выпадает синий осадок)
с жёлтой кровяной солью (выпадает красный осадок)
с концентрированным раствором аммиака (раствор приобретает тёмно-синий цвет)
с азидами щелочных металлов (выпадает коричневый осадок азида меди (II))
Прочие реакции
Нитрат меди (II) реагирует с растворами гидроксиламина (при кипении) и гидразина с выпадением белого осадка азида меди (I):
Нитрат меди (II) реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка:
Получение
Нитрат меди (II) может быть получен растворением в азотной кислоте металлической меди, оксида меди (II) или гидроксида меди (II):
Безводный нитрат меди (II) может быть получен при взаимодействии меди с тетраоксидом диазота (реакция ведётся при 80 °C в этилацетате):
Cu + 2N2O4 ⟶ Cu(NO3)2 + 2NO↑
Применение
Нитрат меди (II) используют для получения чистого оксида меди (II), медьсодержащих катализаторов, как фунгицид, протраву при крашении тканей.
В сочетании с уксусным ангидридом используется в органическом синтезе в качестве реагента для нитрования ароматических соединений (т. н. «условия Менке»).
Токсичность
Нитрат меди (II) является умеренно-токсичным веществом — LD50 для крыс перорально 950 мг/кг (тригидрат).
При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы.
Представляет опасность для окружающей среды — LC50 для рыб 0,29 мг/л в течение 96 ч.
Нитрат меди(II)
Бесцветные кристаллы (безводный)
Голубые кристаллы (кристаллогидраты)
безводный: 187,55 г/моль;
тригидрат: 241,60 г/моль;
гексагидрат: 295,64 г/моль
безводный: 255 °C [1] ;
тригидрат: 114,5 °C;
гексагидрат: 24,4 °C
безводный: 3,05 г/см³;
тригидрат: 2,32 г/см³;
гегсагидрат: 2,074 г/см³
тригидрат: 940 мг/кг
безводный: ромбическая;
тригидрат: ромбическая;
гексагидрат: триклинная;
1,5- и 2,5-гидраты: моноклинная
безводный: −310 кДж/моль;
тригидрат: −1217 кДж/моль
H272; H302; H315; H319; H410
P210; P273; P302+P352; P305+P351+P338
Символы опасности СГС 

Нитра́т ме́ди(II) — неорганическое вещество с формулой 
Содержание
Нахождение в природе
Нитрат меди(II) (в форме осно́вной соли) встречается в природе в виде минералов герхардтита и руаита. Свойства минералов представлены в таблице:
| Герхардтит [2] | Руаит [3] | |
|---|---|---|
| Состав | Cu2NO3(OH)3 | Cu2NO3(OH)3 |
| Цвет | зелёный | темно-зелёный |
| Сингония | орторомбическая | моноклинная |
| Плотность, г/см³ | 3,40—3,43 | 3,38 |
| Твердость | 2 | 2 |
Физические свойства
При кристаллизации из водных растворов образует ряд кристаллогидратов: нона-, гекса- и тригидраты. Также известны кристаллогидраты, содержащие 1,5 и 2,5 молекулы H2O. Параметры кристаллической решетки кристаллогидратов [5] :
Химические свойства
Разложение
Нитрат меди(II) при нагревании разлагается с образованием оксида меди(II) и диоксида азота:

Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты:
Гидролиз
Нитрат меди(II) в водном растворе диссоциирует на ионы с одновременной гидратацией катиона:
Катион тетрааквамеди(II) подвергается обратимому гидролизу:
Обменные реакции
В водных растворах нитрат меди(II) вступает в реакции ионного обмена, характерные для растворимых солей двухвалентной меди, например:
с щёлочью (выпадает голубой осадок)
с фосфатом натрия (выпадает синий осадок)
с жёлтой кровяной солью (выпадает красный осадок)
с концентрированным раствором аммиака (раствор приобретает тёмно-синий цвет)
с азидами щелочных металлов (выпадает коричневый осадок азида меди(II))
Прочие реакции
Нитрат меди(II) реагирует с растворами гидроксиламина (при кипении) и гидразина с выпадением белого осадка азида меди(I):

Нитрат меди(II) реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка:
Получение
Нитрат меди(II) может быть получен растворением в азотной кислоте металлической меди, оксида меди(II) или гидроксида меди(II):


Безводный нитрат меди(II) может быть получен при взаимодействии меди с тетраоксидом диазота (реакция ведётся при 80 °C в этилацетате):
Применение
Токсичность
Нитрат меди(II) является умеренно-токсичным веществом — LD50 для крыс перорально 950 мг/кг (тригидрат).
При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы.
Представляет опасность для окружающей среды — [8]
Медь азотнокислая — важный для промышленности нитрат
Медь азотнокислая или нитрат меди (II) — неорганическое 
Безводный нитрат меди — белый порошок с бесцветными гигроскопичными кристаллами, водорастворимый. Растворим также в спиртах, этилацетате, жидком аммиаке, диметилсульфоксиде (ДМСО). При нагревании разлагается на оксид меди и диоксид азота. Ядовит.
Водный раствор приобретает ярко-голубой цвет. В зависимости от концентрации растворенного вещества, из него выкристаллизовываются кристаллогидраты с разным количеством молекул воды. Кристаллы имеют голубой цвет, во влажном воздухе поглощают влагу и расплываются. В сухом воздухе они постепенно выветриваются и превращаются в безводную соль
 |  |  |
| Диметилсульфоксид высокой очистки (Франция) | Медь азотнокислая | Аммиак водный 25% ЧДА |
Медь азотнокислая — достаточно активное химическое вещество. Проявляет сильные окислительные свойства. Например, бумага, которую пропитали ее спиртовым раствором, после высыхания способна самовоспламеняться.
Нитрат меди реагирует со щелочами, фосфором, фосфатами, жидким аммиаком, многими солями, гидроксиламином и гидразином.
На предприятиях, имеющих дело с нитратом меди, нужно строго следить за соблюдением техники безопасности и противопожарной безопасности.
Хранить медь азотнокислую следует на прохладных, сухих, проветриваемых складах, т.к. при нагревании и разложении выделяются газы. Безводную соль необходимо защитить от влияния воздуха, так как она впитывает влагу и превращается в кристаллогидрат, поэтому ее хранят в герметично запаянных пластиковых мешках или другой герметичной таре.
Нитрат меди
Характеристики и физические свойства нитрата меди
Летучий, при слабом нагревании разлагается. Хорошо растворяется в воде (гидролизуется по катиону).
Рис. 1. Нитрат меди (II). Внешний вид.
Таблица 1. Физические свойства нитрата меди.
Молярная масса, г/моль
Температура плавления, o С
Температура разложения, o С
Растворимость в воде (0 o С), г/100мл
Получение нитрата меди
Нитрат меди (II) может быть получен при растворении меди, оксида или гидроксида меди в азотной кислоте:
Химические свойства нитрата меди
Нитрат меди (II) – средняя соль, образованная слабым основанием – гидроксидом меди (II) (Cu(OH)2) и сильной кислотой – азотной (HNO3). Формула – Cu(NO3)2. Гидролизуется по катиону. Характер среды водного раствора нитрата меди (II) кислый. Уравнение гидролиза будет выглядеть следующим образом:
Cu 2+ + H2O ↔ CuOH + + H + ;
Теоретически возможна вторая ступень:
Нитрат меди реагирует со щелочами (1), гидратом аммиака (2):
Вступает в реакции комплексообразования:
При нагревании до температуры выше 170 o С нитрат меди разлагается на оксид меди (II), диоксид азота и кислород:
Применение нитрата меди
Нитрат меди нашел применение в неорганическом и органическом синтезе, а также используется в текстильной промышленности (протрава при крашении тканей) и производстве фунгицидов (химические вещества, предназначенные для борьбы с грибковыми заболеваниями у растений).
Примеры решения задач
| Задание | Каковы масса и объем тетраоксидадиазота (N2O4), которые потребуются для получения 10 г нитрата меди (II)? |
| Решение | Запишем уравнение реакции получения нитрата меди (II) из меди и тетраоксидадиазота: |
Масса нитрата меди (II), рассчитанная по уравнению будет равна:
Тогда, масса тетраоксидадиазота, рассчитанная по уравнению:
Составим пропорцию и найдем истинную массу тетраоксидадиазота:
х = 92 × 10 / 187,55 = 4,91, значит
Найдем объем тетраоксидадиазота:
х = 22,4× 4,91 / 92 = 1,2, значит
| Задание | Сколько литров диоксида азота выделится при термическом разложении 50 г нитрата меди (II)? |
| Решение | Запишем уравнение реакции термического разложения нитрата меди (II): |
Найдем количество вещества нитрата меди (II):
Согласно уравнению реакции:
Тогда, объем выделившегося диоксида азота:
V(NO2) = 0,6 × 22,4 = 13,44 л.
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Гидролиз нитрата меди (II)
Общие сведения о гидролизе нитрата меди (II)
В обезвоженном состоянии – это бесцветные кристаллы, а в виде кристаллогидратов – голубые. Формула – Cu(NO3)2. Молярная масса – 187,55 г/моль.
Рис. 1. Нитрат меди (II). Внешний вид.
Гидролиз нитрата меди (II)
Нитрат меди (II) – средняя соль, образованная сильной кислотой – азотной (HNO3) и слабым основанием – гидроксидом меди (II) (Сu(OH)2). Гидролизуется по катиону. Среда кислая. Теоретически возможна вторая ступень.
Cu 2+ +NO3 — + HOH ↔ СuOH + + NO3 — + H + (ионное уравнение);
Cu(OH)NO3 ↔ СuOH + + NO3 — (диссоциация соли);
СuOH + + NO3 — + HOH ↔ Сu(OH)2↓ + NO3 — + H + (ионное уравнение);
Cu(OH)NO3 + HOH ↔ Сu(OH)2↓ + HNO3 (молекулярное уравнение).
Примеры решения задач
Получение сульфата меди (II) из соответствующего основного оксида возможно действием на него кислоты:
Для того, чтобы получить из сульфата сульфид нужно пропустить через раствор сульфата меди (II) сероводород:
Оксид меди (II) из соответствующего сульфида образуется путем обжига последнего:
Растворив осадок оксида меди (II) в азотной кислоте получим нитрата меди той же валентности:
| Задание | Докажите качественный состав нитрата меди (II). |
| Решение | Для того, чтобы подтвердить качественный состав какого-либо вещества нужно для начала записать уравнение его диссоциации (в данном случае соли): |
Качественная реакция на ионы Cu 2+ — образование комплексной соли ярко красного цвета при взаимодействии с молекулами аммиака:
Качественной реакции на нитрат-ионы не существует.


















