Что такое ch4 химия
Метан: способы получения и свойства
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение метана
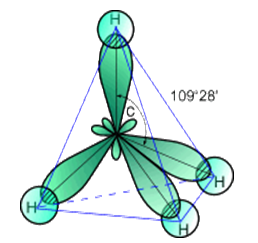
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
Например. При нитровании метана образуется преимущественно нитрометан:2. Реакции разложения метана (д егидрирование, пиролиз)Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. 3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окислениеПродукт реакции – так называемый «синтез-газ». Получение метана1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. 4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: 5. Получение метана в промышленностиМетан, получение, свойства, химические реакцииМетан, получение, свойства, химические реакции.Метан, CH4 – простейший по составу предельный углеводород, органическое вещество класса алканов. В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе, в рудничном и болотном газах. Растворен в нефти, в пластовых и поверхностных водах. В твердом состоянии встречается в виде газогидратов. Метан, формула, газ, характеристики:Химическая формула метана CH4, рациональная формула CH4. Изомеров не имеет. Является одним из парниковых газов. Его вклад в парниковый эффект составляет 4-9 %. Помимо газообразного состояния в природе встречается еще и в твердом состоянии на дне морей, океанов и в зоне вечной мерзлоты в виде метаногидратов ( гидратов природного газа ), именуемых «горючий лёд». Пожаро- и взрывоопасен. Почти не растворяется в воде и других полярных растворителях. Зато растворяется в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие). Метан по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007. Физические свойства метана:* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении. Химические свойства метана:Химические свойства метана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции: CH4 + H2O → CО + 3H2 (kat = Ni/Al2O3 при t o = 800-900 о С или без катализатора при t o = 1400-1600 о С). Образующийся в результате реакции синтез-газ может быть использован для последующих синтезов метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов. Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы метана, отрывая у них атом водорода, в результате этого образуется свободный метил CH3·, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома : Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования; CH4 + Br· → CH3· + HBr; – рост цепи реакции галогенирования; CH3· + Br· → CH3Br; – обрыв цепи реакции галогенирования. Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование метана проходит поэтапно – за один этап замещается не более одного атома водорода. При избытке кислорода: Горит голубоватым пламенем. CH4 → C + 2H2 (при t o > 1000 о С). В реакциях каталитического окисления метана могут образовываться спирты, альдегиды, карбоновые кислоты. 2CH4 + O2 → 2CН3OH (при t o = 200 о С, kat); – образуется метанол; CH4 + O2 → НCНO + H2O (при t o = 200 о С, kat); – образуется формальдегид; 2CH4 + 3O2 → 2НCOОН + H2O (при t o = 200 о С, kat); – образуется муравьиная кислота. Получение метана в промышленности и в лаборатории. Химические реакции – уравнения получения метана:Метан в промышленных и лабораторных условиях получается в результате следующих химических реакций: CО + 3H2 → CH4 (kat = Ni, t o = 200-300 о С); Применение и использование метана:– как топливо для автомобилей, судов, газовых плит, печей, паяльных ламп, зажигалок и пр. бытовых приборов; – как сырье в химической промышленности для проведения реакций органического синтеза. Молекула метана: строение, физические и химические свойстваВ последнее время довольно много программ передач на телевидении и статей в интернете посвящено теме глобального потепления на Земле. Ученые связывают этот факт с двумя парниковыми газами: диоксидом углерода и метаном. О характеристиках первого соединения в большей или меньшей степени знает каждый человек. Свойства молекулы метана рассматривают в общем курсе химии. Самый простой в ряду алкановИменно так следует охарактеризовать молекулу метана. Состоит она всего из пяти атомов: Атом углерода имеет на внешнем электронном уровне четыре неспаренных электрона. Конфигурация внешних электронных оболочек для него записывается в виде символов 2s2 2p2. Здесь цифры перед латинскими буквами говорят о периоде, в котором расположен элемент в периодической системе Менделеева. Числа после букв s и p указывают на количество электронов, находящихся на соответствующих энергетических оболочках. Из этой конфигурации видно, что валентность углерода равна IV, то есть ему необходимы 4 дополнительных электрона, чтобы достроить оболочки и получить энергетически более стабильную конфигурацию. Водород H — это самый простой элемент в периодической таблице. Он состоит всего из одного протона и электрона (существуют изотопы водорода, содержащие также нейтроны в ядре, например, дейтерий и тритий). Поэтому электронная конфигурация для него записывается просто 1s1. Атом водорода имеет валентность I.
Геометрия строения и ковалентная связьМолекула CH4 имеет не произвольное, а вполне конкретное геометрическое строение. В пространстве она представляет собой объемную фигуру тетраэдр. В геометрии она называется правильной треугольной пирамидой. Ее вершины образованы атомами водорода, каждый из которых соединен с углеродом, расположенным в центре тетраэдра. Центральный угол, образованный связями H-C-H, составляет 109,5 градуса. Это геометрическое строение обеспечивает физическую прочность молекулы. Физические характеристикиЭтот газ относится к одним из самых легковоспламеняющихся и взрывоопасных. Если в воздушной смеси находится 5−15 объемных процентов метана, то достаточно незначительной искры, которая приведет к взрыву. Самовозгорание газа происходит, если его нагреть до температуры выше 537 C. Химические свойстваПоскольку химическая связь молекулы CH4 является достаточно прочной, необходимо для ее вступления в реакцию затратить некоторую энергию активации. Этот порог может быть снижен благодаря использованию различных катализаторов. Основной реакцией метана, которая характеризует его химические свойства, является взаимодействие с кислородом. В упрощенном виде ее записывают так: CH4 + 2*O2 = CO2 + 2*H2O. В действительности же ее протекание связано с рядом этапов: Все эти этапы горения молекулы метана происходят в течение нескольких миллисекунд. Еще одним видом типичных реакций с метаном является взаимодействие с сильными окислителями галогенами. Например, с хлором происходит следующая реакция: CH4 + Cl2 = CH3Cl + HCl.
Основные источники на ЗемлеСуществует несколько основных источников CH4 на нашей планете. Среди них важное значение имеют следующие:
Парниковый газНесмотря на небольшое содержание метана в воздухе, для него характерна еще одна неблагоприятная в плане парникового эффекта особенность. В короткие периоды времени (порядка 10 лет) его способность задерживать тепло от поверхности планеты является ярко выраженной и характеризуется величиной 63 вместо 23. В последние столетия из-за быстрого развития различных отраслей хозяйства и промышленности концентрация метана в воздухе значительно увеличилась (на 150% в период с 1750 по 1998 год). В последние два десятилетия эта цифра возросла в 1000 раз! Так, в 1998 году существовало всего 1,7 молекул метана на один миллиард молекул воздуха, в 2018 году этот показатель уже составил 1858. Наступившее глобальное потепление может привести к выделению гигантских количеств этого газа из естественных экосистем, расположенных на дне океанов, что приведет к усугублению ситуации с климатом в мире. Таким образом, молекула метана является самой простой в ряду алканов, ее структурное строение представляет собой тетраэдр. В виде газа CH4 является взрывоопасным и легко воспламеняющимся. В последнее время разрабатываются новые технологии, которые призваны сократить количество выбрасываемого в воздух метана из-за его сильного парникового эффекта. МетанХарактеристики и физические свойства метанаРис. 1. Строение молекулы метана. Получение метанаСинтетические способы получения метана показывают взаимосвязь неорганических веществ с органическими. Можно выделить промышленные (1, 2, 3) и лабораторные (4, 5) способы его получения: CO + 3H2→ CH4 + H2O (kat = Ni, t = 200 – 300 o C) (2); Химические свойства метанаМетанпредставляет собой малореакционноспособное органическое соединение. Так, в обычных условиях он не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде. Все химические превращения, характерныедля метана протекают с расщеплением cвязейC-H: Различают каталитическое (в качестве катализаторов применяют соли меди и марганца) (1, 2, 3) и полное (сгорание) (4) окисление метана: Конверсию метана водяным паром и диоксидом углерода также можно отнести к способам его окисления: Крекинг метана – важнейший метод химической переработки нефти и её фракций с целью получения продуктов меньшей молекулярной массы – смазочных масел, моторных топлив и т.д., а также сырья для химической и нефтехимической промышленности: Применение метанаМетан составляет сырьевую основу важнейших химических промышленных процессов получения углерода и водорода, ацетилена, кислородсодержащих органических соединений – спиртов, альдегидов, кислот. Примеры решения задач
Найдем количество вещества метана: Согласно уравнению реакции n(CH4) :n(Cl2) = 1:1, значит,количество моль хлора равно: Тогда, масса хлора будет равна (молярная масса – 71 г/моль): | ||||
| Ответ | Масса хлора равна 35,5 г. |
| Задание | Рассчитайте объемы хлора и метана, приведенные к нормальным условиям, которые потребуются для получения тетрахлорида углерода массой 38,5 г. |
| Решение | Запишем уравнение реакции хлорирования метана до тетрахлорида углерода (реакция происходит под действием УФ-излучения): |
Рассчитаем количество вещества тетрахлорида углерода (молярная масса равна – 154 г/моль):
n(CCl4) = 38,5 / 154 = 0,25 моль.
Согласно уравнению реакции n(CCl4) : n(CH4) = 1:1, т.е. n(CCl4) = n(CH4) = 0,25 моль. Тогда объем метана будет равен:
V(CH4) = 0,25 × 22,4 = 5,6 л.
По уравнению реакции найдем количество вещества хлора. n(CCl4) : n(Cl2) = 1:4, т.е. n(Cl2) =4 × n(CCl4) = 4 × 0,25 = 1 моль. Тогда объем хлора будет равен: