Что такое awm genesis
Что такое awm genesis
Не секрет, что практически весь арсенал из серии шутеров Counter-Strike был позаимствован студией Axlebolt для Standoff 2. Так, одним из важнейших атрибутов вооружения в мобильной игре стала снайперская винтовка AWM — полный аналог AWP, убойная и очень медленная. Игроки часто выбирают ее для соревновательных матчей и используют в других режимах игры, но при этом не показывают выдающихся результатов по убийствам или ассистам. Почему так происходит? Неужели мощная винтовка не дает игрокам раскрыть навыки?
В этом гайде вы узнаете:
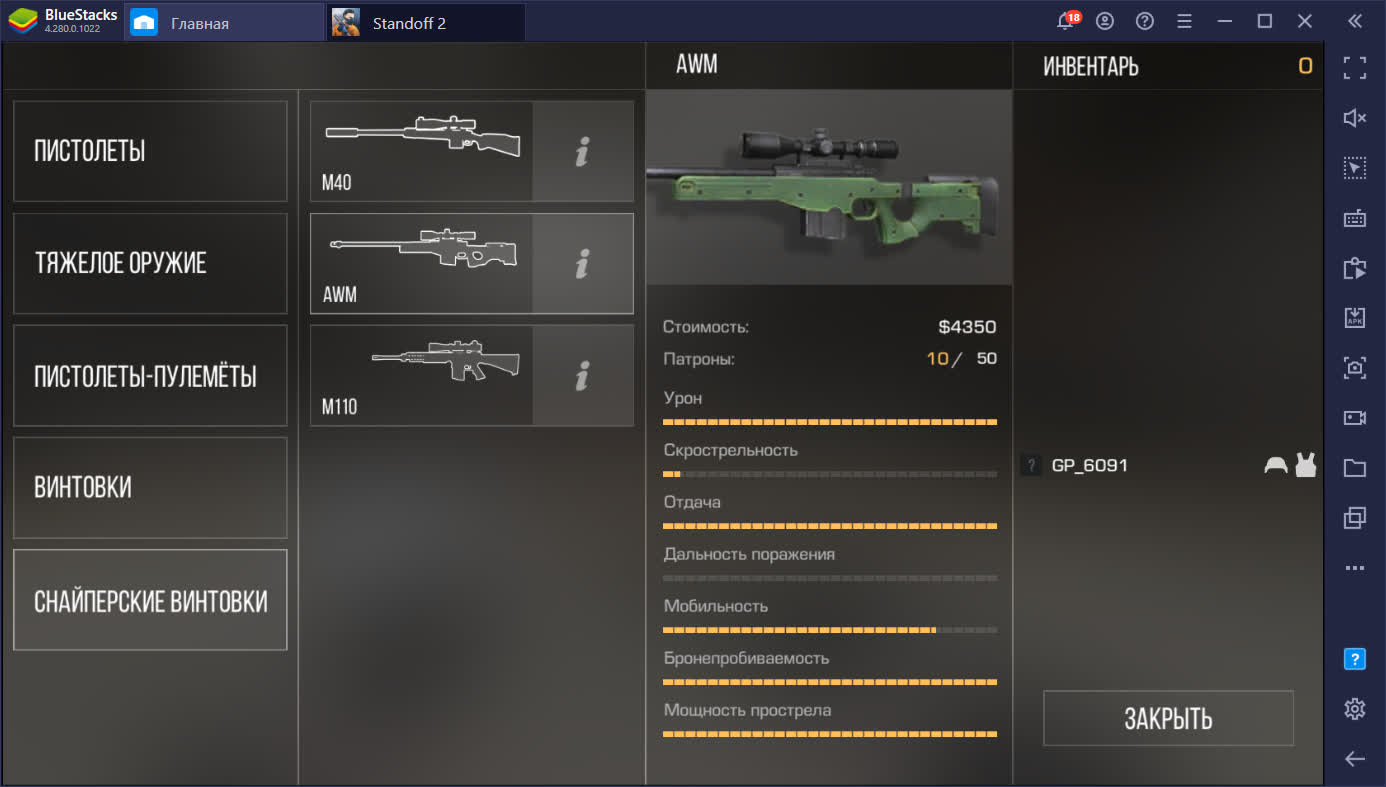
Характеристики AWM
| Урон | 30/30 |
| Скорострельность | 2/30 |
| Отдача | Очень высокая |
| Дальность поражения | Очень высокая |
| Мобильность | 25/30 |
| Бронепробиваемость | 30 |
| Мощность прострелов | 30/30 |
| Количество патронов в обойме | 10 |
| Боезапас патронов | 50 |
| Стоимость | 4350$ |
Темп игры Standoff 2 сильно отличается от CS:GO. Он динамичнее за счет меньших по размеру карт и хаотичной системе респауна: порой противники появляются прямо за спиной. Эта ситуация застает врасплох даже игроков с автоматами, реакции которых не хватает для быстрой нейтрализации «взявшегося ниоткуда» врага. И если подобные проблемы преследуют более подвижных игроков, то владельцы AWM просто обречены!
Конечно, не все так драматично. Однако динамика, плотность и респауны очень усложняют игровой процесс с этой винтовкой. Низкий темп стрельбы в совокупности с высокой отдачей требуют от снайперов постоянного контроля позиции или надежного прикрытия из одного/двух тиммейтов, которые охраняют подходы (справедливо для режима «Аркада»).
Как играть с AWM?
Чтобы показывать класс при игре с AWM в Standoff 2, запомните 3 вещи:
Тренируйте навык стрельбы из AWM. Если вы хотите играть как профи, то уделяйте процессу тренировки хотя бы 30-40 минут в день. Это может быть стрельба по мишеням в режиме «Тренировка», матчи «Командного боя» или «Аркады». Также проверьте настройки чувствительности мыши при прицеливании и откалибруйте их под себя.
Как играть против соперников с AWM?
Справиться со снайпером поможет сокращение дистанции, обход по флангу и командный прессинг.
Далеко не каждый игрок в Standoff 2 способен попасть по движущейся цели из снайперской винтовки. Даже опытные стрелки, которые посвящают игре несколько часов в день, допускают ошибки из-за системных проблем проекта или по причине резких, непредсказуемых движений соперника. Поэтому используйте короткие перебежки, прячьтесь за надежными укрытиями и сокращайте расстояние до вражеского снайпера. Заставьте его покинуть позицию и перевооружиться, а затем добейте парой точных выстрелов или быстрой очередью.
Практически все карты в Standoff 2 созданы таким образом, чтобы у вас была возможность подойти к определенной позиции минимум тремя способами. Это то, что сильно осложняет жизнь снайперам, и этим необходимо пользоваться. Если вы видите, что какая-то линия поля простреливается с AWM, постарайтесь зайти врагу с фланга или с тыла, пока он сосредоточил огонь на ваших тиммейтах или контролирует зону.
Наконец, самая рисковая тактика, которая дает хорошие результаты. Она требует работы в команде, поэтому ее не получится применять в игре со случайными тиммейтами. Займите позиции в разных частях локации, которую контролирует противник с AWM. Убедившись, что его не страхуют другие игроки, одновременно выбегайте из укрытий. Из-за обилия появившихся целей 90% снайперов теряется и не производят ни одного точного выстрела. Это ваш шанс прорвать оборону, подойти поближе и вынудить врага сменить позицию.
Обзор доступных скинов
На момент написания гайда в Standoff 2 доступно 10 скинов для AWM:
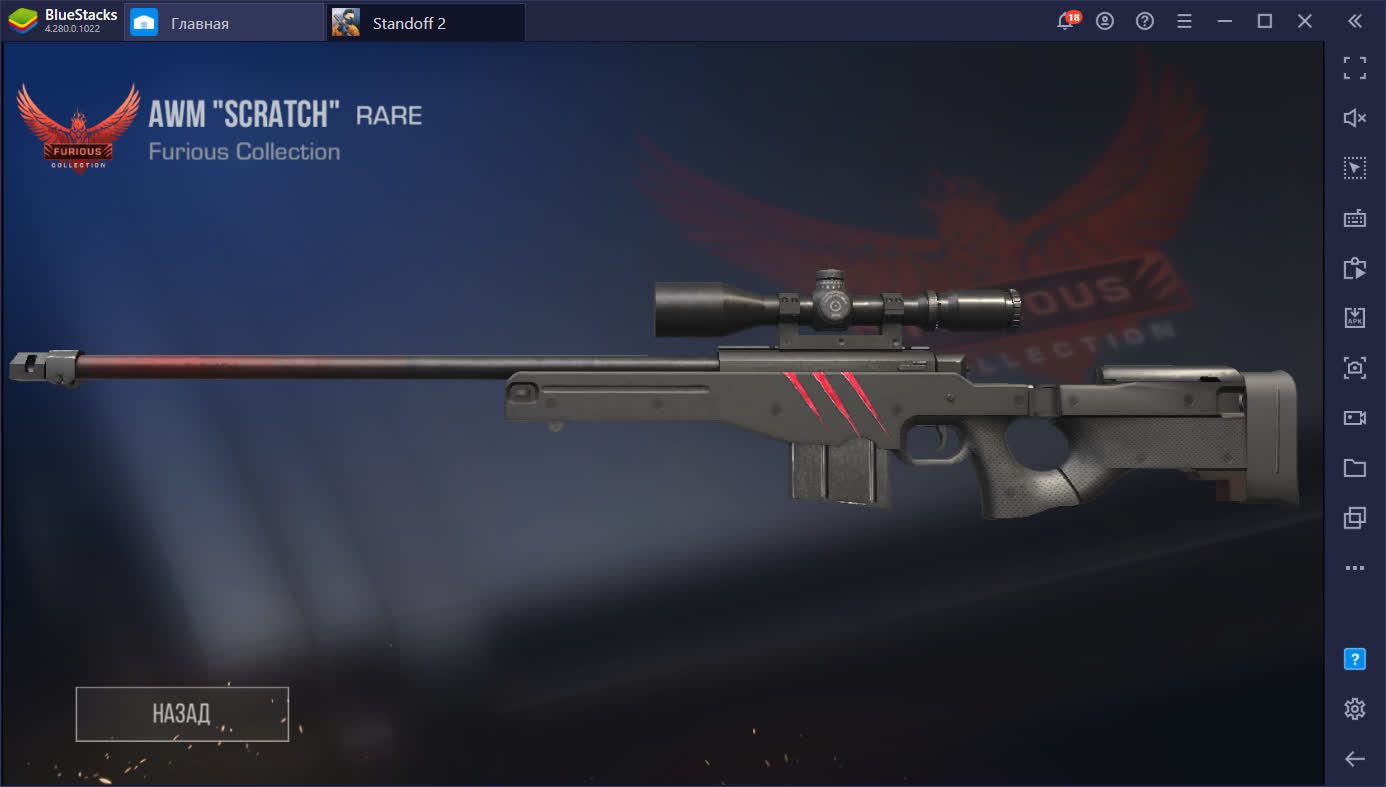
Редкий “Scratch” из кейса Furious
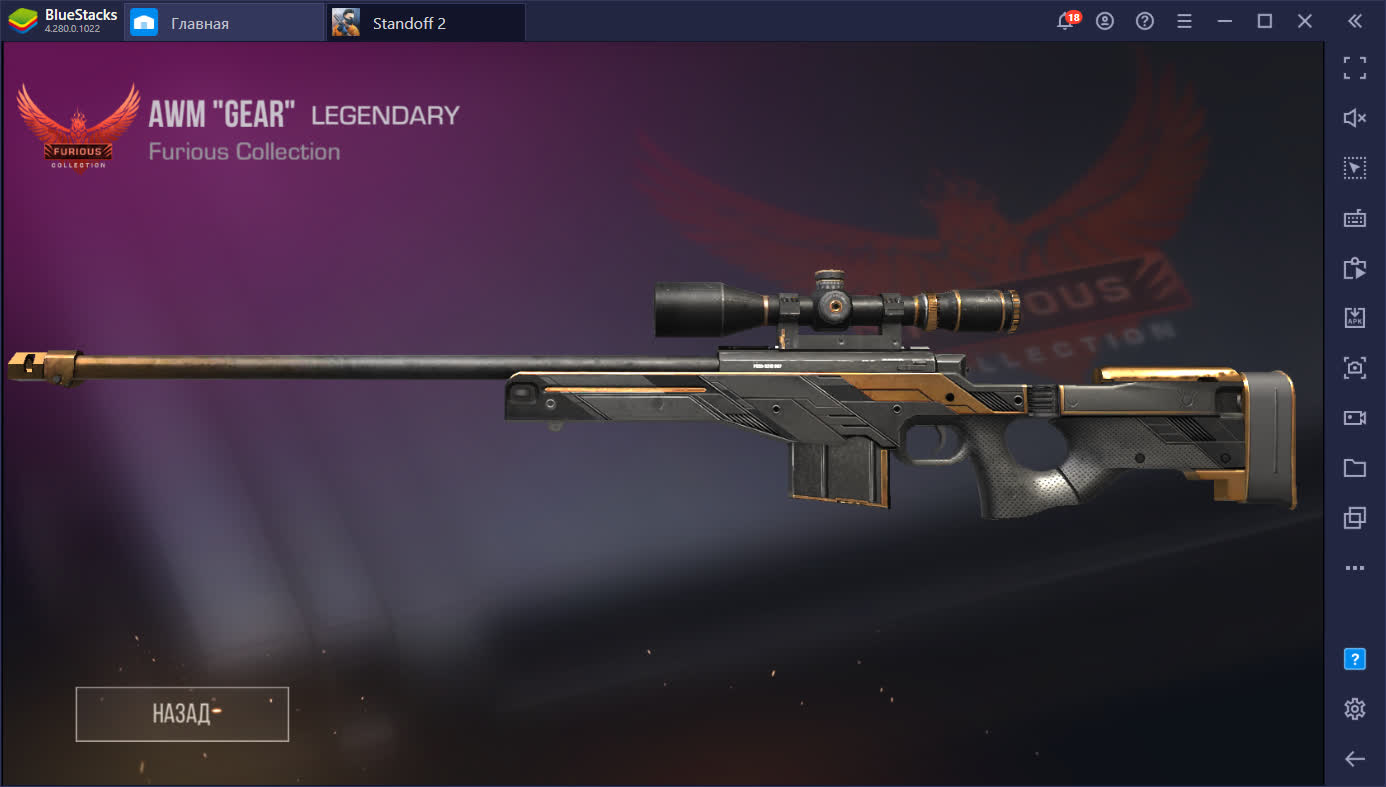
Легендарный “Gear” из кейса Furious
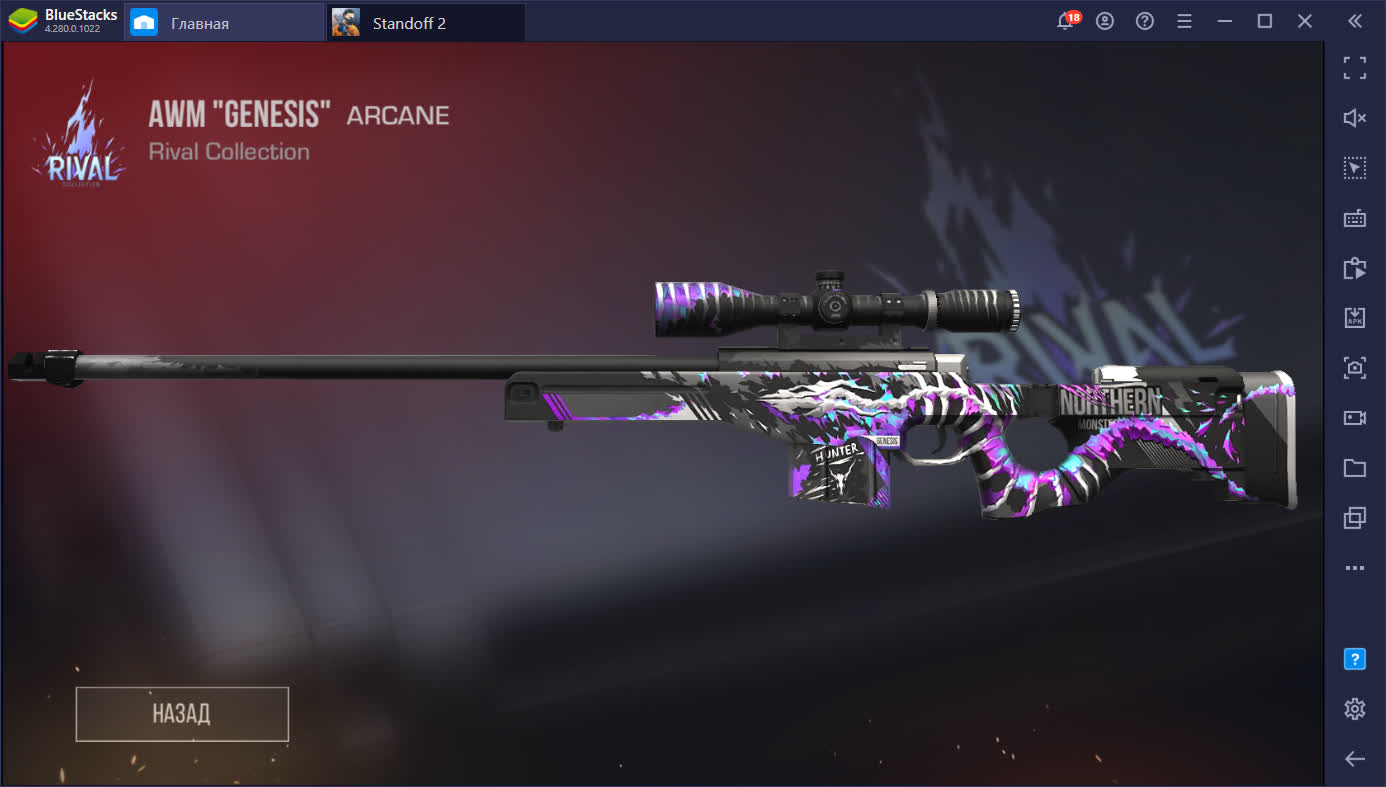
Мифический “Genesis” из кейса Rival
Легендарный “Dragon” из кейса Scorpion
Сосудистая мальформация
Представляют собой плотный клубок расширенных сосудов, в котором вены контактируют с артериями без участия капиллярной сети ввиду ее отсутствия. В результате отклонения, артериальная кровь шунтируется в систему глубоких и поверхностных вен без отдачи питательных веществ и выведения углекислого газа. Размеры сосудистых мальформаций могут быть как малыми, так и огромными.
Причины нарушения не выяснены до конца, однако считается, что оно не связано с наследственностью. Симптоматика бывает размытой и неспецифичной, вследствие чего АВМ обнаруживается при проведении КТ / МРТ головного или спинного мозга по стороннему поводу (например, при инсульте или травме). Механизмы и последствия влияния АВМ на жизнедеятельность человека непредсказуемы, поэтому заболевание требует адекватного лечения.
Причины сосудистых мальформаций
Сосудистая мальформация является врожденным дефектом строения сосудов центральной нервной системы. Имеет корреляцию с нарушениями внутриутробного развития плода и родовыми травмами, однако конкретные провоцирующие факторы данного явления не выяснены.
Местные аномалии формирования артерий и вен мозга происходят у эмбриона не позднее 1-2 месяца беременности.
Прямой взаимосвязи между наличием данной аномалии, а также возрастом или полом пациента, на сегодняшний день не обнаружено.
Симптоматика и клиническая картина
АВМ может не давать о себе знать на протяжении долгих лет, поэтому пациенты часто узнают о своем диагнозе случайно, проходя диагностические мероприятия по смежным поводам. Мальформации, увеличивающиеся в объеме, могут оказывать избыточное давление на мозг, и лишь в этом случае проявляются неврологические (очаговые) симптомы.
Клиническая картина нарушения неспецифична, поэтому требует углубленной дифференциальной диагностики.
В обычной жизни АВМ могут проявлять себя в следующих признаках:
• Внутричерепная гипертензия с характерным болевым синдромом давящего или пульсирующего характера;
• Вялость, апатия, снижение работоспособности;
• Расстройство координации движений;
• Видимое снижение интеллектуальных способностей;
• Моторная афазия и иные речевые нарушения;
• Подавление иннервации отдельных участков тела;
• Шаткость походки и внезапные падения (зачастую на спину или бок);
• Мышечная гипотония и судорожные приступы;
• Нарушения зрения (косоглазие, выпадение полей зрения, частичная или полная слепота);
• Эпилептические припадки разной длительности и интенсивности;
Симптомы заболевания полностью зависимы от локализации мальформации (лобная или височная доля, мозжечок, основание головного мозга, спинной мозг).
Разрыв патологически измененных сосудистых клубков также влечет за собой определенные острые проявления. Это осложнение приводит к внутреннему кровотечению в головной или спинной мозг, сопряженному с внезапным нарушением их кровоснабжения. При субарахноидальном кровоизлиянии и образовании гематомы в мозге, проявления патологии становятся различимыми.
Больной может жаловаться на следующие симптомы:
• Резкий и внезапный приступ сильнейшей головной боли;
• Тошнота и интенсивная рвота без объективных причин (извержение желудочного содержимого при этом не приносит облегчения);
• Светобоязнь (боли в глазных яблоках при взгляде на источник света или нахождении в освещенном помещении);
• Обездвиженность глаз и нарушения зрения вплоть до полной его утраты;
• Нарушения экспрессивной и импрессивной речи (больной произносит нечленораздельные звуки и обрывки фраз, не воспринимает информацию из сторонних уст);
Если вы или ваши близкие столкнулись с приведенными клиническими проявлениями патологии, в неотложном порядке обращайтесь за профессиональной помощью.
Дифференциальная диагностика АВМ
Лучшие специалисты отделения сосудистой хирургии в нашем центре организуют оптимальные диагностические мероприятия, позволяющие распознать заболевание в любой форме. Дифференциальная диагностика в нашем отделении выполняется соответственно высшим медицинским стандартам.
Сосудистые мальформации определяются при помощи таких исследований:
1. Оценка текущего состояния пациента, анализ его жалоб, углубленное изучение анамнеза;
2. Первичный неврологический осмотр, в ходе которого выявляются признаки конкретного местоположения АВМ в соответствии с клинической картиной поражения определенных участков головного или спинного мозга;
3. Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), позволяющие послойно изучить структуру мозга, наглядно увидеть местоположение АВМ и ее объем, оценить общее состояние исследуемого органа;
4. Ультразвуковая допплерография, дающая возможность наблюдать пространственное положение кровеносных сосудов в пораженной области в режиме реального времени, а также дифференцировать патологию с иными видоизменениями их анатомической структуры;
5. Ангиография, выполняемая при помощи контрастного вещества, которое вводится в сосудистое русло; помогает оценить состояние вен и артерий с помощью рентгеновского снимка.
При затруднении в постановке диагноза, вам может потребоваться дополнительная консультация невролога и нейрохирурга. Обычно сосудистая мальформация (если она имеется у пациента) диагностируется сразу.
Методы лечения заболевания
Полноценная терапия больных с сосудистыми мальформациями требует возможности проведения основных вариантов лечения – эмболизации, радиохирургического и хирургического. Тактика подбирается опытным специалистом. При этом оценивается потенциальный риск осложнений от выбранного способа терапии в соотношении с риском спонтанного прогрессирования и течения заболевания.
Лечение направлено строго на облитерацию мальформации для исключения угрозы кровоизлияний. Каким способом будет достигнута эта цель, решает специалист, основываясь на результатах диагностики, индивидуальных особенностях и возрастной категории больного.
Хирургическое лечение представляет собой довольно сложную процедуру, в ходе которой АВМ удаляется из мозга через трепанационное отверстие (механическое раскрытие черепной полости).
Радикальная экстирпация применяется в случаях крупного объема клубков АВМ.
Радиохирургическое лечение (где мальформация иссекается гамма-ножом при помощи специфических излучений) пригодно только в случае малых размеров сосудистого клубка.
Эндоваскулярный метод не является столь агрессивным и подразумевает перекрытие просвета АВМ через сосуд.
При игнорировании лечения, сосудистая мальформация может спровоцировать тяжелые осложнения:
• Кровоизлияние в головной или спинной мозг на фоне разрыва очага АВМ;
• Стойкие двигательные расстройства (парезы конечностей и иных частей тела);
• Тяжелые неврологические нарушения.
Если лечение оказалось невозможным ввиду большого размера АВМ, следует заняться профилактикой ее разрыва.
Профилактические меры
Целенаправленно предупредить формирование сосудистых мальформаций нельзя, поскольку они развиваются еще внутриутробно. Однако если АВМ была диагностирована, но лечение на данный момент является невозможным, вы должны заняться адекватной профилактикой разрыва мальформации.
Предупредить осложнения можно следующими путями:
1. Контроль над уровнем артериального давления, купирование приступов его повышения при помощи гипотензивных медикаментозных препаратов;
2. Исключение психоэмоциональных стрессов;
3. Отказ от тяжелых физических нагрузок.
С остальными мерами протекции от осложнений АВМ вас ознакомит наш специалист в персональном порядке.
Что такое awm genesis
ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
ФГБУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» РАМН, Москва
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Микрохирургическое лечение некровоточивших артериовенозных мальформаций головного мозга
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2018;82(5): 119-124
Горожанин В. А., Пилипенко Ю. В., Белоусова О. Б., Элиава Ш. Ш. Микрохирургическое лечение некровоточивших артериовенозных мальформаций головного мозга. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2018;82(5):119-124.
Gorozhanin V A, Pilipenko Iu V, Belousova O B, Éliava Sh Sh. Microsurgical treatment of non-bleeding cerebral arteriovenous malformations. Zhurnal Voprosy Neirokhirurgii Imeni N.N. Burdenko. 2018;82(5):119-124.
https://doi.org/10.17116/neiro201882051119
ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Лечение некровоточивших (в англоязычной литературе: unruptured, неразорвавшихся) артериовенозных мальформаций (АВМ) головного мозга вызывает множество споров среди нейрохирургов всего мира. Наиболее обсуждаемые вопросы — выбор метода и показаний к тому или иному методу лечения. Несмотря на накопленные данные, включая результаты рандомизированных исследований, единого мнения по этой проблеме среди специалистов пока не сформировалось. Цель исследования — проанализировать существующие на сегодняшний день представления о тактике ведения и обоснованности микрохирургического лечения некровоточивших АВМ головного мозга на основании последних опубликованных исследований.
ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
ФГБУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» РАМН, Москва
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Артериовенозные мальформации (АВМ) головного мозга являются самой частой врожденной патологией развития сосудов головного мозга, которая проявляется клинически. Первые симптомы заболевания, как правило, появляются в молодом возрасте [1—5]. В структуре всей нейрохирургической патологии АВМ составляют небольшую часть, однако с учетом того, что наиболее частым проявлением заболевания является кровоизлияние, зачастую с образованием обширных внутримозговых гематом и неблагоприятным течением, проблема лечения АВМ остается актуальной по сей день.
К настоящему времени показания к хирургическому и другим видам лечения АВМ, проявившихся внутричерепным кровоизлиянием, сформулированы достаточно четко [6]. В то же время подход к лечению некровоточивших (в англоязычной литературе: unruptured, неразорвавшихся) АВМ остается предметом дискуссий. Он основывается, как правило, на сопоставлении риска хирургического лечения и вероятности спонтанного кровоизлияния из АВМ [7, 8]. Эта задача требует более точного определения частоты и клинической значимости этих рисков. Помимо микрохирургического, необходимо рассматривать с тех же позиций и другие существующие в настоящее время методы лечения АВМ — эндоваскулярный и радиохирургический, а также комбинацию различных методов.
За последнее время интерес к лечению некровоточивших АВМ возрос, что отразилось в появлении ряда публикаций, обсуждающих эту проблему. Анализ этих публикаций представляет большой интерес, так как лечение АВМ головного мозга — одно из основных направлений работы сосудистого отделения НМИЦ нейрохирургии им. Н.Н. Бурденко и ряда других нейрохирургических клиник России.
Приводим результаты основных исследований.
Исследование ARUBA (A Randomized multicenter clinical trial of Unruptured Brain AVMs)
В 2013 г. опубликованы результаты исследования некровоточивших АВМ — ARUBA trial [9]. Это первое проспективное рандомизированное исследование, в котором проводилось сравнение результатов консервативного и интервенционного лечения неразорвавшихся АВМ головного мозга с применением статистического анализа данных. Всего были рандомизированы 223 пациента. Наиболее частая манифестация АВМ включала головную боль и эпилептические приступы, однако также немалую часть (42%) составляли больные с бессимптомными АВМ. В результате рандомизации были сформированы две приблизительно равноценные по числу больных группы: группа консервативного лечения (109 пациентов) и группа интервенционного лечения (114), включающего эмболизацию, радиохирургию, микрохирургическую резекцию или комбинацию этих методов. В течение 33 мес наблюдения инсульт или летальный исход наблюдались у 30,7% пациентов в интервенционной группе и 10,1% — в группе консервативного лечения. Инвалидизирующий исход (по модифицированной шкале Рэнкина (mRs) 2 балла и более) имели 46,2% больных в интервенционной группе. В группе консервативного лечения такие больные составили 15,1%. Исходя из полученных результатов, авторы пришли к выводу, что консервативная тактика ведения (по сути, наблюдение) неразорвавшихся АВМ предпочтительнее, чем хирургическое и другие интервенционные виды лечения. Следует отметить, что в ходе работы авторы [10—12] столкнулись с трудностями набора пациентов, в связи с чем исследование завершилось ранее планируемого срока, что вызвало вопросы по поводу обобщения результатов.
Исследование SAIVMS (the Scottish Audit of Intracranial Vascular Malformations Study)
Схожие с исследованием ARUBA результаты были получены в популяционном проспективном когортном исследовании SAIVMS, в котором проводилось сопоставление консервативной и интервенционных групп. В отличие от исследования ARUBA группы не были рандомизированы. Исследование проводилось в два этапа: в 1999—2003 гг. и 2006—2010 гг. В работе использовалась база данных Национальной службы здравоохранения Шотландии. В исследование вошли 204 взрослых пациента старше 16 лет с диагнозом «неразорвавшаяся АВМ» [13].
Критика ARUBA и SAIVMS
Публикация результатов исследований ARUBA и SAIVMS в журналах Lancet и JAMA вызвала шквал критики со стороны нейрохирургов всего мира. По мнению многих, исследования имели ряд значимых ограничений, которые влияли на достоверность результатов.
Критика сводилась к следующим положениям.
— В исследовании ARUBA из 1740 пациентов с АВМ, подвергшихся скринингу, были рандомизированы всего 226 (13%) человек. Из 1514 случаев, не подвергшихся рандомизации, 1014 были исключены по причине верификации кровоизлияния в анамнезе или предыдущего лечения. Из 500 пациентов, соответствовавших критериям исследования, 323 пациента отказались от участия в нем, а 177 пациентов лечились в клиниках, не принимавших участия в исследовании. В Университете Сан-Франциско (Калифорния) с потоком более 50 неразорвавшихся АВМ в год с апреля 2007 г. по июнь 2010 г. в исследование были включены лишь 4 больных с АВМ [10, 14]. По причине возможности отказа пациентов от включения в исследование был нарушен принцип рандомизации. Данная тактика могла послужить также причиной малой численности выборки, так как отказавшихся от участия в исследовании было на 50% больше, чем рандомизированных.
— Количество пациентов в интервенционной группе (114) и особенно в подгруппах разных методов лечения было слишком мало. Так, микрохирургический метод применялся у 5 пациентов, эмболизация — у 30, радиохирургия — у 31, микрохирургия с эмболизацией — у 12, эмболизация и радиохирургия — у 15, микрохирургия с радиохирургией — у 1 пациента. При таком численном составе групп невозможно показать преимущество того или иного метода лечения.
— Выбор метода лечения в интервенционной группе вызвал много вопросов. Так, 80% АВМ в исследовании ARUBA и 70% в исследовании SAIVMS подверглись эмболизации или радиохирургии. Учитывая, что, по данным метаанализа большого числа работ по применению разных методов в лечении АВМ, опубликованного в 2011 г. van J. Beijnum и соавт. [8], тотальное иссечение АВМ выполнялось в 96% случаев, а полная облитерация была достигнута при радиохирургии в 38% случаев, при эмболизации в 13%, распределение методов лечения представляется не соответствующим основным принципам лечения АВМ [15—20]. Кроме того, по данным того же метаанализа, риск кровоизлияния после микрохирургического лечения в 9 раз меньше, чем после эндоваскулярного или радиохирургического. По данным некоторых авторов [21], частичная окклюзия АВМ даже повышает риск возможного кровоизлияния в дальнейшем. Возможно, высокий процент летальных исходов, инсультов и инвалидизации в интервенционной группе исследования ARUBA обусловлен рисками выбранных видов лечения, при которых высока вероятность неполной облитерации АВМ, что в свою очередь повышает риск кровоизлияния.
— В исследовании ARUBA 90% АВМ составляли мальформации, соответствовавшие категориям I—III по шкале Спецлер—Мартин (С—М) — так называемые low-grade АВМ. Хорошо известно, что такие мальформации чаще всего доступны для микрохирургического лечения в связи с низким риском осложнений. Но, несмотря на то что 76 (68%) пациентов в группе интервенционного лечения имели «low-grade» АВМ, только 18 пациентам была проведена микрохирургическая резекция [22, 23].
— Осложнения после хирургических вмешательств чаще всего возникают в раннем послеоперационном периоде. Симптоматика, развивающаяся в отдаленные сроки, может быть проявлением естественного течения заболевания — кровоизлияния из остаточной части в случае отсутствия тотальной окклюзии АВМ. В исследовании ARUBA конечной точки (кровоизлияние или летальный исход) достигли 10% пациентов в группе наблюдения и 30,7% — в интервенционной группе.
В большинстве исследований, посвященных геморрагическим инсультам, исход оценивается по mRs в конце всего периода наблюдения. Это достаточно простой вариант оценки клинического состояния пациента. В качестве промежуточной точки были приняты возможный летальный исход или инвалидизация — по mRs ≥2. За 36 мес данный исход зафиксирован у 6 (14%) из 43 пациентов в группе наблюдения и 17 (38,6%) из 44 в интервенционной группе. Количество летальных исходов было схожим (2 случая в группе наблюдения, 3 — в интервенционной группе). Высокий риск осложнений (38,6%) в интервенционной группе существенно отличается от данных литературы по исходам лечения неразорвавшихся малых АВМ, расположенных вне функционально значимых зон. Также в работе не были проанализированы причины плохих исходов при интервенционном лечении (техника вмешательств или особенности АВМ).
Также нужно отметить, что большой процент операций в интервенционной группе исследования ARUBA составлял радиохирургический метод, эффективность которого сложно оценить при катамнестическом обследовании менее 3 лет, учитывая окно облитерации.
Как в SaIVMS, так и в ARUBA все методы лечения были объединены в одной интервенционной группе, при этом превалировали немикрохирургические методы. Степень облитерации АВМ составила 63—71% [25].
Из 104 изначально планируемых медицинских центров в исследовании участвовало только 39, причем из 14 центров в исследование были включены по 1—2 больных, хотя в каждом за время исследования могли пролечиться около 60 больных с АВМ. Таким образом, 22 (56%) центра предоставили ≤5% от общего количества включенных в исследование пациентов. Главным критерием выбора центра послужил опыт лечения не менее 10 пациентов с АВМ в год, что не может не вызвать вопроса, так как результаты хирургического лечения АВМ напрямую коррелируют с опытом лечения.
Большинство пациентов были набраны из европейских центров (79 из Франции и 51 из Германии), меньшая часть — из Северной Америки (около 40). В этих центрах существуют разные традиции в стратегии лечения АВМ. Так, в европейских клиниках доминирует концепция эндоваскулярного и радиохирургического методов лечения, тогда как в США активно применяется микрохирургический подход [26].
В декабре 2016 г. в Милане состоялась конференция по проблемам лечения АВМ, в которой приняли участие 24 члена европейских ассоциаций нейрохирургов, эндоваскулярных хирургов и радиохирургов (радиологи), в том числе представители микрохирургического и радиологического отделений НМИЦ нейрохирургии им. Н.Н. Бурденко [27].
Были обсуждены и согласованы следующие ключевые позиции по лечению АВМ:
1. Церебральные АВМ являются сложным заболеванием, ассоциированным с потенциально опасным естественным течением.
2. Выводы, сделанные в исследовании ARUBA, не могут быть использованы при лечении неразорвавшихся АВМ.
3. Учитывая доступные комбинированные методы лечения, выбор тактики должен осуществляться с участием всех соответствующих специалистов, занимающихся лечением данной патологии.
4. Данные о потенциальном риске кровоизлияния и ограничения в повседневной активности у больных с неразорвавшимися АВМ служат достаточным основанием для хирургического лечения неразорвавшихся «low-grade» АВМ (категории I и II по шкале С—М).
5. На основании коллегиального решения в каждом конкретном случае могут быть определены также показания для лечения АВМ с большим риском по шкале С—М.
6. Если лечение показано, дальнейшая стратегия должна утверждаться консилиумом специалистов.
После рассмотрения преимуществ и недостатков рандомизированного исследования участники предложили создать проспективный европейский междисциплинарный реестр по лечению АВМ.
Другие исследования, проведенные в соответствии с критериями ARUBA
Результаты исследования ARUBA подтолкнули многих нейрохирургов провести собственные исследования по оценке результатов лечения АВМ различными методами. Был опубликован ряд работ, в которых группы больных подобраны по тем же критериям, какие были использованы в исследовании ARUBA, для более корректного сопоставления результатов. К этим критериям были отнесены неразорвавшиеся АВМ, верифицированные по МРТ; возраст старше 18 лет; отсутствие какого-либо лечения ранее. Приводим результаты этих работ.
В 2016 г. J. Wong и соавт. [28] опубликовали работу, включающую 155 больных, подвергшихся микрохирургическому вмешательству. Средний срок наблюдения составил 36 мес. Тотальное иссечение АВМ было подтверждено церебральной ангиографией (ЦАГ) в 98,1% случаев. Были зафиксированы ранний послеоперационный дефицит и перманентная инвалидизация (по mRs ≥3), составившие 12,3 и 4,5% соответственно для всей группы и 9,3 и 3,4% соответственно для АВМ категорий I и II по шкале С—М.
M. Javadpour и соавт. [29] провели проспективное исследование результатов лечения 34 пациентов в микрохирургической группе. 70,5% составляли пациенты с АВМ категорий I и II по С—М. У всех пациентов была выполнена тотальная резекция АВМ, что было подтверждено в каждом случае данными ЦАГ. Геморрагических, ишемических инсультов, а также летальных исходов в катамнестическом исследовании не наблюдалось. Появившаяся сразу после операции неврологическая симптоматика оказалась стойкой и не изменилась через 6 мес после вмешательства у 14,7% (mRs ≥1) и 6% (mRs ≥2).
У пациентов наибольшую часть осложнений составили стойкие зрительные нарушения.
Одна из последних крупных хирургических работ, опубликованная в 2017 г., — исследование J. Schramm и соавт. [30]. Это проспективное исследование включает 288 АВМ (144 из них — неразорвавшиеся), прооперированных одним нейрохирургом за 29 лет. Критериям ARUBA соответствовали 104 пациента. В данной подгруппе из 63 (61%) пациентов с категориями I и II по С—М стойкая инвалидизация (по mRs ≥2) наблюдалась у 9 (14,3%). Из 288 АВМ большую часть (53,5%) составляли малые АВМ (менее 3 см в диаметре). Сфокусировавшись на анализе данной подгруппы, авторы пришли к выводу, что микрохирургическая резекция таких АВМ приводит к лучшим исходам (стойкая инвалидизация 7,8%, из которых 3,2% значимая), нежели мультимодальное или консервативное лечение.
В ходе ретроспективного анализа J. Nerva и соавт. [31] отобрали группы больных после радиохирургии и микрохирургического вмешательства — 49 и 51% соответственно. В микрохирургической группе в 84% случаев производилась предоперационная эмболизация АВМ. В хирургической группе стойкий неврологический дефицит отмечен в 5% случаев при АВМ категорий I и II, и в 50% случаев у больных c АВМ категорий III—V по С—М. При оценке катамнеза выявлено, что в группе с АВМ категорий I и II по С—М исходов типа 2 по mRs не наблюдалось, а в группе с АВМ категорий III—V по С—М 33% больных были инвалидизированы (по mRs ≥2). Таким образом, авторы пришли к выводу, что у больных с АВМ категорий I и II по С—М, соответствовавших критериям исследования ARUBA, оперативное вмешательство помогает достичь отличных результатов лечения.
Другие исследования, выполненные не по критериям ARUBA
В 2015 г. M. Potts и соавт. [14] для уточнения безопасности и эффективности микрохирургии «low-grade» АВМ представили свой опыт лечения 112 неразорвавшихся АВМ. Авторы отметили более благоприятный исход у больных с неразорвавшимися АВМ (хорошие функциональные исходы по mRs 0—1 в 91% случаев) по сравнению с разорвавшимися АВМ (61%). Авторы также проанализировали все работы по микрохирургии «low-grade» АВМ начиная с 1986 г., включившие в общей сложности 1235 пациентов. Результаты анализа были представлены ими в виде таблицы. 
По итогам анализа авторы пришли к выводу, что микрохирургия должна быть выбрана в качестве «золотого стандарта» в лечении большинства «low-grade» АВМ, за исключением глубинных или АВМ функционально значимых зон, для которых методом выбора является радиохирургия.
M. Elhammady и R. Heros [33] проанализировали еще более узкую группу — бессимптомные АВМ. Ее составил 31 пациент с радиохирургическим лечением. 94% случаев были представлены АВМ категорий I—III по С—М, относительно небольших размеров. Частота облитерации через 5 лет после лечения составила 78%, а ежегодная частота кровоизлияний — 1,7%. В заключение данной работы авторы отмечают, что, несмотря на высокую эффективность радиохирургического лечения, в случае АВМ категорий I—III по С—М этот метод более актуален у пожилых и соматически тяжелых больных с небольшими АВМ и является лишь альтернативой микрохирургической резекции, которая предпочтительна в случае ее технической возможности, в особенности у молодых и соматически здоровых пациентов.
Достаточно большую серию, включающую 368 больных с неразорвавшимися АВМ, которым выполнена микрохирургическая резекция, представили D. Bervini и соавт. [34]. Средний срок катамнеза составил 270 дней. Подтвержденная данными ЦАГ тотальная резекция наблюдалась в 97,7% случаев. У пациентов с неразорвавшимися АВМ по шкале Спецлер—Понс, А (соответствует категориям I и II по шкале С—М) новый стойкий неврологический дефицит mRs ≥2 и mRs ≥3 на момент последнего осмотра был у 1,6 и 0,5% больных соответственно. По шкале Спецлер—Понс В (соответствует категории III по шкале С—М) аналогичный дефицит наблюдался уже в 14 и 2,8% случаев. После хирургического лечения пациентов с АВМ по шкале Спецлер—Понс С (соответствует категориям IV и V по шкале С—М) дефицит составил 38,6 и 15,9%. Таким образом, учитывая частоту нового неврологического дефицита mRs ≥3 в группах Спецлер—Понс, А и В, исходы при хирургическом лечении лучше, чем при консервативном.
В опубликованной серии больных с 220 «low-grade» АВМ после микрохирургической резекции, с катамнестическим исследованием M. Morgan и соавт. [23] отметили, что послеоперационная инвалидизация в среднем составила 0,9%, летальность — 0,5%. Кровоизлияний после операции не отмечено.
В уже упоминавшемся выше крупном метаанализе по лечению всех церебральных АВМ, включая разорвавшиеся и неразорвавшиеся, в том числе АВМ высокого риска по шкале С—М, тотальное иссечение достигнуто в 96% случаев, полная облитерация при стереотаксической радиохирургии — в 38%, при эмболизации — в 13% случаев. Частота тяжелых осложнений составила 7,4% случаев после микрохирургии, 6,6% — после эндоваскулярной окклюзии и 5,1% — после радиохирургии [8]. Следует отметить, что представленная частота осложнений гораздо ниже, чем по результатам исследования ARUBA. Результаты данного метаанализа согласуются с результатами и современными направлениями лечения АВМ.
Таким образом, по данным большинства приведенных работ, можно заключить, что микрохирургическая резекция является методом выбора для «low-grade» АВМ.
Планируемые рандомизированные исследования по хирургическому лечению АВМ
Учитывая выводы, полученные в исследовании ARUBA, для окончательного подтверждения предпочтительного микрохирургического лечения «low-grade» АВМ в настоящее время планируется и разрабатывается дизайн крупного рандомизированного исследования BARBADOS [35]. Его задача — сопоставить результаты лечения неразорвавшихся АВМ микрохирургическим методом и при консервативном лечении/наблюдении. В исследование планируется включить только те центры, где по предварительной оценке послеоперационная инвалидизация при неразорвавшихся «low-grade» АВМ составляет не более 10%.
Также проводится набор пациентов в исследование TOBAS [36]. В этом исследовании планируется сопоставить интервенционную и консервативную группы, но акцент будет сделан на сравнении отсроченных результатов (через 10 лет). Вторая планируемая задача — выяснить, эффективна ли эмболизация афферентов АВМ перед микрохирургическим или радиохирургическим лечением, и если да, то какова эта эффективность.
Заключение
Несмотря на то что исследования ARUBA и SAIVMS относятся к проспективным мультицентровым рандомизированным, их результаты оказались противоречащими многочисленным и достаточно хорошим результатам микрохирургического лечения АВМ, представленным в других работах. Учитывая этот факт, а также множество погрешностей в дизайне этих исследований, в настоящее время выбор тактики лечения неразорвавшихся АВМ остается по-прежнему спорным и не имеет стандартизованных критериев показаний к операции.
Сложность в унификацию подходов к лечению вносят гетерогенность самого заболевания, многообразие методов лечения, малое количество наблюдений в отдельно взятых клиниках, а также различия в опыте нейрохирургов.
Для преодоления этих трудностей наиболее рациональной следует признать существующую в настоящее время общемировую тенденцию нейрохирургического сообщества планирования новых мультицентровых проспективных рандомизированных исследований с модернизированным дизайном, которые позволяют получить максимально достоверные основания для формирования клинических рекомендаций.
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Представленная статья, которая, по сути, является обзором литературы, посвящена одной из актуальных проблем сосудистой нейрохирургии — тактике лечения неразорвавшихся артериовенозных мальформаций (АВМ). Основная дискуссия, освещаемая в источниках литературы, относится к выбору метода лечения этих АВМ.
В частности, большое внимание уделяется сравнительной характеристике микрохирургического метода и таких малоинвазивных методик, как эндоваскулярные вмешательства и радиохирургия. Широко обсуждаются также комбинированные методы. Представленная работа содержит тщательный анализ данных литературы, включающей 36 источников. Статья соответствует профилю журнала и представляет несомненный практический интерес, так как обобщает накопленный многими авторами опыт и может способствовать принятию более адекватного и обоснованного решения при выборе того или иного метода лечения. Дизайн исследования соответствует современным стандартам, список литературы можно считать полноценным. Принципиальных замечаний нет, плагиата, а также конфликта интересов не отмечено.