Что такое auc в фармакологии это
Что такое auc в фармакологии это
AUC — аббревиатура от англоязычного Area Under the Curve (площадь под кривой). В медицинской и фармацевтической обычно используется без перевода.
AUC в фармакокинетике
AUC — фармакокинетический параметр, характеризующий суммарную концентрацию лекарственного препарата в плазме крови в течение всего времени наблюдения. Математически определяется как интеграл от 0 до ∞ функции концентрации препарата (фармакокинетической кривой) в плазме крови от времени и равен площади фигуры, ограниченной фармакокинетической кривой и осями координат. Параметр AUC связан с другими фармакокинетическими параметрами — объемом распределения, общим клиренсом. При линейности кинетики препарата в организме величина AUC пропорциональна общему количеству (дозе) препарата, попавшего в системный кровоток.
AUC T — площадь под частью фармакокинетической кривой, от начала исследования (t = 0) до некоторого времени t = T (обычно заданное в часах). Например, AUC24 равен площади под фармакокинетической кривой в течение первых 24-х часов исследования.
AUC в исследовании кислотности органов желудочно-кишечного тракта
AUC [H + ] или просто AUC («интегральная кислотность») — широко используемое в зарубежных работах обозначение показателя, применяемого для оценки кислотоподавляющих свойств лекарственных препаратов и равного площади под заданным участком рН-метрической кривой. В отечественной литературе этот показатель называется «площадь ощелачивания» (Рапопорт С.И. и др.). AUC [H + ] равен S (iн, iк, 0) работы «Математический анализ компьютерных рН-грамм верхних отделов ЖКТ (п. 4 на стр. 2)».
Что такое auc в фармакологии это
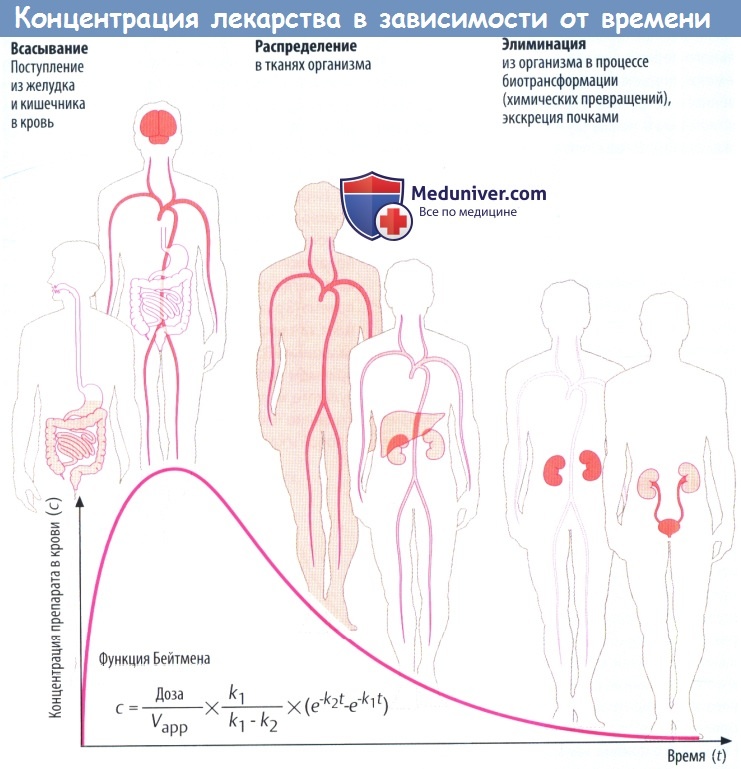
(А) Лекарственные средства попадают в организм и выводятся из него разными путями. Таким образом, организм представляет собой открытую систему, в которой фактическая концентрация препарата отражает взаимодействие между его поступлением (приемом) и эвакуацией (элиминацией).
Скорость всасывания препарата в желудке и кишечнике зависит от множества факторов: скорости растворения вещества (в случае приема твердой лекарственной формы) и транзита по ЖКТ, проницаемости слизистой для препарата, его градиента концентрации на границе слизистой и крови,кровоснабжения слизистой оболочки.
Всасывание из кишечника приводит к повышению концентрации лекарственного вещества в крови. Препарат разносится с кровью к различным органам (распределение), которые поглощают его в количестве, соответствующем его химическим свойствам и скорости кровотока через орган.
Например, органы с хорошим кровоснабжением, такие как головной мозг, получают большее количество препарата, чем органы с низким кровоснабжением. В результате поглощения тканями происходит снижение концентрации лекарственного вещества в крови. По мере снижения градиента на границе слизистой оболочки и крови всасывание в кишечнике замедляется. Пик концентрации в крови достигается тогда, когда количество вещества, покидающего кровь за единицу времени, равно количеству всосавшегося.
Поступление вещества в ткани печени и почек представляет собой перемещение в органы выведения. Концентрация препарата в крови в различные периоды времени представляет собой совокупность процессов абсорбции, распределения и элиминации, которые пересекаются во времени.
Если распределение происходит значительно быстрее, чем элиминация, снижение концентрации в крови вначале происходит быстро, а затем замедляется. Фаза быстрого снижения обозначается как α-фаза (фаза распределения), медленного — как β-фаза (фаза элиминации). Если препарат распределяется быстрее, чем абсорбируется, концентрацию препарата в крови можно описать математически упрощенной функцией Бейтмена (k1 и k2 — константы скорости для абсорбции и элиминации соответственно).
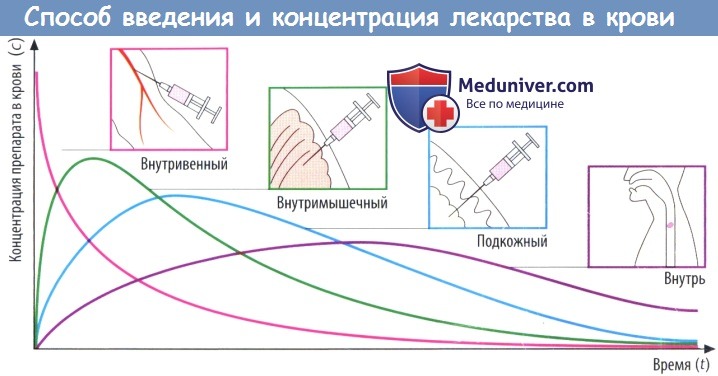
(В) Скорость абсорбции зависит от способа введения препарата. Чем выше скорость абсорбции, тем короче будет время (tmax), которое требуется для достижения пика концентрации в плазме (cmax), тем выше будет cmax и тем раньше уровень препарата в крови снова начнет снижаться.
Площадь под кривой, описывающей зависимость концентрации препарата в крови от времени (AUC), не зависит от пути введения препарата при условии, что доза и биодоступность остаются теми же (закон соответственных состояний). Таким образом, AUC можно использовать для вычисления биодоступности (F) препарата.
Значение AUC, измеренное после приема внутрь и в/в введения определенной дозы конкретного лекарственного вещества, соответствует проценту вещества, попавшего в системный кровоток после приема внутрь: F = AUCприем внутрь/AUCв/в введение.
Определение концентрации препарата в крови позволяет сравнить различные патентованные лекарственные средства, содержащие одно и то же действующее вещество в одинаковой дозе. Идентичные кривые зависимости концентрации в крови от времени для препаратов различных производителей (при условии стандартных лекарственных форм) означают биоэквивалентность стандартного вещества и нового исследуемого препарата.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое auc в фармакологии это
А – количество ЛС в организме, мг или мкмоль.
Аа – количество ЛС, остающегося в месте абсорбции, мг или мкмоль.
Ае – количество неизменённого ЛС, выделенного с мочой, в мг или мкмолях.
Аеl (m) – количество выведенных метаболитов, в мг или мкмоль
Аеτ,ss– кумулятивное количество неизменённого ЛС, выведённого с мочой в течение интервала дозирования при равновесном состоянии, мг или мкмоль.
А(m) – количество метаболита в организме, мг или мкмоль.
Аmin – минимальное количество ЛС в организме, необходимое для получения предопределённого уровня или эффекта, мг или мкмоль.
AN, max – максимальные и минимальные количества ЛС в организме после N-й дозы.
AN,min– фиксированного объёма, данной за фиксированный интервал дозирования в мг или мкмолях.
AN,t– количество ЛС, невыделенное с мочой после N-й дозы, в мг или мкмолях.
ARE – количество ЛС, остающееся невыделенным с мочой после однократной дозы в мг или в мкм.
Ass – количество ЛС в организме в равновесном состоянии во время внутривенной инфузии с постоянно скоростью, мг или мкмоль.
Ass, av– среднее количество ЛС в интервале дозирования при равновесном состоянии, мг или мкмоль.
Ass,max; Ass, min – максимальные и минимальные количества ЛС в организме во время интервала дозирования в равновесном состоянии при введении фиксированной дозы через фиксированный интервал времени, мг или мкмоль.
Ass,t– количество ЛС в организме во время t интервала дозирования при равновесном состоянии и введении фиксированной дозы через фиксированные интервалы, мг или мкмоль.
AUC – площадь под кинетической кривой плазменной концентрации ЛС от нуля до бесконечности, указываемый в локальном контексте специфического интервала времени, например – интервала между дозами, мг*час/л или мкмоль/ч.
AUCb – полная площадь под кинетической кривой концентрации ЛС, мг-час/л или мкмоль/час.
AUC(m) – площадь под кинетической кривой плазменной концентрации метаболита, мг/час/л или мкмоль/час.
АUCss – площадь под кинетической кривой плазменной концентрации ЛС в интервале дозирования при равновесном состоянии, мг/час/л или мкМ/час.
С – концентрация ЛС в плазме крови, мг/л или мкмоль
С(0) – исходная концентрация ЛС, получаемая обычно экстраполяцией к нулю времени, в мг/л или мкмолях.
С1; C2 – коэффициенты с единицами концентраций, мг/л или мкмоль.
Сa – концентрация ЛС в жидкости места абсорбции, мг/л или мкмоль.
CA – концентрация ЛС в артериальной крови, мг/л или мкмоль.
Сb – концентрация ЛС в крови, мг/л или мкмоль.
Сbd – концентрация связанного ЛС в плазме, мг/л или мкмоль.
СD – концентрация ЛС в диализате, мг/л или мкмоль.
Cl – концентрация ингибитора метаболизма, мг/л или мкмоль.
CLbD– полный клиренс ЛС из крови, л/час.
CLbH – гепатический клиренс ЛС из крови, л/час.
СLcr – почечный клиренс креатинина мл/мин. или л/час.
CLD – диализный клиренс, основанный на концентрации ЛС в плазме, л/час.
СLf – клиренс, связанный с образованием метаболита из ЛС, л/час.
СLH – гепатический клиренс ЛС из плазмы, л/час.
Clint – истинный клиренс ЛС в органе его выведения, л/час.
СL(m) – полный клиренс метаболита, л/час.
CL(PD) – клиренс перитонеального диализа по концентрации ЛС в плазме, л/час.
CLR – почечный клиренс ЛС в л/час.
Clu – клиренс несвязанного ЛС, л/час.
С(m)ss – равновесная концентрация метаболита в плазме, мг/л или мкмоль.
Сmax – высшая концентрация ЛС в плазме после внесосудистого введения, в мг/л или в мкмолях/л.
С(m)ss– концентрация метаболита ЛС при равновесии во время в/в инфузии с постоянной скоростью в мг/л или мкмолях.
Cmin – минимальная концентрация ЛС, необходимая для получения требуемой интенсивности эффекта в мг/л или в микромолях.
СN, max – максимальная и минимальная концентрации ЛС в плазме после N доз введения фиксированной дозы при равных интервалах дозирования, в мг/л или мкмолях.
СPC – концентрации ЛС в перитонеальной полости, мг/л или мкмоль.
Сss – плазменные равновесные концентрации при в/в инфузии с постоянной скоростью, мг/л или мкмоль.
Сss, av – средняя плазменная концентрация ЛС в интервале дозирования при равновесном состоянии и введении фиксированных доз через равные интервалы, мг/л или мкмоли.
Сss, max; Css, min – максимальная и минимальная концентрации ЛС в плазме при их равновесии и введении фиксированных доз через равные интервалы дозирования, мг/л или микромоли.
СТ – средняя концентрация ЛС в неплазменных жидкостях, мг/л или мкмоли.
СTW – концентрация ЛС, несвязанного в водной фазе организма, в мг/л или мкл.
C upper/lower – максимальные и минимальные пределы для концентраций ЛС.
Сu – концентрация несвязанного ингибитора или ЛС в плазме.
Сu1 – концентрация несвязанного в плазме ЛС, мг/л или мг/мкмоли.
CV – концентрация ЛС в венозной крови.
DL – нагрузочная доза, мг или ммоль.
DM – поддерживающая доза в фиксированно-дозном режиме.
DMmax – максимальная поддерживающая доза для обеспечения постоянства нахождения концентраций ЛС в нижних и верхних пределах за время интервала дозирования в равновесном состоянии.
E – экстракционное отношение (без символа)ж;
DL – нагрузочная доза, в мг или мкмолях
DM – поддерживающая доза в фиксированно-дозном режиме;
DM, max – максимальная поддерживающая доза для поддержания плазменной концентрации ЛС в равновесии между верхним и нижним пределами в течение интервала дозирования.
Е – экстракционное отношение, в %.
EC50 – концентрация, обеспечивающая половину максимального эффекта.
Eh – гепатическое экстракционное отношение.
Emax – максимальный эффект в единицах исходов.
F – биодоступность ЛС (в долях или %).
Fbd – отношение связанной и полной концентраций в плазме.
Fd – клиренс путём диализа, как отношение к общему клиренсу.
Fe – свободная фракция неизменённого ЛС, систематически выделяемая путём экскреции с мочой.
FEV1 – форсированный объём выдоха за 1 сек., л.
FH – фракция ЛС, поступающая в печень, помимо выведения за 1 цикл через другие органы.
fm – фракция ЛС, систематически доступная для его метаболизма.
Fm – фракция введённой дозы ЛС, поступающая в общую циркуляцию в виде метаболита.
FR – фракция отфильтрованного и выделенного ЛС, ре-абсорбированного почечными канальцами.
Fu – отношение несвязанного и общего ЛС в плазме.
Fur – oтношение несвязанных концентраций ЛС в плазме к их общим концентрациям в крови.
FuT – отношение общей и свободной концентраций ЛС во внутриклеточной жидкости.
FUT – отношение несвязанной и общей концентраций ЛС в тканях
γ – фактор формы в соотношениях концентрация-эффект.
GFR – скорость гломерулярной фильтрации, мл/мин.= л/час
k – константа скорости элиминации ЛС, час –1
КА – константа ассоциации связывания ЛС с белками, л/моль.
КI – равновесная константа ингибирования.
k (m) – константа Михаэлиса-Ментена, мг/л или мкмоль.
Км’ – константа Михаэлиса-Ментена, выраженная в терминах полной плазменной концентрации, мкг/л или мкмоль.
Кр – равновесное отношение ЛС между тканями и кровью или плазмой.
m – наклон центра интенсивности эффекта по отношению к логарифмической кривой изменения концентрации и единицами эффекта.
МРТ – среднее время задержки молекул ЛС в организме в часах.
n – число единиц измерения (условное число).
N – число доз, а не единиц.
P – коэффициент проницаемости, см/мин, или см/час.
Q – поток крови, л/мин.или л/час.
QD – поток диализата в системе гемодиализа, мл/мин.или л/час.
Qf – скорость потока фильтрата из системы гемофильтрации, мл/мин, или л/час.
QH – гепатический кровоток через портальную вену и печёночную артерию, л/мин. или л/час.
ρ – отношение концентраций ЛС в клетках крови к несвязанным концентрациям в плазме.
Rac – отношение аккумуляции (индекс) ЛС.
Rd – отношение несвязанного клиренса у отдельного и типового пациента.
RF – индивидуальная почечная функция у типового пациента.
R0 – скорость постоянной внутривенной инфузии, мг/час.
Rt – скорость потока крови, мг/час.
S – фактор солевой формы.
τ – интервал дозирования, часы.
τ max – максимум интервала дозирования, необходимый для пребывания в пределах между верхней и нижней концентрациями ЛС, часы.
tmax – время достижения максимальной концентрации после введения внесосудистой дозы ЛС, минуты или часы.
Td – длительность действия ЛС в часах.
Tinf – длительность инфузии ЛС с постоянной скоростью, часы.
Tm – максимальная скорость трансорта (секреции) ЛС в почечные канальцы.
T 1 /2 – период полувыведения, часы.
tt – время оборота, часы.
V – кажущийся объём распределения ЛС в организме, вычисленный по концентрации в плазме, в литрах.
VB – объём крови, л.
VD– объём раствора ЛС в диализате, собранного при гемодиализе, л.
Vm – Максимальная скорость метаболизма ферментативно осуществляемой реакции, мг/час или мкмоль/час.
V(m) – кажущийся объём распределения метаболитов ЛС, рассчитанный по их концентрациям в плазме, литры.
Vp – объём плазмы, л.
VPC – объём диализата в перитонеальной полости, л.
VR – содержание воды во внутриклеточной жидкости, л.
VT – физиологический внеплазменный объём, в котором распределено ЛС, л.
Vss – кажущийся равновесный объём распределения ЛС, рассчитанный по концентрации ЛС в плазме, л.
VTW – объём внеплазменной воды, в которой распределено ЛС, л.
Vu – кажущийся объём распределения, основанный на концентрации несвязанного ЛС в плазме, л.
Основные фармакокинетические параметры
Фармакокинетика — раздел клинической фармакологии, изучающий пути введения, биотрансформацию, связь с белками крови, распределение и выведение лекарственных средств (ЛС).
Один из основных показателей, определяющих фармакологический эффект, — концентрация ЛС в области рецептора, однако в условиях целостного организма установить её невозможно. Экспериментально доказано, что в большинстве случаев имеется корреляция между концентрацией препарата в крови и его содержанием в других биологических жидкостях и тканях.
Поэтому для определения фармакокинетических параметров ЛС изучают его содержание в крови. Чтобы получить соответствующие представления о поступлении препарата в кровь и выведении его из организма, определяют содержание ЛС в плазме крови в течение длительного времени, используя методы жидкостной или газожидкостной хроматографии, радиоиммунный и иммуноферментный анализы, спектрофотометрический метод. На основании полученных данных строят график (фармакокинетическую кривую), отмечая на оси абсцисс время исследования, а на оси ординат — концентрацию ЛС в плазме крови.
В связи со сложностью описания деталей процесса распределения ЛС во всех органах и тканях, организм условно представляют в виде одной или нескольких изолированных проницаемой мембраной частей (камер), в которых Л С распределяется. Этот вид моделирования называют камерным. За центральную камеру обычно принимают кровь и хорошо кровоснабжаемые органы (сердце, лёгкие, печень, почки, эндокринные железы), за периферическую — менее интенсивно кровоснабжаемые органы и ткани (мышцы, кожу, жировую ткань). В этих камерах ЛС распределяется с разной скоростью: быстрее — в центральной, медленнее — в периферической. К наиболее простым относят однокамерную модель, когда предполагают, что после введения препарата его концентрация убывает по моноэкспоненциальному закону. В соответствии с законами линейной кинетики скорость изменения количества препарата в камере пропорциональна его количеству в этой камере.
Кажущийся объём распределения (Vd) — гипотетический объём жидкости организма, необходимый для равномерного распределения всего количества ЛС (введённой дозы) в концентрации, аналогичной таковой в плазме крови. Этот показатель измеряют в л/кг. При внутривенном введении объём распределения равен отношению дозы ЛС к его начальной концентрации в крови.
• Высокие значения объёма распределения свидетельствуют о том, что ЛС активно проникает в биологические жидкости и ткани. При этом, если ЛС активно связывается, например, жировой тканью, его концентрация в крови может практически мгновенно стать очень низкой, а объём распределения достигнет нескольких сотен литров, превысив реальный объём жидкостей организма. Поэтому этот показатель и называют кажущимся объёмом распределения.
• Объём распределения зависит от различных факторов.
— Физико-химические свойства ЛС (молекулярная масса, степень ионизации и полярности, растворимость в воде и жирах) влияют на его прохождение через мембраны.
— Физиологические факторы (возраст, пол, общее количество жировой ткани в организме). Например, у пожилых людей и ново рождённых Vd снижен.
— Патологические состояния, особенно заболевания печени, почек, сердечно-сосудистой системы (ССС).
Максимальная концентрация (Сmax) и время наступления максимальной концентрации (Тmax). При поступлении ЛС в системный кровоток (в случае внесосудистого введения) его концентрация постепенно возрастает, достигая значения (Сmax) в момент Тmax, а затем начинает снижаться.
• Если процесс абсорбции имеет линейный характер (скорость процесса прямо пропорциональна количеству ЛС в системе), скорость этого процесса характеризуется константой абсорбции (kabs), измеряемой в часах и рассчитывается через период полувсасывания (Т1/2abs) — время, в течение которого всасывается 1/2 введённой дозы препарата.
Биодоступность (F) — часть дозы Л С (в %), достигшая системного кровотока после вне-сосудистого введения (в этом случае не всё количество препарата достигает системного кровотока).
• Абсолютную биодоступность определяют соотношением значений площади под кинетической кривой (area under curve, AUC) при вне-сосудистом и внутривенном введениях препарата.
— В рамках однокамерной модели при внутривенном введении площадь под кинетической кривой определяется отношением начальной концентрации в крови (Со) к константе элиминации (кеl)
— AUC прямо пропорциональна однократной дозе ЛС, введённой внутривенно (в/в), и обратно пропорциональна общему клиренсу препарата. Она связана с величиной объёма распределения:
где Vd — объём распределения, кеl — константа элиминации, D — доза, AUC — площадь под кинетической кривой.
• Биоэквивалентность (относительная биодоступность) — соотношение количества ЛС, поступившего в системное кровообращение при применении его в различных лекарственных формах или лекарственных препаратах, выпускаемых различными фирмами. Если сравниваемые ЛС аналогичны (действующее вещество, доза, лекарственная t форма), но изготовлены разными производителями, их называют дженериками, и в этом случае необходимо исследование их биоэкви— валентности. Два лекарственных препарата биоэквивалентны, если они обеспечивают одинаковую биодоступность ЛС.
Константа скорости элиминации (кеl) — процент снижения концентрации вещества в крови в единицу времени (отражает долю препарата, выводимую из организма за единицу времени). Элиминация складывается из процессов биотрансформации и экскреции. Константа скорости элиминации характеризует элиминацию в рамках однокамерной модели при линейном характере процесса выведения. Период полувыведения (Т1/2) — время, необходимое для снижения концентрации препарата в крови на 50% в результате элиминации. В рамках линейной модели Т1/2 рассчитывают по формуле:
• Практически за один Т 1 / 2 из организма выводится 50% ЛС, за два периода — 75%, за 3 периода — приблизительно 90% и т.д.
• Зависимость между Т1/2 и кеl важна для подбора режима дозирования и особенно для определения интервала между дозами.
Клиренс (CI) — объём плазмы или крови, полностью освобождающийся от ЛС в единицу времени. Этот показатель количественно характеризует выведение препарата и выражается в мл/мин или л/ч. В рамках линейной модели клиренс рассчитывают по формуле:
• Общий клиренс представляет собой сумму почечного и печёночного клиренсов (так как эти органы служат основными путями выведения ЛС). (Другие пути выведения или внепечёночный метаболизм при расчёте общего клиренса обычно не учитывают.)
— Печёночный клиренс характеризует биотрансформацию ЛС в печени (метаболический клиренс) и выведение с жёлчью (жёлчный клиренс).
— Почечный клиренс отражает выведение препарата с мочой. На пример, почечный клиренс циметидина приблизительно составляет 600 мл/мин, метаболический — 200 мл/мин, жёлчный — 10 мл/мин, поэтому общий клиренс равен 810 мл/мин.
• Основные физиологические факторы, определяющие клиренс, — функциональное состояние основных физиологических систем организма, объём притекающей крови и скорость кровотока в органе. Печёночный клиренс зависит от скорости печёночного кровотока или функциональной способности метаболизирующих ферментов. Например, клиренс лидокаина, интенсивно метаболизируемого печёночными ферментами, зависит прежде всего от скорости его доставки к печени (т.е. от объёма притекающей крови и скорости кровотока), поэтому, например, при застойной сердечной недостаточности он снижен. Клиренс же фенотиазинов зависит в основном от активности метаболизирующих ферментов, поэтому при поражении гепатоцитов клиренс препаратов этой группы резко снижается, вследствие чего концентрация их в крови значительно возрастает.
Равновесная (или стационарная) концентрация (Css) — концентрация, достигнутая при состоянии, когда в каждом интервале между приёмом очередных доз количество всасывающегося ЛС равно количеству элиминируемого [т.е. при стационарном (steady state), или равновесном, состоянии]. Т.е. если ЛС вводят в постоянной дозе через фиксированные интервалы времени, продолжительность которых меньше времени элиминации, его концентрация в крови возрастает, а затем колеблется в пределах средней величины между максимальными и минимальными значениями.
• При достижении С проявляется в полном объёме клинический эффект ЛС. Чем меньше Т1/2 ЛС, тем скорее достигается Си и тем выражение будут её колебания. Например, Т1/2 новокаинамида равен 2— 3 ч, и при назначении через каждые 6 ч его Css характеризуется большим разбросом значений. Поэтому для предупреждения и уменьшения колебаний Css в крови всё большее распространение получают лекарственные формы с замедленным высвобождением активного вещества.
В клинической практике фармакокинетические параметры используют, в частности, для расчёта назначаемых доз препаратов.
• Для расчёта нагрузочной дозы, требуемой для достижения необходимой эффективной концентрации ЛС в крови, используют объём распределения:
где Dнагр — нагрузочная доза, VD — объём распределения, С — концентрация ЛС в плазме крови.
• Для расчёта поддерживающей дозы, т.е. дозы, необходимой для поддержания нужной концентрации ЛС в крови, используют значение клиренса:
где Dnoд — поддерживающая доза, Сl — общий клиренс, Сss — равновесная концентрация.
К основным фармакокинетическим процессам относят всасывание, метаболизм (биотрансформацию), распределение и выведение ЛС.