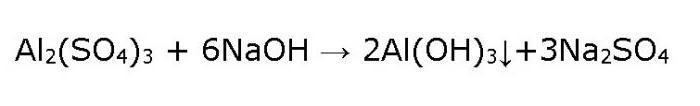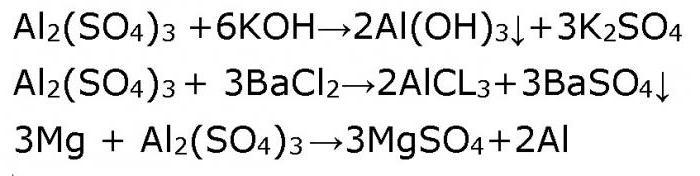Что такое al2 so4
Сульфат алюминия
| Сульфат алюминия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Сульфат алюминия |
| Химическая формула | Al2(SO4)3 |
| Физические свойства | |
| Молярная масса | 342,15 г/моль |
| Плотность | 1,62—2,672 г/см³ |
| Термические свойства | |
| Температура плавления | 770 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| Регистрационный номер EC | 233-135-0 |
Содержание
Описание
Сульфат алюминия — это соль белого цвета с серым, голубым или розовым оттенком, при обычных условиях существует в виде кристаллогидрата Al2(SO4)3·18H2O — бесцветных кристаллов. При нагревании теряет воду не плавясь, при прокаливании распадается на Al2O3 и SO3. Хорошо растворяется в воде. Технический сульфат алюминия можно получить, обрабатывая серной кислотой боксит или глину, а чистый продукт, — растворяя Al(OH)3 в горячей концентрированной H2SO4.
Сульфат алюминия применяется для очистки воды хозяйственно-питьевого и промышленного назначения и для использования в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E-520. [1]
Химические свойства
Сульфат алюминия разлагается при температурах от 770 до 860 °C:
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают при соединении алюминия с серной кислотой:
Сульфат алюминия
Сульфат алюминия растворим в воде и, в основном, используется в качестве флокулянта для очистки питьевой и технической воды станциями очистки сточных вод, а также в производстве бумаги.
Сульфат алюминия иногда упоминается как серная кислота, квасцы алюмоаммиачные или пищевая добавка Е 523. Безводная форма встречается в природе как редкий минерал Миллозевичит, содержащийся в вулканических средах, а также получается при сжигании угольных отходов. Сульфат алюминия образует множество различных гидратов, в числе которых кристаллогидрат Al2(SO4)3*16H2O и октадекагидрат Al2(SO4)3*18H2O.
Сульфат алюминия обладает способностью поглощать и удерживать молекулы воды из окружающей атмосферы.
Получение сульфата алюминия технического возможно путем добавления гидроксида алюминия Al(OH)3 в серную кислоту H2SO 4.
Также возможно получение сульфата алюминия из тетрагидроксоалюмината натрия.
Сульфат алюминия – это белое или почти белое кристаллической формы или в виде порошка соединение без запаха. Он растворим в воде, не летуч и легковоспламеняем. Сульфат алюминия обладает чрезвычайно кислым вкусом.
Применение сульфата алюминия
Раствор сульфата алюминия используется для очистки воды и как краситель в обработке текстиля. В процессе очистки воды раствор сульфата алюминия приводит к коагулированию, нежелательные примеси и загрязненные частицы оседают на дно сосуда и легко отфильтровываются.
При растворении в большом количестве нейтральной или слегка щелочной воды, раствор сульфата алюминия образует студенистый осадок гидроксида алюминия Al(OH)3, который используется при печати и окрашивании тканей, так как является нерастворимым пигментом.
Сульфат алюминия иногда используется для снижения pH почвы сада, что в свою очередь приводит при выращивании некоторых видов цветов (Гортензии) к их повторному цветению.
Сульфат алюминия является активным ингредиентом некоторых антиперспирантов.
В строительстве он используется в качестве гидроизолятора и ускорителя в производстве бетона.
Сульфат алюминия может быть использован в борьбе с моллюсками, насекомыми и слизняками.

В медицине сульфат алюминия входит в состав лекарств, облегчающих боль и дискомфорт, вызванные укусами насекомых. Он помогает разрушить токсичные химические вещества, содержащиеся в укусах, и помогает уменьшить их воздействие на кожу. Эти препараты выпускается в виде спреев, которые наносятся непосредственно на пораженные участки кожи и эффективнее помогают, если будут использованы сразу же после укуса.
Вред сульфата алюминия
Сульфат алюминия вреден при проглатывании или вдыхании. Вдыхание паров сульфата алюминия вызывает кашель и, возможно, одышку.
При контакте с кожей или глазами сульфат алюминия вызывает раздражение, покраснение, зуд и боль. Употребление сульфата алюминия внутрь приводит к сильному раздражению кишечника и желудка, сопровождаемое рвотой, тошнотой и диареей.
Это соединение может вызывать сильные ожоги, если контактирует с открытыми участками кожи.
Первая помощь при отравлении сульфатом алюминия
При попадании сульфата алюминия на кожу или в глаза необходимо промыть пораженный участок водой. В случае вдыхания паров необходимо выйти из токсичной области и медленно отдышаться. Если сульфат алюминия был применен внутрь, необходимо выпить стакан молока, а затем спровоцировать рвоту.
При отравлении сульфатом алюминия ни в коем случае нельзя использовать бикарбонаты, так как такое сочетание в буквальном смысле является взрывным.
Хранение сульфата алюминия
Сульфат алюминия необходимо хранить в прохладном, сухом месте в плотно закрытой таре, не смешивая с другими веществами.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Даже если сердце человека не бьется, то он все равно может жить в течение долгого промежутка времени, что и продемонстрировал нам норвежский рыбак Ян Ревсдал. Его «мотор» остановился на 4 часа после того как рыбак заблудился и заснул в снегу.
Препарат от кашля «Терпинкод» является одним из лидеров продаж, совсем не из-за своих лечебных свойств.
По статистике, по понедельникам риск получения травм спины увеличивается на 25%, а риск сердечного приступа – на 33%. Будьте осторожны.
Упав с осла, вы с большей вероятностью свернете себе шею, чем упав с лошади. Только не пытайтесь опровергнуть это утверждение.
В Великобритании есть закон, согласно которому хирург может отказаться делать пациенту операцию, если он курит или имеет избыточный вес. Человек должен отказаться от вредных привычек, и тогда, возможно, ему не потребуется оперативное вмешательство.
Согласно исследованиям ВОЗ ежедневный получасовой разговор по мобильному телефону увеличивает вероятность развития опухоли мозга на 40%.
Американские ученые провели опыты на мышах и пришли к выводу, что арбузный сок предотвращает развитие атеросклероза сосудов. Одна группа мышей пила обычную воду, а вторая – арбузный сок. В результате сосуды второй группы были свободны от холестериновых бляшек.
Согласно мнению многих ученых, витаминные комплексы практически бесполезны для человека.
Кроме людей, от простатита страдает всего одно живое существо на планете Земля – собаки. Вот уж действительно наши самые верные друзья.
Согласно исследованиям, женщины, выпивающие несколько стаканов пива или вина в неделю, имеют повышенный риск заболеть раком груди.
Существуют очень любопытные медицинские синдромы, например, навязчивое заглатывание предметов. В желудке одной пациентки, страдающей от этой мании, было обнаружено 2500 инородных предметов.
В стремлении вытащить больного, доктора часто перегибают палку. Так, например, некий Чарльз Йенсен в период с 1954 по 1994 гг. пережил более 900 операций по удалению новообразований.
74-летний житель Австралии Джеймс Харрисон становился донором крови около 1000 раз. У него редкая группа крови, антитела которой помогают выжить новорожденным с тяжелой формой анемии. Таким образом, австралиец спас около двух миллионов детей.
Общеизвестный препарат «Виагра» изначально разрабатывался для лечения артериальной гипертонии.
Полиоксидоний относится к иммуномодулирующим препаратам. Он воздействует на определенные звенья иммунитета, благодаря чему способствует повышению устойчивости о.
Сульфат алюминия, характеристика, свойства и получение, химические реакции
Сульфат алюминия, характеристика, свойства и получение, химические реакции.
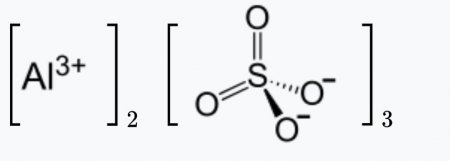
Сульфат алюминия – неорганическое вещество, имеет химическую формулу Al2(SO4)3.
Краткая характеристика сульфата алюминия:
Сульфат алюминия – неорганическое вещество белого цвета.
Химическая формула сульфата алюминия Al2(SO4)3.
Хорошо растворяется в воде, этиленгликоле. Плохо растворим в этаноле.
С водой сульфат алюминия образует кристаллогидраты с различным содержанием воды Al2(SO4)3·nH2O, где n может быть вплоть до 18. Наиболее распространенными являются гексадекагидрат Al2(SO4)3·16H2O и октадекагидрат Al2(SO4)3·18H2O.
Устойчив при обычной температуре.
Сульфат алюминия пожаро- и взрывобезопасен. По степени воздействия на организм продукт относится к веществам 3-го класса опасности в соответствии с ГОСТ 12.1.005.
В земной коре сульфат алюминия находится как в свободном чистом состоянии, в форме кристаллогидратов, а также в составе двойных солей.
Сульфат алюминия в чистом состоянии распространён в природе в виде минерала миллозевичита. В форме кристаллогидратов сульфат алюминия встречается в природе в виде минерала алуногена Al2(SO4)3·17H2O.
Двойные соли сульфат алюминия образует с сульфатами ряда металлов, к которым, к примеру, относится и природный минерал алунит K2SO4·Al2(SO4)3·Al(OH)3.
В пищевой промышленности сульфат алюминия используется в виде добавки Е520.
Физические свойства сульфата алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al2(SO4)3 |
| Синонимы и названия иностранном языке | aluminium sulphate (aluminum sulfate (англ.) |
алюминий сернокислый (рус.)
Получение сульфата алюминия:
В промышленности сульфат алюминия получается взаимодействием гидроксида алюминия с серной кислотой.
В лаборатории сульфат алюминия получают в результате следующих химических реакций:
Химические свойства сульфата алюминия. Химические реакции сульфата алюминия:
1. реакция взаимодействия сульфата алюминия и гидроксида натрия :
В результате реакции образуются гидроксид алюминия и сульфат натрия.
2. реакция взаимодействия сульфата алюминия и гидроксида калия :
В результате реакции образуются гидроксид алюминия и сульфат калия.
3. реакция взаимодействия сульфата алюминия и гидроксида лития :
В результате реакции образуются гидроксид алюминия и сульфат лития.
4. реакция взаимодействия сульфата алюминия и нитрата бария:
5. реакция взаимодействия сульфата алюминия и нитрата свинца:
В результате реакции образуются сульфат свинца и нитрат алюминия.
6. реакция взаимодействия сульфата алюминия и фосфата натрия :
В результате реакции образуются фосфат алюминия и сульфат натрия.
7. реакция взаимодействия сульфата алюминия и фосфата калия :
В результате реакции образуются фосфат алюминия и сульфат калия.
8. реакция взаимодействия сульфата алюминия и гидрокарбоната натрия:
Al2(SO4)3 + 6NaHCO3 → 3Na2SO4 + 2Al(OH)3 + 6CO2.
В результате реакции образуются сульфат натрия, гидроксид алюминия и оксид углерода (IV).
9. реакция взаимодействия сульфата алюминия и гидрокарбоната кальция:
В результате реакции образуются сульфат кальция, гидроксид алюминия и оксид углерода (IV). Данная реакция используется для очистки воды. Гидроксид алюминия выпадает в осадок и его хлопья увлекают за собой различные примеси.
10. реакция взаимодействия сульфата алюминия и карбоната натрия и воды:
11. реакция термического разложения сульфата алюминия:
12. реакция термического разложения октадекагидрата сульфата алюминия:
Октодекагидрат сульфата алюминия разлагается на сульфат алюминия и воду.
Применение и использование сульфата алюминия:
Сульфат алюминия используется во множестве отраслей промышленности и для бытовых нужд:
– как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения;
– в фотографии входит в составы стабилизирующих растворов и дубящих фиксажей;
– как пищевая добавка Е520;
– в качестве морилки при крашении и печати текстильных изделий;
– в бумажной, текстильной, кожевенной и других отраслях промышленности.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
сульфат алюминия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфата алюминия
реакции
Алюминий сульфат и другие соединения алюминия в природе и жизни человека
В повседневной жизни каждый из нас ежеминутно сталкивается с умопомрачительным количеством химических веществ, как природных, так и созданных самим человеком. Остановимся на двух химических соединениях: сульфат алюминия, гидроксид алюминия. Что это такое и почему стоит обратить на них внимание?
Чтобы познакомиться, нужно заземлиться
Алюминий сульфат (глинозём) наряду с алюмосиликатами и различными видами глины составляет основную массу земной коры. Это позволяет алюминию занимать первое место среди металлов по распространенности на Земле. В природе сульфат алюминия, формула которого Al2(SO4)*18H2O, является кристаллогидратом и представляет собой растворимые в воде кристаллы белого цвета с серым, голубым или розовым оттенком.
В отличие от алюминия сульфата, гидроксид его представляет собой белое твердое вещество, нерастворимое в воде. Алюминий сульфат, гидроксид алюминия, каолинит широко распространены. Их добывают в Сибири, Крыму, Китае, Японии, а также в странах Центральной и Южной Америки.
Зри в пробирку
Чтобы познать истину, определим, какими же химическими свойствами обладают сульфат и гидроксид Al. Перефразируем крылатое выражение Козьмы Пруткова «Зри в корень!» на более прагматичное: «Зри в пробирку!»
Рассматривая взаимодействие гидроксида алюминия Al(OH)3 со щелочами, будем внимательны и учтем условия, при которых происходит реакция. Именно от них будут зависеть конечные продукты:
Сам же гидроксид Al(OH)3 получают в лаборатории непрямым путем, то есть не из оксида и воды, что в этом случае невозможно, а из соли алюминия. Для этого берут раствор сульфата алюминия и действуют на него щелочью, например едким натром, осторожно вливая его по каплям.
Суммируя все выше приведенные реакции, доказывающие амфотерность гидроксида алюминия, сделаем вывод: в кислой среде химическое равновесие смещается в сторону образования солей Al, а в щелочной – в сторону образования метаалюминатов или гидроксоалюминатов.
Поддерживающий традиции
Отдохнем от сложностей «двуликости» амфотерного гидроксида алюминия и обратимся к традиционной средней соли – сульфату алюминия. Никаких отступлений от правил. Растворы средних солей реагируют со щелочами, с кислотами, с другими солями, с металлами, стоящими в ряду Бекетова (ряд напряжений металлов) до метала, ион которого содержится в молекуле соли. Например, алюминий сульфат в растворе будет реагировать с литием, калием, кальцием, натрием и магнием. Подтвердим это уравнениями реакций.
Сульфат алюминия, формула которого Al2(SO4)3, является продуктом взаимодействия слабого основания гидроксида алюминия Al(OH)3 и сильной сульфатной кислоты H2SO4. Поэтому в водном растворе он легко гидролизирует. Избыток ионов водорода H + обнаруживается с помощью индикатора лакмуса, меняющего свой синий цвет в растворе сульфата алюминия на красный. Таким образом, мы устанавливаем, что раствор сульфата алюминия имеет кислую реакцию.
Можно было бы продолжить углубляться в приятные и волнующие для химика-эстета подробности данной темы, если бы вдали не замаячило подозрительно-скептическое лицо с вопросом: «Ну и что я с этого буду иметь?»
Они придут на помощь
Чтобы развеять все сомнения, скажем, что вы уже имеете массу полезных и даже жизненно необходимых вещей, благодаря таким соединениям, как алюминий сульфат, гидроксид алюминия и другим алюминийсодержащим реагентам. В первую очередь Al(OH)3 используют для очистки жесткой воды. После данного процесса вода становится прозрачнее и светлее и освобождается от солей, делающих ее жесткой.
В стремлении быть всегда красивыми и ухоженными нам помогают лосьоны, гели, тоники. А ведь они тоже содержат алюминий сульфат. Широко рекламируемая инновация в индустрии дезодорантов-антиперспирантов под названием «кристаллы свежести» – не что иное, как алюмокалиевые квасцы, компонентом которых является алюминий сульфат. Соединения алюминия имеют обволакивающую способность и поэтому используются также в производстве разноцветных хлопчатобумажных тканей и в фармакологии.
Сульфат алюминия
| Сульфат алюминия | |
|---|---|
 | |
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность | |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| ГОСТ | ГОСТ 3758-75 |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES | |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Токсичность | малотоксично |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Содержание
Физические свойства
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
2 Al + 3 H2SO4 ⟶ Al2(SO4)3 + 3 H2
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.