Что такое al2 so4 3 в химии
Молярная масса сульфата алюминия
Молярная масса сульфата алюминия
Хорошо растворим в воде (гидролизуется по катиону). Полностью разлагается щелочами в растворе и при спекании.
Рис. 1. Сульфат алюминия. Внешний вид и строение молекулы.
Брутто-формула сульфата алюминия – Al2(SO4)3. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(Al2(SO4)3) = 2×27 + 3×32 + 12×16 = 54 + 96 + 192 =342.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
Это означает, что молярная масса сульфата алюминия 342 г/моль.
Примеры решения задач
| Задание | Составьте формулу соединения магния, серы и кислорода, если соотношение масс элементов в нём m(Mg):m(S):m(O) = 3:4:8. |
| Решение | Для того, чтобы узнать, в каких отношениях находятся химические элементы в составе молекулы необходимо найти их количество вещества. Известно, что для нахождения количества вещества следует использовать формулу: |
Найдем молярные массы магния, серы и кислорода (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева округлим до целых чисел). Известно, что M = Mr, значит (Mg) = 24 г/моль, M(S) = 32 г/моль, а М(O) = 16 г/моль.
Тогда, количество вещества этих элементов равно:
n (Mg) = 3 / 24 = 0,125 моль.
n (S) = 4 / 32 = 0,125 моль.
n (О) = 8 / 16 = 0,5 моль.
Найдем мольное отношение:
n(Mg) :n(S): n(О) = 0,125:0,125:0,5 = 1:1:4.
т.е. формула соединения магния, серы и кислорода имеет вид MgSO4. Это сульфат магния.
| Задание | Вычислите, какая масса оксида серебра (I) разложилась, если в ходе реакции образовалось металлическое серебро и выделился кислород объемом 5,6 л кислорода (н.у.)? |
| Решение | Запишем уравнение реакции разложения оксида серебра (I): |
Вычислим количество вещества кислорода по формуле:
n (O2) = 5,6 / 22,4 = 0,25 моль.
Согласно уравнению реакции n(O2) :n(Ag2O) = 1 : 2, значит:
n(Ag2O) = 2 × n(O2) = 2 × 0,25 = 0,5 моль.
Найдем молярную массу оксида серебра (I)(значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(Ag2O) = 2×Ar(Ag) + Ar(O) = 2×108 + 16 = 216 + 16 = 232 г/моль.
Соли алюминия: получение и свойства
Соли алюминия
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксоалюминатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Na[Al(OH)4] разбиваем на NaOH и Al(OH)3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO2:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Комплекс разрушается при взаимодействии с хлорной водой (водным раствором хлора) Cl2:
2Na[Al(OH)4] + Cl2 → 2Al(OH)3↓ + NaCl + NaClO
При этом хлор диспропорционирует.
Также комплекс может прореагировать с избытком хлорида алюминия. При этом выпадает осадок гидроксида алюминия:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Гидролиз солей алюминия
Растворимые соли алюминия и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Al 3+ + H2O = AlOH 2+ + H +
II ступень: AlOH 2+ + H2O = Al(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты алюминия и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Алюминаты
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы разделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO2 разбиваем на Na2O и Al2O3
Тогда нам станет очевидно, что алюминаты реагируют с кислотами с образованием солей алюминия :
KAlO2 + 4HCl → KCl + AlCl3 + 2H2O
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
Под действием избытка воды алюминаты переходят в комплексные соли:
Сульфат алюминия
| Сульфат алюминия | |
|---|---|
 | |
| Традиционные названия | сернокислый алюминий |
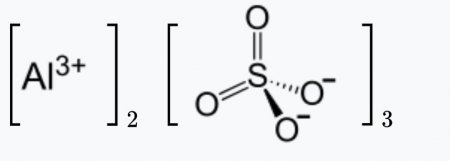
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность | |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| ГОСТ | ГОСТ 3758-75 |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES | |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Токсичность | малотоксично |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Содержание
Физические свойства
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
2 Al + 3 H2SO4 ⟶ Al2(SO4)3 + 3 H2
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.
Степень окисления в Al2(SO4)3
Общие сведения о сульфате алюминия и степени окисления в Al2(SO4)3
Брутто-формула – Al2(SO4)3. Молярная масса сульфата алюминия равна 342,15 г/моль.
Рис. 1. Сульфат алюминия. Внешний вид.
Хорошо растворяется в воде (гидролизуется по катиону). В кипящей воде разлагается. Не реагирует с кислотами. Полностью разлагается щелочами в растворе и при спекании, реагирует с гидратом аммиака. Вступает в реакции обмена.
Al2(SO4)3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав сульфата алюминия, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления алюминия постоянна и равна номеру группы Периодической системы Д.И. Менделеева, в которой он расположен, со знаком плюс (алюминий – металл), т.е. (+3). Степень окисления кислорода в составе кислот, а, значит и в их остатках равна (-2). Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности:
Степень окисления серы в сульфате алюминия равна (+6):











