Что такое абсцесс почки
Что такое абсцесс почки
И.М. Каганцов, В.В. Сизонов, В.И. Дубров, В.Г. Сварич, А.Х.-А. Шидаев, В. М. Орлов, А.А. Москаль
1) ФГБУ «Национальный медицинский исследовательский центр им. В. А. Алмазова» МЗ РФ; 2) ФГБОУ ВО «Сыктывкарский ГУ им. Питирима Сорокина», Сыктывкар, Россия; 3) ФГБОУ ВО РостГМУ Минздрава России, Ростов-на-Дону, Россия; 4) ГБУ РО «Областная детская клиническая больница», Ростов-на-Дону, Россия; 5) 2-я детская больница, Минск, Республика Беларусь; 6) ГУ «Республиканская детская клиническая больница», Сыктывкар, Россия
Литература
1. Bitsori M., Raissaki M., Maraki S., Galanakis E. Acute focal bacterial nephritis, pyonephrosis and renal abscess inchildren. PediatrNephrol. 2015;30(11):1987–1993.
2. Wan-Ling Chen, I-Fei Huang, Jiun-Ling Wang et al. Comparison of Acute Lobar Nephronia and Acute Pyelonephritis in Children: A Single-Center Clinical Analysis in Southern Taiwan. Pediatrics and Neonatology. 2015;56:176–182.
3. Rote A.R., Bauer S.B., Retik A.B. Renal abscess in children. J Urol. 1978;119:254–258.
4. Wang Y.T., Lin K.Y., Chen M.J., Chiou Y.Y. Renal abscess in children: a clinical retrospective study. ActaPaediatr Taiwan. 2003;44:197–201.
5. Angel C., Shu T., Green J., Orihuela E., Rodriquez G., Hendrick E. Renal and peri-renal abscesses in children: proposed physio-pathologic mechanisms and treatment algorithm. PediatrSurg Int. 2003;19:35–39.
6. Cheng C.H., Tsai M.H., Su L.H., Wang C.R., Lo W.C., Tsau Y.K., et al. Renal abscess in children: a 10-year clinical and radiologic experience in a tertiary medical center. Pediatr Infect Dis J. 2008;27:1025–1927.
7. Chun-Yu Chen, Huang-Tsung Kuo, Yu-Jun Chang et al. Clinical assessment of children with renal abscesses presenting to the pediatric emergency department. BMCPediatr. 2016;16:189.
8. Comploj E., Cassar W., Farina A. et al. Conservative management of paediatric renal abscess. J Pediatr Urol. 2013;9(6):1214–1217.
9. Linder B.J., Granberg C.F. Pediatric renal abscesses: A contemporary series. J Pediatr Urol. 2016;12(2):99.e1-5.
10. Seguias L., Srinivasan K., Mehta A. Pediatric renal abscess: a 10-year single-center retrospective analysis. HospPediatr. 2012;2(3):161–166.
11. Врублевский С.Г., Мазаев А.П., Горбунов А.В. и др. Абсцессы почек у детей. Детская хирургия. 2016;20(4):178–180. Russian (Vrublevsky S.G., Mazaev A.P., Gorbunov A.V. and others. Kidneyabscessesinchildren. Children’s surgery. 2016;20(4):178–180).
12. Hung C.H., Liou J.D., Yan M.Y., Chang C.C. Immediate percutaneous drainage compared with surgical drainage of renal abscess. Int. Urol. Nephrol. 2007;39(1):51–55.
13. Zhang X., Xie Y., Huang G., Fu H. Analysis of 17 children with renal abscess. Int J Clin Exp Pathol. 2019;12(9):3179–3184.
14. Yudin Ya. B., Prokopenko Yu. D., Valtfogel I. V. Acute purulent kidney diseases in children. Kemerovo: Kemerovo Publishing House, 1991. 100 p. Russian (Юдин Я.Б., Прокопенко Ю.Д., Вальтфогель И.В. Острые гнойные заболевания почек у детей. Кемерово: Кемеровское кн. изд-во, 1991. 100 с).
Антибактериальная терапия острой гнойной инфекции почек
В.В. Рафальский
Термин «острая гнойная инфекция почек» является собирательным понятием, объединяющим ряд нозологических форм, часть из которых входит в понятие инфекции верхних отделов мочевыводящих путей (острый пиелонефрит), часть относится к гнойно-деструктивным заболеваниям почек (абсцесс, карбункул почки). Объединяющим признаком этой группы инфекций является необходимость госпитализации пациента, проведения в кратчайшие сроки активной антибактериальной терапии, нередко хирургического вмешательства, а также высокий риск развития бактериемии и уросепсиса.
В России инфекция почек занимает первое место среди урологических заболеваний, причем распространенность инфекционно-воспалительных заболеваний почек остается стабильной и довольно высокой (в 2000 г. соответствующий показатель составляет 1245,3 на 100 тыс. населения). По данным НИИ урологии, полученным при ежегодном анкетировании главных специалистов-урологов регионов и областей, в 1997–1999 гг. среди урологических заболеваний пиелонефриты занимают второе место в структуре нозологий – 11,1% [1]. При сравнении показателей первичной инвалидности по основным группам урологических заболеваний хронический пиелонефрит занимает второе место (21,4–23%), уступая только злокачественным образованиям [2].
С позиции рационального выбора антибактериальной терапии важно выделять внутрибольничные (нозокомиальные) и внебольничные (амбулаторные) формы инфекций почек и мочевых путей (ИПМП). Внебольничные ИПМП возникают у пациентов вне стационара, но при этом они могут приводить к госпитализации с последующим лечением в стационарных условиях. Под нозокомиальными ИПМП подразумевают клинически и лабораторно подтвержденную инфекцию, не существовавшую и не находившуюся в инкубационном периоде при поступлении больного в стационар и развившуюся не ранее чем через 48 ч от момента госпитализации. Как известно, одной из особенностей нозокомиальных инфекций является более вариабельный спектр возбудителей, чем для инфекций, возникших в амбулаторных условиях, увеличение в структуре возбудителей синегнойной палочки, ацинетобактерий, серраций, энтерококков, золотистого стафилококка. Другой особенностью нозокомиальных инфекций, в том числе и инфекций ИПМП, является более высокая частота выделения устойчивых штаммов.
В рамках одной статьи невозможно обсудить универсальные рекомендации по эмпирическому выбору антимикробной терапии при нозокомиальных ИПМП, так как особенности микробного спектра резистентности основных возбудителей могут существенно отличаться даже в разных отделениях крупного стационара. Напротив, этиология и особенности устойчивости уропатогенов к антибиотикам при внебольничных ИПМП более предсказуемы. Поэтому в настоящей статье прежде всего будут обсуждаться особенности антибиотикотерапии внебольничных инфекций.
Важным моментом, который необходимо учитывать при выборе антибиотика, подборе дозы и длительности введения препарата, является наличие или отсутствие осложняющих факторов.
Исторически сложилось, что термин «осложненные ИПМП» использовали в научной литературе для описания популяции пациентов, у которых антибиотикотерапия короткими курсами была неэффективна. Позже было замечено, что неэффективность применения антибиотиков связана с наличием у пациентов врожденных или приобретенных аномалий мочевыводящих путей, конкрементов и других инородных тел (катетеры, стенты). В настоящее время термин «осложненные ИПМП» объединяет достаточно широкий круг ИПМП, развивающихся на фоне анатомических аномалий мочевыводящих путей, метаболических или гормональных нарушений, иммунодефицита или при инфицировании нетипичными, устойчивыми микроорганизмами, в том числе и нозокомиальными штаммами.
Своевременное выявление осложняющих факторов и соответствующая коррекция терапии значительно повышают эффективность применения антибиотиков при осложненных ИПМП. Выявление и способы коррекции факторов, осложняющих ИПМП, находятся в компетенции многих специалистов: урологов, эндокринологов, терапевтов, онкологов, гинекологов, химиотерапевтов. Нередко эффективная терапия пациентов с осложненными ИПМП возможна только при их взаимодействии.
Применительно к острым гнойным заболеваниям почек к неосложненным инфекциям можно отнести только острый пиелонефрит у женщин без наличия каких-либо предшествующих фоновых заболеваний или состояний. Все другие варианты пиелонефрита, включая пиелонефрит у мужчин, пиелонефрит на фоне аномалий развития, иммунодефицита, мочекаменной болезни, сахарного диабета и т. д., относят к осложненным ИПМП.
К осложненной острой гнойной инфекции почек относят также нозокомиальный пиелонефрит, гнойно-деструктивные заболевания почек (карбункул, абсцесс почки, апостематозный пиелонефрит, некроз почечных сосочков, эмфизематозный пиелонефрит, нагноившаяся киста почки, пионефроз, инфицированный гидронефроз).
Этиология и патогенез
Большинство бактериальных инфекций, прежде всего острый пиелонефрит, затрагивающих паренхиму почек, развивается вследствие инфицирования восходящим путем, когда инфекция проникает из нижних отделов мочевыводящих путей.
Из литературы известно, что 70–80% всех случаев пиелонефрита обусловлены Escherichia coli [3], другие бактерии выделяются реже. Данные исследования UTIAP-3, проводившегося НИИ антимикробной химиотерапии в 2004–2005 гг. в 9 городах Российской Федерации, подтверждают этот факт. E. coli выделялась у 74,1% пациентов с неосложненным и у 65,1% пациентов с осложненным пиелонефритом (рис. 1).
Рис. 1. Этиология острых пиелонефритов в России, 2004–2005 гг. (n=162)
Вторым по частоте выявления возбудителем являлась Klebsiella pneumoniae, выделявшаяся у 11,1% пациентов с неосложненными и у 10,7% с осложненными пиелонефритами.
Гнойно-деструктивные заболевания почек также часто вызываются грамотрицательными палочками рода Enterobacteriacea (E. coli, K. pneumoniae и др.), неферментирующими грамотрицательными бактериями (P. aureginosa) и S. aureus (рис. 2; рис. 3). Реже встречается гематогенный путь распространения инфекции, более характерный для карбункула почки (субкапсулярный абсцесс) и апостематозного пиелонефрита. Как правило, гематогенный путь распространения инфекции характерен для пациентов с иммунодефицитом или нейтропенией (см. рис. 2). При гематогенном распространении инфекции основными возбудителями являются S. aureus, кандиды, микобактерия туберкулеза.
Рис. 2. Возбудители гнойно-деструктивных заболеваний почек
Рис. 3. Этиология гнойно-деструктивных поражений почек. Смоленск, 2001–2003 гг. (n=52) [4]
В настоящее время выбор эффективной антимикробной терапии ИПМП, в том числе и острых гнойных заболеваний почек, должен проводиться с учетом резистентности основных возбудителей.
При выборе антибактериальной терапии пиелонефрита необходимо ориентироваться в первую очередь на данные по резистентности E. coli. Результаты описанного выше исследования UTIAP-3 свидетельствуют о высокой резистентности уропатогенных штаммов E. coli к ко-тримоксазолу – 19–25% и ампициллину – 36–40% (рис. 4). Определяется достаточно высокая резистентность к фторированным хинолонам II–III поколения, ципрофлоксацину (10–18,6%) и левофлоксацину (10–16%). Хорошей активностью обладают ингибиторозащищенные аминопенициллины (амоксициллин/клавуланат), цефалоспорины II–IV поколения (цефуроксим, цефотаксим, цефепим). Активность аминогликозидов изменяется в зависимости от характера инфекции, гентамицин и амикацин обладают хорошей активностью в случае неосложненного пиелонефрита, однако у пациентов с осложненным пиелонефритом в 10% выделяются штаммы кишечной палочки, устойчивые к гентамицину, при этом амикацин сохраняет свою активность.
Не выявлено ни одного устойчивого штамма к ингибиторозащищенным цефалоспоринам (цефоперазон/сульбактам), карбапенемам (имипенем).
Рис. 4. Резистентность E. coli, выделенной у пациентов с пиелонефритами. Россия, 2004–2005 гг. (n=122) [4]
К сожалению, до настоящего времени в Российской Федерации не проводилось масштабных многоцентровых исследований, посвященных изучению антибиотикорезистентности возбудителей гнойно-деструктивных заболеваний почек. Обобщение единичных небольших исследований позволяет заключить, что профиль резистентности возбудителей гнойно-деструктивных заболеваний почек, относящихся к семейству Enterobacteriaceae, не отличается от такового у пациентов с пиелонефритом. Данные по чувствительности S. aureus свидетельствуют о высокой активности оксациллина, амоксициллина/клавуланата, ко-тримоксазола, клиндамицина, рифампицина, ванкомицина, линезолида [4].
Лечение
Терапия проводится в условиях специализированного стационара. Как правило, параллельно с проведением адекватной антибактериальной терапии решается вопрос о необходимости и объеме оперативного вмешательства. Вопрос о хирургической тактике в отношении пациентов с острыми гнойными заболеваниями почек выходит за рамки настоящей статьи, однако необходимо отметить, что в последние годы в связи с использованием современных антибиотиков отмечается тенденция к уменьшению частоты и объема оперативного вмешательства. Это обусловлено появлением данных об особенностях патогенеза этой инфекции, изменении спектра возбудителей и их чувствительности к антибиотикам, появлением новых классов антибактериальных препаратов [5].
Выбор антибиотика производится эмпирически, до начала применения антибактериальных препаратов желательно провести забор материала для бактериологического исследования. Необходимо учитывать, что частота выделения бактерий из мочи у пациентов с гнойно-деструктивными заболеваниями составляет около 30% и может снижаться при нарушении пассажа мочи из пораженной почки. Также имеет место невысокая частота выделения возбудителя из крови (рис. 5). Наиболее информативным материалом для микробиологического исследования является материал, полученный интраоперационно.
Рис. 5. Частота выделения возбудителей острых гнойных инфекций почек из разного материала, % (n=52) [7]
Краткая характеристика антибактериальных препаратов
Как было показано, аминопенициллины и ко-тримоксазол в силу высокой устойчивости уропатогенов не могут рекомендоваться для терапии гнойно-деструктивных заболеваний почек и даже неосложненного пиелонефрита. Нитрофурантоин, фосфомицин, нефторированные хинолоны не должны применяться прежде всего в силу их фармакокинетических особенностей.
Антимикробный спектр ингибиторозащищенных аминопенициллинов (амоксициллин/клавуланат) расширен за счет таких грамотрицательных бактерий, как Klebsiella spp., P. vulgaris. Ингибиторозащищенные аминопенициллины активны в отношении микрофлоры с приобретенной резистентностью, обусловленной продукцией b-лактамаз: стафилококков, грамотрицательных бактерий – E. coli, P. mirabilis. Препарат может накапливаться в высоких концентрациях не только в моче, но и в стенке мочевого пузыря, паренхиме почек, сыворотке крови.
Цефалоспорины II–IV поколения активны in vitro в отношении основных возбудителей как неосложненных, так и осложенных пиелонефритов, а также грамотрицательных возбудителей гнойно-деструктивных заболеваний почек. Принимая во внимание их относительно невысокую стоимость, хороший профиль безопасности, низкую токсичность, парентеральные цефалоспорины III поколения (цефотаксим, цефтриаксон) могут рассмариваться как базовые препараты для терапии острых гнойных заболеваний почек. Однако при подозрении на госпитальную инфекцию, предпочтение необходимо отдавать ингибиторозащищенным цефалоспоринам (цефоперазон/сульбактам) или цефалоспоринам IV поколения (цефепим). Цефалоспорины II– IV поколения обладают низкой активностью в отношении S. aureus, поэтому при подозрении на инфекцию, вызванную этим микроорганизмом (субкапсулярный абсцесс, карбункул почки), необходимо использовать либо ингибиторозащищенные цефалоспорины, либо другие антибиотики, активные в отношении стафилококков.
Карбапенемы (имипенем, меропенем, эртапенем) по сравнению с цефалоспоринами более устойчивы к гидролизующему действию бактериальных b-лактамаз, в том числе b-лактамаз расширенного спектра, и обладают более широким спектром активности. Применение карбапенемов оправдано прежде всего при подозрении на госпитальную ИПМП, гнойно-деструктивные заболевания. При пиелонефрите карбапенемы рассматриваются как препараты резерва, но при угрожающих жизни инфекциях могут быть рассмотрены в качестве первоочередной эмпирической терапии. Преимуществом карбапенемов является активность, перекрывающая практически весь спектр вероятных возбудителей, как пиелонефритов, так и гнойно-деструктивных заболеваний почек. Исключением может служить недостаточно высокая активность эртапенема в отношении неферментирующих грамотрицательных бактерий и энтерококков, что ограничивает использование этого препарата при госпитальных инфекциях.
Фторхинолоны обладают широким антимикробным спектром и высокой активностью в отношении основных возбудителей ИПМП, в первую очередь грамотрицательных палочек. Фторхинолоны характеризуются высокой биодоступностью при приеме внутрь и оптимальной фармакокинетикой, которая обеспечивает высокие бактерицидные концентрации препаратов в моче и необходимые терапевтические концентрации препаратов в паренхиме почек, слизистой оболочке мочевыводящих путей. Фторхинолоны обладают высоким профилем безопасности у взрослых, хорошо переносятся больными, не обладают нефротоксичностью. Однако данные по резистентности уропатогенов к фторхинолонам (см. рис. 4) свидетельствуют о том, что эта группа препаратов может эффективно использоваться только при неосложненном пиелонефрите. При осложненном пиелонефрите уровень резистентности достигает 16% даже для фторхинолонов III поколения (левофлоксацин). Существуют достаточно убедительные основания, чтобы предположить, что подобный профиль резистентности к фторхинолонам имеет место и при гнойно-деструктивных заболеваниях почек.
Как было показано, аминогликозиды, особенно амикацин, обладают высокой активностью в отношении основных возбудителей ИПМП, создают высокие концентрации в моче. В то же время они обладают некоторыми особенностями, ограничивающими их применение у пациентов с ИПМП. Известно, что одной из характерных нежелательных реакций для аминогликозидов является нефротоксичность. Поэтому аминогликозиды оправдано использовать только у госпитализированных пациентов, при этом необходимо учитывать такие факторы риска, как наличие нарушений функции почек, возраст, дозы и длительность лечения аминогликозидами, одновременное применение других нефротоксичных препаратов (амфотерицин В, полимиксин В, ванкомицин, петлевые диуретики, циклоспорин).
Пиелонефрит
Пациенты с тяжелым и среднетяжелым пиелонефритом, как правило, получают лечение в условиях стационара. При неосложненном пиелонефрите, развившемся в амбулаторных условиях, препаратами выбора являются фторхинолоны (ципрофлоксацин, левофлоксацин), второй линии – ингибиторозащищенные пенициллины (амоксициллин/клавуланат), цефалоспорины II–III поколения (цефуроксим, цефотаксим), аминогликозиды в комбинации с b-лактамами. Оптимально проводить ступенчатую терапию – начинать лечение с внутривенного введения антибиотика до нормализации температуры тела с последующим переходом на прием внутрь того же препарата. Длительность терапии –10–14 дней.
При осложненном пиелонефрите препаратами выбора являются ингибиторозащищенные пенициллины (амоксициллин/клавуланат), цефалоспорины II–IV поколения (цефуроксим, цефотаксим, цефепим), ингибиторозащищенные цефалоспорины (цефоперазон/сульбактам), альтернативными препаратами – карбапенемы, комбинация аминогликозидов и b-лактамов. Курс лечения – не менее 14 дней.
При пиелонефрите у беременных препаратами выбора являются ингибиторозащищенные пенициллины (амоксициллин/клавуланат, ампициллин/сульбактам) или цефалоспорины II–IV поколения (цефуроксим, цефотаксим, цефепим), которые назначают внутривенно с переходом на прием внутрь. Общая длительность антибактериальной терапии – не менее 14 дней.
Гнойно-деструктивные заболевания почек
Терапия проводится в условиях специализированного урологического или хирургического стационара. В качестве препаратов выбора используют антибиотики, обладающие активностью против наиболее распространенных возбудителей (см. рис. 3) – ингибиторозащищенные аминопенициллины и цефалоспорины (амоксициллин/клавуланат, цефаперазон/сульбактам), цефалоспорины IV поколения (цефепим), карбапенемы (имипенем, меропенем). Курс лечение – не менее 21–28 дней. При подозрении на инфекцию, вызванную метициллинорезистентными стафилококками, препаратами выбора являются ванкомицин и линезолид.
Определение стадии острого пиелонефрита для выбора лечебной тактики
В структуре заболеваний почек острый пиелонефрит (ОП) составляет около 14%. Гнойные формы развиваются у одной трети больных, нередко приводя к гибели почки (Пытель Ю.А., Золотарев И.И., 1985). При генерализации инфекции и развитии уросепсиса летальность достигает 80% ( Аляев Ю.Г. и соавт., 2008).
Таким образом, если раньше после 48-ми часов течения острого пиелонефрита предпринимались, как правило, открытые оперативные вмешательства, а на операционном столе выяснялось, что имела место лишь инфильтративная или даже серозная форма воспаления, то в настоящее время в арсенале уролога появились методы, диагностические возможности которых позволяют подходить избирательно к лечению разных стадий воспалительного процесса (Аляев Ю.Г. и соавт., 2008).
Уточнению роли различных высокоинформативных, современных инструментальных методов исследования (УЗИ с допплерографией, КТ с контрастированием, МРТ) в диагностике стадий ОП и изучению эффективности проводимого лечения в зависимости от клинической формы и стадии заболевания, посвящена данная работа.
Научная новизна
Практическая значимость
Установлено, что при выявлении серозной стадии ОП при помощи ультразвукового исследования в сочетании с допплерографией, проведение МСКТ или МРТ для уточнения диагноза необязательно. Выявлено, что УЗИ и УЗДГ не обладают достаточной информативностью для проведения дифференциальной диагностики между инфильтративной и гнойно-деструктивной стадиями острого пиелонефрита, в связи с чем больным с подозрением на формирование абсцесса почки настоятельно показаны МСКТ с контрастированием или МРТ. Доказано, что своевременное и адекватное дренирование мочевыводящих путей и правильно подобранная комплексная консервативная патогенетическая терапия в серозную и инфильтративную стадии ОП являются эффективным методом лечения.
Установлено, что при развитии острого пиелонефрита, осложненного абсцессом почки наиболее целесообразно применение чрескожной пункции и дренирования гнойника под ультразвуковым контролем и проведением комплексной консервативной патогенетической терапии. Данная тактика в современных условиях должна быть методом выбора. К открытому оперативному лечению необходимо прибегать при диффузных поражениях почки с формированием нескольких абсцессов, труднодостижимых для пункции с целью эвакуации гнойного содержимого или неэффективности пункционного дренирования.
Содержание работы
Большое значение в нашей работе уделено характеру острого пиелонефрита в плане его возникновения на фоне нарушенного или ненарушенного пассажа мочи по верхним мочевыводящим путям, так как этот фактор существенно влияет на алгоритм обследования и лечения. С учетом целей и задач нашего исследования 207 наблюдавшихся нами больных разделены на 3 группы. В 1-ю группу вошли 113 (54,6%) больных острым необструктивным пиелонефритом, во 2-ю – 30 (14,5%) больных острым обструктивным пиелонефритом и в 3-ю группу составили 64 больных (30,9%) острым пиелонефритом на фоне беременности от 18 до 36 недель.
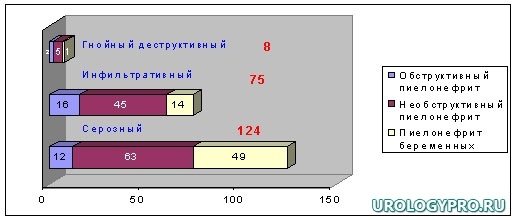
Распределение больных в зависимости от формы и стадии острого пиелонефрита представлено на диаграмме 1.
Диаграмма. 1. Распределение больных в зависимости от стадии острого пиелонефрита.
У 124-х больных (диаграмма 1) острый пиелонефрит нами диагностирован в серозную стадию, причем в 63 (50,8%) наблюдениях он имел необструктивный характер, в 12 (9,7%) – обструктивный и в 49-ти (39,5%) – возник на фоне беременности. У 75-ти больных острым инфильтративным пиелонефритом у 45-ти (60%) он имел необструктивный характер, в 16-ти (21,3%) – обструктивный и в 14-ти (18,7%) – развился на фоне беременности. Из 8-ми больных с тяжелыми гнойно-деструктивными формами заболевания, т.е. с наличием деструкции почечной ткани (абсцесс или карбункул), в 5-ти (62,5%) наблюдениях он носил необструктивный характер, в 2-х (25%) – обструктивный и в 1-ом (12,5%) – развился карбункул почки на фоне беременности.
Анализ клинико-лабораторных симптомов и данных экскреторных урограмм в большинстве наблюдений не позволил с достоверностью судить о клинической стадии болезни и с уверенностью выработать лечебную тактику, особенно когда решался вопрос о необходимости открытого оперативного лечения. Результаты экскреторной урографии мы всегда были вынуждены соотносить с клиническими проявлениями болезни и иными лучевыми методами обследования. Поэтому на начальном этапе нашего исследования мы пришли к выводу, что экскреторную урографию у больных ОП следует выполнять при отсутствии возможности применения КТ или МРТ. В дальнейшем при стадировании острого пиелонефрита мы старались сразу применять современные высокотехнологичные методы обследования, в основном УЗИ с допплерографией и МСКТ, которые позволяли дать оценку структурно-функциональному состоянию почечной паренхимы на принципиально ином, максимально приближенном к морфологическому, уровню диагностики.
Суммарные данные о количестве проведенных обследований у больных острым пиелонефритом в зависимости от характера нарушений уродинамики верхних мочевыводящих путей представлены в табл. 1.
Таблица 1. Распределение больных по видам проведенных исследований (n=207)
Всем 207 обследуемым больным острым пиелонефритом проведено УЗИ почек, 124 из них были в серозной стадии заболевания. Ультразвуковое исследование в В-режиме позволило выявить следующие признаки острого серозного пиелонефрита. Наиболее частым УЗ-признаком данной стадии являлся симптом «выделяющихся пирамидок», который установлен в 53 (42,7%) наблюдениях. Данный симптом обозначает повышение эхогенности почек за исключением области почечных пирамид, которые в результате выраженного отека, четко дифференцируются на остальном фоне. Остальные симптомы встречались несколько реже: утолщение почечной паренхимы преимущественно за счет медуллярного слоя, с незначительным снижением ее эхогенности в 42 (33,9%) и ограничение подвижности пораженной почки – в 34 (27,4%) наблюдениях. При этом следует отметить, что у 43 (37,9%) больных острым серозным пиелонефритом отмечено отсутствие каких-либо ультразвуковых признаков заболевания. Принимая во внимание клинико-лабораторные признаки болезни, мы считали, что неизмененные данные при эхографии почек являются признаком серозной стадии острого необструктивного пиелонефрита. УЗДГ-признаком острого серозного пиелонефрита в 62,1% наблюдений являлось усиление кровотока в проекции всех отделов сосудистой системы почки, так называемая «пылающая почка».
Острый инфильтративный пиелонефрит диагностирован у 75 больных. Выявляемость ультразвуковых признаков инфильтративной стадии острого пиелонефрита довольно высокая и колеблется от 66,7% до 86,7%. Наиболее специфичными УЗ-признаками данной стадии являются: нарушение кортикомедуллярной дифференцировки и появление зон пониженной эхогенности с нечеткими контурамизоны пониженной эхогенности в почке с четким контуром и нарушение корково-медуллярной дифференцировки. Суммарно УЗ-признаки острого инфильтративного пиелонефрита выявлены у 72 (96%) больных, отсутствовали у 3 (4%). Эходопплерографические признаки инфильтративной стадии ОП в виде практического отсутствия кровотока в зоне пониженной эхогенности с нечеткими контурами и усиления периферического сопротивления в огибающих сосудах выявлены у 34 (69,4%) из 49 обследованных больных.
Острый гнойно-деструктивный пиелонефрит с наличием деструкции почечной ткани (абсцесс или карбункул) установлен у 8 больных. Ультразвуковая картина при гнойной деструктивной стадии острого пиелонефрита чаще всего представленная гипоэхогенным очагом, имеющим округлую или овальную форму и четкий контур (абсцесс), выявлена в 7 (87,5%) наблюдениях. Иногда внутри данного очага определялись внутренние перегородки или дольки (карбункул) – 1(12,5%) наблюдение.
Допплерографической картиной гнойно-деструктивной стадии острого пиелонефрита мы считали аваскулярную зону внутри очага, которая свидетельствует о гнойном расплавлении ткани почки. Данный признак был выявлен у всех 8 (100%) больных в этой стадии.
Таким образом, в допплерографическом режиме (энергодопплерографии) на начальных этапах острого пиелонефрита (серозная стадия) у больных регистрируется усиление почечного кровотока. В дальнейшем могут выявляться зоны со сниженной перфузией, отмечается увеличение индекса резистентности по периферии, что связано с развитием вазоконстрикции при прогрессировании воспаления.
В серозной стадии острого пиелонефрита при МСКТ, как правило, мы определяли такие неспецифические признаки как увеличение размеров почки у 9 (34%) пациентов и толщины паренхимы у 12 (44%), нарушение кортико-медуллярной дифференцировки – у 12 (44%)пациентов.
При МСКТ с контрастированием в инфильтративную стадию острого пиелонефрита симптомы заболевания выявлялись наиболее часто, по сравнению с другими методами обследования (от 71,7 до 100%). При этом у всех 53 больных, которым произведена МСКТ, выявлялись зоны пониженной интенсивности накопления сигнала, чаще треугольной или клиновидной формы с нечеткими контурами. Как правило, эти изменения определялась в артериальную и паренхиматозную фазы. Мы связывали данные изменения со спазмом сосудов, обструкцией канальцев и интерстициальным отеком. Это предположение подтверждается тем, что вышеупомянутые области в результате антибактериальной терапии при повторном исследовании полностью исчезали и на их месте, в большинстве наблюдений, не образовывалась рубцовая ткань.
В целом КТ-признаки, характерные для инфильтративной стадии острого пиелонефрита нами выявлены у 75 больных: в 1-й группе – у 45 (60%), во 2-й – 16 (53,3%), в 3-й – у 14 (21,9%).
По данным МСКТ гнойно-деструктивная стадия острого пиелонефрита (абсцесс и карбункул), выявлена нами у 8 (100%) пациентов, благодаря обнаружению образования (зоны) с низкой (пониженной) интенсивностью сигнала округлой формы, не усиливающейся после введения контрастного вещества.
В инфильтративной стадии МРТ выполнена у 10 больных. При этом увеличение почки в размерах обнаружено у 7 (70 %) пациентов, утолщение почечной паренхимы – у 9 (90%). Основным критерием инфильтративной стадии острого пиелонефрита являлось появление в почечной паренхиме зон повышенной интенсивности МР-сигнала с нечеткими контурами на Т2 взвешенных и пониженной интенсивности на Т1 изображениях, выявленное у всех 10 (100%) пациентов.
Признаками абсцесса почки по данным МРТ считали негомогенные участки пониженной интенсивности с четким контуром на Т1-взвешенных изображениях и негомогенные участки с повышением интенсивности сигнала и четким контуром на Т2-взвешенных изображениях. При этом степень повышения интенсивности сигнала считали зависимым от содержания белка, жидкости и клеточного детрита в полости абсцесса. С помощью МРТ мы могли предполагать распространение гнойного процесса в паранефральное пространство.
Важным преимуществом МРТ является то, что этот метод нередко позволяет проводить дифференциальную диагностику между гнойным процессом в ткани почки и нагноением ее кист. Метод позволяет определить характер жидкости внутри кисты (серозная, геморрагическая, гнойная), что влияет на дальнейшую тактику лечения.
В целом МСКТ и МРТ при инфильтративной и гнойно-деструктивной стадиях острого пиелонефрита обладали наибольшей чувствительностью (100%) и специфичностью (100%).
На основании проведенного исследования нами выделены УЗ-, МР- и рентгеновские признаки острого воспаления почки на различных стадиях процесса. Основными УЗ-признаками являются снижение подвижности почки, увеличение почки в размерах, утолщение паренхимы, нарушение кортико-медуллярной дифференцировки. Обнаружение зон пониженной эхогенности с нечетким контуром свидетельствует об инфильтративных изменениях почечной паренхимы. Появление четкого ореола является более специфичным для абсцесса или карбункула почки. Основным допплерографическим критерием серозной стадии острого пиелонефрита мы считали усиление кровотока в проекции всех отделов сосудистой системы почки. При инфильтративных изменениях определяются гипоэхогенные очаги с резким обеднением кровотока. Отсутствие кровотока в четко очерченном участке паренхимы с резко сниженной эхогенностью свидетельствовует в пользу абсцесса или карбункула почки.
КТ-признаками острого пиелонефрита являются увеличение почки с утолщением ее паренхимы, нарушение кортикомедуллярной дифференцировки. Появление зон пониженной интенсивности накопления сигнала с нечетки контуром, преимущественно треугольной формы, свидетельствует об инфильтративной стадии процесса. Наличие зон пониженной интенсивности накопления сигнала округлой формы с четкими контурами указывают на гнойно-деструктивный процесс.
Основными МР-признаками острого пиелонефрита являются: увеличение почки (больше 12 см в продольном сечении), утолщение паренхимы (больше 2 см в среднем сегменте почки), нарушение кортико-медуллярной дифференцировки. Появление в почечной паренхиме зон повышенной интенсивности МР-сигнала с нечеткими контурами на Т-2 взвешенных и пониженной интенсивности на Т-1 взвешенных изображениях свидетельствует об инфильтративных изменениях в почечной паренхиме. При выявлении в почечной паренхиме зон повышенной интенсивности МР-сигнала с четкими контурами на Т-2 взвешенных и пониженной интенсивности на Т-1 взвешенных изображениях можно утверждать о формировании гнойно-деструктивных очагов.
Таким образом, современные методы лучевой диагностики (УЗ-допплерография, МСКТ, МРТ) позволяют дифференцировать интерстициальный отек, преобладающий на этапе серозного воспаления от диффузных и локальных инфильтративных изменений, а последние от гнойной деструкции почечной паренхимы. При этом на начальном этапе обследования всем больным выполняется УЗИ, в том числе с допплерографией. Комплексное УЗИ позволяет практически со 100% точностью диагностировать серозную и гнойно-деструктивную стадии острого пиелонефрита. Поэтому при серозной стадии заболевания обследование больных на этом этапе завершается и на основании клинико-лабораторных данных и результатов УЗИ в сочетании с допплерографией назначается соответствующая терапия. Одновременно за больным в обязательном порядке ведется динамическое наблюдение, которое может внести коррективы в дальнейшее ведение его. При выявлении инфильтративной стадии острого пиелонефрита, поскольку речь идет о дифференциальном диагнозе с гнойно-деструктивной стадией заболевания, целесообразно подтвердить диагноз с помощью МСКТ или у беременных с помощью МРТ, как более точных диагностических методик. При выявлении гнойно-деструктивной стадии ОП комплексным УЗИ обследованием диагноз, как правило, сомнений не вызывает. Однако поскольку в этой ситуации вопрос однозначно решается о том или ином оперативном методе лечения перед его выполнением в этих наблюдениях также целесообразно подтвердить диагноз с помощью МКСТ или МРТ.
Необходимо также отметить, что для уточнения диагноза (определения инфильтративной или гнойно-деструктивной стадий острого пиелонефрита) у большинства больных методом выбора, при наличии возможности выполнения, является МСКТ. Исключение составляют беременные с острым пиелонефритом, у которых методом выбора в дифференциальной диагностике этих стадий острого пиелонефрита является магнитно-резонансная томография.
В качестве антибактериальной терапии в серозной стадии острого необструктивного пиелонефрита мы использовали у 57 (90%) больных цефалоспорины 3 поколения, а защищенные аминопенициллины назначалсь лишь 6 (10%) пациентам. При серозной стадии острого необструктивного пиелонефрита всем 12 больным назначали только цефалоспорины 3 поколения.
При гестационном пиелонефрите в серозной стадии всем пациенткам мы дренировали мочевыводящие пути. При отсутствии дилатации чашечно-лоханочной системы мы ограничивались дренированием мочевого пузыря уретральным катетером на фоне антибактериальной и инфузионной терапии. При наличии дилатации ЧЛС всем пациенткам мы установили антирефлюксные мочеточниковые катетеры-стенты с дренированием мочевого пузыря уретральным катетером до нормализации температуры тела. В качестве этиотропной терапии в этой группе больных мы использовали у 39 (80%) больных цефалоспорины 3 поколения, у 10 (80%) защищенные аминопенициллины.
При лечении острого необструктивного пиелонефрита в инфильтративной стадии с целью антибактериальной терапии у 39 (87%) больных использовались препараты из группы карбапенемов, а у 6 (13%) цефалоспорины 3 поколения на фоне дренирования нижних мочевыводящих путей.
При остром обструктивном пиелонефрите в инфильтративной стадии после восстановления оттока мочи из почки из-за тяжести состояния больных нами 14 (87,6 %) больным антибактериальная терапия проводилась карбапенемами и 2 (12,5%) – цефалоспоринами 3 поколения
В лечении острого пиелонефрита беременных в инфильтративной стадии заболевания во всех 100% наблюдений мы использовали цефалоспорины 3 поколения.
В качестве антибактериальной терапии при гнойно-деструктивной стадии острого пиелонефрита после оперативного лечения мы использовали цефалоспорины 3 поколения у 2 (25%) и карбапенемы по тяжести состояния у 6 (75%).
Основным способом дренирования мочевых путей у подавляющего большинства больных острым серозным необструктивным пиелонефритом являлась установка уретрального катетера в мочевой пузырь, с целью исключения пузырно-мочеточникового рефлюкса как патогенетического фактора развития заболевания. У больных с пиелонефритом беременных этот способ дренирования мочевыводящих путей применен в 18% наблюдений.
Преимущественным видом дренирования мочевыводящих путей при серозной стадии острого пиелонефрита с обструктивным характером заболевания и у пациенток с острым пиелонефритом на фоне беременности являлась установка мочеточникового катетера-стента. В 3 наблюдениях острого обструктивного серозного пиелонефрита при технической невозможности установки мочеточникового катетера-стента дренирование почки осуществлено путем чрескожной пункционной нефростомии. Примененные нами методы дренирования мочевых путей при серозной стадии острого пиелонефрита приведены в табл. 2.
Таблица 2. Методы дренирования мочевыводящих путей больных острым пиелонефритом в серозной стадии (n=124)