Чем питается раковая клетка
Голод не даёт расти раковым клеткам
Чтобы затормозить рост злокачественной опухоли, нужно не только лишить её калорий, но и ограничить раковые клетки в жирных кислотах, которые они используют в своих мембранах.
Раковым клеткам, как и всем остальным, нужно питаться, а с учётом того, что они постоянно делятся, то понятно, что энергии им нужно очень много — больше, чем другим клеткам. Можно ли затормозить рост опухоли, сев на ту или иную диету?
В первую очередь злокачественные клетки поглощают огромное количество глюкозы. Кетогенная диета как раз почти исключает углеводы (и глюкозу в том числе), заменяя их жирами и белками. Некоторые исследователи пытались проверить влияние кетогенной диеты на рак, но результаты получались не вполне убедительными. В то же время есть диеты, которые просто ограничивают нас в калориях, в каком бы виде эти калории ни были. Такие диеты как бы провоцируют в клетках небольшой голод, что идёт на пользу всему организму — увеличивается срок жизни и уменьшается вероятность возрастных болезней (как работают «голодные» диеты, мы недавно рассказывали). Известно, что в некоторых случаях ограничение по калориям тормозит рост раковых опухолей.
Сотрудники Массачусетского технологического института решили напрямую сравнить противораковую эффективность низкокалорийной и кетогенной диеты. Эксперименты на мышах с опухолью поджелудочной железы показали, что низкокалорийная диета намного сильнее тормозит рост опухоли, чем кетогенная. То есть дело не только и не столько в глюкозе (в обоих случаях мыши поглощали одинаково небольшое количество глюкозы), но в чём-то ещё.
Делящимся клеткам нужна не только энергия, нужны ещё строительные молекулы, и среди строительных молекул особенно важны липиды. Из липидов состоят клеточные мембраны, а каждая клетка мало того, что окружена наружной мембраной, она буквально нашпигована мембранными органоидами. Мембраны нужны ядру, митохондриям, эндоплазматической сети, аппарату Гольджи. В состав липидов входят жирные кислоты, которые бывают насыщенные и ненасыщенные. Они отличаются по свойствам, и для того, чтобы мембраны функционировали нормально, насыщенные и ненасыщенные должны быть в определённой пропорции. Липиды клетки могут синтезировать сами, а правильную пропорцию насыщенных и ненасыщенных жирных кислот обеспечивает фермент SCD (stearoyl-CoA desaturase, стеароил-КоА-десатураза), который превращает насыщенные жирные кислоты в ненасыщенные.
В статье в Nature говорится, что и низкокалорийная диета, и кетогенная подавляли активность SCD, то есть у раковых клеток должно было получиться много насыщенных жирных кислот и мало ненасыщенных, из-за чего у них испортились бы клеточные мембраны. Но если диета была кетогенная, клетки получали нужные кислоты из еды (в кетогенной диете, напомним, достаточно много жиров) и продолжали делиться. В низкокалорийной диете мало не только глюкозы, но и жиров, и поэтому с ней раковые клетки активно размножаться не могли, и опухоль росла намного медленнее.
По словам авторов работы, результаты экспериментов на мышах отчасти подтверждаются медицинской статистикой, которая касается больных с опухолями поджелудочной железы: статистика говорит, что клинический прогноз у таких больных совпадает с тем, какие жиры они едят. Однако здесь нужно больше клинических данных, чтобы в достаточной мере обосновать связь между жирами в еде и течением болезни у людей. При этом исследователи вообще сомневаются, что онкобольным нужно садиться на низкокалорийную диету: в таком состоянии у неё могут проявиться отрицательные побочные эффекты. Лучше будет, раз уж мы лучше поняли значение фермента SCD для раковых клеток, найти какое-нибудь средство, которое подавляло бы его активность в опухоли.
Что питает раковые клетки?
О бзор лекции из цикла исследовательских работ д-ра Майкла Грегера на NutritionalFacts.org: «Подвергнуть голоду раковые клетки с помощью ограничения метионина».
Какая же связь этого самого метионина с раком?
Дело в том, что раковые клетки в отличие от вирусов, бактерий или грибковых образований, буквально становятся частью нашего тела. Они подключаются к кровоснабжению организма, и наша собственная кровь питает их, подводя необходимые для их роста и размножения вещества, и в частности одно, от присутствия которого зависит сама жизнь ракового образования.
Какое же вещество так необходимо для его роста?
Тот самый метионин. Раковые клетки прекращают рост в отсутствии поступления к ним вышеупомянутой аминокислоты. Это было обнаружено уже. 40 лет назад учеными Университета в Лос Анжелесе.
Фармацевтические компании мира яростно соревнуются, кто первым найдет средство, позволяющее изолировать метионин, не допуская его в кровь, с тем, чтобы отрезать питание раковых опухолей.
Но…. тот факт, что метионин поступает к нам в организм через еду, сознательно остается без внимания. Понятно, что для фармацевтической индустрии такое разрешение проблемы не сулит никакой прибыли. А эта индустрия одна из самых богатых и влиятельных в мире.
Плюс еще надо посмотреть, какие продукты содержат большее кол-во метионина. Может быть наметятся и другие объяснения, почему фактор еды так старательно обходят вниманием.
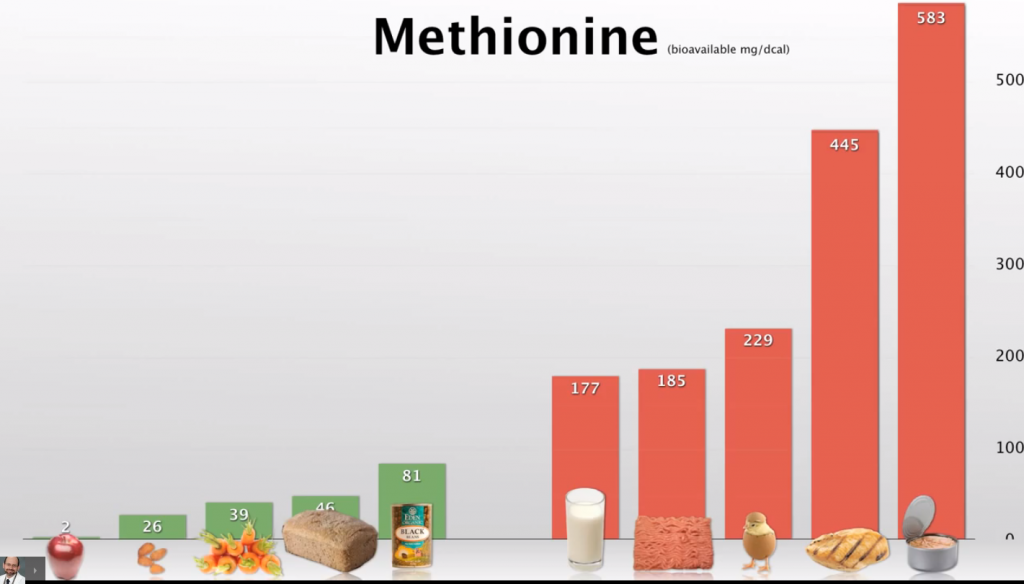
Вот, например, информация из весьма обширной и популярной базы диетических данных Nutritional Data.
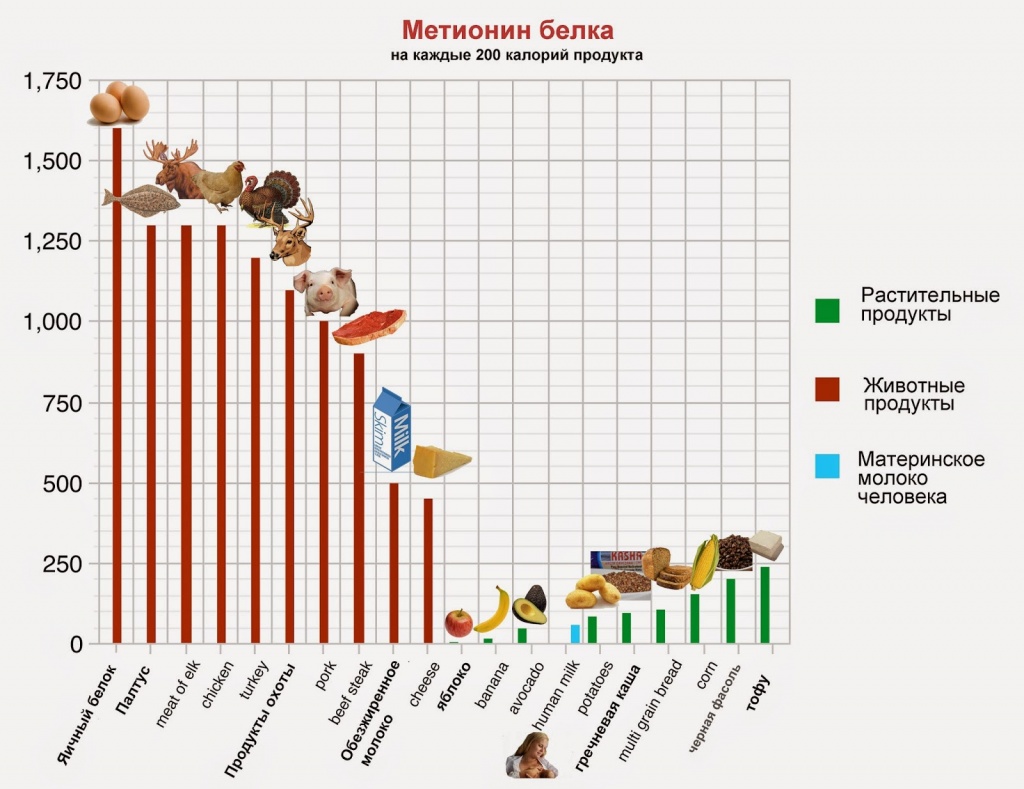
Список продуктов, содержащих наиболее высокое кол-во метионина: nutritiondata.self.com/foods-000084000000000000000-11.html?, описанных на 20 страниц, описывает различные формы животных продуктов, где яйца занимают самое высокое место.
Яйца куриные, яйца гусиные, яйца утиные, мясо курицы, мясо цыпленка. Затем идут бесконечные виды рыбы и продуктов из нее, мясо птиц: индюшек, мясо фазанов, мясо уток, гусей; мясо коров, мясо телят, мясо ягнят, мясо кролика, мясо поросенка, мясо оленей, лосей и других диких объектов охоты, мясо страуса, мясо кита, устрицы, креветки…
Ниже приведён график по содержанию метионина белка, составленный доктором Грегером. (Надо упомянуть, что данные Nutritional Data демонстрируют даже заметно более высокое содержание метионина в рыбе, яйцах и мясе млекопитающих и птиц, чем описывает доктор Грегер).
Самое высокое содержание метионина д-р Грегер отмечает в рыбе
Уже за пределами лекции д-ра Грегера можно предположить, какая не менее влиятельная, чем фармацевтическая промышленность рука, или группа рук в лице определенных индустрий, держат вопрос диеты в стороне от внимания человека.
А по-простому: невольно подумаешь, религиозный, или не религиозный ты человек, наделен, или не наделен способностью сострадать, что ВОЗМОЖНО НЕДАРОМ СУЩЕСТВУЕТ ПОНЯТИЕ ЗАПРЕТНОГО ПЛОДА.
Таблица составлена по данным сайта Диетическая информация (не имеющая отношение к д-ру Майклу Грегеру).
Расследования в поджелудочной: чем питаются раковые клетки
Расследования в поджелудочной: чем питаются раковые клетки
Главное правило медицинской статистики — не говорить о статистике. 14,1 млн новых случаев онкологических заболеваний в мире регистрируется каждый год. 32,6 млн больных раком живут в нашем мире в настоящий момент. По прогнозам врачей, в ближайшие 20 лет количество случаев онкологических заболеваний увеличится на 70%. Неудивительно, что борьба с этой болезнью становится одной из основных задач медицины 21 века. На фото — клетки меланомы на коллагеновом матриксе кожи.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Ученые выяснили, почему рак поджелудочной железы устойчив к действию химиотерапевтических препаратов. Панкреатические опухоли способны отгораживаться защитным изолирующим слоем, который не пропускает к метастазам достаточного количества сосудов. «Питание» онкологических новообразований происходит за счет энергии аминокислот, поставляемых соседними звездчатыми клетками.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Смертельный диагноз?
Что такое химиотерапия?
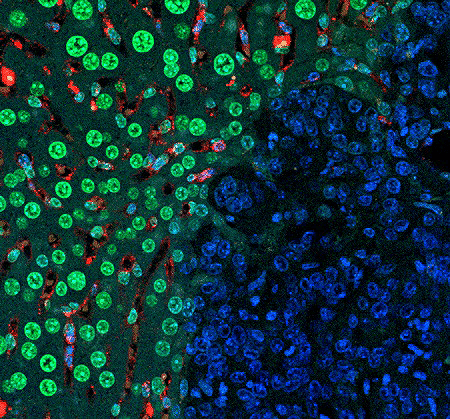
Рисунок 1. Микрофотография метастаза в поджелудочной железе. Сосуды (красного цвета) не проникают к очагу воспаления — раковым клеткам (окрашены синим цветом). Введенный в печень химиотерапевтический агент доксорубицин (зеленый цвет) нормально внедряется в здоровую ткань, но не способен пройти внутрь метастаза.
В научных журналах регулярно появляются новые сообщения об успешном применении химиотерапевтических средств. По какому принципу они работают? Больному вводится ядовитый препарат, который губительно действует абсолютно на все клетки организма. Однако усиленное кровоснабжение раковых клеток, а также их повышенные потребности в питательных веществах способствуют тому, что именно опухоль поглощает бóльшую часть яда. Патологический процесс разрастания очага заболевания приостанавливается. Конечно, нормальные клетки организма тоже страдают от яда, но частью из них можно пожертвовать. Поэтому важно подбирать такие дозы химического агента, которые смогут «отравить» опухоль и не погубить при этом большое количество здоровых тканей.
Излечимо — неизлечимо?
Но метод химиотерапии действует не всегда. И это может означать практически безнадежный случай. Один из них — аденокарцинома поджелудочной железы [4]. Таково научное название злокачественной опухоли, которая развивается в железистом эпителии. Рак поджелудочной железы занимает шестое место в мире по распространенности среди всех онкозаболеваний. Средняя продолжительность жизни больных после постановки диагноза — 6 месяцев. Причина в том, что к моменту обнаружения заболевания опухоль успевает не только значительно повредить железу, но и запустить метастазы в другие органы. Сегодня эта «неизлечимая» болезнь и механизмы ее развития являются объектом пристального медицинского наблюдения.
Почему карцинома не лечится химией?
Еще в 2012 году исследователи из Кембриджского института благотворительной организации Cancer Research UK (Cancer Research UK Cambridge Institute) [5] установили, что панкреатическая опухоль опасна из-за своей способности образовывать защитную капсулу, которая ограничивает количество кровеносных сосудов (рис. 1). Этот процесс называется десмоплазией и обеспечивается за счет звездчатых клеток, окружающих опухоль. В результате опухоль оказывается упакованной в некий защитный футляр, практически не пропускающий кровеносные сосуды. После воздействия химиотерапевтических агентов яды разносятся по всему телу с током крови. Однако аденокарцинома поджелудочной остается неуязвимым для ядов местом: нет кровеносных сосудов — нет и ядов, доставляемых по сосудам. При этом организм больного страдает, ведь рост опухоли не тормозится, а иммунная система ослабляется с каждым новым введением химии.
Дружелюбные соседи
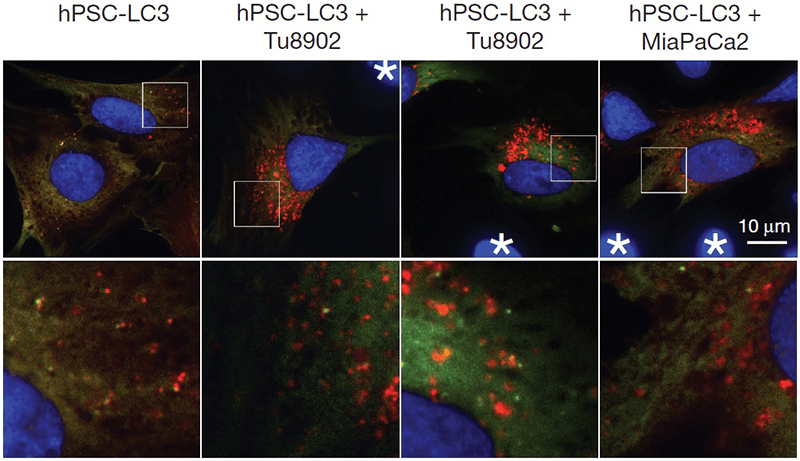
Как опухоли удается разрастаться в отсутствие кровеносных сосудов, «питающих» ее кислородом, глюкозой и остальными необходимыми веществами? В попытке раскрыть причину такой «стойкости» раковых клеток команда ученых из Гарвардской медицинской школы (Harvard Medical School) изучала ткани опухоли поджелудочной железы и их микроокружение [6]. Исследователь Криштован Соуза (Cristovão M. Sousa) проводил с коллегами эксперимент на панкреатических клетках человека и мышей. Они обнаружили, что опухоль стимулирует аутофагию [7], [8] соседних звездчатых клеток, в результате чего в них происходит «переваривание» собственных белков и разложение их на аминокислоты (рис. 2). Особо важна аминокислота аланин, которая активно поглощается опухолевыми клетками и поставляет им энергию.
Рисунок 2. Конфокальные изображения тканей опухоли и ее микроокружения. Ассоциации раковых клеток обозначены звездочками. Красным цветом обозначены лизосомы, в которых происходит процесс аутофагии. Оранжевым цветом обозначены пищеварительные вакуоли звездчатых клеток.
Аминокислота = энергия
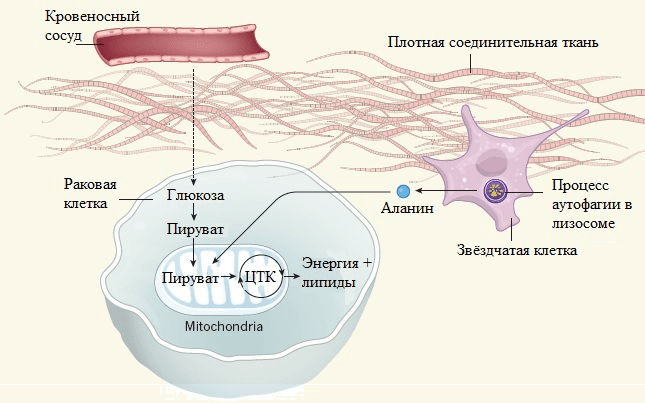
Исследователям удалось проследить метаболический путь аланина, меченного углеродом 13 C, который поступает к клеткам опухоли [6], [9]. В них эта аминокислота транспортируется сначала в цитозоль — полужидкую внутреннюю среду, а затем в митохондрии — «энергетические станции» клетки. Здесь аланин в результате трансаминирования (переноса аминогруппы) превращается в пируват (рис. 3). Это вещество вовлекается в цикл трикарбоновых кислот, который поставляет клетке энергию и ряд важных метаболитов. Таким образом, пируват, получаемый из аланина, играет важную роль, снижая потребность раковых клеток в глюкозе и компенсируя поставки питательных соединений из тока крови. В результате глюкоза может быть использована для других функций — например, для производства аминокислоты серина, необходимой для биосинтеза нуклеиновых кислот, а значит, для поддержания процессов клеточного роста и деления.
Рисунок 3. Аланин из звездчатых клеток перемещается в митохондрии раковых клеток, где превращается в пируват. Пируват — надежный поставщик энергии и молекул липидов. Процесс переноса аминогруппы от аланина и превращение его в пируват можгут происходить и в цитозоле, однако пока неясно, почему аланин направляется именно в митохондрии. Возможно, это связано с тем, что молекула, принимающая аминогруппу от аланина (альфа-кетоглутарат) более доступна в митоходриях, а не во внутриклеточной среде. За счет этого обеспечивается быстрый и эффективный синтез пирувата. ЦТК — цикл трикарбоновых кислот.
Что нам дает исследование звездчатых клеток?
Процесс аутофагии зависит от лизосом — «переваривающих» блоков клетки, где белки подвергаются разложению. В работе исследователей из Гарвардской медицинской школы было продемонстрировано, что раковые клетки поджелудочной железы в момент нехватки энергии отправляют сигналы к соседним звездчатыми клеткам [6]. Те в ответ разлагают собственные белки, чтобы «прокормить» прожорливых соседей. Возможно, дальнейшее исследование сигналов, генерируемых опухолевыми клетками, позволит открыть способ «выключения» этих сигналов, а значит, поможет в борьбе с этим пока что неизлечимым заболеванием.
Новые перспективы: взгляд в будущее
Британские ученые из Имперского колледжа Лондона (Imperial College London) также изучали звездчатые клетки и то, как они влияют на прогрессирование рака поджелудочной железы [10]. Так, в здоровой поджелудочной железе звездчатые клетки не активны; при этом они способны запасать витамин А. Но в случае возникновения и развития онкологического заболевания эти самые клетки выходят из состояния покоя, теряя ретинол. Это является сигналом для звездчатых клеток, которые начинают работать не на себя, а на своих соседей — клетки опухоли. Получается, что витамин А выступает в роли своеобразного защитного агента, поддерживающего стабильность панкреатических клеток. В эксперименте было показано, что добавление в культуру активного метаболита витамина А восстанавливает внутреннюю среду звездчатых клеток и возвращает их в состоянии покоя. Исследователи сообщают, что пока еще рано говорить о глобальной роли ретинола в лечении карциномы поджелудочной железы. Однако новое знание о данном заболевании позволяет надеяться на то, что когда-нибудь врачи смогут справиться с этим сложным диагнозом.
Интервью с онкологом: раковые клетки питаются глюкозой и жиром
Медики и ученые всех стран не перестают искать новые и новые методы диагностики и лечения злокачественных опухолей. И даже несмотря на их старания, онкология не перестает быть серьезной и масштабной проблемой. О том, как организовано лечения раковых больных в нашей стране и в чем главные преимущества отечественной медицины мы поговорим с доктором медицинских наук, профессором, заместителем директора по научной работе РНПЦ онкологии и медицинской радиологии имени Александрова Сергеем Анатольевичем Красным.
Сергей Анатольевич, что для вас онкология?
Онкология – это наука, которая занимается изучением злокачественных опухолей. Практически каждый орган может быть подвержен онкологическому заболеванию, и сегодня всего в этой области можно насчитать до 40 дисциплин.
Почему вот эта приставка «онко-» так часто употребляется сегодня и врачами, и простыми людьми?
Это связано с серьезностью проблемы. Как мы уже говорили, опухоль ведь может возникнуть абсолютно в любом органе человека (где-то чаще, где-то реже), поэтому и появляются отдельные дисциплины. Ведь обычный доктор общей лечебной практики, занимающийся даже узкой проблемой, например, урологией, ксожалению, не может охватить все нюансы онкологических проблем. Поэтому в онкологии и появляется много разных сфер и ответвлений.
Если говорить о прошлом, настоящем и будущем онкологии, где на этом пути находится отечественная медицина?
На сегодня онкология – это одна из самых быстро развивающихся отраслей медицины. Каждые 5 лет у нас кардинально меняется представления об опухолях, методах их лечения и диагностики.
Война против рака началась 40 лет назад и тогда считалось, что достаточно лишь расшифровать его геном. Геном расшифровали, разработали даже несколько эффективных лекарств, но могу сказать, что сегодня мы находимся примерно на том же самом уровне, поскольку победить болезнь все еще не удается. Сейчас у нас делается акцент на ранней диагностике, поскольку 4 стадия болезни крайне трудно поддается лечению. При 1 и 2 нам удается вылечить большое количество пациентов.
Некоторые медики считают, что онкология эта расплата за возрастающую продолжительность жизни человека. Можно ли так сказать?
Да, онкология на самом деле чаще встречается в старшем и пожилом возрасте, соответственно, чем выше риск продолжительности жизни, тем выше вероятность болезни. Смещаются акценты, уже сегодня у нас уменьшается количество смертей от сердечно-сосудистых патологий и растет смертность от рака.
Каковы главные факторы риска онкологии
Следующим фактором я бы выделил малоподвижный образ жизни, рядом с которым стоит избыточной вес и неправильное питание. Избыточный вес вообще является фактором риска возникновения большого количества заболеваний. Хотел бы подробнее рассказать обо всем известных омега-3 и омега-6 жирных кислотах. Омега-3 содержат противоопухолевый антиоксидант, омега-6, напротив, провоцирует воспаление и развитие опухолей. Омега-3 содержится в морепродуктах и фруктах и овощах, омега-6 – в мясе, в частности, красном. Соотношение этих кислот изначально у древних людей было 1: 1, сегодня это 15:1 в пользу омега-6 жирных кислот. Поэтому важно пересмотреть свой рацион, не стоит трижды в день есть мясо, особенно красное, важно употреблять фрукты, овощи и рыбу.
Растительные масла: рапсовое, льняное и оливковое также облают противоопухолевым действием.
Еще один продукт – зеленый чай. Доказано, что 4-5 чашек в день уменьшает развитие опухолевых сосудов (опухоль в таком случае не получает питания и уничтожается), это уникальное действие чая. Пищевые добавки омега-3 также можно принимать, они полезны еще и для сердца.
Опухоли преимущественно питаются сахаром, поскольку его легче всего усвоить. Опять же у первобытных людей не было сахара в рационе, а сегодня человек за год в среднем потребляет 70 кг сахара и таким образом кормит злокачественные клетки в своем организме.
Расскажите о приоритетных направлениях в развитии онкологии на сегодня
Три кита в онкологии: хирургия, химиотерапия и лучевая терапия. Они все на одном уровне и часто используются в комбинации и у каждого при этом есть свои показания. И в этом плюс терапии онкологии именно в нашей стране. Во многих странах лечением онкологических болезней занимаются врачи общей практики, у нас для этого квалифицированные и опытные специалисты.
Как сегодня проходит диагностика и как развивается это направление?
Злокачественные опухоли – очень коварное заболевание и на начальных стадиях они практически никак себя не проявляют. Поэтому если ориентироваться на симптомы, то мы будем диагностировать 3-4 стадию, которые уже плохо поддаются лечению. Поэтому наши силы направлены, по сути, на здоровых людей, у которых и выявляется 1-2 стадия. Так у нас есть программы скрининга для некоторых злокачественных опухолей, которые проводятся по инициативе самих лечебных учреждений. Рак предстательной железы, рак молочной железы, колоректальный рак (колоноскопия сделанная в 50-60 лет помогает предотвратить развитие опухоли в 70% случаев) и рак шейки матки (раз в два года женщины должны сдавать мазок на цитологию). К слову, от рака шейки матки сегодня есть вакцина, против ВПЧ. Если привиться до начала половой жизни, то риск сводится к нулю.
Мы уже говорили, что опухоль поглощает глюкозу, поэтому появилась идея определенным образом эту глюкозу помечать изотопами, которые могут затем накапливаться в опухоли. На этом принципе строится ПЭТ-диагностика (позитронно-эмиссионная томография). Этот центр работает на базе РНПЦ онкологии. Но хочу подчеркнуть, что это не ранняя диагностика, она позволяет нам выявить метастазы и оценивать эффект лечения.
Также у нас уже есть Республиканский центр канцерогенеза, который занимается молекулярно-генетическими исследованиями. Это позволяет максимально индивидуализировать лечение, ведь зная геном опухоли, можно подобрать лечение для каждого конкретного случая. Это новый уровень в лечении онкологии.
Как устроен первичный поликлиничный прием для таких пациентов?
Сегодня во всех областях республики есть онкологические диспасеры, они хорошо справляются с потоком онкологических пациентов. Но все же многие пациенты хотят обследоваться именно в Минске и это приводит к некоторому столпотворению в наших коридорах, но мы работаем над этим вопросом.
Какая еда провоцирует рост раковых клеток?
Мы уже говорили о красном мясе и сахаре. Также важно, как вы готовите продукты. Жареные и копченые блюда также обладают канцерогенным действием, поэтому стоит отдавать предпочтения другим способам готовки.
Всем людям раз в год необходимо сдавать общий анализ крови и биохимический анализ крови, делать УЗИ органов брюшной полости и малого таза, рентген легких. Мужчинам от 50 до 65 лет раз в два года нужно сдавать анализ крови на ПСА. Это минимум, важный для каждого.
Кроме того, каждый человек со своим врачом-терапевтом может определить свою группу риска: она будет зависеть от возраста, состояния здоровья, лишнего веса, вредных привычек и т.д. И тогда доктор выявит, какой орган под угрозой и какие дополнительные обследования вам необходимы.
Влияние диеты на метаболизм раковых клеток на молекулярном уровне
Клетки злокачественных опухолей изменяют свой метаболизм так, чтобы он отвечал нуждам, возникающим при неограниченной клеточной пролиферации. Растущие запросы приводят к изменению потребностей в энергии, биосинтетических предшественниках и промежуточных звеньях передачи сигналов. Как генетические программы, возникающие в результате канцерогенеза, так и транскрипционные и эпигеномные события важны для обеспечения необходимой метаболической активности раковых клеток. В последнее время появляются доказательства того, что факторы окружающей среды играют основную роль в формировании метаболизма клеток опухолей, а диета и питание являются ключевыми компонентами в его определении. В этом обзоре обсуждаются новые концепции в понимании метаболизма злокачественных клеток, а также то, как на него влияют диета и питание.
Метаболизм раковых клеток изменяется, чтобы удовлетворить биосинтетические, биоэнергетические и сигнальные потребности при неконтролируемой клеточной пролиферации. Изменения обмена веществ на молекулярном уровне были обнаружены почти 100 лет назад, когда Отто Варбург и его коллеги сообщили, что злокачественные клетки потребляли больше глюкозы, чем их аналоги в нормальных тканях, и предпочитали ферментировать ее, чтобы вырабатывать лактат вместо более энергетически эффективного окисления до CO2. В настоящее время широко известно, что в раковых клетках происходят также изменения в поглощении и обмене углеводов, липидов и аминокислот. Определенные питательные вещества, которые более активно усваиваются злокачественными клетками, сильно варьируют: в некоторых подгруппах опухолей изменяется метаболизм глюкозы, в других — метаболизм одноуглеродных соединений наряду с усилением зависимости от обмена аминокислот, а также многие другие пути.
Эти наблюдения используются в клинической практике в качестве методов визуализации, и в настоящее время являются предметом исследований, необходимых для разработки лекарственных средств (Stuani et al., 2019; Vander Heiden и DeBerardinis, 2017). Данные концепции были детально рассмотрены в обзорах, выходивших на протяжении многих лет (Weinberg and Chandel, 2015; Wolpaw and Dang, 2018).
Метаболизм злокачественных опухолей, как и все процессы, происходящие в живых организмах, включает в себя как генетические, так и связанные с окружением компоненты. Почти все онкогены и опухолевые супрессоры обладают способностью изменять обмен веществ клетки в той или иной форме (Vander Heiden and DeBerardinis, 2017). Мутации, которые влияют на сигнальные пути и транскрипционные программы, связывают некоторые элементы метаболических каскадов, изменяя экспрессию генов и их активность, например, путем посттрансляционных модификаций участвующих в обмене веществ ферментов и переносчиков. Данные процессы, связанные с возникновением опухоли, также регулируются факторами окружения, специфичными для пространственной ориентации в соответствующей ткани, такими как наличие факторов роста и цитокинов, тип межклеточных контактов. Помимо этих факторов, определяющих активность метаболических каскадов клетки, доступность питательных веществ, на которую непосредственно влияет тканевое окружение, играет главную роль в настройках метаболизма раковых клеток (Palm and Thompson, 2017; Zhu and Thompson, 2019). Она зависит как от метаболитов, высвобождаемых из окружающих клеток, так и от состава плазмы в сосудистой сети.
Уровень метаболитов в плазме крови определяется совокупностью физиологических процессов, в которую вносят вклад кишечник, печень, мышцы, поджелудочная железа и другие органы и ткани. Доступность питательных веществ в плазме изначально определяется потреблением пищи; концентрации метаболитов широко варьируются в зависимости от рациона (Mentch et al., 2015). Известно, что определенные виды диет могут влиять на определенные физиологические аспекты. Например, средиземноморскую диету связывают с увеличением продолжительности жизни. Западная же диета напротив, ассоциирована с ожирением, онкологическими заболеваниями и ишемической болезнью сердца. Интересно, что растительные рационы издавна изучались в контексте терапии рака (Gerson, 1978). И хотя существуют убедительные эпидемиологические доказательства, связывающие данные типы питания с болезнями, молекулярные механизмы, лежащие в основе этих эффектов, еще недостаточно изучены. Еще менее понятно то, как диета может формировать метаболические пути в организме, не говоря уже о влиянии на прогрессию или лечение злокачественных новообразований (Goncalves et al., 2019a; Kanarek et al., 2020; Lien and Vander Heiden, 2019). Текущие исследования центрального углеродного обмена, в котором участвуют углеводы, липиды и аминокислоты, дают представление о потенциальных путях воздействия на метаболизм раковых клеток. В данном обзоре обсуждаются результаты недавних исследований, которые расширяют понимание взаимосвязи диеты и онкологических заболеваний на молекулярном уровне, и предлагаются стратегии для терапевтических воздействий, направленных на эти механизмы.
Принципы и механизмы взаимосвязи диеты и метаболизма раковых клеток
Как упоминалось ранее, обмен веществ в раковых клетках сильно зависит от многих факторов окружения, включая кислотность среды в опухоли, состав популяций стромальных и иммунных клеток и механические свойства структуры опухоли. Эти особенности были рассмотрены в обзорах (Bi et al., 2020; Wolpaw and Dang, 2018). Особый интерес представляют питательные вещества микроокружения опухоли, которые определяют большую часть метаболизма опухолевых клеток (Chen et al., 2019; Tasdogan et al., 2020). Действительно, хотя опухолевый метаболизм крайне неоднороден и обусловлен анатомическим расположением, генетическими профилями и целым рядом других факторов, было показано, что у некоторых типов опухолей развивается метаболическая зависимость от определенных питательных веществ, таких как, например, глютамин и цистеин. Их доступность определяется доставкой нутриентов с плазмой из системного кровотока в опухолевые клетки (Muir and Vander Heiden, 2018). В связи с этим детерминанты доступности питательных веществ плазмы представляют особый интерес, так как они служат основной точкой контроля над метаболизмом опухоли и поддаются фармакологическим, физиологическим воздействиям и воздействиям соответствующего окружения.
Доступность питательных веществ контролирует клеточный метаболизм посредством множества механизмов. Одним из таких процессов является поглощение клетками питательных веществ из окружающей микросреды, которое строго регулируется кинетическими свойствами активных переносчиков, в том числе их константами Михаэлиса (Nelson and Cox, 2000). В физиологических условиях раковые клетки сталкиваются с концентрациями питательных веществ, которые находятся на на том же уровне, что и в соответствующих нормальных тканях или превышают их. Такое увеличение доступности нутриентов влияет на скорость их усвоения, которая затем распространяется на изменения характера поступления веществ в клетку через метаболическую сеть и нижестоящие пути (Palm and Thompson, 2017). Эта парадигма лучше всего иллюстрируется способностью печени определять высокие уровни глюкозы и реагировать на это усилением синтеза гликогена. Эта перестройка осуществляется, в частности, путем увеличения константы Михаэлиса печеночного транспорта глюкозы (5 мМ). При голодании концентрации глюкозы низкие (3 мМ), что позволяет ей обходить поглощение клетками печени и возвращаться в системный кровоток. Однако в состоянии сытости концентрация глюкозы в плазме возрастает (8 мМ), что приводит к пропорциональному усилению поглощения глюкозы (Mueckler and Thorens, 2013). Такое трехкратное увеличение поглощения глюкозы по сравнению с исходным уровнем приводит к синтезу гликогена и, таким образом, позволяет печени выполнять свою ключевую роль в поддержании гомеостаза глюкозы. Метаболом плазмы отражает потребление пищи в контексте индивидуальной метаболической гетерогенности, которая включает в себя такие факторы, как функция печени, состав кишечного микробиома, а также метаболизм в мышцах и жировой ткани (Zeevi et al., 2015). В новой, еще недостаточно изученной области исследований рассматривалось применение профилирования метаболитов в сочетании с диетическим мониторингом для прогнозирования изменений в циркулирующей плазме, возникающих в результате потребления тех или иных питательных веществ. Хотя общие тенденции питания отражаются в метаболоме плазмы, необходимы дальнейшие исследования, чтобы тщательно изучить детальные особенности рациона, включая отдельные продукты и их влияние на концентрацию метаболитов (Wittenbecher et al., 2015). Клиническая ценность изучения характера питания и связанных с ним изменений в обмене веществ подтверждается установленными взаимосвязями между определенными диетами и нарушением регуляции обмена веществ всего организма. Целая плеяда хронических состояний, связанных с метаболическим синдромом, таких как ожирение, инсулинорезистентность и гипергликемия, также ассоциированы с более высоким риском развития онкологических заболеваний и худшим прогнозом для пациента (Perry and Shulman, 2020). Связь ожирения с раком объясняется рядом механизмов, в том числе стрессом эндоплазматического ретикулума, развитием воспаления, нарушениями передачи сигналов, связанных с гормональной регуляцией и, возможно, измененным метаболизмом в результате возникновения колебаний уровня метаболитов в плазме (Iyengar et al., 2016; Ulrich et al., 2018). Гипергликемия также связана с повышенным риском развития рака и прогрессированием уже существующих онкологических заболеваний. Этот канцерогенный эффект может быть обусловлен системными эффектами инсулина / инсулиноподобного фактора роста 1 (ИФР-1), другими факторами роста, а также передачей сигналов в воспалительном каскаде и прямым поглощением глюкозы опухолевыми клетками, приводящим к эпигенетическим и биосинтетическим изменениям (Goncalves et al. al., 2018). Таким образом, роль опосредованных диетой изменений в системном обмене и их влияние на метаболизм опухоли (рис. 1) требуют дальнейшего изучения.
Метаболизм макронутриентов и молекулярные механизмы рака
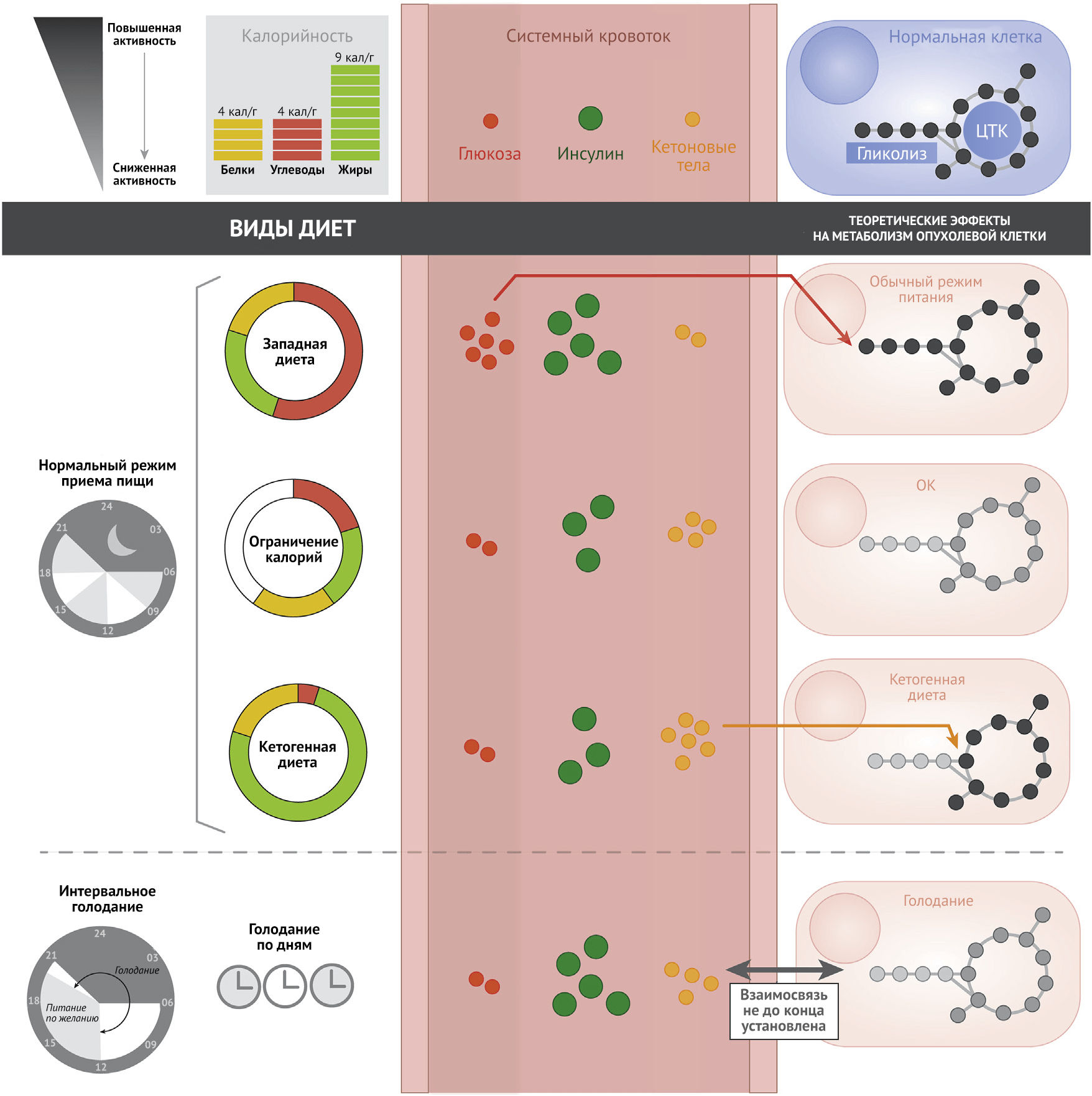
Ограничение калорий
Как показал ряд исследований, ограничение калорий (ОК) (рис. 1), не приводящее к недоеданию, увеличивает продолжительность жизни и вызывает отсрочку развития возрастных заболеваний, включая рак. Данное явление было тщательно изучено на грызунах; оказалось, что эффекты ОК, заключающиеся в предотвращении развития опухолей и увеличении продолжительности жизни, по-видимому, характерны для разных видов — от червей до приматов (Fontana et al., 2010; Mattison et al., 2017). Многочисленные исследования на животных показали, что ОК может предотвращать возникновение многих видов злокачественных новообразований, а также сдерживать прогрессию и метастазирование существующих опухолей (Lv et al., 2014). Такие положительные эффекты были обнаружены при исследовании злокачественных новообразований различных органов и тканей, включая молочную железу, легкое, простату, мозг, мочевой пузырь, поджелудочную железу, печень, кожу, прямую кишку и яичники (Castejon et al., 2020; Lv et al., 2014). Молекулярные механизмы, которые предположительно лежат в основе этих эффектов, обычно связывают со снижением содержания в крови некоторых гуморальных регуляторов, таких как факторы роста и цитокины. В частности, ОК было ассоциировано с более низкими уровнями циркулирующего ИФР-1, который, как известно, задействует сигнальные сети с участием RAS/MAPK и PI3K/AKT/mTOR, нарушение регуляции которых часто ассоциировано с возникновением опухолей (Goncalves et al., 2018). Таким образом, ОК, по-видимому, оказывает множество разнообразных воздействий на сигнальные пути, и эти воздействия могут иметь противоопухолевый эффект. Кроме того, было показано, что ОК оказывает антиангиогенное и проапоптотическое действие на опухоли у мышей, а также обладает системным противовоспалительным действием (O’Flanagan et al., 2017). Влияние на метаболизм на данный момент оказалось менее изучено, но уже успело стать предметом предварительных исследований. ОК замедляет скорость основного обмена, что было продемонстрировано у участников исследования, проведенного Редманом с соавт. в 2018 году (Redman et al., 2018). Предполагается, что ОК замедляет процессы старения и защищает от болезней, связанных с возрастом, из-за уменьшения продукции митохондриальных активных форм кислорода и связанного с этим окислительного повреждения клеток (Sohal and Allen, 1985). По сравнению с питанием ad libitum (AL) (неограниченное питание по желанию — прим. пер.) потребление пищи с ОК у мышей также вызывает первоначальное увеличение синтеза жирных кислот (ЖК) с последующим компенсаторным усилением интенсивности их окисления (Bruss et al., 2010). Этот циклический паттерн метаболизма в жировой ткани отражает динамические изменения в экспрессии ферментов синтеза ЖК, таких как синтаза жирных кислот и ацетил-КоА-карбоксилаза (ACC-1). Кроме того, ОК было связано со снижением уровня гликолиза и изменениями в жирнокислотном составе мембран, выражающимся в уменьшении содержания полиненасыщенных ЖК (ПНЖК) и повышением уровня мононенасыщенных ЖК (Jove et al., 2014). Считается, что как увеличение интенсивности окисления ЖК, так и снижение количества ПНЖК в составе мембран помогают защитить клетки от окислительного стресса (Weinberg and Chandel, 2015). Также было показано, что ОК влияет и на другие метаболические пути, включая карнитиновый челночный механизм транспорта ЖК в митохондрии, метаболизм сфингозина и метионина (Green et al., 2017). В будущем большой интерес будет представлять управление метаболическими путями для оценки степени, в которой изменения в процесса обмена веществ, вызванные ОК, могут угнетать процесс канцерогенеза.
Голодание
Как показывают недавние исследования, различные режимы голодания, такие как интервальное голодание и ограниченное по времени питание, благотворно влияют на здоровье человека (de Cabo and Mattson, 2019; Longo and Mattson, 2014; Mitchell et al., 2019). Голодание (рис. 1), определяемое как периоды калорийной депривации в диапазоне от нескольких часов до дней, является привлекательной альтернативой ОК, так как определенные схемы голодания легче соблюдаются и переносятся онкобольными, которые подвергаются риску нежелательной потери веса и кахексии (Safdie et al., 2009). Интересно, что кратковременное голодание у людей сильно влияет на уровень ИФР-1 в сыворотке крови, тогда как при длительном ОК этого может не происходить. Исследования на клетках дрожжей и млекопитающих показали, что периодическое ограничение поступления питательных веществ защищает как не экспрессирующие онкогены дрожжи, так и нормальные клетки млекопитающих от окислительного стресса и тяжелых побочных эффектов химиотерапии; тем не менее, при этом оно не обладает протективным эффектом по отношению к дрожжам, экспрессирующим онкогены, и раковым клеткам и может повышать их чувствительность к данным воздействиям (Lee et al., 2012; Raffaghello et al., 2008).
В эксперименте на мышах голодание на протяжении 24–60 часов защищало животных от чрезвычайно высоких доз химиотерапевтических препаратов (Lee et al., 2012; Raffaghello et al., 2008) и радиации (de la Cruz Bonilla et al., 2019), а также повышало эффективность химиотерапии у мышей, которым были трансплантированы клетки рака поджелудочной железы, меланомы, рака молочной железы, глиомы и нейробластомы (D’Aronzo et al., 2015; Lee et al., 2012), что в некоторых случаях приводило к долгосрочной безрецидивной выживаемости (Lee и др., 2012). В качестве объяснения механизмов этого явления предполагается следующее: голодание оказывает протективное действие по отношению к нормальным клеткам вследствие того, что гормональные и метаболические изменения во время голодания способствуют переходу клеток в устойчивое к стрессу состоянию, которое характеризуется переключением от процессов роста к восстановлению (Di Biase et al., 2017; Lee et al., 2012; Nencioni et al., 2018). Опухолевые же клетки не способны достичь стрессоустойчивого состояния и поэтому оказываются не защищены от стресса или сенсибилизированы к нему. Голодание и «диеты, имитирующие голодание» могут также улучшить исходы онкологических заболеваний, усиливая противоопухолевый иммунитет с помощью стимуляции опосредованной Т-клетками цитотоксичности (Di Biase et al., 2016).
Влияние голодания и диет в целом (рис. 1) на риск развития злокачественных образований у человека все еще остается недостаточно изученным (Marinac et al., 2016; Yokoyama et al., 2016). Тем не менее, было показано, что голодание действительно может воздействовать на определенные аспекты канцерогенеза. Контролируемое исследование, в ходе которого изучалось интервальное голодание — режим питания, при котором пища потребляется AL через день, а затем следует день ОК, — показало снижение уровня метионина и гормона щитовидной железы (T3) в плазме (Stekovic et al., 2019). Другое недавнее исследование на добровольцах продемонстрировало значительные изменения в профилях метаболитов в крови после 58 часов голодания (Teruya et al., 2019). Эти данные отражают изменения в механизмах антиоксидантной защиты, активности митохондрий и перестройке пентозофосфатного пути наряду с другими изменениями клеточного обмена веществ, характерными для раковых заболеваний. У онкобольных, голодающих на протяжении 5–56 часов до и/или после химиотерапии побочные эффекты наблюдались реже и сеанс в целом переносился лучше, что как раз согласуется с ранее полученными результатами на дрожжах, мышах и клетках млекопитающих (Safdie et al., 2009). Таким образом, голодание является интересным способом влияния на метаболизм опухолевых клеток, который к тому же может действовать совместно с химиотерапией и лучевой терапией.
Баланс макронутриентов
Потребление углеводов и жиров
Особенности индивидуального потребления отдельных макронутриентов может играть такую же важную роль в регуляции продолжительности жизни, здоровья и развития заболеваний, как и калорийность поглощаемой пищи. Диеты с высоким содержанием насыщенных жиров и углеводов, такие как «западная диета», связаны с негативными последствиями для здоровья. Состав метаболитов в плазме крови отражает повышение уровня центрального углеродного обмена с высоким содержанием короткоцепочечных ацилкарнитинов и циркулирующих аминокислот (Bouchard-Mercier et al., 2013; Douris et al., 2015). Недавнее исследование было посвящено выяснению влияния диет с низким содержанием углеводов или белков на вышеупомянутые факторы, а также их возможной положительной роли в профилактике или лечении онкологических заболеваний. Кетогенная диета (КД) — это особая разновидность низкоуглеводной диеты, наиболее изученная в контексте онкозаболеваний. Классическая КД применяется как дополнение при лечении эпилепсии и определяется как «диета с высоким содержанием жиров, умеренным содержанием белков и низким содержанием углеводов» с заданным весовым соотношением жира 4:1 или 3:1 к суммарному количеству белков и углеводов (Huffman and Kossoff, 2006). КД приводит к снижению уровня глюкозы в крови, что вызывает кетоз, ассоциированный со уменьшением интенсивности гликолиза и усилением β-окисления ЖК (Puchalska and Crawford, 2017). Синтез кетоновых тел из ЖК в печени обеспечивает выработку энергии для мозга и других органов. Это воздействует на центральный метаболизм углерода, включая изменение глюкозного обмена, что, как известно, необходимо для жизнедеятельности опухолевой клетки (Allen et al., 2014; Goncalves et al., 2019b; Liberti and Locasale, 2016). Также исследователи предположили, что КД действует через механизмы, аналогичные тем, которые, как считается, имеют место при ОК, включая снижение уровня анаболических гуморальных факторов, таких как ИФР-1 и инсулин, и усиление интенсивности окислительного стресса в опухолевой ткани (Allen et al., 2014; Xia et al., 2017). Интересно, что недавнее исследование продемонстрировало синергичное действие КД и ингибиторов каскада PI3K — вероятно, за счет подавления выработки инсулина (Hopkins et al., 2018).
На сегодняшний нет явных доказательств того, что низкоуглеводные диеты и КД снижают заболеваемость раком или улучшают исходы онкологических заболеваний у людей (Erickson et al., 2017), однако многое еще предстоит изучить. Исследования КД на мышах, в том числе с применением ксенотрансплантации, показали неоднозначные результаты. В части из них было продемонстрировано подавление роста опухоли (Caso et al., 2013; Klement et al., 2016), в то время как в других — обнаружено влияние на рост опухоли только в сочетании с химиотерапией или радиотерапией (Allen et al., 2013) или же вовсе не выявлено никаких положительных эффектов КД (Maurer et al., 2011). Следует отметить, что в данных исследованиях имеются значительные различия в составе макронутриентов в контрольных диетах и КД, и в большинстве этих работ потребление белка было ниже в группах КД. Было показано, что потребление белка оказывает влияние на опухоли, и это является одним из основных факторов, вызывающих сомнение в надежности результатов данных экспериментов. Тем не менее, в двух этих исследованиях поддерживали согласованное потребление белка между группами и при этом отмечали положительный эффект КД и низкоуглеводных диет на моделях ксенотрансплантата рака предстательной железы (Caso et al., 2013), что свидетельствует о возможной пользе низкоуглеводных диет или КД при некоторых онкозаболеваниях. Известно, что злокачественные опухоли могут очень сильно различаться между собой по степени зависимости от глюкозного обмена (Liberti et al., 2017). Однако неизвестно, предопределяет ли предпочтение опухолью глюкозного типа метаболизма ее реакцию на диеты, которые изменяют уровень глюкозы в крови.
Потребление белка
Хотя потребление белка оказывает значительное влияние на здоровье человека, исследований, оценивающих, как белок в составе рациона влияет на рак, к настоящему времен проведено не так уж и много. В одной из работ продемонстрировано, что у мужчин и женщин среднего возраста, которые сообщали об умеренном (10–19 % калорий из белка) или высоком (20 % или более калорий из белка) потреблении белка, значительно повышался уровень смертности от онкологических заболеваний по сравнению с теми, кто сообщил о низком потреблении белка, но эта тенденция кардинальным образом менялась для лиц старше 65 лет (Levine et al., 2014). Интересно, что риск развития онкологических заболеваний среди лиц среднего возраста несколько уменьшался при потреблении растительного белка, который отличается от, животного своим аминокислотным составом. Это исследование также показало, что у мышей, находящихся на низкобелковой диете (4 % калорий из белка), уменьшалась частота возникновения опухолей и рост имплантированных опухолевых клеток рака молочной железы и меланомы по сравнению с мышами, которые потребляли большое количество белка (18 % калорий из белка). Как у людей, так и у мышей в группах с низкобелковой диетой уровень ИФР-1 был понижен, что ранее было показано для людей со уменьшенным потреблением белка (Fontana et al., 2008). Другое исследование продемонстрировало, что у мышей, находившихся на низкоуглеводной диете с высоким содержанием белка (58 % калорий из белка), замедлялся рост ксенотрансплантированной плоскоклеточной и колоректальной карцином, а также снижалась частота спонтанного возникновения опухолей в модели рака молочной железы по сравнению с мышами, получавшими питание по типу «западной диеты» (Ho et al., 2011). У мышей, находящихся на низкоуглеводной диете с высоким содержанием белка, не обнаруживалось снижение выработки ИФР-1, но происходило уменьшение концентрации глюкозы и инсулина в крови.
Различные исследования показывают противоположные взгляды на то, имеет ли смысл ограничение потребления белков или углеводов для лечения и профилактики онкологических заболеваний, и это можно объяснить несколькими причинами. Так, не исключено, что разные виды опухолей по-разному реагируют на нехватку макронутриентов, как показано на рисунке 1. При этом некоторые опухоли в значительной степени полагаются на гликолиз, и такие новообразования более чувствительны к рациону с ограниченным содержанием углеводов, чем к рациону с ограниченным белком; другие же опухоли, зависимые от сигнального пути ИФР-1, лучше реагируют на ограничение потребления белка. Другое возможное объяснение состоит в том, что ограничение потребления любого макронутриента выгодно по сравнению с рационом, насыщенным всеми тремя макронутриентами, поскольку недостаток даже одного макронутриента вызывает некоторые из тех же реакций на голодание, которые наблюдаются при ОК и которые, как считается, обладают противоопухолевым эффектом. Также остается не до конца понятным, могут ли диеты с низким содержанием белка подавлять рост раковых клеток вследствие нехватки одной или нескольких аминокислот; известно, что опухоли часто демонстрируют повышенную потребность в определенных аминокислотах (более подробно обсуждается ниже). Для ответа на эти вопросы и лучшего понимания влияния макронутриентного состава в рационе на онкологические заболевания необходимо проведение дальнейших исследований.
Баланс аминокислот в рационе при онкологических заболеваниях
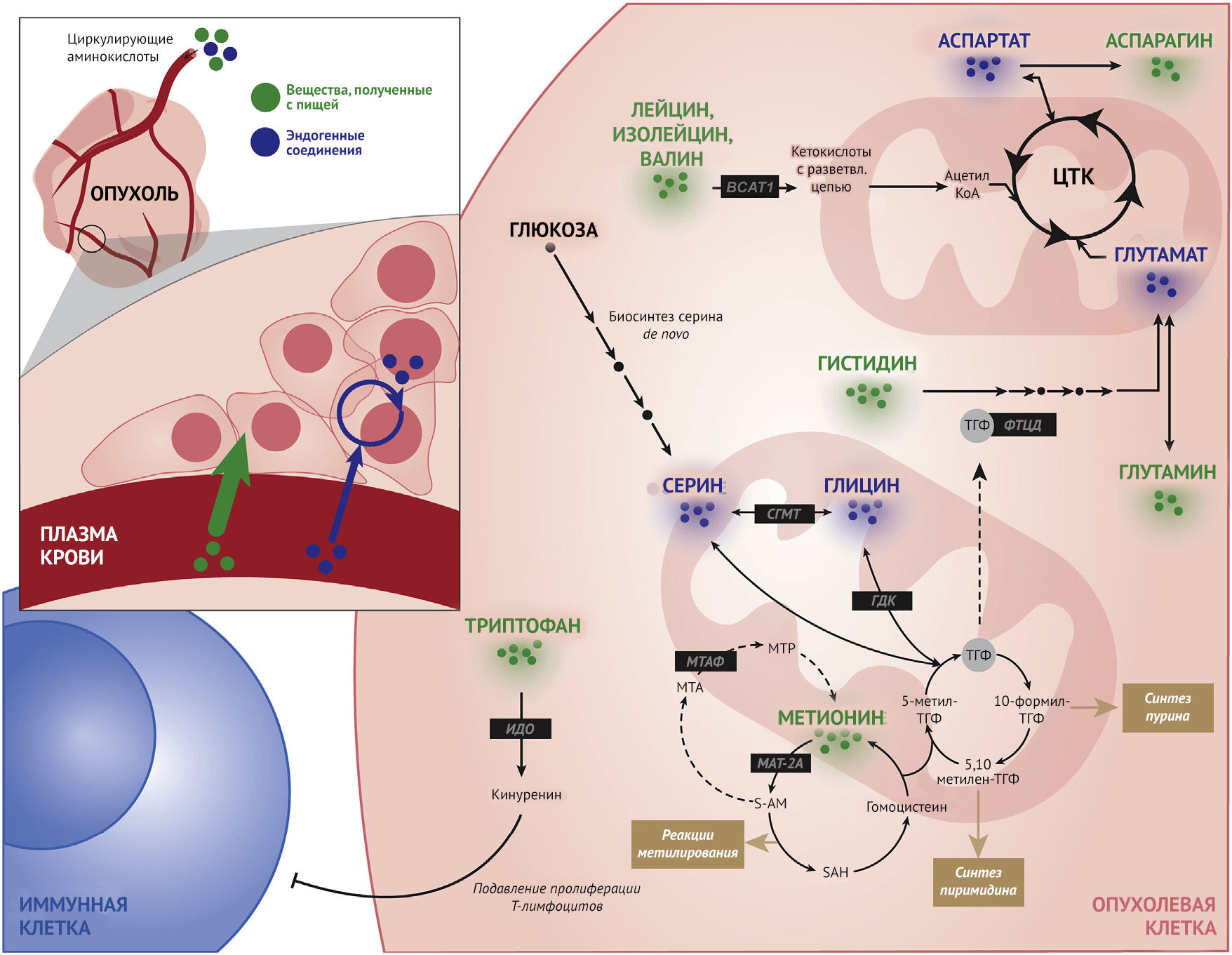
Метаболизм аминокислот при онкозаболеваниях
Метаболизм метионина
Метионин является серосодержащей аминокислотой, участвующей в обеспечении окислительно-восстановительного гомеостаза, метилировании хроматина и нуклеиновых кислот, синтезе полиаминов и других метаболических процессах. Будучи незаменимой аминокислотой, поступающий с пищей метионин превращается в S-аденозилметионин (S-AM), который является универсальным донором метильной группы для реакций метилирования, и гомоцистеин, который участвует в фолатном цикле и путем транссульфурации превращается в метионин. Метилтиоаденозин (МТА) в ходе метаболизма также превращается в метионин при участии МТА-фосфорилазы (МТАФ) в процессе реутилизации метионина. Для опухолевых клеток характерен измененный метаболизм метионина (Sanderson et al., 2019a). Метионин может быть важным маркером в контексте клинического стадирования рака, поскольку поглощение L-(метил 11C)-метионина (MET) имеет значительную прогностическую ценность (Luckerath et al., 2015). Также в опухолевых клетках был отмечен повышенный синтез белка и активность участвующих в метаболизме метионина ферментов, включая метионинаденозилтрансферазу 2А (MAT-2A) и никотинамид-N-метилтрансферазу (NNMT) (Eckert et al., 2019; Ulanovskaya et al., 2013; Wang et al., 2019).
Прицельное воздействие на обмен метионина в раковых клетках показал свои результаты: так, введение рекомбинантной метиониназы (rMETase) оказалось успешной тактикой в исследованиях на соответствующих доклинических моделях (Hoffman et al., 2019). Другим перспективным направлением в изучении метионинового обмена является снижение количества метионина в рационе (ограничение пищевого метионина — ОПМ), которое, как было показано, увеличивает
продолжительность жизни (Barcena et al., 2018; Lee et al., 2014). Ограничение доступности метионина может стимулировать снижение интенсивности его метаболизма. Как показано в недавнем исследовании, в клетках, дефицитных по МТАФ и подвергнутых ОПМ, накопление MTA снижалось до уровней, наблюдаемых в клетках с нормальной экспрессией MTAФ (Sanderson et al., 2019b). В процессе канцерогенеза ОПМ способствует определенным терапевтическим реакциям в доклинических моделях, начиная от моделей с использованием ксенотрансплантатов, полученных от пациентов, и заканчивая анатомически ограниченными автохтонными моделями с генетически определенными драйверными мутациями. При этом наблюдалось синергическое взаимодействие ОПМ с химиотерапией и лучевой терапией. В каждом из этих случаев механизмы, лежащие в основе ОПМ, по-видимому, являются автономными для клеток и сопряжены с измененными потребностями в биосинтезе нуклеотидов и окислительно-восстановительными реакциями, которые являются результатом изменений в метаболизме метионина, вызванных ОПМ. Определение клинически значимого режима ОПМ является сложной задачей, поскольку истощение запасов метионина обладает токсическими эффектами. Недавнее исследование показало, что понижение уровня метионина хорошо переносится в течение трех недель без существенных побочных эффектов у здоровых добровольцев (Gao et al., 2019). Помимо обнаружения у него противоопухолевых свойств, ОПМ представляет собой интересную перспективу как способ избирательно влиять на метаболизм в раковых клетках посредством диетического вмешательства.
Метаболизм цистеина
Цистеин, который может быть синтезирован из метионина в процессе транссульфурации или полученан клеткой в своей окисленной форме — в виде цистина — через антипортер аминокислот системы Xc, способен ограничивать продукцию глутатиона и, следовательно, может играть важную роль в поддержании окислительно-восстановительного гомеостаза клетки (Zhu et al., 2019). Показано, что некоторые виды рака активируют систему Хc в условиях окислительного стресса (Polewski et al., 2016), а истощение запасов внутриклеточного цистеина может привести к окислительной, железозависимой форме неапоптотической гибели клеток, называемой ферроптозом (Dixon et al., 2012). Раковые клетки часто демонстрируют более высокие уровни образования активных форм кислорода наряду с повышенной интенсивностью потребления железа, исходя из чего было высказано предположение, что фармакологическая индукция ферроптоза может быть одной из селективных стратегий лечения онкозаболеваний (Hassannia et al., 2019). И хотя на сегодняшний день это выглядит очень перспективным, исследователям еще предстоит выяснить, могут ли изменения пищевых стратегий, такие как ограничение потребления цистеина/цистина, изменения в потреблении антиоксидантов или добавок железа, влиять на чувствительность опухоли к ферроптозу и окислительно-восстановительным процессам (Piskounova et al., 2015; Sayin et al., 2014).
Аминокислоты с разветвленной цепью (BCAA)
Лейцин, изолейцин и валин образуют группу BCAA, которые, как известно, функционируют и как промежуточные звенья различных биохимических реакций, и как компоненты чувствительных к определенным нутриентам сигнальных путей, участвующих в канцерогенезе. В ряде тканей BCAA катаболизируются аминотрансферазой аминокислот с разветвленной цепью 1 (BCAT-1) (Neinast et al., 2019). Используя кетоглутарат в качестве кофактора, BCAT1 катализирует превращение BCAA в глутамат и их соответствующие кетокислоты с разветвленной цепью (BCKA). Затем BCKA подвергаются декарбоксилированию в митохондриях с образованием сложных эфиров ацил-КоА, которые могут поступать в цикл трикарбоновых кислот (ЦТК).
Данный путь обеспечивает альтернативу утилизации глюкозы в ЦТК, и, соответственно, гиперэкспрессия BCAT1 была обнаружена во многих типах опухолей, включая глиобластомы (Toñjes et al., 2013), рак молочной железы и некоторые злокачественные новообразования системы крови (Raffel et al., 2017). Как на добровольцах, так и на мышиных моделях хронического миелоидного лейкоза (ХМЛ) было показано, что для роста опухоли необходима аберрантная метаболическая активность BCAT1. Однако механизмы, которые регулируют обмен BCAA, по-видимому, сильно различаются в разных типах опухолей. Исследование протоковой аденокарциномы поджелудочной железы (ПАДЖ) и немелкоклеточного рака легкого (НМРЛ) на мышиных моделях показало значительные различия в способах утилизации BCAA, причем получаемый из BCAA азот способствовал синтезу заменимых аминокислот и ДНК в опухолях НМРЛ (Mayers et al., 2016). Таким образом, как генетические аспекты, так и характеристика микроокружения опухоли формируют те или иные особенности метаболизма BCAA в различных видах злокачественных образований. Эти наблюдения показывают, что ограничение поступления в организм BCAA с помощью диетических манипуляций представляет определенный клинический интерес (Sivanand and Vander Heiden, 2020). И хотя это еще предстоит подробно изучить на лабораторных моделях рака, исследования на мышах показали, что поступивший с пищей валин играет ключевую роль в поддержании гемопоэтических стволовых клеток (ГСК) в костномозговых нишах. Подобным образом валин может использоваться и стволовыми клетками опухолей, дающими начало злокачественным новообразованиям крови (Taya et al., 2016). BCAA подробно изучались в контексте ожирения и инсулинорезистентности, их повышенное содержание было ассоциировано с системными метаболическими заболеваниями. Уровень циркулирующих в плазме BCAA связан с разрушением скелетных мышц в результате ассоциированный с раком кахексии — состояния истощения, наблюдаемого у пациентов с запущенными онкологическими заболеваниями. Использование экзогенных добавок BCAA показало ограниченные эффекты предотвращения потери мышечной массы в результате раковой кахексии. Интересно также, что согласно данным недавнего исследования, системное повышение уровня BCAA происходит до развития ПАДЖ и на мышиных моделях, и у добровольцев. Это позволяет предполагать, что высвобожденные из тканей BCAA могут служить источниками питательных веществ для опухолевых клеток (Mayerset et al., 2014).
Метаболизм триптофана
Микроокружение опухоли состоит из опухолевых клеток, внеклеточного матрикса, а также иммунных и стромальных клеток. Несмотря на то, что взаимодействие между различными компонентами этой среды очень сложное, катаболизм триптофана считается наиболее важным процессом, приводящим к подавлению противоопухолевой активности иммунных клеток. В частности, процесс превращения триптофана в его иммуномодулирующий метаболит, кинуренин, в опухолевых клетках происходит с помощью активности фермента индоламин-2,3-диоксигеназы (ИДО) (Uyttenhove et al., 2003). В печени и головном мозге эта катаболическая реакция осуществляется триптофан-2,3-диоксигеназой (ТДО), что влияет на общий уровень триптофана. Хотя ИДО широко вовлечена в процесс канцерогенеза, было также показано, что ТДО в огромных количествах экспрессируется в злокачественных глиомах, что свидетельствует о роли метаболизма триптофана в образовании и прогрессии опухолей. Механизмы, лежащие в основе этих процессов, на сегодняшний день изучены недостаточно, но, как предполагается, могут включать вовлечение арильных углеводородных рецепторов (Opitz et al., 2011). Такой скоординированный ответ, регулируемый обменом триптофана, может позволить опухолевым клеткам изменять характер взаимодействий с иммунной системой, что представляет значительный интерес в качестве возможной мишени для таргетной терапии рака или улучшения понимания диетотерапии онкозаболеваний (Platten et al., 2019).
Метаболизм серина и глицина
Взаимодействие фолатного цикла и обменного пути метионина образует основу системы процессинга одноуглеродных единиц, которые служат молекулярными строительными блоками и необходимы для биосинтеза липидов, нуклеотидов и белков, а также является основным компонентом поддержания окислительно-восстановительного гомеостаза (Locasale, 2013; Yang et al., 2016). Данные пути одноуглеродного метаболизма объединяет зависимость от поступления различных аминокислот, включая серин и глицин, для создания функциональных выходов, как показано на рисунке 2. Соответственно, ограничение поступления серина и глицина из пищи замедляло рост опухоли в ряде как автохтонных мышиных моделей, так и при использовании ксенотрансплантатов (Labuschagne et al., 2014; LeBoeuf et al., 2020; Maddocks et al., 2017; Sullivan et al., 2019). Хотя серин и глицин могут синтезироваться в организме de novo в процессе гликолиза, повышенные уровни как поступления серина из пищи, так и его биосинтеза позволяют предположить, что одноуглеродный метаболизм при онкозаболеваниях может быть изменен. Значение его многогранно и включает синтез нуклеотидов, синтез сфинголипидов, поддержание функции митохондрий, процессы метилирования и обеспечение окислительно-восстановительного гомеостаза (Gao et al., 2018; Reid et al., 2018).
Метаболизм аргинина, гистидина, аспартата и аспарагина
Опухолевые клетки часто демонстрируют специфическую ауксотрофию (неспособность к синтезу того или иного соединения или вещества — прим. пер.) и в отношении других аминокислот. Зависимость раковых клеток от экзогенного поглощения этих питательных веществ, по-видимому, является своего рода слабым местом в их метаболизме, прицельное воздействие на которое может синергически сочетаться с фармакологической терапией в будущем. В случае аспарагина было показано, что его внутриклеточные концентрации определяют интенсивность поглощения других аминокислот, включая серин, аргинин и гистидин, выступая в качестве фактора обмена (Krall et al., 2016). Действительно, возможно, благодаря активации пути mTORC1, а также влиянию на синтез нуклеотидов, поддержание количества внутриклеточного аспарагина служит важным регулятором пролиферации раковых клеток (Pavlova et al., 2018; Zhang et al., 2014). Поскольку опухолевые клетки часто ведут себя как аспарагиновые ауксотрофы, при введении аспарагиназы, снижающей биодоступность экзогенного аспарагина, был продемонстрирован определенный успех в подавлении пролиферации раковых клеток и снижении метастатического потенциала опухоли (Hettmer et al., 2015; Knott et al., 2018). Известно, что раковые клетки импортируют аргинин для использования его в самых разных процессах, включая регуляцию пролиферации клеток, модификацию белковых молекул и иммуномодуляцию (Qiu et al., 2015). Аномальная экспрессия и функция ферментов, участвующих в катаболизме аргинина, в частности, аргиносукцинатсинтазы (АСС), были описаны при ряде онкологических заболеваний. Использование ауксотрофии аргинина и изменений метаболизма в качестве мишеней различных воздействий оказались успешными в доклинических моделях с ксенотрансплантатами; однако, чтобы определить, могут ли данные свойства распространяться на другие опухоли, необходимы дальнейшие исследования. Гистидин также задействован в модуляции эффективности и токсичности при лечении метотрексатом — метаболитной терапии, которая, как известно, препятствует образованию тетрагидрофолата (ТГФ) из дигидрофолата (ДГФ) в рамках фолатного цикла. Учитывая, что ТГФ является важным кофактором для функционирования ряда ферментов, участвующих в процессе пролиферации клеток, метотрексат может подавлять рост опухоли. Пул доступного ТГФ также может быть уменьшен еще больше за счет усиления метаболизма гистидина, который осуществляется посредством активности ТГФ-зависимой формимидоилтрансферазы/циклодеаминазы (ФТЦД). Фактически было показано, что диеты, богатые гистидином, повышают эффективность лечения метотрексатом и снижают токсичность, что было продемонстрировано на мышиных моделях (Kanarek et al., 2018).
Микробиота, диета и рак
Обсуждение диет остается незавершенным без рассмотрения кишечного микробиома — консорциума из триллионов микроорганизмов, которые вносят значительный, но все еще не в полной мере изученный вклад в обмен веществ хозяина. Микробный состав кишечника, вероятно, претерпел значительные изменения в ходе истории человечества, поскольку рацион людей менялся как на протяжении краткосрочных, так и долгосрочных периодов времени; при этом «западная диета» с высоким содержанием жиров и углеводов оказалась ассоциирована с развитием большей популяции микробиоты, расщепляющей полисахариды для извлечения калорий и обеспечения необходимой энергии, получаемой из пищи, а ОК — с повышением уровня пробиотических микроорганизмов и подавлением роста провоспалительных штаммов (Turnbaugh et al., 2009; Zheng et al., 2018). Изменения в составе микрофлоры, колонизирующей кишечник, также связаны с метаболическими фенотипами у каждого конкретного хозяина (Perry et al., 2016; Turnbaugh et al., 2009). И хотя роль микробиома в процессе канцерогенеза еще недостаточно определена, обусловленные диетой изменения в микробиоте кишечника важны для формирования, прогрессии, а также успешной терапии опухоли. В случае колоректального рака (КРР) микробный дисбаланс, или дисбиоз, между опухолевой тканью и прилегающей слизистой оболочкой в ряде исследований был ассоциирован с обогащением новообразования специфическими микроорганизмами, такими как Fusobacterium nucleatum, Escherichia coli и Bacteroides fragilis (Collins et al., 2011; Iida et al., 2013; Nakatsu et al., 2015). Кроме того, последние данные продемонстрировали миграцию комменсальной микробиоты в метастазы КРР (Bullman et al., 2017), а также влияние микроорганизмов на модуляцию противоопухолевого иммунитета и ответа на терапию (Jin et al., 2019; Routy et al., 2018; Viaud et al., 2013). Кроме того, недавно полученные данные позволяют предположить, что многие свойства опухолей могут определяться составом микробиома, который можно охарактеризовать по присутствующей в периферической крови бесклеточной ДНК (Poore et al., 2020). Также появляются данные о механизмах, связывающих микроорганизмы с опухолевыми клетками, такие как недавнее исследование обмена NAD+, которое демонстрирует, что опухолевые клетки могут обеспечивать необходимый для них уровень синтеза NAD за счет питательных веществ, полученных от микроорганизмов (Shats et al., 2020). Учитывая, что микробиом, как известно, осуществляет контроль над множеством функций клетки и целого организма, интересно предположить, что могут существовать и многие другие взаимосвязи между режимом питания и «поведением» опухоли (Cani, 2018).
Заключение
Наше понимание различных аспектов диеты и питания все еще находится в зачаточном состоянии, отсутствие знаний распространяется также и на здоровье человека. В популярной культуре и среди ученых широко обсуждается вопрос о том, что же представляет собой здоровое питание. Ответ варьируется от низкоуглеводных КД до рационов с высоким содержанием углеводов, но с низким — насыщенных жиров, таких как типичные растительные диеты. Еще менее ясно, как эти диеты влияют на обмен веществ на клеточном уровне. Хотя исследования, в которых используются технологии метаболомики и отслеживания стабильных изотопов, привели к новым разработкам по фундаментальным вопросам диеты, многое еще предстоит понять. В самом деле, необходимы контролируемые исследования по потреблению пищи с участием различных групп населения, чтобы оценить широту вариабельности между пациентами при нормальном обмене веществ. Без этого трудно понять метаболизм опухоли и влияние на него различных типов рациона. Тем не менее, есть несколько интересных примеров того, как конкретные диеты могут прицельно воздействовать на определенные аспекты метаболизма опухоли и приводить к значимым последствиям, которые можно интерпретировать на молекулярном уровне. Эти эффекты могут происходить как системно, как, по-видимому, в случае снижающих инсулин противоопухолевых эффектов КД, так и автономно на уровне отдельных клеток, что, вероятно, имеет место при ограничении потребления серина/глицина или метионина. Воздействуя на усвоение питательных веществ в организме, модуляция режима питания может оказывать большое влияние на метаболизм опухолевых клеток, что может происходить само по себе или в сочетании с терапией. Эти наблюдения, хотя и являются многообещающими для определения потенциальных будущих терапевтических мишеней, требуют более глубокого понимания, которого мы ожидаем достигнуть в ближайшие годы.