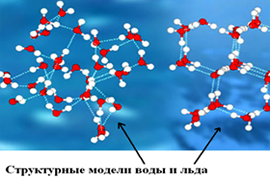
Чем отличаются молекулы воды и молекулы льда
Разница между водой и льдом
В ключевое отличие между водой и льдом заключается в том, что вода не имеет регулярного расположения молекул, тогда как лед имеет определенную кристаллическую структуру. С начальных этапов эволюции Зе
Содержание:
В ключевое отличие между водой и льдом заключается в том, что вода не имеет регулярного расположения молекул, тогда как лед имеет определенную кристаллическую структуру.
С начальных этапов эволюции Земли вода была основной частью Земли. На сегодняшний день вода покрывает более 70% поверхности земли. Отсюда большая часть воды находится в океанах и морях; что составляет около 97%. Реки, озера и пруды содержат 0,6% воды, и около 2% приходится на полярные ледяные шапки и ледники. Некоторое количество воды находится под землей, а незначительное количество находится в газовой форме в виде паров и облаков. Среди них менее 1% воды осталось для непосредственного использования человеком. Эта чистая вода также загрязняется день ото дня, и должен быть надлежащий план экономии воды.
Что такое вода?
Что такое лед?
Водородные связи важны для создания этой упорядоченной твердой структуры во льду. Водородные связи удерживают H2Молекулы O находятся на определенном расстоянии друг от друга, образуя кристаллическую структуру. При этом объем той же массы H2O расширяется (это означает, что при замерзании масса воды становится сравнительно большим, образуя лед). Поскольку при замерзании объем воды увеличивается, плотность льда ниже, чем у воды. Следовательно, он может плавать на воде. Это предотвращает замерзание воды на дне водоемов в зимний период, тем самым защищая водную жизнь.
В чем разница между водой и льдом?
Кроме того, мы можем определить разницу между водой и льдом по их объему и плотности. То есть; при той же массе объем воды сравнительно меньше льда. Потому что плотность воды выше, чем у льда. Приведенная ниже инфографика о разнице между водой и льдом показывает больше различий между ними.
Чем отличаются молекулы воды и молекулы льда?
Понятие молекулы ( и производные от него представления о молекулярном строении вещества, структуры собственно молекулы) позволяет понимать свойства веществ создающих мир. Современные, как и ранние, физико-химические исследования опираются и базируются на грандиозном открытие об атомно-молекулярном строении вещества. Молекула – единая «деталь» всех веществ, существование которой предположил ещё Демокрит. Потому именно её структура и взаимосвязь с другими молекулами (образуя определенное строение и состав) и определяет/объясняет все различия между веществами, их видом и свойствами.
Сама молекула, будучи не самой мельчайшей составной частью вещества (коей является атом) имеет определенную структуру, свойства. Определяется структура молекулы числом вхожих в неё определенных атомов и характером связи (ковалентной) между ними. Состав этот неизменен, даже если вещество преобразуется в другое состояние(как примеру, происходит с водой – об этом пойдет речь дальше).
Характеристики воды, её состояния
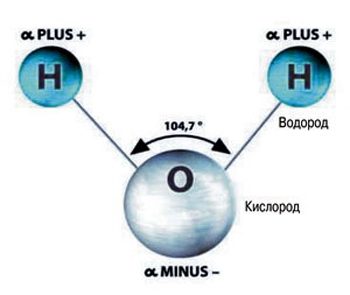
Состав такого вещества, как вода (равно как и её химическая формула) знаком каждому. Каждую её молекулу составляют три атома: атом кислорода, обозначающийся буквой «О», и атомы водорода – латинская «Н», в количестве 2-х. Форма молекулы воды не симметрична (схожа с равнобедренным треугольником).
Вода, как вещество, составляющие её молекулы, реагирует на внешнюю «обстановку», показатели окружающей среды — температуру, давление. Зависимо от последних вода способна изменять состояние, которых три:
Помимо данных различий, естественно, разнятся и способы «перехода» вещества из одного состояния (жидкого) в другие. Эти переходы и трансформируют вещество, и провоцируют передачу энергии (выделение/поглощение). Среди них есть процессы прямые – преобразование жидкой воды в пар (испарение), в лед (замерзание) и обратные – в жидкость из пара (конденсация), из льда (таяние). Также и состояния воды — парообразное и лед — могут трансформироваться друг в друга: возгонка – лед в пар, сублимация – обратный процесс.
Специфичность льда как состояния воды
Широко известно, что лед замерзает ( трансформируется из воды) при пересечении температурой в сторону уменьшения границы в ноль градусов. Хотя, в этом всем понятном явлении, есть свои нюансы. К примеру, состояние льда неоднозначно, различны его виды, модификации. Отличаются они первоочередно условиями, при которых возникают – температурой, давлением. Таких модификаций насчитывается аж пятнадцать.
Лед в разных своих видах имеет различное молекулярное строение (молекулы же неотличимы от молекул воды). Природный и естественный лед, в научной терминологии обозначающийся как лед Ih — вещество с кристаллической структурой. То есть, каждая молекула с четырьмя окружающими её «соседками» (расстояние между всеми равное) создают геометрическую фигуру тетраэдр. Другие фазы льда обладают более сложной структурой, к примеру высокоупорядоченная структура тригонального, кубического или моноклинного льда.
Основные отличия льда от воды на молекулярном уровне
Первое и напрямую не относящееся к молекулярному строению воды и льда различие между ними – показатель плотности вещества. Кристаллическая структура, присущая льду, образовываясь, способствует одновременному уменьшению плотности (с показателя почти в 1000 кг/м³ до 916,7 кг/м³). А это стимулирует увеличение объема на 10%. 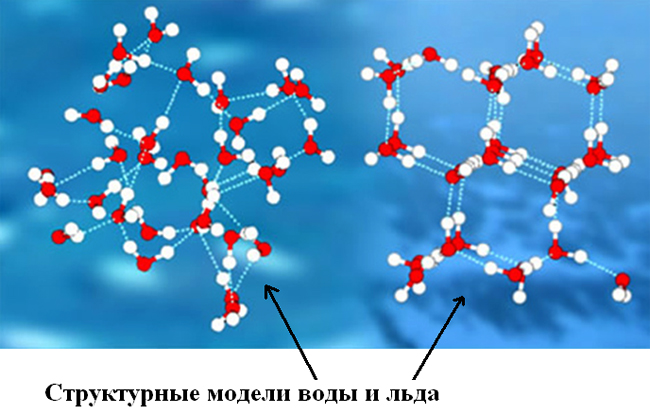
Основное же отличие в молекулярном строении этих агрегатных состояний воды (жидкого и твердого) в количестве, виде и силе водородных связей между молекулами. Во льду же (твердом состоянии) ими объединены пять молекул, а собственно связи водородные прочнее.
Отличает вещество воды в разных её состояниях (агрегатных) не только структура расположения молекул (молекулярное строение), но и движение их, сила взаимосвязи/притяжения между ними. Молекулы воды в жидком состоянии достаточно слабо притягиваются, обеспечивая текучесть воды. В твердом же льду наиболее сильно притяжение молекул, потому и мала их двигательная активность (она обеспечивает постоянство формы льда).
Чем отличаются молекулы воды и молекулы льда?
Молекула воды
Все живые организмы на планете Земля состоят из воды. Этажидкость встречается везде и без нее жизнь невозможна. Большая ценность водыобусловлена уникальными свойствами жидкости и простым составом. Чтобыразобраться во всех особенностях, рекомендуется детально ознакомиться со структуроймолекулы воды.
Модель строения воды
Молекула воды включает два атома водорода (Н) и один атомкислорода (О). Элементы, из которых состоит жидкость, определяют всюфункциональность и особенности. Модель молекулы воды имеет форму треугольника.Вершину этой геометрической фигуры представляет крупный элемент кислорода, авнизу находятся небольшие атомы водорода.
Молекула воды обладает двумя положительными и двумяотрицательными полюсами зарядов. Отрицательные заряды формируются из-за излишкаэлектронной плотности у атомов кислорода, а положительные – из-за нехваткиэлектронной плотности у водорода.
Неравномерное распределение электрических зарядов создаетдиполе, где диполярный момент составляет 1,87 дебай. Вода обладает способностьюрастворять вещества, поскольку ее молекулы пытаются нейтрализоватьэлектрическое поле. Диполя приводят к тому, что на поверхности погруженных вжидкость веществ становятся слабее межатомные и межмолекулярные связи.
Вода отличает большой устойчивостью при растворении прочихсоединений. В обычных условиях из 1 млрд молекул только 2 распадаются, а протонпереходит в строение иона гидроксония (образуется при растворении кислот).
Вода не меняет свой состав при взаимодействии с другимивеществами и не влияет на структуру этих соединений. Такая жидкость считаетсяинертным растворителем, что особо важно для живых организмов.
Полезные веществапоступают к различным органам через водные растворы, поэтому важно, чтобы ихсостав и свойства оставались неизменными.
Вода сохраняет в себе память орастворенных в ней веществах и может применяться многократно.
Каковы особенности пространственной организации молекулыводы:
Атомы водорода соединяются с атомами кислорода и образуютмолекулу воды с ковалентной связью. Водородные соединения более сильные,поэтому, когда они разрываются, то молекулы присоединяются к другим веществам,способствуя их растворению.
Это свойство подтверждается и большой теплотойпарообразования, что делает жидкость хорошим энергоносителем. Вода – отличныйрегулятор температуры, способен нормализировать резкие перепады этогопоказателя. Теплоемкость жидкости повышается, когда ее температура 37 градусов.Минимальные показатели соответствуют температуре человеческого тела.
Относительная молекулярная масса воды составляет 18.Рассчитать этот показатель достаточно легко. Следует заранее ознакомиться сатомной массой кислорода и водорода, которая равна 16 и 1 соответственно. Вхимических задачах нередко встречается массовая доля воды. Этот показательизмеряется в проценте и зависит от формулы, которую требуется рассчитать.
Строение молекулы в различных агрегатных состояниях воды
В жидком состоянии молекула воды состоит из моногидроля,дигидроля и тригидроля. Количество этих элементов зависит от агрегатногосостояния жидкости. Пар включает одну H₂O – гидроль (моногидроль). Две H₂Oобозначают жидкое состояние – дигидроль. Три H₂O включает лед.
Агрегатные состояния воды:
При этом существуют переходные состояния жидкости, например,при испарении или замерзании. Для начала требуется разобраться, отличаются лимолекулы воды от молекул льда. Так замерзшая жидкость имеет кристаллическуюструктуру. Модель льда может иметь форму тетраэдр, тригональной и моноклиннойсингонии, куба.
Обычная и замерзшая вода отличаются плотностью.Кристаллическая структура приводит к меньшей плотности и увеличению объема.Основное различие между жидким и твердым состоянием – это количество, сила иразновидность водородных связей.
Состав не меняется ни в одном агрегатном состоянии.Отличается строение и движение составных частей жидкости, сила связей водорода.Обычно молекулы воды слабо притягиваются друг к другу, размещаются хаотично,поэтому жидкость такая текучая. Лед отличается более сильным притяжением, таккак создается плотная кристаллическая решетка.
Многих интересует, одинаковы ли объемы и состав молекулхолодной и горячей воды. Важно запомнить, что состав жидкости не меняется ни водном из агрегатных состояний. Молекулы при нагревании или остывании жидкостиотличаются расположением. В холодной и горячей воде разные объемы, так как в первомслучае структура упорядоченная, а во втором – хаотичная.
Когда лед тает, то его температура не меняется. Только послетого, как жидкость меняется свое агрегатное состояние, показатели начинаютподниматься. Для таяния требуется определенное количество энергии, котороеназывается удельной теплотой плавления или лямбда воды. Для льда показательравен 25000 Дж/кг.
Строение молекул воды, их связи и свойства. Влияние внешних физических воздействий на молекулы воды?
В данной статье поговорим про строение молекул воды, их связи и свойства.
Забежав немного вперёд напишу:
Задача, выполняемая Ячейкой Мэйера — «лёгкое» разложение молекул воды под действием электрического тока, сопровождаемого электромагнитным излучением.
Для её решения разберёмся, что же вода из себя представляет? Каково строение молекул воды? Что известно о молекулах воды и их связях? В статье, я использовал различные публикации, имеющиеся в достаточном количестве в Интернете, но они размножены в большом количестве, поэтому, кто их автор, мне не понятно и ссылаться на источник с моей стороны глупо. Мало того, эти публикации «запутаны» до безобразия, что затрудняет восприятие, и значительно увеличивает время изучения. Анализируя статьи, я извлёк то, что может направить Вас на понимание того, с чем мы будем иметь дело в процессе добычи дешёвой энергии, а точнее в процессе разрыва молекул воды на составляющие – водород и кислород.
Итак, рассмотрим наиболее весомые понятия о строении молекул воды!
Вода — вещество, основной структурной единицей которого является молекула H2O, состоящая из одного атома кислорода и двух атомов водорода.
Молекула воды имеет структуру как бы равнобедренного треугольника: в вершине этого треугольника расположен атом кислорода, а в основании его — два атома водорода.
Угол при вершине составляет 104°27, а длина стороны — 0,096 нм. Эти параметры относятся к гипотетическому равновесному состоянию молекулы воды без ее колебаний и вращений.
Геометрия молекулы воды и её электронные орбиты изображены на рисунке.
Молекула воды представляет собой диполь, содержащий положительный и отрицательный заряды на полюсах.
Если «свободную» молекулу воды — не связанную с другими молекулами, поместить в электрическое поле, то она «повернётся» отрицательными полюсами в сторону положительной пластины электрического поля, а положительными полюсами в сторону отрицательной пластины. Именно этот процесс изображён на рисунке 1, позиция — 3В, поясняющем работу Ячейки Мэйера в статье «Вода вместо бензина».
Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура — правильный тетраэдр. Таково строение самой молекулы воды.
Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4-мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Именно такое упорядоченное состояние молекул воды можно назвать «структурой».
Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28′, направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру.
Когда лёд плавится, его тетрагональная структура разрушается и образуется смесь полимеров, состоящая из три-, тетра-, пента-, и гексамеров воды и свободных молекул воды.
В жидком состоянии вода – неупорядоченная жидкость. Эти водородные связи — спонтанные, короткоживущие, быстро рвутся и образуются вновь.
Группируясь, тетраэдры молекул воды образуют разнообразные пространственные и плоскостные структуры.
И из всего многообразия структур в природе базовой является гексагональная (шестигранная) структура, когда шесть молекул воды (тетраэдров) объединяются в кольцо.
Такой тип структуры характерен для льда, снега и талой воды, которую из-за наличия такой структуры, называют «Структурированной водой». О полезных свойствах структурированной воды пишут много, но не это тема нашей статьи.
Логично будет, что структурированная вода — образующая гексагональные структуры является наихудшим вариантом структуры воды, которую возможно использовать для разложения на водород и кислород.
Поясню почему: Молекулы воды, группируясь по шесть в гексамер, имеют электронейтральный состав — у гексамеров нет положительных и отрицательных полюсов. Если поместить гексамер структурированной воды в электрическое поле, то он не будет никак на него реагировать.
Поэтому логически можно заключить, что необходимо, чтобы в воде было как можно меньше организованных структур. На самом деле, всё наоборот, гексамер — это не завершённая структура, есть ещё более интересное понятие — кластер.
Структуры объединённых молекул воды называют кластерами, а отдельные молекулы воды — квантами. Кластер — объёмное соединение молекул воды, в том числе гексамеров, у которого имеются и положительные и отрицательные полюса.
В дистиллированной воде кластеры практически электронейтральны, потому что в результате испарения, произошло разрушение кластеров, а в результате конденсации, сильные связи между молекулами воды не появились. Однако, их электропроводность можно изменить.
Если дистиллированную воду помешать магнитной мешалкой, связи между элементами кластеров будут частично восстановлены и электропроводность воды изменится. Другими словами, дистиллированная вода – это вода, у которой минимальное количество связей между молекулами.
В ней диполи молекул находятся в разориентированном состоянии, поэтому диэлектрическая проницаемость дистиллированной воды очень высока, и она плохо проводит электрический ток.
В то же время, для повышения управляемости кластерами воды, в неё добавляют кислоты или щёлочи, которые участвуя в молекулярных связях, не позволяют молекулам воды образовывать гексагональные структуры, образуя при этом электролиты. Дистиллированная вода является противоположностью структурированной воде, в которой связей между молекулами воды в кластеры огромное количество.
На моём сайте имеются, и будут появляться статьи, которые, на первый взгляд «отдельные» и не имеют никакого отношения к другим статьям. На самом деле, большинство статей сайта имеет взаимосвязь в одно целое.
В данном случае, описывая свойства дистиллированной воды, я использую Дипольную теорию электрического тока, это альтернативное понятие об электрическом токе, которое подтверждается и наукой и практикой лучше, чем классическое понятие.
При воздействии энергии источника электрического тока, все диполи атомов воды (как проводника) поворачиваются, ориентируясь своими одноимёнными полюсами в одном направлении.
Если молекулы воды до появления внешнего электрического поля создавали кластерную (взаимно ориентированную) структуру, то для ориентации во внешнем электрическом поле потребуется минимальное количество энергии источника электрического тока.
Если же структура была не организованной (как у дистиллированной воды), то потребуется большое количество энергии.
Заметьте, «в народе» бытует мнение, что дистиллированная вода и талая вода должны обладать одинаковыми электропроводными свойствами, ведь что у одной, что у другой отсутствуют химические примеси (как правило – соли), их химический состав одинаков, да и строение молекул воды что в талой воде, что в дистиллированной одинаково.
На самом деле всё выглядит наоборот, отсутствие примесей совсем не говорит о свойствах электропроводности воды. Не понимая этого, некоторые люди, «убивают» аккумуляторные батареи ещё на этапе их заправки электролитом, подменяя дистиллированную воду на талую, или просто очищенную через угольный фильтр.
Как правило, заправленный аккумулятор, который куплен на автомобильном рынке служит меньше, чем тот, который вы купили сухозаряженным и разбавив серную кислоту дистиллированной водой, заправили его сами.
Это лишь потому, что «готовый» электролит, или заправленный аккумулятор – это в наше время средство заработка, а чтобы определить какая вода использовалась, надо провести дорогую экспертизу, никто этим не заморачивается. Торгашу не важно, сколько прослужит аккумулятор на твоём авто, а Вам тоже, возиться с кислотой не очень хочется.
Зато, я Вас уверяю, аккумулятор, над которым попотеете Вы, при минусовых температурах будет намного бодрее, чем заправленный из уже готового бутылочного электролита.
Продолжим!
В воде кластеры периодически разрушаются и образуются снова. Время перескока составляет 10-12 секунд.
Так как, строение молекулы воды несимметрично, то центры тяжести положительных и отрицательных зарядов ее не совпадают. Молекулы имеют два полюса — положительный и отрицательный, создающие, как магнит, молекулярные силовые поля.
Такие молекулы называют полярными, или диполями, а количественную характеристику полярности определяют электрическим моментом диполя, выражаемым произведением расстояния l между электрическими центрами тяжести положительных и отрицательных зарядов молекулы на заряд e в абсолютных электростатических единицах: p = l·e
Для воды дипольный момент очень высокий: p = 6,13·10-29 Кл·м.
Кластеры воды на границах раздела фаз (жидкость-воздух) выстраиваются в определенном порядке, при этом все кластеры колеблются с одинаковой частотой, приобретая одну общую частоту.
При таком движении кластеров, учитывая, что входящие в кластер молекулы воды являются полярными, то есть, имеют большой дипольный момент, следует ожидать появления электромагнитного излучения.
Это излучение отличается от излучения свободных диполей, так как диполи являются связанными и колеблются совместно в кластерной структуре.
Частота колебаний кластеров воды и соответственно, частота электромагнитных колебаний может быть определена по следующей формуле:
где a — поверхностное натяжение воды при заданной температуре; М
— масса кластера.
где V — объем кластера.
Объем кластера определяется с учетом размеров фрактальной замкнутой структуры кластера или по аналогии с размерами домена белка.
При комнатной температуре 18°С частота колебаний кластера f равна 6,79·109 Гц, то есть длина волны в свободном пространстве должна составлять λ = 14,18 мм.
Но что, же будет происходить при воздействии на воду внешнего электромагнитного излучения? Поскольку вода является самоорганизованной структурой и содержит как упорядоченные в кластеры элементы, так и свободные молекулы, то при воздействии внешнего электромагнитного излучения будет происходить следующее. При сближении молекул воды (расстояние изменяется от R0 до R1) энергия взаимодействия изменяется на большую величину, чем при их взаимном удалении (расстояние изменяется от R0 до R2).
Но, поскольку молекулы воды имеют большой дипольный момент, то в случае внешнего электромагнитного поля, они будут совершать колебательные движения (например, от R1 до R2). При этом в силу приведенной зависимости приложенное электромагнитное поле будет больше способствовать притяжению молекул и тем самым организованности системы в целом, т.е. образованию гексагональной структуры.
При наличии же примесей в водной среде, они покрываются гидратной оболочкой таким образом, что общая энергия системы стремится принять минимальное значение.
И если общий дипольный момент гексагональной структуры равен нулю, то в присутствие примесей гексагональная структура вблизи них нарушается таким образом, чтобы система приняла минимальное значение, в ряде случаев шестиугольники преобразуются в пятиугольники, и гидратная оболочка имеет форму близкую к шару. Примеси (например, ионы Na+) могут стабилизировать структуру, делать ее более устойчивой к разрушению.
Самоорганизованная система воды при воздействии электромагнитного излучения не будет перемещаться как единое целое, но каждый элемент гексагональной, а в случае примесей локально и другого вида, структуры будет смещаться, т.е. будет происходить искажение геометрии структуры, т.
е. возникать напряжения. Такое свойство воды очень напоминает полимеры. Но полимерные структуры обладают большими временами релаксации, которые составляют не 10-11–10-12 с, а минуты и больше.
Поэтому энергия квантов электромагнитного излучения, переходя во внутреннюю энергию организованной водной структуры в результате её искажений, будет накапливаться ею, пока не достигнет энергии водородной связи, которая в 500–1000 раз больше энергии электромагнитного поля.
При достижении этой величины происходит разрыв водородной связи, и структура разрушается.
Это можно сравнить со снежной лавиной, когда происходит постепенное, медленное накапливание массы, а затем стремительный обвал.
В случае с водой происходит разрыв не только слабой связи между кластерами, но и более сильных связей — в строении молекул воды. В результате этого разрыва могут образовываться Н+, ОН–, и гидратированный электрон е–.
Голубой цвет чистой воды обязан наличию именно этих электронов, а не только рассеянию естественного света.
Заключение
Таким образом, при воздействии электромагнитного излучения с водой происходит накапливание энергии в кластерной структуре до некоторого критического значения, затем происходит разрыв связей как между кластерами, так и других, происходит лавинообразное освобождение энергии, которая может затем трансформироваться в другие типы.
В следующей статье«Разрыв молекул воды на водород и кислород. Закон Ома и Ячейка Мэйера», мы определимся с условиями разрыва молекул воды и разберёмся, как Закон Ома препятствует «нашим желаниям».