Чем определяется валентные возможности атома
Валентные возможности атомов
Атомы химических элементов и их валентные возможности
В начале прошлого века научная общественность была потрясена открытием британского физика Э. Резерфорда, который в своем докладе «Рассеяние α- и β-лучей и строение атома» говорил об открытии атомного ядра.
Данное открытие в тандеме со знанием о электронах сместило главенствующую тогда теорию о валентности, заменив ее на теорию о химических связях.
Однако понятие о валентности не пропало из научного мира. Вклад в научное развитие этого термина внесли Э. Франкленд, Ф. А. Кекуле и А. М. Бутлеров.
Согласно проделанным открытиям, атомы химических элементов состоят из:
Свойства атомов химических элементов определяет количество электронов на их последнем (внешнем) электронном слое. Именно они участвуют в образовании химических связей разных типов. Такие электроны называются валентными.
Валентность — количество связей образованных атомом при участии его валентных электронов.
Для определения валентных возможностей атома необходимо рассмотреть распределение электронов на его энергетических уровнях.
Только атомы образовавшие химические связи могут характеризоваться понятием валентности.
Валентность обозначают римскими цифрами от I до VIII.
Число валентных электронов или число общих электронных пар определяет валентность.
Понятие валентности сопряжено со степенью окисления и часто совпадает с его значением.
Чем определяются, какие факторы влияют
Валентность атома определяется количеством валентных электронов:
Атомы могут иметь основное и возбужденное состояние, из-за чего большинство химических элементов имеют переменную валентность.
В основном состоянии валентность зависит от неспаренных электронов последнего (иногда и предпоследнего) энергетических уровней. Обычное состояние фиксируется в Периодической таблице Менделеева.
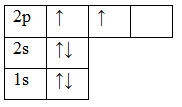
Например, валентность углерода в основном состоянии равна II из-за двух неспаренных электронов на 2p-орбитали.
Дополнительная энергия, которую может получать атом, приводит его в возбужденное состояние. В таком случае уже соединенные электроны могут распариваться и участвовать в образовании новых связей. Валентность повышается.
Валентность углерода в возбужденном состоянии может повышаться до четырех, так как в таком состоянии у него распариваются 2s-электроны.
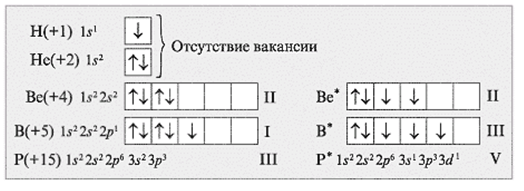
В формуле возбужденное состояние атома обозначается звездочкой.
Определение валентности элемента по электронно-графическим формулам
Для определения количества электронов на энергетических уровнях необходимо полагаться на номер и место химического элемента в Периодической системе Д. И. Менделеева.
Определив количество электронов, необходимо распределить их по свободным орбиталям в порядке заполнения по шкале энергии:
В одной ячейке или на одной орбитали могут располагаться либо 1 электрон, либо 2 электрона с противоположными спинами — разными направлениями вращения.
Орбитали разных уровней могу размещать в своих свободных ячейках разное количество электронов:
По количеству электронов, оставшихся неспаренными в ячейках, можно узнать валентность атомов химических элементов. Электронные формулы обычно записываются не полностью, а в кратком варианте, указывая только крайние электронные уровни каждого слоя.
Можно сформулировать следующие закономерности электронного строения атома:
Селен, углерод, фосфор, сера, азот, хлор и другие примеры
Рассмотрим заполнение электронных уровней на примерах.
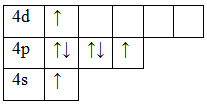
Углерод С обладает номером 6 в Периодической системе химических элементов Д. И. Менделеева, соответственно, он обладает 6 электронами.
Они полностью заполняют уровни 1s / 2s и частично уровень 2р. В обычном состоянии углерод обладает валентностью II. Свободная орбиталь 2р подуровня позволяет орбитали 2s распариваться. Тогда валентность углерода может изменяться на IV.
Азот N обладает номером 7 в ПСХЭ Менделеева и 7 электронами.
Они полностью занимают уровни 1s / 2s и частично 2р. В обычном состоянии азот обладает валентностью III. Перейти в возбужденное состояние путем распаривания 2s-электронов атом не способен, так как относится ко второму периоду, а на втором энергетическом уровне больше нет свободных подуровней и орбиталей, способных принять распарившиеся электроны. Максимальная валентность азота равна IV (за счет образования связи, не только по обменному, но и по донорно-акцепторному механизму), валентность V — не достигается.
Особенностью азота является несоответствие его валентности номеру группы ПС. Азот не обладает валентностью равной V, однако обладает соответствующей степенью окисления +5. НЕсоответствие значений валентностей и степеней окисления атомов азота в некоторых его соединениях является еще одной особенностью этого элемента.
Кислород О обладает номером 8 в ПСХЭ Менделеева и 8 электронами. Возбужденного состояния у кислорода так же нет.
Электроны полностью занимают уровни 1s / 2s и частично 2р. Валентность кислорода равна II — постоянная валентность.
Фтор F обладает номером 9 в ПСХЭ Менделеева и 9 электронами. Они полностью занимают уровни 1s / 2s и частично 2р. Фтор обладает только валентностью I, которая не меняется.
Алюминий Al обладает номером 13 в ПСХЭ Менделеева и 13 электронами. Они полностью занимают уровни 1s / 2s, 2p / 3s и частично уровень 3р. Несмотря на электронную конфигурацию основного (стационарного) состояния атома, валентность I практически не встречается. У алюминия постоянная валентность III (из этого следует что энергия перехода в возбужденное состояние для этого элемента не высока и атомы алюминия всегда пребывают именно в возбужденном состояние).
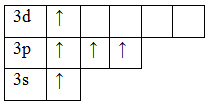
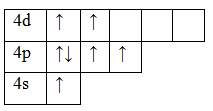
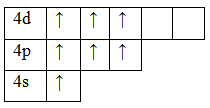
Фосфор P обладает номером 15 в ПСХЭ Менделеева и 15 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s и частично уровень 3р. В обычном состоянии фосфор обладает валентностью III. Распаривание 3s электронов создает возбужденное состояние, в котором пять валентных электронов занимают 5 ячеек, и валентность в таком случае поднимается до V.
Сера S занимает 16 место в ПСХЭ Менделеева и обладает 16 электронами.
Они полностью занимают 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии сера обладает валентностью II. Распаренные электроны могут занимать ячейки подуровня 3d, валентность поднимается до IV и VI.
Хлор Cl обладает номером 17 в ПСХЭ Менделеева и 17 электронами.
Они полностью занимают уровни 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии валентность хлора равна I. В возбужденном состоянии хлор может повышать свою валентность до III, V или VII. Формально данный ХЭ может обладать валентностью IV и VI.
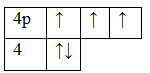
Селен Se обладает номер 34 в ПСХЭ Менделеева, соответственно, он обладает 34 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s, 3p / 4s, 3d, отдав 30 электронов. Еще 4 заполняют орбиталь 4р — (1 ячейка занята полностью, еще 2 содержат по одному электрону). Валентность селена в обычном состоянии равна II.
Однако селен относится к элементам с переменной валентностью, поэтому также может обладать значением валентности IV и VI.
Элементы, имеющие несколько значений валентности
Значение валентности зависит от состояния атома — обычного или возбужденного.
Не все атомы химических элементов могут переходить в возбужденное состояние. По этому признаку они делятся на химические элементы с переменной и постоянной валентностью.
Постоянная валентность наблюдается у щелочных, щелочноземельных металлов, водорода, кислорода, фтора и алюминия.
Все остальные химические элементы обладают переменной валентностью, обусловленными существованием как возбужденных, так и обычных (стационарных) состояний.
Что такое степень окисления
Степень окисления — условная величина электрического заряда атома, входящего в состав химического соединения. Расчет значений этой величины основывается на предположении, что при образовании химической связи происходит полная передача электрона от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. В результате таких представлений каждому атому можно приписать целочисленный электрический заряд. В неорганической химии степень окисления очень часто совпадает с валентностью.
Степень окисления зачастую не совпадает с реальным значением электрического заряда атома, (совпадение наблюдается только в случае ионных соединений). Она используется лишь для систематизации и классификации химических элементов. Степень окисления широко используется при составлении формул, международных названий элементов, объяснения их окислительно-восстановительных свойств.
СО обозначается арабскими цифрами (валентность римскими).
В чем отличие валентности и степени окисления
Валентность и степень окисления не являются равнозначными понятиями, хоть их числовое значение может совпадать.
Валентность используется для определения числа химических связей атома, причем как полярных, так и неполярных.
Степень окисления используется для выражения значения электрического заряда, сосредоточенного на атоме.
Валентные возможности атомов
Всего получено оценок: 349.
Всего получено оценок: 349.
Количество ковалентных связей, которые может образовывать атом, называется валентностью элемента. Валентные возможности атомов обусловлены наличием валентных электронов на внешнем энергетическом уровне.
Строение атома
Все элементы планеты образованы атомами. Это мельчайшие частицы, состоящие из положительно заряженного ядра и отрицательно заряженных электронов. Ядро включает протоны и нейтроны. Электроны, притягиваемые ядром, располагаются и движутся по орбиталям на разном расстоянии от центра. Неравномерное положение электронов относительно ядра называется энергетическими уровнями.
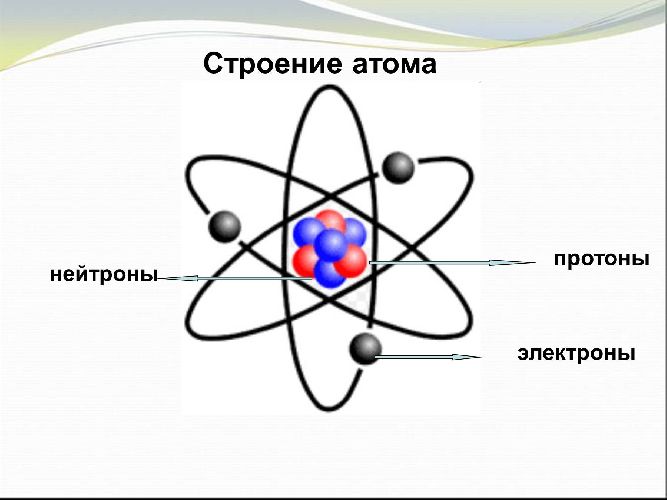
В таблице Менделеева высшая валентность соответствует номеру группы, в которой находится элемент. Количество энергетических уровней совпадает с номером периода, электронов – с порядковым номером.
Валентные возможности
Чтобы оценить валентные возможности атомов химических элементов, необходимо подробно рассмотреть распределение электронов на энергетических уровнях.
Валентность соответствует числу неспаренных электронов, располагающихся на s- и р-орбиталях внешнего энергетического уровня. Валентные электроны атомов элементов, входящих в побочные группы периодической таблицы, располагаются на s-орбитали внешнего уровня и d-орбиталях, образующих внешний подуровень.
В обычном (стационарном) состоянии электроны занимают определённое положение в атоме. Стационарная электронная конфигурация зафиксирована в таблице Менделеева. При возбуждённом состоянии (реакции с другими элементами) энергия атома перераспределяется, и электроны меняют своё положение.
Фосфор находится в V группе, главной подгруппе. Это значит, что в атоме находится пустой d-подуровень. В возбуждённом состоянии спаренные электроны s-уровня распариваются, и один электрон переходит на d-подуровень. Образуется пять свободных, неспаренных электронов. Соответственно, атом фосфора приобретает пятую валентность.
Распаривание происходит с затратой энергии. Расход энергии компенсируется образованием ковалентных связей с высвобождением энергии.
В зависимости от возможности переходить в возбуждённое состояние элементы делятся на две группы: с переменной и постоянной валентностью. Постоянную валентность (соответствует номеру группы) имеют щелочные, щелочноземельные металлы, фтор и алюминий. Переменная валентность присуща всем остальным элементам. Инертные газы не вступают в реакции, поэтому считается, что валентность у них отсутствует.
Что мы узнали?
Валентность показывает, сколько атомов может присоединить элемент посредством ковалентных связей. Значение валентности совпадает с количеством электронов на внешнем энергетическом уровне и соответствует номеру группы периодической таблицы, в которой находится элемент. Из-за возможности переходить в возбуждённое состояние большинство элементов имеют непостоянную валентность. Одинаковую валентность в любом состоянии сохраняют активные металлы и фтор.
Валентные возможности атомов химических элементов
Понятие валентность происходит от латинского слова «valentia» и было известно еще в середине XIX века. Первое «пространное» упоминание валентности было еще в работах Дж. Дальтона, который утверждал, что все вещества состоят из атомов, соединенных между собой в определенных пропорциях. Затем, Франкланд ввел само понятие валентности, которое нашло дальнейшее развитие в трудах Кекуле, который говорил о взаимосвязи валентности и химической связи, А.М. Бутлерова, который в своей теории строения органических соединений связывал валентность с реакционной способностью того или иного химического соединения и Д.И. Менделеева (в Периодической системе химических элементов высшая валентность элемента определяется номером группы).
Валентность элемента определяется числом неспаренных электронов атоме, поскольку они принимают участие в образовании химической связи между атомами в молекулах соединений.
Основное состояние атома (состояние с минимальной энергией) характеризуется электронной конфигурацией атома, которая соответствует положению элемента в Периодической системе. Возбужденное состояние – это новое энергетическое состояние атома, с новым распределением электронов в пределах валентного уровня.
Графические электронные формулы
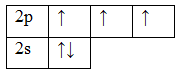
Электронные конфигурации электронов в атоме можно изобразить не только в виде электронных формул, но и с помощью электронно-графических формул (энергетических, квантовых ячеек). Каждая ячейка обозначает орбиталь, стрелка – электрон, направление стрелки (вверх или вниз) показывает спин электрона, свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении. Если в ячейке 2 электрона, такие электроны называются спаренными, если электрон 1 – неспаренный. Например:
Орбитали заполняют следующим образом: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Поскольку на 2p подуровне три орбитали с одинаковой энергией, то каждый из двух электронов занял по одной орбитали. Одна орбиталь осталась свободной.
Определение валентности элемента по электронно-графическим формулам
Валентность элемента можно определить по электронно-графическим формулам электронных конфигураций электронов в атоме. Рассмотрим два атома – азота и фосфора.
Т.к. валентность элемента определяется числом неспаренных электронов, следовательно, валентность азота равна III. Поскольку у атома азота нет свободных орбиталей, для этого элемента невозможно возбужденное состояние. Однако III, не максимальная валентность азота, максимальная валентность азота V и определяется номером группы. Поэтому, следует запомнить, что с помощью электронно-графических формул не всегда можно определить высшую валентность, а также все валентности, характерные для этого элемента.
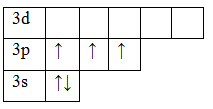
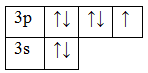
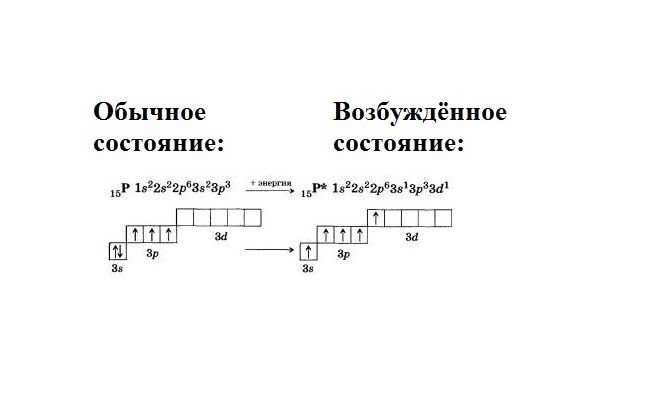
15P 1s 2 2s 2 2p 6 3s 2 3p 3
В основном состоянии атом фосфора имеет 3 неспаренных электрона, следовательно, валентность фосфора равна III. Однако, в атоме фосфора имеются свободные d-орбитали, поэтому электроны, находящиеся на 2s – подуровне способны распариваться и занимать вакантные орбитали d-подуровня, т.е. переходить в возбужденное состояние.
Теперь атом фосфора имеет 5 неспаренных электронов, следовательно для фосфора характерна и валентность, равная V.
Элементы, имеющие несколько значений валентности
Элементы IVA – VIIA групп могут иметь несколько значений валентности, причем, как правило, валентность изменяется ступенчато на 2 единицы. Такое явление обусловлено тем, что в образовании химической связи электроны участвуют попарно.
В отличие от элементов главных подгрупп, элементы В-подгрупп, в большинстве соединений не проявляют высшую валентность, равную номеру группы, например, медь и золото. В целом, переходные элементы проявляют большое разнообразие химических свойств, которое объясняется большим набором валентностей.
Рассмотрим электронно-графические формулы элементов и установим, в связи с чем элементы имеют разные валентности (рис.1).
Задания: определите валентные возможности атомов As и Cl в основном и возбужденном состояниях.
Ответы:
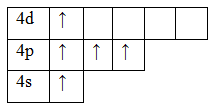
33As 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3
Основное состояние. Валентность равна III.
Возбужденное состояние. Валентность равна V.
17Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Основное состояние. Валентность равна I.
Возбужденное состояние 1. Валентность равна III.
Возбужденное состояние 2. Валентность равна IV.
Возбужденное состояние 3. Валентность равна VII.
Электроотрицательность. Степень окисления и валентность химических элементов
Содержание:
Электроотрицательность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
Степень окисления (СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
При определении СО следует руководствоваться следующими правилами:
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
Валентность. Валентные возможности атомов
Валентность — это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Для определения валентности применяются определенные правила:
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
Таким образом, сера способна проявлять валентности II, IV, VI.
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.