Чем определяется уникальность свойств каждой аминокислоты
В чем сходство и отличия в строении аминокислот? Чем определяется уникальность свойств каждой аминокислоты?



Аминокислоты имеют двойственную природу. Наличие карбоксильной группы определяет их кислотные свойства, а аминогруппа – основные.
Большинство аминокслот – амфотерные вещества. Аминокислоты отличаются друг от друга строением радикалов. Последние могут содержать дополнительную карбоксильную или аминогруппу, а так же атомы серы, способные образовывать между собой дисульфидные связи, включать гидрофильные или гидрофобные группировки атомов.
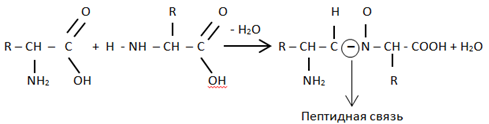
За счет взаимодействия каких групп аминокислот происходит образование пептидных связей? Нарисуйте схему пептидной связи.
Аминогруппа одной аминокислоты соединяется с карбоксильной группой другой аминокислоты, при этом выделяется молекула воды. Между соединившимися аминокислотами возникает ковалентная связь, называемая пептидной.
Уровни организации белковой молекулы. Примеры
Уровни организации белковой молекулы:
— Первичная (полипептидная цепь или последовательность аминокислот)
— Вторичная (нить закручивается в виде спирали) – шелк, ногти, волосы.
— Третичная (фибрилла, нить аминокислот сворачивается в клубок) – инсулин, миаглобин
— Четвертичная (несколько молекул глобул) – гемоглобин.
12. Какие связи стабилизируют вторичную структуру белковой молекулы? Почему вторичная структура пептидов достаточно прочная, хотя поддерживающие ее связи значительно слабее ковалентных? α-спираль и βструктура. Приведите примеры белков с такой структурой.
α-спираль: водородные связи между остатком карбоксильной группы одной аминокислоты и остатком аминогруппы другой аминокислоты. Водородная связь между С=О и N-H.
β-структура: водородные связи между остатками карбоксильных и аминогрупп одной цепи и остатками одноименных групп другой цепи.
N-H группа n-ого аминокислотного остатка взаимодействует с С=О группой другого остатка.
Присутствие водородных связей в значительном количестве делает структуры типа α-спирали и β-складчатого слоя достаточно крепкими (ногти, волосы, шелк)
Что представляет собой третичная структура белковой молекулы? Назовите связи, стабилизирующие третичную структуру. Какие из них более прочные? Приведите примеры белков с такой структурой.
Третичная структура – спираль полипептида, которая свернулась и образовала фибриллу.
β-структура: суперспираль (несколько спиралей, скрученных вместе) водородные и ковалентные связи
α-структура: ионные, водородные, ковалентные, гидрофобные связи
Между β-структурами в основном водородные.
Имеются три вида аминокислот – А, B, С. Составьте несколько вариантов пептидов из пяти аминокислот. Будут ли эти пентапептиды обладать одинаковыми свойствами и структурами? Ответ поясните.
АВСАВ; АВССВ; СААВВ; ВАВСА; САСАВ
Эти пять пентапептидов будут обладать различными свойствами и функциями, т.к. в белках основополагающую роль играет не просто набор аминокислот, но и их последовательность
Что такое денатурация белка? В какой последовательности при денатурации идет разрушение структур белка? Что такое ренатурация?
Денатурация белка – это разрыв связей, стабилизирующих макромолекулы. И структура белка, и его свойства и функции изменяются, т.к. происходит нарушение четвертичной, третичной и вторичной структуры.
Ренатурация – восстановление структуры белка после денатурации.
Чем определяется уникальность свойств каждой аминокислоты
Подробное решение параграф §7 по биологии для учащихся 10 класса, авторов Теремов А.В., Петросова Р.А. Углубленный уровень 2017
Рассмотрите приведенные в табл.3 структурные формулы аминокислот. Какие химические элементы входят в состав этих аминокислот?
Кислород, водород, углерод, азот.
1. В чём сходство и отличия в строении аминокислот? Чем определяется уникальность свойств каждой аминокислоты?
Аминокислоты имеют двойственную природу. Наличие карбоксильной группы определяет их кислотные свойства, а аминогруппы – основные. Большинство аминокислот – амфотерные вещества. Аминокислоты отличаются друг от друга строением радикалов. Последние могут содержать дополнительную карбоксильную группу или аминогруппу, а также атомы серы, способные образовывать между собой дисульфидные связи, включать гидрофильные или гидрофобные группировки атомов.
Все аминокислоты состоит из амино — группы и карбонильной группы, но отличаются радикалом. Каждая аминокислота имеет свой радикал, чем они и отличаются.
2. За счёт взаимодействия каких групп аминокислот происходит образование пептидных связей? Нарисуйте схему пептидной связи.
Связь, образованная между карбоксильной группой одной аминокислоты и аминогруппой другой, называется пептидной связью.
3. Какие связи стабилизируют вторичную структуру белковой молекулы? Почему вторичная структура пептидов достаточно прочная, хотя поддерживающие её связи значительно слабее ковалентных?
Вторичная структура белка – это определённая компоновка полипептидной цепи за счёт водородных связей, возникающих между СО — и NH — группами. Существуют два типа вторичной структуры: α — спираль и (3 — структура (рис. 31).
а — спираль – полипептидная цепь, закрученная спирально и удерживаемая водородными связями, возникающими между группами –СО– и –NH– в витках спирали.
Другой разновидностью вторичной структуры является β — структура. Это слоистая, складчатая структура, образованная параллельно расположен — ными соседними участками полипептидных цепей. Слои в этой структуре также связаны друг с другом водородными связями. (3 — структура встречается в глобулярных белках, где чередуется с а — спиральными участками.
Хотя водородные связи слабее ковалентных, присутствие их в значительном количестве делает структуры типа a — спирали или b — складчатого слоя достаточно прочными.
4. Используя формулы из табл. 3, напишите в тетради структурную формулу трипептида аланил — цистеинил — глицина.
NH2 — CH(CH3) — CO — NH — CH(CH2SH) — CO — NH — CH2 — COOH
5. Что представляет собой третичная структура белковой молекулы? Назовите типы химических связей, стабилизирующих третичную структуру (см. рис. 32). Какие из них наиболее прочные? Объясните почему.
Третичная структура – это пространственная конфигурация белка в виде компактных глобул.
Связи, стабилизирующие третичную структуру белка. В стабилизации третичной структуры играют роль связи между боковыми радикалами аминокислот.
С О H N Водородная связь между аминокислотами.
S S Дисульфидная связь между серусодержащими радикалами цистеина
COO – H3N+ Ионная связь между заряженными группами полипептидной цепи.
R R Гидрофобная связь между неполярными радикалами аминокислот.
Пептидная связь – Сама пептидная связь является частично двойной в силу лактим — лактамной таутомерии. Поэтому вокруг нее невозможно вращение, а сама она по прочности в полтора раза превосходит обычную ковалентную связь.
6. Имеются три вида аминокислот – А, В, С. Составьте несколько вариантов пептидов из пяти аминокислот. Будут ли эти пентапептиды обладать одинаковыми свойствами и структурами? Ответ поясните.
Эти пять вариантов пептидов будут обладать различными свойствами и функциями. Так как в белках основополагающую роль играет, не просто набор аминокислот, но и их последовательность.
Аминокислоты, пептиды и белки. Контрольно-обобщающий урок с учетом подготовки к ЕГЭ
Разделы: Биология
Тема: Аминокислоты, пептиды, белки.
Оборудование: таблицы «Аминокислоты», «Структура белков», плакаты «Структурная классификация аминокислот», штатив, пробирки, колбы, раствор яичного белка, реактивы Na OH, CuSO4, HNO3,медный купорос, ацетат свинца, капельница, пипетка, сухое горючее или грелка.
Основные понятия:
| Пептид Полипептид Белок Протеин I, II, III, IV структура Денатурация Ковалентные связи Водопроводные связи Гидрофобные связи Ионные связи Ван-дер-Вальсовы силы | Мономер Полимер  -спираль -спираль  -спираль -спираль Фибриллярные белки Глобулярные белки Мембранный белок Аминокислота Гидрофильность Гидрофобность Глобула | Основные аминокислоты Кислые аминокислоты Нейтральные аминокислоты Незаменимые аминокислоты Заменимые аминокислоты Дисульфидная связь Фермент Протеом Протеасома Протеомика Белковая инженерия |
План урока
II. Самостоятельная работа. Тест с уровнем знаний А, В, С
IV. Заключение. Резюме
V. Подведение итогов
Оцениваются:
4–5 человек за индивидуальную работу
2 – за решение задач
3–4 – за сообщение
2–4 – за демонстрацию опытов
Все за тестовые задания.
Учитель: Белки являются важными химическими соединениями, входящими в состав всех живых клеток и живых организмов с функционированием белков связано формирование признаков, характерных для всех клеток и всего организма. Нарушение строения и функционирования белков может привести к заболеваниям. Цель нашего урока – обобщить, повторить материал по теме «Пептиды и белки», так как в ЕГЭ встречается много вопросов по данной теме, и выявить пробелы. Работаем индивидуально, попарно, коллективно по желанию.
1. Индивидуальное задание по дидактическим карточкам (письменно)
а) Какими свойствами обладают аминокислоты, если аминогруппа (–NH2) по свойствам аналогична аммиаку, а карбоксильная группа (–CООН) карбоновой кислоте?
б) В чем сходство и отличие в строении этих аминокислот? Какой группой определяется уникальность свойств каждой аминокислоты?
1. Аминокислоты амфотерны, т.к. обладают и кислотными и основными свойствами. NH2 – придает основные свойства, СООН – кислые свойства.
2. Отличаются аминокислоты по радикалу, сходство что имеют все аминогруппу, карбоксильную группу, которые связаны через атом углерода (а–с).
3. Уникальность свойств аминокислот определяется радикалом аланин. Валин – с гидробобным радикалом – неполярные аминокислоты, глицин с гидрофильным радикалом, т.е. полярная аминокислота, заменимая в организме, аланин тоже заменимая, а вапин абсолютно незаменимая.
2. Индивидуальная работа у доски. Решение задач
| Молекулярная масса белка 100000. Определить длину гена. | Решение учащихся: Мм аминокислоты (1) – 100 Ответ: длина гена 1020 нм |
| Участок молекулы ДНК кодирующий часть полипептидной цепи имеет строение Ц–А–Т–Т–Т–Т–Г–А–Т. Определить какими аминокислотами закодирована цепь ДНК | Решение учащихся: Одна амнокислота соответствует 3 нуклеидам, проводим транскрипцию и РНК по принципу комплементарности и по таблице находим аминокислоты 3. Работа с плакатом «Функции белков» на магнитной доске. Определить группу белков по выполняющей функции и исключить лишнее
В это время остальные дети работают коллективно по вопросам. 4. Фронтальная работа по вопросам (вопрос – ответ) 1. Что такое пептиды и белки? Ответ учащегося: Линейные полимеры, состоящие из остатков аминокислот, соединенных друг с другом пептидными связями. Цепи из небольшого числа аминокислотных остатков – пептиды, а цепи состоящие более чем из 10 аминокислотных остатков называются полипептиды или белки. 2. Как вы понимаете простые и сложные белки? Ответ учащегося: Простые содержат только аминокислотные остатки. Сложные содержат еще и неаминокислотные компоненты: производные витаминов, углеводные и липидные компоненты.. 3. Полипептид глюкагон состоит из 29 аминокислотных остатков. На доске представлен фрагмент белка глюкагона. Проанализируйте и ответьте на вопрос: От чего зависит структура и физикохимические свойства белков и пептидов? Ответ учащегося: От числа, химической структуры и порядкового расположения аминокислотных остатков. 4. Какие функциональные группы входят в состав аминокислот? (использование таблицы) 5. Какими свойствами обладают аминокислоты? Ответ учащегося: амфотерными, т.к. аминогруппа придает аминокислоте основные свойства, а карбоксильная группа – кислотные свойства. По радикалу все аминокислоты отличаются друг от друга, т.к. радикал может содержать СН3, СООН, NH2 и другие химические группировки. 6. Как опытным путем доказать, что в белке имеются циклические аминокислоты, радикал которых содержит бензольные кольца. Учащийся показывает опыт. Опыт №1. С помощью ксантопротеиновой реакции (греч. Хаntos – желтый). К 5 каплям 1% раствора яичного белка добавляем 3 капли концентрированной азотной кислоты (осторожно!) и нагреваем. Появился осадок желтого цвета. После охлаждения в пробирку добавляем 5–10 капель 10% раствора едкого натра до появления оранжевого окрашивания (связано с образованием натриевой соли этих нитросоединений). 7. На какие три группы можно классифицировать аминокислоты? Ответ учащегося: структурную, электрохимическую, биологическую. 8. Используя таблицу, ответьте на вопрос: На чем основана каждая классификация а) структурная – на особенностях строения радикала выделяют алифатические незамещенные, амифатические замещенные, циклические аминокислоты (Приложение 2. Таблица №1) б) электрохимическая классификация строится по кислотно-основным свойствам радикала аминокислот (Приложение 2. Таблица № 2)
в) биологическая классификация распределяет аминокислоты на группы по степени незаменимости их для организма человека (Приложение 2. Таблица №3).
Учитель. Кроме 20 стандартных аминокислот в белках живых организмов встречается необычная кислота – селеноцистеин. Она похожа на цистеин, но вместо атома серы в ее радикале расположен атом селена. Селеноцистеин обнаружен у разных организмов от древнейших бактерий до человека. Он входит в состав ферментов и в последние годы рассматривается как 21 белковая кислота, шифруется в ДНК и РНК. В РНК кодируется триплетом УГА. Этот триплет означает окончание трансляции, но если он окружен особыми сочетаниями триплетов, то в рибосоме с этим триплетом взаимодействует транспортная РНК. Так же в организме животных и человека встречаются аминокислоты, которые не входят в состав белков, но имеют важное биологическое значение. Например, тироксин, гормон щитовидной железы является производным тирозина, 9. Физические свойства аминокислот? – Легко растворяются в полярных растворителях (вода, этанол). 10. Какие уровни организации белков имеются в природе и какими связями обусловлены? – Первичная, вторичная, четверичная структуры связи: пептидные, водородные, гидрофобные, ионные, дисульфидные, глобулярные. 11. Каким опытным путем доказать пептидную связь? – Биуретовая реакция на определение пептидной связи. Метод основан на способности пептидной связи в щелочной среде образовывать с сульфидом меди окрашенные комплексные соединения. Опыт 2 (учащийся) В пробирке вносим 5 капель 1% раствора яичного белка (вначале профильтровали через марлю и развели с дистиллированной водой 1:10), три капли 10% раствора гидрооксида натрия и 1 каплю сульфата меди, все перемешиваем. Содержимое приобретает фиолетовое окрашивание. 12. Что собой представляет вторичная структурна белка? – II структура полипептидная цепь уложенная определенным образом с многочисленными водородными связями между атомами пептидных групп. Различают 2 вида структур:
13. Что собой представляет третичная и четвертичная структура белка? – III структура – спираль, уложенная в глобу (шарик). Связи возникают между радикалами. Они могут быть разными:
– IV структура – агрегат, состоящий из 2-х или более полипептидных цепей, связанных между собой нековалентными связями. 14. Приведите примеры белков III и IV структур, относящихся к разным классам.
– IV структура – гемоглобин 15. Какими свойствами обладают белки?
Опыт 3. Денатурация белка Куриный белок растворяем в 150 мл воды. Наливаем в пробирку 4–5 мл раствора и нагреваем на горелке до кипения. Раствор помутнел, т.к. белок денатурировал. Получившийся осадок при нагревании не растворяется при охлаждении и разбавленный водой, значит обратного процесса – ренатурации не происходит, т.к. разрушена I структура белка. 16. Какие функции в клетке выполняют белки? Приведите примеры. 1. Двигательная – актин, миозин, белок мышц; 3. Рецепторная – рецептор инсулина, глюкагон, т.е. белковые гормоны. 4. Защитная – антитела, протромбин, фибриноген; 5. Структурная – кератин, белок, волос, перьев птиц, когтей пресмыкающихся и зверей. 6. Энергетическая – 1 г белка – 17,6 кДж. 7. Ферментативная – не всегда белки ферменты, но все ферменты – белки. 17. Какими свойствами обладают белки и при каких условиях функционируют? 1) высокая эффективность действия 18. В каких случаях белок применяется как противоядие? – При отравлении солями тяжелых металлов. Опыт 4. В две пробирки наливаем по 1–2 капли раствора белка и медленно при встряхивании по каплям добавляем в 1 пробирку насыщенный раствор медного купороса, а в другую – ацетата свинца. В пробирке образовалось труднорастворимое солеобразное соединение белка. Данный опыт иллюстрирует применение белка, как противоядие при отравлении солями тяжелых металлов. II. Самоятоятельная работа. Тест с заданиями уровня А, В, С (проверить можно взаимопроверкой или индивидуально) (Приложение 4) 1. Болезни, обусловленные нарушением синтеза функционирования белков. IV. Заключение. Резюме Белки являются важнейшими химическими соединениями, функционирующими в клетке и организме. Благодаря уникальным особенностям своей пространственной структуры они вступают во взаимодействия друг с другом и другими химическими соединениями, что сопровождается выполнением ими определенной работы. Нормально функционирующие белки принимают непосредственное участие в формировании фенотипа здорового человека. Мутации белок-кодирующих генов ведут к нарушению структуры или функционирования белков, что может явиться причиной болезни. Измененные белки человеческого организма и нативные белки болезнетворных микроорганизмов являются наиболее распространенными мишенями для лекарственного воздействия. Зная механизмы активации генов, транскрипции, трансляции, фолдинга белков и посттрансляционных изменений белков, можно регулировать синтез белков с помощью фармакологических препаратов. В свою очередь, регулируя синтез белков и их активность, можно управлять процессом развития нормальных и патологических признаков. Изучая закономерности формирования третичной структуры белков, ученые конструируют белки с заранее заданными свойствами V. Подведение итогов урока Приложения: Приложение 1: Сообщение учащихся
| ||||||||||









 -аминомаляная кислота (ГАМК) одним из нейромедиаторов.
-аминомаляная кислота (ГАМК) одним из нейромедиаторов. , располагаются в одной плоскости. Пептидная связь характерна для первичной структуры белка, где аминокислоты белков располагаются линейно. I – структура отличается количеством аминокислот, последовательностью и соотношением радикалов. При записи последовательности N конец записывается слева, а С конец справа.
, располагаются в одной плоскости. Пептидная связь характерна для первичной структуры белка, где аминокислоты белков располагаются линейно. I – структура отличается количеством аминокислот, последовательностью и соотношением радикалов. При записи последовательности N конец записывается слева, а С конец справа.