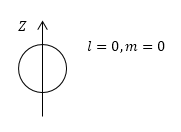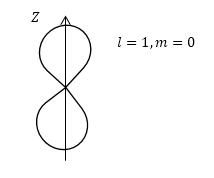Чем определяется плотность электронного облака
Понятие об электронном облаке. Волновая функция.



Электронное облако — это наглядная модель, отражающая распределение электронной плотности в атоме или молекуле. В качестве наглядной модели состояния электрона в атоме в химии принят образ облака, плотность соответствующих участков которого пропорциональна вероятности обнаружить там электрон. Электронное облако рисуется наиболее плотным (там, где наибольшее число точек) в областях наиболее вероятного обнаружения электрона. Так как электрон несет отрицательный заряд, то его орбиталь представляет собой определенное распределение заряда, которое получило название электронного облака.
Вероятность нахождения электрона в определённой области пространства описывается волновой функцией, которая характеризует амплитуду волны, как функцию координат электрона. В наиболее простом случае эта функция зависит от трёх пространственных координат и называется орбиталью. В соответствии с определением волновой функции, орбиталью называется область около ядерного пространства, в котором наиболее вероятно нахождение электрона.
Квантовые числа
Для характеристики поведения электрона в атоме введены квантовые числа: главное, орбитальное, магнитное и спиновое.
Главное квантовое число попределяет энергию и размеры электронных орбиталей, принимает значения 1,2,3,4… и характеризует оболочку или энергетический уровень. Чем больше п, тем выше энергия. Оболочки (уровни) имеют буквенные обозначения:K (n=1), L (n=2), M (n=3), N (n=4), Q (n=5).
Орбитальноеl – определяет форму атомной орбитали. Электронные оболочки расщеплены на подоболочки, поэтому орбитальное квантовое число также характеризует энергетические подуровни в электронной оболочке атома. Орбитальные кв. числа принимают целочисленные значения от 0 до (п-1). Подоболочки также обозначаются буквами: подоболочка (подуровень).
Электроны с орбитальным кв. числом 0 называются s- электронами, имеют сферическую форму.
Электроны с орбитальным кв. числом 1 называются р- электронами, форма, напоминающая гантель.
Электроны с орбитальным кв. числом 2 называются d- электронами, форма сложнее чем р- орбитали.
Порядок заполнения орбиталей электронами. Принцип минимума энергии. Принцип Паули. Правило Хунда. Правило Клечковского
При заполнении атомных орбиталей электронами соблюдаются три основные правила.
Правило Клечковского.Заполнение уровней и подуровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел. Если для двух орбиталей эта сумма будет одинакова, то электрон идет в ту орбиталь, где n меньше.
Что такое электронная плотность?
электронная плотность это мера того, насколько вероятно найти электрон в данной области пространства; или вокруг атомного ядра, или в «окрестностях» внутри молекулярных структур.
Чем выше концентрация электронов в данной точке, тем больше плотность электронов, и, следовательно, она будет отличаться от окружающей среды и будет демонстрировать определенные характеристики, которые объясняют химическую реакционную способность. Графический и отличный способ представить такую концепцию через карта электростатического потенциала.
Например, структура энантиомера S-карнитина с соответствующей картой электростатического потенциала показана на верхнем изображении. Можно наблюдать масштаб, составленный из цветов радуги: красный, чтобы указать область большей электронной плотности, и синий для этой области, бедной электронами..
Как правило, области, где электронная плотность низкая (желтый и зеленый цвета), являются наименее реактивными в молекуле.
концепция
И изменение этих полей приводит к различиям в электронных плотностях на поверхностях Ван-дер-Ваальса (все эти поверхности сфер).
Структура S-карнитина представлена моделью сфер и стержней, но если бы это было для его поверхности Ван-дер-Ваальса, стержни исчезли бы, и наблюдался бы только матовый набор сфер (с теми же цветами).
Электроны будут с большей вероятностью бродить вокруг более электроотрицательных атомов; однако в молекулярной структуре может быть более одного электроотрицательного атома, и, следовательно, группы атомов, которые также оказывают свое собственное индуктивное действие.
Это означает, что электрическое поле изменяется больше, чем можно предсказать, наблюдая за молекулой во время полета; то есть, может быть более или менее поляризация отрицательных зарядов или электронной плотности.
Это также можно объяснить следующим образом: распределение зарядов становится более однородным.
Карта электростатического потенциала
Обратите внимание, что очень сложно определить, как индуктивные эффекты работают в сложной молекуле, такой как белок..
Чтобы получить представление о таких различиях в электрических полях в структуре, используется вычислительный расчет карт электростатического потенциала..
Эти расчеты состоят из помещения положительного точечного заряда и перемещения его вдоль поверхности молекулы; там, где плотность электронов меньше, возникает электростатическое отталкивание, и чем выше отталкивание, тем интенсивнее будет синий цвет.
Там, где электронная плотность больше, будет сильное электростатическое притяжение, представленное красным цветом..
В расчетах учитываются все структурные аспекты, дипольные моменты звеньев, индуктивные эффекты, вызванные всеми сильно электроотрицательными атомами и т. Д. И в результате вы получите эти красочные поверхности и визуальную привлекательность.
Сравнение цветов
Выше приведена карта электростатического потенциала для молекулы бензола. Обратите внимание, что в центре кольца более высокая плотность электронов, а его «точки» имеют голубоватый цвет из-за менее электроотрицательных атомов водорода. Также это распределение зарядов связано с ароматическим характером бензола.
На этой карте также наблюдаются зеленый и желтый цвета, что указывает на приближение к бедным и богатым электронами регионам..
Если бы оба держали одну и ту же цветовую шкалу, это бы показало, что красный цвет на карте бензола превратился из слабого оранжевого. При этой стандартизации можно сравнивать карты электростатического потенциала и, следовательно, электронные плотности нескольких молекул..
Если нет, карта будет служить только для определения распределения заряда для отдельной молекулы.
Химическая реактивность
Наблюдая карту электростатического потенциала и, следовательно, областей с высокой и низкой электронной плотностью, можно предсказать (хотя и не во всех случаях), где химические реакции будут происходить в молекулярной структуре.
В то время как области с низкой электронной плотностью, они реагируют с отрицательно заряженными разновидностями, или с теми, у которых есть пары без электронов, чтобы разделить; последние известны как нуклеофилы.
Электронная плотность в атоме
В атоме электроны движутся с огромной скоростью и могут одновременно находиться в нескольких областях пространства.
Однако с увеличением расстояния до ядра электроны приобретают потенциальную электронную энергию, и их вероятностное распределение уменьшается.
Это означает, что электронные облака атома не имеют определенной границы, но размыты. Поэтому не легко вычислить атомный радиус; разве что есть соседи, которые устанавливают разницу в расстояниях между их ядрами, половину которых можно принять за атомный радиус (r = d / 2).
Атомные орбитали и их функции радиальных и угловых волн демонстрируют, как изменяется электронная плотность в зависимости от расстояния, отделяющего их от ядра..
Чем определяется плотность электронного облака
На этом уроке вы узнаете, как устроена электронная оболочка атома, и сможете объяснить явление периодичности. Познакомитесь с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
I. Состояние электронов в атоме
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов.
Электрон вращается вокруг ядра атома с невообразимой скоростью. Так, за 1 секунду он делает столько оборотов вокруг ядра атома, сколько оборотов делает пропеллер самолета вокруг оси за 5–5,5 лет непрерывной работы двигателя. Пропеллер самолета образует «облако», находящееся в одной плоскости, а электрон образует объемное облако –электронное облако, форма и размер которого зависят от энергии электрона.
Если обозначить точками все вероятные места нахождения электрона в атомном пространстве за некоторое время, то совокупность этих точек будет представлять собойэлектронное облако.
II. Электронное облако
Электронное облако – это модель, которая описывает состояние (движение) электрона в атоме.
Электронное облако не имеет строго очерченных границ и плотность его неравномерна.
Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (
90%), называется орбиталью.
Виды электронных орбиталей
Форма орбитали в пространстве
Количество орбиталей в атоме.
Условное обозначение орбитали – клетка:
(электронное облако s – электрона)
Электронное облако такой формы может занимать в атоме одно положение
(электронное облако p – электрона)
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z.
(электронное облако d – электрона)
(электронное облако f – электрона)
Электронное облако такой формы может занимать в атоме семь положений.
Число электронов в атоме определяют по порядковому номеру
О – 8 электронов, S – 16 электронов.
На одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:
Cледовательно, на s – орбитали максимально может разместиться два электрона (s 2 ); на p – орбитали максимально может разместиться шесть электронов (p 6 ) на d – орбитали максимально может разместиться десять электронов (d 10 ); f – четырнадцать электронов (f 14 ).
Располагаясь на различных расстояниях от ядра, электроны образуют электронные слои (энергетические уровни) – каждому слою соответствует определённый уровень энергии.
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент
О – 2 уровня, S – три уровня.
Для элементов главных подгрупп (А) число электронов на внешнем уровне = номеру группы.
+15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
III. Формулы отражающие строение атомов первого и второго периодов
– схема строения атома, отображает распределение электронов по энергоуровням.
+1 Н 1s 1
– электронная формула, отображает число электронов по орбиталям.
— электронно-графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.
У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.
IV. Распределение электронов по энергетическим уровням элементов третьего и четвертого периодов ПСХЭ
1. Порядок заполнения уровней и подуровней электронами
Электронные формулы атомов химических элементов составляют в следующем порядке:
Порядок заполнения электронами атомных орбиталей определяется :
Принципом наименьшей энергии
Шкала энергий:
1s внешнего энергетического уровня, называются s-элементами. Это первые 2 элемента каждого периода, составляющие главные подгруппы I и II групп.
Элементы, в атомах которых электронами заполняется p-подуровень внешнего энергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III—VIII групп.
Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.
В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца.
В четвертом периоде у первых двух элементов (калия и кальция) электроны идут на четвертый энергетический уровень (4s-подуровень), а затем у последующих десяти элементов (от скандия до цинка) завершается заполнение третьего энергетического уровня (3d-подуровня).
«Проскок» или «провал» электрона
Особо следует отметить палладий, у которого «проваливаются» два электрона:
Pd1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10
V. Тест
Решите тестовые задания (один верный вариант ответа).
1. Заряд ядра атома фосфора равен
2. Количество энергоуровней в атоме равно
а) порядковому номеру элемента;
в) заряду ядра атома;
3. Число нейтронов в атоме цинка равно
4. В ряду элементов Na, Mg, Al, Cl металлические свойства
г) сначала убывают, а затем возрастают
5. Формула высшего оксида RO2 характерна для
6. Электронная формула строения атома меди, это-
а) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 ;
б) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 ;
в) 1s 2 2s 2 2p 6 3s 1 3p 6 4s 2 3d 10 ;
7. Заряд ядра атома кальция равен
8. Число электронов на внешнем энергоуровне для элементов главных подгрупп равно
в) порядковому номеру элемента;
9. Число нейтронов в атоме железа равно
10. В ряду элементов C, Si, Ge, Sn способность отдавать валентные электроны
г) сначала увеличивается, а затем уменьшается.
11. Формула летучего водородного соединения для элемента с электронным строением атома 1s22s22p2 – это
12. Электронная формула строения атома мышьяка, это-
а) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 11 4p 3 ;
б) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 4p 4 ;
в) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 4p 4 ;
Представление о распределении объемного заряда и электростатического потенциала в атоме
Вы будете перенаправлены на Автор24
Распределение плотности электронного облака в атоме водорода
Рассмотрим пространственную структуру атома водорода в стационарном состоянии.
Вероятность нахождения электрона в элементе объема:
Структура электронного облака задает пространственную конфигурацию атома. Часто, для упрощения, рассматривают радиальное и угловое распределения плотности облака отдельно.
Плотность вероятности для координаты r при этом описано функцией:
Нахождение средних расстояний дает формулу:
Готовые работы на аналогичную тему
При этом плотность вероятности равна:
Плотность электронного облака в атоме со многими электронами
Электростатический потенциал в атоме
Из закона сохранения энергии имеем:
На потенциал накладываются граничные условия вида:
Так как около ядра вклад электронов в потенциал несущественный, то следующее граничное условие запишем как:
Подставим выражение (11) в формулу (9) получаем:
Уравнение Пуассона содержит одну неизвестную функцию.
Решение:
Решение:
Ответ: На полярной оси вероятность обнаружить электрон равна нулю.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 08 06 2021
Профессор Знаев
ОСНОВНОЕ МЕНЮ
НАЧАЛЬНАЯ ШКОЛА
РУССКИЙ ЯЗЫК
ЛИТЕРАТУРА
АНГЛИЙСКИЙ ЯЗЫК
НЕМЕЦКИЙ ЯЗЫК
ИСТОРИЯ
БИОЛОГИЯ
ГЕОГРАФИЯ
МАТЕМАТИКА
ИНФОРМАТИКА
Электронные облака. Форма и размер электронного облака

Из-за особенностей поведения электрона, с которыми мы познакомились в первом параграфе, нам, жителям макромира, представить себе характер такого движения невозможно. Это связано с тем, что в макромире, в соответствии с представлениями современной физики, для него просто нет никаких аналогий. Однако положение не безнадежно – мы можем воспользоваться моделью поведения электрона в атоме, в которой используется представление об электронном облаке (ЭО).

Чтобы понять, что это такое, допустим, что мы можем очень много раз «сфотографировать» электрон в атоме (например, в атоме водорода), то есть точно зафиксировать его положение в каждый момент времени. Принцип неопределенностей нам это не запрещает. Наложив друг на друга эти «фотографии», мы получим картину, показанную на рисунке 6.6 а. Если же мы будем фиксировать только положение электрона на плоскости, в которой лежит ядро, то изображение получится несколько иным (см. рис. 6.6 б). Оба эти рисунка дают нам представление об электронном облаке: рисунок а – вид этого облака со стороны, а рисунок б – сечение облака плоскостью, проходящей через ядро. Рисунок а отражает внешний вид облака, а рисунок б дает представление о его внутреннем строении.
Электронное облако – область пространства, в каждой из точек которой может находиться данный электрон.
В разных местах электронного облака вероятность обнаружить электрон может быть разная.
Различная плотность точек в разных частях рисунка 6.6 соответствует разной вероятности нахождения электрона в этих частях электронного облака.
Вероятность обнаружить электрон в какой-либо части облака характеризуется физической величиной, называемой электронная плотность (r е). Она определяется как отношение числа электронов (Nе) к объему (V), который они равномерно заполняют:

Чем больше электронная плотность, тем выше вероятность нахождения электрона в этой части облака (и тем гуще расположены точки на рис. 6.6).
Электронная плотность резко уменьшается с увеличением расстояния от ядра, но теоретически равна нулю только на бесконечном от него расстоянии. Отсюда следует, что YI не имеет четких границ. В сторону ядра электронная плотность уменьшается еще более резко и вблизи него практически равна нулю.
Электронное облако характеризуется размером, формой и распределением в нем электронной плотности.
Все, что мы говорили об электронном облаке, относится к ЭО одной орбитали, но электрон может находиться на разных орбиталях. Естественно, что электронные облака в этих случаях тоже будут разные, то есть, будут отличаться по размеру, форме и распределению электронной плотности.
Как мы уже отмечали, электронное облако не имеет четких границ, края его как бы размыты в пространстве. Что же понимать под размером такого объекта, и как описать его форму?
Для ответа на эти вопросы нам придется более детально разобраться в том, как «устроены»некоторые электронные облака, то есть, каково их строение. А строение такого необычного объекта, как электронное облако, характеризуется лишь распределением по его объему электронной плотности. Сначала познакомимся со строением самых простых электронных облаков.
Начнем с 1s-ЭО. В верхней части рис. 6.7 изображено сечение этого облака плоскостью, проходящей через ядро атома. В нижней части рисунка помещен график, показывающий, как меняется электронная плотность в этом облаке. Такой график мог бы построить некий очень маленький «наблюдатель «, пролетающий через атом по оси x и непрерывно измеряющий при этом электронную плотность. Точно такой же график построил бы наш «наблюдатель», если бы пролетал через 1s-ЭО по любому другому направлению, но обязательно через центр облака. Следовательно, в 1s-ЭО распределение электронной плотности не зависит от направления, и форма этого облака – шарообразная.
Но не всегда легко представить себе форму электронного облака, рисуя лишь графики распределения электронной плотности. Поэтому обычно форму электронного облака характеризуют его граничной поверхностью.
Граничная поверхность электронного облака – поверхность,в любой точке которой вероятность нахождения электрона одинакова,а внутри которой общая вероятность нахождения электрона достаточно велика.
Построим граничную поверхность 1s-ЭО. На рис. 6.7 вспомогательные линии, относящиеся к этому построению, изображены пунктиром. В результате мы получим две сферы: внешнюю (а) и внутреннюю (б), между которыми вероятность обнаружить электрон равна 90 %. Внутренняя сфера мала, находится вблизи ядра и при образовании атомом химических связей ее присутствие никак не проявляется, поэтому обычно говорят, что 1s-ЭО имеет форму шара.
По-иному устроено 2p-ЭО (рис. 6.8). Оно состоит из двух одинаковых частей, симметричных относительно центра облака. Между ними, на плоскости m (перпендикулярной плоскости чертежа), электрон находиться не может. Граничная поверхность 2p-ЭО (ее сечение обозначено на рисунке буквой а) похожа по форме на две половинки апельсина и представляет собой тело вращения (простейшими телами вращения являются цилиндр, конус, шар и тор (приближенную форму тора имеет бублик) с осью x. Если наш «наблюдатель»полетит через это облако вдоль оси x, то график, который он построит, не будет сильно отличаться от такого же графика для 1s-ЭО, только высота максимумов будет немного меньше. По любому другому направлению (кроме лежащих в плоскости m), например, вдоль прямой f, электронная плотность будет еще меньше, но максимумы кривой останутся на тех же расстояниях от ядра (см. нижний график). Это постоянство максимумов характерно и для других электронных облаков, что позволяет нам выбрать в каждом облаке сферу «с «с радиусом, в конце которого электронная плотность по этому направлению максимальна.
Такой постоянный радиус и характеризует размер электронного облака. Этот радиус называют радиусом электронного облака и обозначают rЭО. В случае рассмотренных нами орбиталей именно на этом расстоянии от ядра вращался бы электрон, если бы он не обладал волновыми свойствами.
Радиус электронного облака – радиус сферы, на которой по любому направлению от ядра электронная плотность этого облака максимальна.
2p-подуровень образован тремя орбиталями, следовательно, в атоме может быть три 2p-ЭО. А так как электроны взаимно отталкиваются, эти облака располагаются в пространстве так, чтобы максимумы их электронной плотности находились как можно дальше друг от друга. Это возможно только в том случае, если оси облаков будут взаимно перпендикулярны, например, направлены вдоль осей прямоугольной системы координат. Поэтому 2p-ЭО так и обозначают: 2рх-, 2рy— и 2pz-ЭО (рис. 6.9). Если каждое из этих облаков образовано одним или двумя электронами, то суммарное электронное облако всех электронов подуровня за счет сложения электронной плотности будет иметь шарообразную форму (как у 1s-ЭО). Такую же шарообразную форму будут иметь суммарные электронные облака любого подуровня, если, конечно, каждое из отдельных облаков будет образовано одним или двумя электронами.
Форма и строение других электронных облаков сложнее. Так 2s-ЭО, будучи также, как и все s-облака шарообразным, двухслойное (рис. 6.10 а). Внутри внешнего слоя с главным максимумом электронной плотности есть еще один слой со значительно меньшей электронной плотностью.
3p-ЭО состоит из четырех частей (рис. 6.10 б). Две большие области похожи по форме на половинки 2p-ЭО, но ближе к ядру расположены еще две маленькие области с меньшей электронной плотностью. В пространстве оси 3p-электронных облаков, так же, как и оси 2p-ЭО, взаимно перпендикулярны.
С увеличением главного квантового числа n форма электронных облаков (c одинаковым l) все более и более усложняется, но внешние области таких облаков остаются похожими, геометрически почти подобными.
Еще сильнее усложняется форма облаков с увеличением орбитального квантового числа. Рассмотрим форму 3d-облаков. Из пяти облаков этого подуровня четыре по форме совершенно одинаковы, а пятое от них отличается (рис. 6.11)( На самом деле ситуайция с пятым облаком несколько сложнее) Каждое из четырех одинаковых 3d-облаков образовано четырьмя областями, напоминающими по форме округлые апельсиновые дольки. Пятое облако состоит из трех частей, две из которых отдаленно напоминают 2р-облако, а третья образует похожий на тор поясок вокруг первых двух.
Размеры электронных облаков зависят от заряда ядра: чем больше заряд ядра, тем оно сильнее притягивает электрон и тем меньше размер электронного облака. При одном и том же заряде ядра размер облака зависит, прежде всего, от главного квантового числа n. Наглядно эта зависимость представлена на рис. 6.12 в виде диаграммы размеров электронных облаков. На этой диаграмме по вертикальной оси отложены (без строгого соблюдения масштаба) значения радиусов электронных облаков, а по горизонтальной оси – орбитальное квантовое число. Положения радиусов ЭО на диаграмме символически отмечены кружочками.
Радиусы электронных облаков с одинаковыми значениями главного квантового числа примерно равны, а с разными значениями n – сильно отличаются. Из-за этого электронная оболочка атома оказывается слоистой.(Точные квантово-механические расчеты показывают, что радиусы облаков одного слоя немного различаются, но эти различия незначительны)
Электронный слой – совокупность электронных облаков, близких по размеру.
Облака одного слоя, отличающиеся только значениями магнитного квантового числа, соответствуют орбиталям одного подуровня. В случае р-подуровней разным значениям m соответствует только разная ориентация электронных облаков. У облаков одного ЭПУ с большим значением l, например, у 3d-облаков, отличается еще и форма.
ЭЛЕКТРОННОЕ ОБЛАКО, ГРАНИЧНАЯ ПОВЕРХНОСТЬ ЭО, ФОРМА ЭО, РАДИУС ЭО, ДИАГРАММА РАЗМЕРОВ ЭО, ЭЛЕКТРОННЫЙ СЛОЙ.
1.Существуют ли в Природе электронные облака? А электроны?
2.Попробуйте найти аналогии между электронной оболочкой и многоэтажным жилым домом оригинальной архитектуры.
4.Опишите изменение электронной плотности, зафиксированное «наблюдателем», пролетевшим через 1s-ЭО вдоль прямых а и б (рис. 6.13).
5.Опишите изменение электронной плотности, зафиксированное «наблюдателем», пролетевшим через 2р-ЭО а) сквозь центр атома по направлению, перпендикулярному оси x (рис.6.8); б) параллельно оси x, вне сферы наибольшей электронной плотности; в) параллельно оси x, захватывая сферу наибольшей электронной плотности.
6. Какие электронные облака образуют второй электронный слой?
7.Чем отличаются друг от друга электронные облака орбиталей со следующими наборами квантовых чисел: а) n = 2, l = 0, m = 0 и n = 2, l = 1, m = 0; б) n = 2, l = 1, m = 0 и n = 2, l = 1, m = 1; в) n = 1, l = 0, m = 0 и n = 2, l = 0, m = 0?
8.Сколько электронных облаков образуют полностью заполненный четвертый электронный слой?
9.Какое электронное облако одного и того же атома больше по размерам а) 2р-ЭО или 3р-ЭО, б) 2р-ЭО или 3s-ЭО, в) 1s-ЭО или 2р-ЭО?
10.Какое из электронных облаков больше: 1s-ЭО атома водорода, или 1s-ЭО атома гелия?
11.Как вы думаете, во сколько раз радиус 1s-ЭО атома урана меньше радиуса такого же облака атома водорода?
12.У каких из перечисленных ниже электронных облаков одного и того же атома примерно одинаковые размеры: 1s-ЭО, 4p-ЭОб 3d-ЭО, 4s-YI, 3s-ЭО?