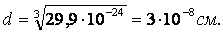Чем определяется длина связи
Длина химической связи
Нильс Бор отмечал: «… благодаря большой массе ядер по сравнению с массой электронов можно с большой точностью рассчитывать конфигурации атомов в молекулах, эти конфигурации соответствуют хорошо известным стурктурным формулам, которые оказались столь необходимыми для упорядочения химических данных». [3]
Для определения длины химической связи используют различные методы. Газовую электронографию, микроволновую спектроскопию, спектры комбинационного рассеяния и ИК спектры высокого разрешения применяют для оценки длины химических связей изолированных молекул в паровой (газовой) фазе.
Межъядерные расстояния в кристаллах определяют с помощью рентгеноструктурного анализа, нейтронографии и электронографии. [4]
Считается, что длина химической связи является аддитивной величиной, определяемой суммой ковалентных радиусов атомов, составляющих химическую связь. Л.Полинг в своей книге [5] привёл значения ковалентных радиусов большого числа элементов.
Однако, длина химической связи (dAB) между электроотрицательным и электроположительным атомами несколько короче, чем длина, полученная сложением ковалентных радиусов элементов (rA и rB), составляющих молекулу. Поправка на отклонение от принципа аддитивности ковалентных радиусов учитывается уравнением Шомакера-Стивенсона:
и составляет величину k = 0,09 Δχ, где Δχ — разность значений электроотрицательностей атомов χA и χB.
В настоящее время разработана практическая шкала электротрицательностей атомов. [6]
Параметры ковалентных связей
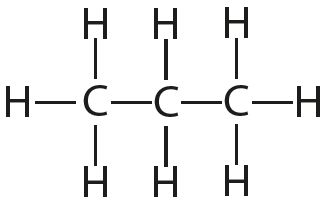
Параметры, характеризующие ковалентные связи, весьма многообразны. Важнейшими из них являются энергия связи, длина связи, полярность, поляризуемость. Длина связи – это расстояние между центрами связанных атомов (r). Поскольку атомы в молекулах колеблются вдоль линий связей, измеряемые расстояния представляют собой средние значения. Длина связи выражается через сумму ковалентных радиусов атомов. Ковалентный радиус – это половина длины ковалентной связи в молекуле, образованной одинаковыми атомами (рис. 28).
Если в молекуле соединяются более двух различных атомов, то средняя энергия связи не совпадает с величиной энергии диссоциации молекулы. Если в молекуле представлены различные типы связи, то каждому из них можно приближенно приписать определенное значение Е. Это позволяет оценить энергию образования молекулы из атомов. Например, энергию образования молекулы пентана из атомов углерода и водорода можно вычислить по уравнению: В табл. 4.2 рассматривается взаимосвязь между энергией химической связи и свойствами веществ. Взаимосвязь между энергией химической связи и свойствами веществ Энергия связи, кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
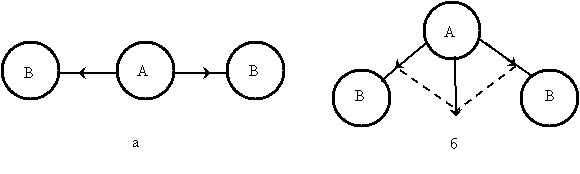
Рис. 4.1. Дипольные моменты отдельных связей в молекулах типа АВ2 различного строения: а – линейное строение, б – угловое строение
На рис. 4.1 изображены схемы возможного строения молекулы типа АВ2; векторы дипольных моментов отдельных связей А—В показаны стрелками, направленными от А к В. При линейном строении (рис. 4.1, а) равные по величине дипольные моменты двух связей А—В противоположны по направлению. Следовательно, дипольный момент такой молекулы будет равен нулю. В случае углового строения (рис. 4.1, б) векторная сумма дипольных моментов двух связей А—В отличается от нуля; такая молекула обладает дипольным моментом и является полярной. Поэтому наличие или отсутствие дипольного момента у молекулы типа АВ2 позволяет сделать вывод о ее геометрическом строении.
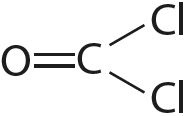
Например, молекула СО2 имеет симметричное линейное строение:
Полярность молекул оказывает заметное влияние на свойства образуемых ими веществ. Полярные молекулы стремятся ориентироваться по отношению друг к другу разноименно заряженными концами. Следствием такого диполь-дипольного взаимодействия является взаимное притяжение полярных молекул и упрочнение связей между ними. Поэтому вещества, образованные полярными молекулами, обладают, как правило, более высокими температурами плавления и кипения, чем вещества, молекулы которых неполярны.
Строение и ожидаемая полярность молекул
Пространственная конфигурация
Примеры
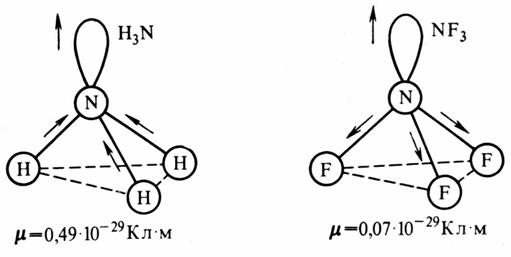
Рис. 4.2. Сложение электрических моментов диполя связывающей и несвязывающей электронных пар молекул H 3 N и NF 3
Это объясняется тем, что в Н3 N направление электрического момента диполя связывающей N—Н и несвязывающей электронной пары совпадает и при векторном сложении обусловливает большой электрический момент диполя. Наоборот, в NF 3 моменты связей N—F и электронной пары направлены в противоположные стороны, поэтому при сложении они частично компенсируются (рис. 4.2). Значения электрических моментов диполя некоторых молекул приведены в табл. 4.7.
Электрический момент диполя
4.7. Вопросы и задания
4.7.14. Вычислите среднюю энергию связи Н— Se и Н—Те для соединений H 2 Se и Н2Те, если стандартные теплоты образования этих соединений соответственно равны 85,77 и 154,39 кДж/моль. Энергия диссоциации H 2 равна 435,9 кДж/моль.
4.7.17. К каким атомам смещены связывающие электронные облака в следующих молекулах: а) НС1; б) НВг; в) HI ; г) NaH ; д) КН; е) ВеО; ж) N0; з) BN ; и) C 1 F ; к) ClBr ; л) MgS ; м) BeCl 2; н) ВВ r 3; о) СО2; п) OF 2; р) MgF 2; с) А1С13?
4.7.18. Рассчитайте эффективные заряды на атомах следующих молекул: a ) BrCl ; б) BrF ; в) C 1 F ; г) НС1; д) НВ r ; е) HI ; ж) LiBr ; з) LiF ; и) NaCl ; к) Nal ; л) NO ; м) Н2О ( NH 3 ( HNH = 107°).
4.7.19. Как изменяется полярность в ряду молекул: а) HF ; НС1; НВ r ; HI ; б) NH 3; РН3; А sH 3?
4.7.27. Какая молекула, аммиак или арсин имеет больший дипольный момент? Почему?
4.7.28. Почему молекула CCl 4 неполярная, а CH 3 Cl – полярная?


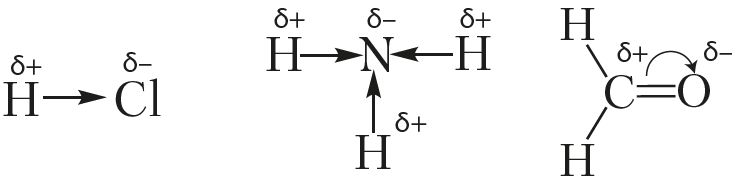
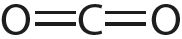
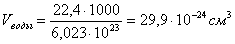 , отсюда
, отсюда