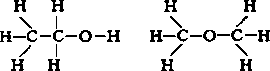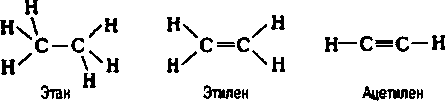Чем описывается химический состав молекулы
Молекулы. Химические формулы. Молекулярные массы
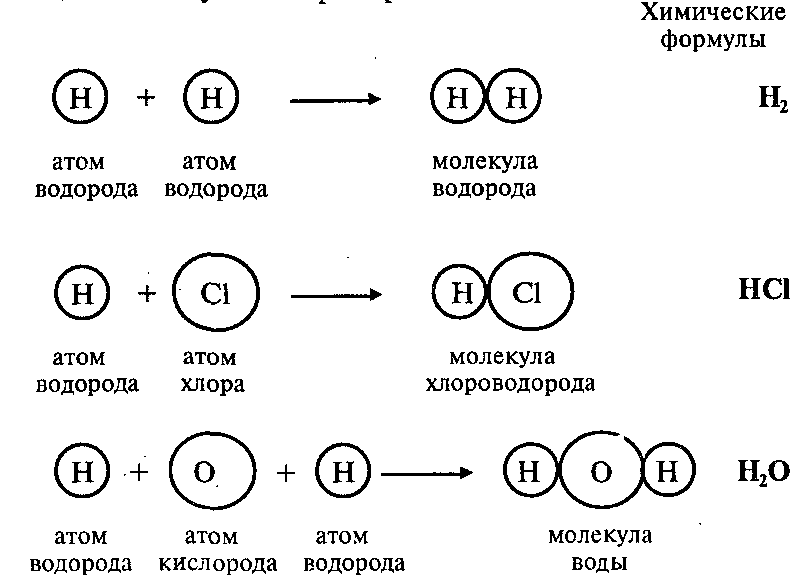
Атомы могут соединяться друг с другом. В результате этого соединения обычно образуются более сложные частицы – молекулы. Например:
Эти примеры показывают, что соединяться друг с другом могут атомы одного элемента и атомы разных элементов. Число атомов, которые соединяются друг с другом, может быть различным.
Состав любой молекулы можно выразить химической формулой.
Так, молекула водорода имеет формулу Н2. Число «2» в этой формуле показывает число атомов водорода в молекуле водорода.
Числа в химических формулах, которые показывают, сколько атомов данного элемента входит в состав молекулы, называются индексами.
Молекула хлороводорода имеет формулу НCl, так как она состоит из одного атома водорода и одного атома хлора. Молекула воды имеет формулу Н2O. Эта формула показывает, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Молекула серной кислоты состоит из двух атомов водорода Н, одного атома серы S и четырех атомов кислорода О. Значит, формула молекулы серной кислоты — H2SO4.
Существуют молекулы, в состав которых входит несколько одинаковых групп атомов. В формулах таких молекул эти группы атомов заключают в скобки, а индекс за скобками показывает число этих групп в молекуле. Например, формула Cu(NO3)2 показывает, что эта молекула состоит из одного атома меди и двух групп атомов NО3, т. е. двух атомов азота и шести атомов кислорода.
Таким образом, химические формулы доказывают качественный и количественный состав молекулы (из атомов каких элементов состоит молекула и сколько этих атомов в молекуле).
Согласно закону постоянства состава (Ж. Пруст, Франция, 1808 г.): Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.
Так как вещество состоит из одинаковых молекул, то состав молекулы определяет состав всего вещества. Различия в химических свойствах веществ обусловлены различиями в составе и строении молекул, из которых состоят эти вещества. Поэтому можно сделать вывод:
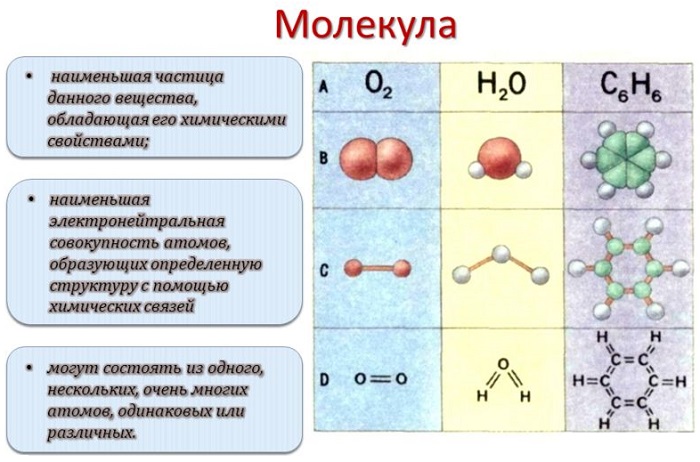
Молекула — это наименьшая частица вещества, которая сохраняет его химические свойства.
Масса любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы, то получается относительная молекулярная масса, которая обозначается символом Мr.
Например, относительная молекулярная масса воды Н2O равна:
Mr(H2О) = Ar(H) + Аr(Н) + Аr(О) = 2Аr(Н) + Аr(О) =2∙1+16=18;
относительная молекулярная масса сульфата железа (III) Fe2(SO4)3 равна: Mr[Fe2(SO4)3] = 2Ar(Fe) + 3Ar(S) + 12Ar(O) = 2∙56+3∙32+12∙16=400;
Относительная молекулярная масса вещества Мr — это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода С.
Например, относительная молекулярная масса воды Mr(H2О) = 18. Это значит, что масса молекулы воды в 18 раз больше 1/12 части массы атома углерода.
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля (ω) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:
где ω(Х) — массовая доля элемента Х; Ar(X) — относительная атомная масса элемента Х; n — число атомов элемента Х в молекуле вещества; Мr — относительная молекулярная масса вещества.
Что важно знать о молекулах в химии — особенности строения молекул
Молекула в химии: определение
Молекула — это электронейтральная частица вещества, состоящая из конечного числа атомов, связанных между собой ковалентными связями, имеющая определенную пространственную структуру и массу, а также обладающая всеми химическими свойствами этого вещества и способная к самостоятельному существованию.
В некоторых случаях вещество может состоять из химически несвязанных атомов, но при этом иметь молекулярное строение — например, все инертные газы. Для инертных газов понятия атом и молекула, можно условно назвать равносильными понятиями.
Так из определения можно сказать, что молекула характеризуется качественным и количественным составом. Качественный состав показывает, из каких атомов состоит молекула.
Молекулы воды или пероксида водорода состоят из атомов водорода и кислорода, а молекула углекислого газа — из атомов углерода и кислорода.
Количественный состав показывает сколько атомов каждого вида содержится в молекуле. Этот параметр при записи молекулярной формулы отражается в индексах химических элементов, из которых она составлена.
Молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула углекислого газа — из одного атома углерода и двух атомов кислорода.
Особенности строения, масса молекулы
Особенности строения молекулы
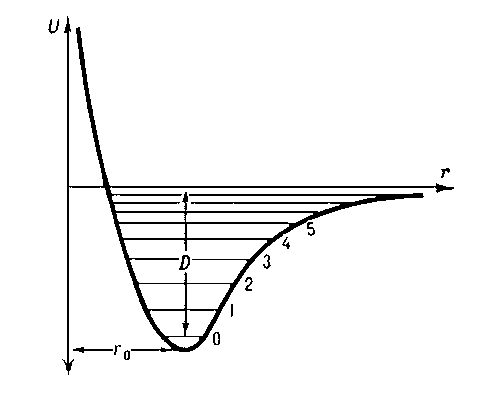
Центральным положением классической теории является положение о химической связи. Природа химической связи в классической теории не рассматривается — учитываются лишь такие характеристики, как валентные углы, углы между плоскостями, образованными тройками ядер, длины связей и их энергии.
Таким образом, молекула в классической теории представляется динамической системой, в которой атомы рассматриваются как материальные точки. В данной системе атомы и связанные группы атомов могут совершать механические вращательные и колебательные движения.
Молекула состоит из атомов, а если точнее — из атомных ядер, окруженных определенным числом внутренних электронов, и из внешних валентных электронов, образующих химические связи. Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул вещества не зависят от способа его получения.
Атомы объединяются в молекуле в большинстве случаев с помощью химических связей. Как правило, такая связь образуется одной, двумя или тремя парами электронов, находящихся в совместном владении двух атомов, образуя общее электронное облако, форма которого описывается типом гибридизации. Молекула может иметь положительно и отрицательно заряженные атомы (ионы).
Состав молекулы передается химическими формулами — краткой записью, которая устанавливается на основе атомного соотношения элементов вещества и молекулярной массы.
Каждому атому в определенном валентном состоянии в молекуле можно приписать определенный атомный, или ковалентный радиус (в случае ионной связи — ионный радиус), характеризующий размеры электронной оболочки атома (иона), образующего химическую связь в молекуле. Размер электронной оболочки молекулы является условной величиной.
Молекулы состоят из электронов и атомных ядер. Расположение последних в молекуле передает структурная формула (для передачи состава используется брутто-формула).
К веществам, сохраняющим молекулярную структуру в твердом состоянии, относятся: вода, оксид углерода (IV), многие органические вещества. Они характеризуются низкими температурами плавления и кипения. Большинство же твердых (кристаллических) неорганических веществ состоят не из молекул, а из других частиц (ионов, атомов) и существуют в виде макротел (кристалл хлорида натрия, кусок меди и т. д.).
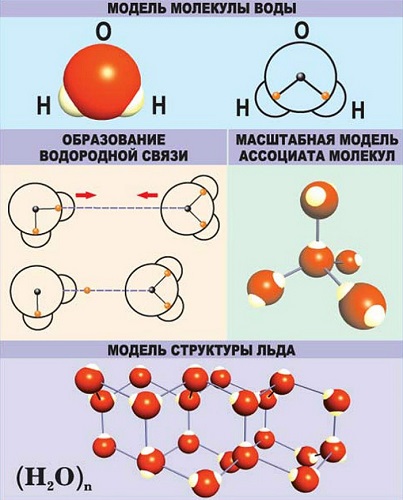
Рис.1. Модель молекулы воды.
Масса молекулы
Масса молекулы (Mr) — относительная молекулярная (атомная) масса вещества — это отношение массы молекулы (или атомов) данного вещества к 1 / 12 массы атома углерода.
Молярная масса (M) — это масса вещества, взятого в количестве одного моля.
Молекулы относительно высокой молекулярной массы, состоящие из повторяющихся низкомолекулярных фрагментов, называются макромолекулами. Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов, которые и представляют собой макромолекулы.
Состав и виды молекул
Молекулы относительно высокой молекулярной массы, состоящие из повторяющихся низкомолекулярных фрагментов, называются макромолекулами. Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов, которые и представляют собой макромолекулы.
Макромолекулы чаще всего встречаются в биологии. Рассмотрим некоторые примеры таких молекул.
Молекула может иметь совсем другие свойства, чем атомы, из которых она состоит. Например, сахар (глюкоза или сахароза) представляет собой комбинацию атомов. В него входят кислород, углерод и водород. Углерод в отдельности может представлять собой серое твердое вещество, а кислород и водород — оба газы.
Образуя между собой ковалентные связи, эти атомы создают сладкое питательное вещество, богатое энергией, которое многим животным помогает выжить.
В биологии много других примеров макромолекул, например, РНК, ДНК, ферменты, иммуноглобулин, гемоглобин и др.
Также макромолекулами называют полимерные соединения, которые могут быть синтезированы из множества мономеров и составлять большие и длинные цепи.
Типы химических связей в молекуле
Химическая связь — это связь между атомами в молекуле, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Металлическая — это связь, образованная между ядрами атомов металлов, расположенных в узлах кристаллических решеток, объединенных общим облаком электронов.
Водородная — это вид химической связи, образованной между некоторыми молекулами, содержащими водород, и другим, более электроотрицательным атомом (кислородом, азотом, фтором, реже серой).
Ионная — имеет электрическую природу, то есть это один из видов химической связи, в основе которого лежат электростатические взаимодействия между заряженными ионами: катионом (положительно заряженным ионом) и анионом (отрицательно заряженным ионом).
Обычно ионная связь образуется между типичными металлом и неметаллом, например: поверенная соль (хлорид натрия), оксид бария и т.д.
Ковалентная — может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам, либо по обменному механизму (обобществление пары электронов), либо по донорно-акцепторному механизму (из электронов донора и свободной орбитали акцептора). Отличается наибольшей устойчивостью и энергетической емкостью.
Ковалентной связью связаны атомы в молекулах простых веществ (хлор, бром, кислород и др.), органических веществ. То есть ковалентная связь образуется между атомами неметаллов. Если неметаллы одинаковые, то образуется ковалентная неполярная связь, а если связь образуется между разными неметаллами — то это ковалентная полярная связь (Рис.2).
Рис.2. Образование ковалентной полярной связи (на примере соляной кислоты).
Естествознание. 10 класс
Конспект урока
Естествознание, 10 класс
Перечень вопросов, рассматриваемых в теме:
Качественный состав – это перечень всех образующих вещество химических элементов.
Количественный состав – это число атомов каждого химического элемента в составе мельчайшей частицы вещества – его молекулы.
Запись, выражающая качественный и количественный состав вещества с помощью хими-ческих знаков, называется химической формулой.
Закон постоянства состава: Многие вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.
Химическая связь – это совокупность сил, связывающих и удерживающих атомы или другие частицы в устойчивых структурах (молекулах и др.).
Гибридизация атомных орбиталей – это их перемешивание в пространстве с целью выравнивания и обеспечения наиболее полного перекрывания.
Аллотропия – это явление, при котором один и тот же химический элемент образует несколько простых веществ. Простые вещества, образованные одним элементом – это аллотропные модификации (видоизменения) этого элемента.
Изомерия – это явление, при котором существуют вещества, имеющие одинаковый состав, но разное химическое строение, а потому и свойства. Вещества, имеющие одинаковый состав, но разное химическое строение, а потому и разные свойства, называются изомерами.
Основная и дополнительная литература по теме урока:
Теоретический материал для самостоятельного изучения
Учение о молекуле лежит в основе всех
других обобщений, так что современную химию
можно по праву назвать молекулярной химией.
А. М. Бутлеров, (1828-1886), русский химик, создатель теории химического строения органических веществ, учёный-пчеловод и лепидоптеролог, общественный деятель
Установление взаимосвязи между свойствами веществ и строением молекул составляет фундаментальную научную проблему химии. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении порядка расположения атомов (связей) в исходных соединениях и характера изменений при образовании из них других соединений.
Первые представления о структуре молекул основывались на химическом анализе. Со времен М.В. Ломоносова (1741), который высказал мысль, что свойства вещества зависят от рода, числа и расположения «элементов» (атомов), составляющих его «корпускулу» (молекулу), представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволило определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле, составленной на основе качественного и количественного анализа, а также закона постоянства состава (Ж.Пруст). В дальнейшем А.М. Бутлеров (1861) ввел понятие химического строения (как порядка связи атомов в молекуле) и показал, что свойства вещества определяются его составом и химическим строением. Стереохимическая гипотеза Я. Вант-Гоффа и Ле Беля (1874) расширила понятие строения. Оказалось, что свойства вещества зависят как от химического (в топологическом плане), так и пространственного строения молекул. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов. В таблице 1 отражена зависимость пространственного строения веществ от типа гибридизации.
«Пространственное строение частиц в зависимости от типа гибридизации». Приведите свои примеры веществ.
Тип гибриди-зации центрального атома
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.
Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.
Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
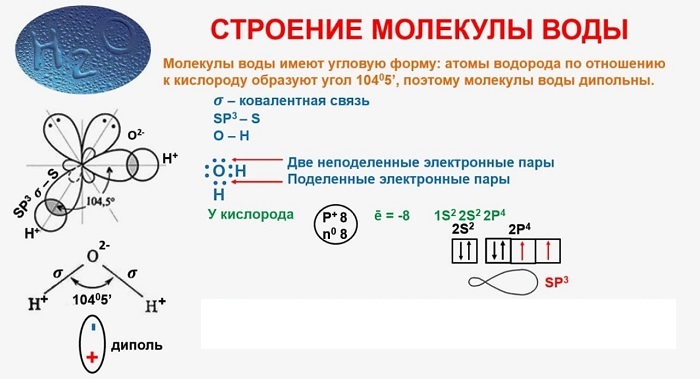
В качестве примера рассмотрим строение наименьшей частицы воды.
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Водородная — основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.
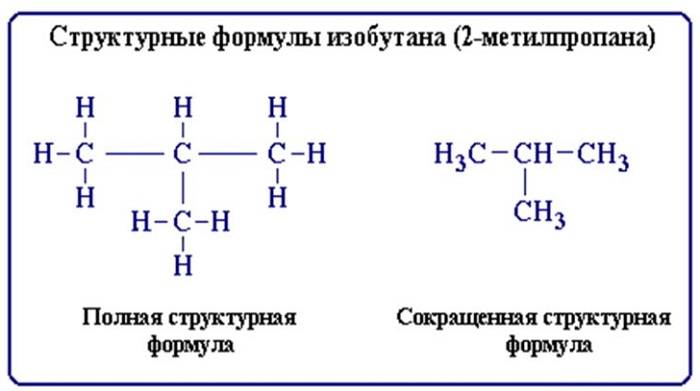
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.
В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы
Современная наука выделяет следующие свойства молекул:
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.
Молекула
Полезное
Смотреть что такое «Молекула» в других словарях:
молекула — ы, ж. molecule f. Мельчайшая частица вещества, обладающая всеми его химическим свойствами, способная существовать самостоятельно. БАС 1. Молекюль. Веселитский 26. Молекула и молекюль. Михельсон 1865. Молекюла. Так называется безконечная… … Исторический словарь галлицизмов русского языка
МОЛЕКУЛА — (новолат. molecule, уменьшит. от лат. moles масса), наименьшая ч ца в ва, обладающая его осн. хим. св вами и состоящая из атомов, соединённых между собой химическими связями. Число атомов в М. составляет от двух (Н2, О2, HF, KCl) до сотен и тысяч … Физическая энциклопедия
МОЛЕКУЛА — МОЛЕКУЛА, мельчайшая частица вещества (например, химического соединения), определяющая химические свойства этого вещества. Молекула может состоять из одного атома, но обычно состоит из двух или более атомов, удерживаемых вместе ХИМИЧЕСКИМИ… … Научно-технический энциклопедический словарь
МОЛЕКУЛА — (уменьшительная форма от лат. moles – масса) наименьшая частица химического соединения; состоит из системы атомов, с помощью химических средств может распадаться на отдельные атомы. Молекулы благородных газов, гелия и т. д. одноатомны; сложнейшие … Философская энциклопедия
молекула — эксимер, генонема, эписома, хромосома, микрочастица, макромолекула Словарь русских синонимов. молекула сущ., кол во синонимов: 10 • биомолекула (1) • … Словарь синонимов
МОЛЕКУЛА — МОЛЕКУЛА, наименьшая частица вещества, обладающая его основными химическими свойствами. Состоит из атомов, расположенных в пространстве в определенном порядке и соединенных химическими связями. Состав и расположение атомов отражены в химической… … Современная энциклопедия
МОЛЕКУЛА — (новолат. molecula уменьшит. от лат. moles масса), микрочастица, образованная из атомов и способная к самостоятельному существованию. Имеет постоянный состав входящих в нее атомных ядер и фиксированное Число электронов и обладает совокупностью… … Большой Энциклопедический словарь
МОЛЕКУЛА — МОЛЕКУЛА, молекулы, жен. (от лат. moles масса) (ест.). Мельчайшая частица вещества, способная существовать самостоятельно и обладающая всеми свойствами данного вещества. Молекулы состоят из атомов. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МОЛЕКУЛА — МОЛЕКУЛА, ы, жен. Мельчайшая частица вещества, обладающая всеми его химическими свойствами. М. состоит из атомов. | прил. молекулярный, ая, ое. Молекулярная масса. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Молекула — или частица система или группа атомов … Энциклопедия Брокгауза и Ефрона
МОЛЕКУЛА — [франц. molecule от лат. moles масса ] наименьшая частица данного вещества, обладающая его основными хим. свойствами, способная к самостоятельному существованию и состоящая из одинаковых или различных атомов, соединенных в одно целое хим. связями … Геологическая энциклопедия