Чем опасно у вич инфицированных пневмония
Чем опасно у вич инфицированных пневмония
Пневмоцистная пневмония (пневмоцистоз) – болезнь, возникающая только у людей с поврежденной иммунной системой, особенно ВИЧ- инфицированных и без лечения имеет фатальные последствия.
Возбудитель повсеместно распространен в окружающей среде, однако при сохранных естественных защитных механизмах не вызывает никаких изменений. Источником является больной человек, выделяющий цисты в окружающую среду при кашле.
Основные группы риска среди взрослых и детей:
При повышении температуры, возникновении одышки, непродуктивного кашля.
При частом поверхностном дыхании, головных болях, слабости, потливости., болях в грудной клетке, сухом надсадном кашле. При возникновении ночного лающего кашля с приступами удушья.
У взрослых симптомы нарастают постепенно: снижается аппетит, усиливается бледность, покашливание, мучительный сухой кашель, одышка при физической нагрузке, тахикардия, лихорадка, ночная потливость, немотивируемая потеря веса, случается пневмоторакс.
В 1-2 неделю аускультативно, как правило, не выявляется нарушений.
При ВИЧ- инфекции отмечается еще более вялое течение пневмоцистной пневмонии, с развитием симптомов в течение недель и месяцев. Может не быть ни одышки, ни кашля (или небольшой сухой кашель), а только медленно прогрессируют дыхательные расстройства («укорачивается» дыхание). Обращает на себя внимание диссонанс между выраженностью нарушений дыхания и скудостью физикальных данных (отсутствуют хрипы), хотя аускультативная картина и может быть самой разнообразной – как с влажными, так и сухими хрипами. Частота дыхания у взрослых может достигать 30-50 дыханий в минуту.
Прогноз и профилактика пневмоцистной пневмонии.
Прогноз при пневмонии такого рода зависит от состояния иммунной системы и тяжести течения.
Осложнения. Ведущим осложнением, чаще всего обусловливающим летальность, является дыхательная недостаточность, связанная с резким нарушением вентиляции и газообмена. Возможны также такие осложнения, как абсцессы, спонтанный пневмоторакс (на фоне образования мелких легочных кист), экссудативный плеврит.
Без лечения летальность у различных групп населения может достигать 100%. Пневмоцистная пневмония может рецидивировать даже после полного выздоровления уже через несколько недель. Поэтому большая роль отдается профилактическому лечению.
Первичная профилактика показана ВИЧ-инфицированным пациентам с количеством CD4+ клеток в крови менее 200 на 1 мкл и\или при наличии орофарингеального кандидоза. Целесообразность первичной профилактики для других иммунокомпроментированных пациентов не определена. Вторичная профилактика показана всем лицам, перенесшим пневмоцистную пневмонию. И первичная, и вторичная профилактика может быть прекращена у ВИЧ-положительных лиц, если количество CD4+ превышает 200 на 1 мкл и остается на таком уровне более 3 месяцев.
Показания к лечению и назначение медикаментозной профилактики определяет врач.
Самолечение опасно для здоровья.
По вопросам данной патологии можно проконсультироваться по телефону 34-01-03.
Подготовила врач – терапевт ГУЗ ЛОЦПБС и ИЗ
Пневмоцистная пневмония у лиц с тяжелыми дефектами иммунитета
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено: увеличением диапазона применения цитостатической терапии с целью лечения злокачественных опухолей; внедрением в практику пересадки донорских органов, трансплантации кос
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено:
Объединяющим свойством различных популяций пациентов в данном случае является их повышенная восприимчивость к различным инфекционным агентам, что объясняется снижением пороговых значений вирулентности [1, 6]. Повреждения легочной ткани как инфекционной, так и неинфекционной природы являются едва ли не самой часто описываемой патологией среди пациентов с различными нарушениями иммунитета. При этом легочная инфекция занимает лидирующее положение среди всех инвазивных инфекций, которые диагностируются у такого рода больных [6, 9, 10].
Риск возникновения инфекций нижних дыхательных путей (ИНДП) в группе больных со сниженным иммунитетом весьма различается и зависит от ряда факторов, наиболее важными среди которых являются: нейтропения, аспирация, характер и степень выраженности изменений со стороны иммунной системы (табл. 1), а также эпидемиологическая ситуация в регионе. Одним из наиболее серьезных факторов риска возникновения ИНДП у данной категории пациентов является выраженная и продолжительная нейтропения [5, 8].
Пациент с нарушениями иммунитета, с одной стороны, постоянно находится под воздействием патогенов окружающей среды, а с другой — именно наличие дефекта иммунитета определяет тип легочной инфекции, которая у него развивается. У таких пациентов наиболее распространенными причинами развития ИНДП являются: нозокомиальная инфекция, зачастую резистентная к антибиотикам; воздействие факторов окружающей среды (воздушно-капельная инфекция и/или инфекция, передающаяся через питьевую воду); инфекции, порог вирулентности которых высок среди популяции; реактивация ранее перенесенных инфекций (например, туберкулез) [10, 12].
Каковы же основные особенности респираторных инфекционных процессов у больных со сниженным иммунитетом, знание которых помогает своевременно распознать и как можно быстрее начать проводить специфическое, адекватное терапевтическое лечение.
Успешность проводимой эмпирической антибактериальной терапии во многом зависит от предварительно проведенного микробиологического обследования и идентификации возбудителя. В абсолютном большинстве случаев речь идет о грибковой или смешанной бактериально-грибковой флоре. Этиологическая расшифровка ИНДП у данной категории больных представлена следующим образом [1–3, 6, 11]:
Довольно часто в популяции пациентов с нейтропенией [11, 12] возникают микст-инфекции, основу которых составляют: инфекции респираторно-сентициального вируса, либо ЦМВ, или инвазия Aspergillus spp. в сочетании с грамотрицательной флорой или P. carinii/jiroveci. Пневмоцистоз в виде моноинфекции и/или в виде микст-инфекции чаще всего описывается у пациентов, получающих системную кортикостероидную терапию (это касается как длительных курсов монотерапии кортикостероидами, так и использования их в качестве составной части режима химиотерапевтической поддержки у онкологических больных).
В современной литературе описывается увеличение количества грибковых поражений и их торпидное течение у пациентов со сниженным иммунитетом, несмотря на применение новейших противогрибковых препаратов [8, 11, 12]. В настоящее время наиболее актуальными являются три инфекционных агента, вызывающих легочные изменения: Pneumocystis carinii/jirovici, представители рода Aspergillus (особенно A. fumigatus) и Cryptococcus neoformans [12, 14].
Таксономически пневмоцисты относят к грибам. В начале нового тысячелетия тип Pneumocystis carinii, вызывающий инфекции у человека, был выделен в отдельный вид Pneumocystis jiroveci — в честь чешского ученого-паразитолога Отто Йировеца, впервые описавшего этот микроорганизм как причину заболевания у человека.
P. jiroveci, являющийся внеклеточным паразитом с преимущественным тропизмом к легочной ткани, поражает пневмоциты 1-го и 2-го порядков. Сложности при проведении дифференциальной диагностики в случае подозрения на развитие у пациента пневмоцистной пневмонии (ПП) в основном объясняются тем фактом, что стандартное обследование больных малоинформативно, до 20% из них имеют стертую клинику, а рентгенологическое обследование не выявляет патологии. Первыми признаками развивающейся ПП являются медленно нарастающая гипоксемия, одышка и кашель при скудности данных физического осмотра и рентгенологических проявлений.
С клинических позиций выделяют три стадии болезни.
Диагностические мероприятия, направленные на выявление Pneumocystis jiroveci, начинают с получения индуцированной мокроты. Материал исследуют методом прямой микроскопии окрашенных мазков. В последнее время для более точной диагностики разработаны и применяются метод ПЦР, иммунофлюоресцентные методы с моно- и поликлональными антителами. Бронхоскопия с бронхоальвеолярным лаважем в сочетании с трансбронхиальной биопсией позволяет почти в 100% случаев обнаружить возбудителя и, следовательно, является наиболее эффективным и достоверным методом диагностики ПП. В тех случаях, когда пациенты прибегали к лечению пентамидином, эффективность диагностики с использованием бронхоальвеолярного лаважа снижалась до 60%. Окончательный диагноз пневмоцистоза ставится при обнаружении цист или трофозоидов в ткани или альвеолярной жидкости [7, 9].
В настоящее время обследование пациентов с подозрением на развитие ПП проводится по следующей схеме — всем больным с пневмонией лечение назначается эмпирически, и только при тяжелом легочном процессе проводится легочная биопсия. В отсутствие адекватного специфического лечения пневмоцистоза летальность достигает 100% у пациентов с иммунодефицитами и 50% — у недоношенных детей. Прогноз остается неблагоприятным (зависит от фонового состояния), и без коррекции иммунного статуса у 15% пациентов возникают рецидивы ПП [4, 8].
У пациентов, не получающих триметоприм-сульфаметоксазол (или иные антибактериальные препараты, назначаемые в режиме химиопрофилактики при высоком риске развития пневмоцистоза (табл. 2), сохраняется высокая вероятность возникновения пневмоцистоза на фоне развития ЦМВ-инфекции, что, возможно, связано с блокировкой альвеолярных макрофагов и снижением функции CD4-лимфоцитов.
Относительно частоты выявления пневмоцистоза в группе пациентов с иммунодефицитными состояниями (в которую не вошли пациенты с ВИЧ-инфекцией), следует отметить, что при отсутствии своевременно проводимых профилактических мероприятий примерно у 5–12% пациентов развивается развернутая клиника пневмоцистоза [13]. Применение активной антиретровирусной терапии существенно снижает риск развития ПП при СПИДе. В случае снижения уровня CD4 Рисунок 1. Обзорная рентгенография органов грудной клетки от 11.11.04.
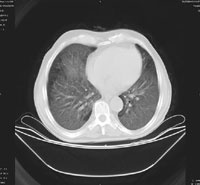
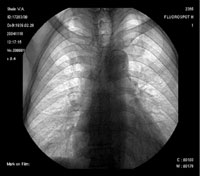
На момент госпитализации: состояние средней степени тяжести, обусловленное дыхательной недостаточностью. При осмотре кожных покровов видны сухие следы расчесов, акроцианоз. В подмышечных, паховых областях с обеих сторон пальпируются единичные, мягко-эластичной консистенции безболезненные лимфатические узлы. В легких при аускультации выслушивается жесткое дыхание, хрипов нет. Частота дыхания — 23–24 в минуту, пульс — 87 в минуту, артериальное давление — 140/80 мм рт. ст. Со стороны пищеварительной, мочеполовой, нервной систем патологии не выявлено. Больному была назначена антибактериальная терапия, включающая ципрофлоксацин, рифампицин. Помимо антибиотиков пациент получал муколитики, фестал, альмагель, бисакодил. На фоне проводимого лечения сохранялись гектические подъемы температуры, нарастала дыхательная недостаточность. С учетом затяжного течения пневмонии больной повторно был осмотрен фтизиатром, данных, подтверждающих туберкулез, снова не было выявлено. В ходе обследования методом иммуноферментного анализа и иммунного блотинга были выявлены антитела к ВИЧ, что заставило пересмотреть диагностический алгоритм и предположить развитие у больного ПП либо поражения легких в рамках ЦМВ-инфекции; окончательно не был исключен из диагностического ряда и вариант развития туберкулезного процесса в легких. Ввиду вышесказанного к проводимой терапии был добавлен бисептол в адекватных дозах. При иммунологическом исследовании выявлено абсолютное снижение CD4 до 19,3/ мкл. Все вышеперечисленное позволило диагностировать у больного ВИЧ-инфекцию в стадии 3Б (СПИД-ассоциированный комплекс), двустороннюю субтотальную пневмонию. При проведении (11.11.04) повторного рентгенологического исследования ОГК (рис. 1) отмечалась отрицательная динамика в виде нарастания объема и интенсивности инфильтрации легочной ткани. При ультразвуковом исследовании органов брюшной полости обнаружены диффузные изменения печени, поджелудочной железы, селезенки, увеличение лимфоузлов подмышечных, паховых областей. При контрольной компьютерной томографии ОГК отмечалась отрицательная динамика в виде прогрессирования диффузных изменений в обоих легких (рис. 2, 3). На фоне лечения у больного нарастала дыхательная недостаточность, сохранялись гектические подъемы температуры, развился ОРДС, в связи с чем пациент был переведен в отделение реанимации и интенсивной терапии, где осуществлялись респираторная поддержка, проводились антибактериальная, дезинтоксикационная терапия, противоязвенное и антитромботическое лечение, симптоматическая терапия. Однако, несмотря на все перечисленные мероприятия, 23.11.04 г. наступила остановка сердечной деятельности по типу асистолии.
 |
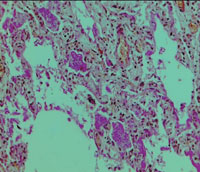
| Рисунок 4. Гиалиновые мембраны на стенках альвеол (окраска гематоксилином и эозином). Микрофотография |
 |
| Рисунок 5. Скопления Pneumocystis jiroveci в просветах альвеол (окраска PAS-методом). Микрофотография |
Согласно материалам аутопсии у больного было подтверждено наличие двухсторонней полисегментарной ПП, ОРДС: полнокровие капилляров альвеолоцитов и наличие гиалиновых мембран на стенках альвеол (рис. 4, 5).
Литература
А. Ф. Шепеленко, доктор медицинских наук, доцент
М. Б. Миронов, кандидат медицинских наук
А. А. Попов
Главный военный клинический госпиталь им. Н. Н. Бурденко,
ММА им. И. М. Сеченова, ГИУВ МО РФ, Москва
Пневмония при ВИЧ
Пневмония у ВИЧ-инфицированных характеризуется особенностью возбудителей инфекции, течения заболевания и лечения. Нередко клиническая картина ничем не отличается от других видов воспаления лёгких, однако в виду отсутствия у врачей настороженности в отношении ВИЧ-инфекции, диагностика иммунодефицитных пневмоний затруднительна.
В Юсуповской больнице пульмонологи применяют современную аппаратуру и инновационные методы обследования, позволяющие быстро установить точный диагноз. Для лечения пациентов пульмонологи используют современные препараты, эффективно действующие в условиях иммунодефицита. В клинике терапии работают врачи, имеющие огромный опыт лечения иммунодефицитных пневмоний. Все сложные случаи воспаления лёгких обсуждаются на заседании экспертного Совета.
Причины пневмонии при ВИЧ-инфекции
Пневмонию у ВИЧ-инфицированных вызывают грамотрицательные палочки. Часто при наличии иммунодефицита в виде пневмонии протекает туберкулёз. Одними из наиболее известных и значимых возбудителей оппортунистических пневмоний у ВИЧ-инфицированных пациентов в эру ретровирусной терапии остаются пневмоцисты.
Развитие пневмоцистной пневмонии определяет не только степень выраженности иммунодефицита, но и его характер. Средняя частота пневмоцистной пневмонии при ВИЧ-инфекции в настоящее время составляет 50 %, а при других иммунодефицитных состояниях не превышает 1 %. Развитию воспаления лёгких способствует нарушение клеточного и гуморального иммунитета.
Клинико-диагностические критерии пневмонии
Диагностика пневмонии у ВИЧ-инфицированных является сложной из-за отсутствия патогномоничных клинических признаков, частого сочетанного течения нескольких оппортунистических заболеваний одновременно на фоне глубокого поражения иммунной системы. Отсутствуют и точные лабораторные критерии, которые позволяли бы подтвердить диагноз.
Пневмония у ВИЧ-инфицированных начинается подостро. На протяжении нескольких недель нарастают следующие симптомы:
Во время физикального исследования врачи обнаруживают лихорадку и учащённое дыхание, перкуссия и аускультация грудной клетки изменений не выявляют. В Юсуповской больнице пациентам с подозрением на иммунодефицитную пневмонию делают крупнокадровую флюорографию или рентгенографию в двух проекциях. На рентгенограммах можно увидеть двусторонние изменения – ограниченные затемнения легочных полей или сетчатую перестройку легочного рисунка. Иногда пульмонологи видят множественные очаговые тени или круглые полости. У некоторых ВИЧ-инфицированных больных изменений, характерных для воспаления лёгких, может совсем не быть. В этом случае в Юсуповской больнице пациентам делают компьютерную томографию.
Изменения лабораторных показателей неспецифичны. В большинстве случаев пневмоний у ВИЧ-инфицированных увеличивается активность лактатдегидрогеназы, однако это бывает и при других респираторных заболеваниях на фоне СПИДа. При измерении газового состава крови врачи иногда обнаруживают гипоксемию, увеличение парциального давления кислорода и респираторный алкалоз (смещение рН в кислую сторону). Характерным признаком инфекции является снижение парциального давления кислорода при физической нагрузке.
Поскольку пневмоцистную пневмонию легко спутать с другими свойственными ВИЧ-инфицированным заболеваниями, а курс лечения долгий и сопряжён с тяжелыми побочными эффектами, врачи Юсуповской больницы для подтверждения диагноза используют лабораторные методы. Сначала прибегают к иммунофлюоресцентному окрашиванию мокроты с использованием моноклональных антител. Если возбудитель не найден, выполняют диагностическую бронхоскопию и трансбронхиальную биопсию лёгкого. Если бронхоскопия оказалась неинформативной или состояние пациента ухудшается, врачи клиник-партнёров проводят открытую биопсию лёгкого.
Золотым стандартом диагностики пневмонии у ВИЧ-инфицированных является микроскопическая визуализация возбудителя. В настоящее время часто используют иммунофлюоресцентную диагностику с использованием моноклональных антител. Серологические методы могут быть малоинформативными из-за выраженного иммунодефицита. В клиниках-партнёрах проводят молекулярную диагностику иммунодефицитных пневмоний.
При исследовании периферической крови специфических изменений при пневмоцистной пневмонии не наблюдается. Диагностировать пневмоцистную пневмонию помогает высокий уровень скорости оседания эритроцитов. Часто имеют место изменения в крови, характерные для поздних стадий СПИДа.
Лечение пневмонии у ВИЧ-инфицированных
Основным препаратом для лечения пневмонии у ВИЧ-инфицированных пациентов является ко-тримоксазол (комбинация триметоприма и сульфаметоксазола). При недостаточной эффективности или непереносимости ко-тримоксазола пациентам в европейских странах назначают пентамидин для внутривенного введения. Данный препарат не зарегистрирован в РФ и врачи Юсуповской больницы его не применяют.
Резервной схемой лечения пневмоцистной пневмонии умеренной степени тяжести является комбинация клиндамицина с примахином. Схема лечения пневмонии у ВИЧ-инфицированных обязательно включает комбинированную антиретровирусную терапию, если пациент не получал её ранее. Кортикостероидные гормоны назначают на фоне начала антибактериальной терапии с целью предупреждения усиления дыхательной недостаточности.
Запишитесь на приём к пульмонологу по телефону клиники. Контакт-центр Юсуповской больницы работает круглосуточно. Пациентов с симптомами пневмонии в зависимости от тяжести течения заболевания госпитализируют в клинику терапии или отделение реанимации и интенсивной терапии. Пульмонологи лечат пациентов с воспалением лёгких согласно европейских рекомендаций, используют индивидуальные схемы терапии.
Внебольничные пневмонии у взрослых больных ВИЧ-инфекцией: особенности течения и лечения, профилактика
Полный текст:
Аннотация
По результатам анализа публикаций показано, что заболеваемость бактериальной пневмонией у инфицированных вирусом иммунодефицита человека (ВИЧ) в 5–10 раз превышает показатель в популяции. При широкомасштабном применении антиретровирусной терапии (АРВТ) заболеваемость внегоспитальной пневмонией (ВП) снижается, но не так значительно, как в случае других оппортунистических инфекций. Наиболее значимыми факторами риска развития ВП признаны потребление наркотиков, табакокурение, ВИЧ-ассоциированная иммуносупрессия, цирроз печени и отсутствие АРВТ или перерывы в лечении. Развитие тяжелых, осложненных и инвазивных форм ВП и, как следствие, риск неблагоприятного исхода у больных ВИЧ-инфекцией встречается значительно чаще, чем среди населения в целом. В эндемичных по туберкулезу странах у больных ВИЧ-инфекцией бактериальную пневмонию наиболее часто приходится дифференцировать с пневмоцистной пневмонией и туберкулезом, особенно у лиц с подострым началом заболевания. Базовые принципы лечения ВП одинаковы для всех пациентов вне зависимости от ВИЧ-статуса. Однако в регионах с высоким бременем туберкулеза с множественной лекарственной устойчивостью микобактерий туберкулеза (МБТ) назначение фторхинолона ВИЧ-инфицированному пациенту с неисключенным туберкулезом имеет серьезные ограничения. Показано, что в случае ошибочного первоначального диагноза за 10 дней монотерапии фторхинолоном МБТ формируют устойчивость к препарату, что значительно усложняет и значительно повышает стоимость лечения туберкулеза. β-Лактамные антибактериальные препараты (АБП) не обладают противотуберкулезной активностью, а макролиды по причине чрезвычайно слабой активности в отношении МБТ Всемирной организацией здравоохранения в 2016 г. исключены из списка препаратов для лечения туберкулеза. Поэтому у ВИЧ-инфицированных наиболее оправданным началом стартовой эмпирической терапии ВП является именно комбинация β-лактамного АБП и современного макролида. Доказано, что вакцинация 23-валентной полисахаридной пневмококковой вакциной имеет серьезное проективное действие в отношении развития ВП у пациентов с ВИЧ-инфекцией, однако наиболее высокий индекс профилактической эффективности отмечен у лиц с относительно сохранным иммунитетом, нежели у больных с количеством CD4
Ключевые слова
Об авторах
д. м. н., профессор кафедры инфекционных болезней с курсами эпидемиологии и фтизиатрии медицинского института ФГАОУ ВО «Российский университет дружбы народов»; тел.: (495)-365-25-33;
к. м. н., менеджер проектов по клиническому развитию медицинского отдела ООО «Эбботт Лэбораториз»; тел.: (495)-258-42-80;
Список литературы
1. Федеральный научно-методический центр по профилактике и борьбе со СПИДом ФБУН ЦНИИЭ. Справка «ВИЧ-инфекция в Российской Федерации на 31 декабря 2014 г.». URL: http://www.hivrussia.ru/files/bul_40.pdf (дата обращения: 06.08.2016).
2. Литвинова Н.Г., Кравченко А.В., Шахгильдян В.И. и др. Поражение нижних дыхательных путей у больных ВИЧ-инфекцией. Эпидемиология и инфекционные болезни. 2004; 4: 24–27.
3. Hirschtick R.E., Glassroth J., Jordan M.C. et al. Bacterial pneumonia in persons infected with the human immunodeficiency virus. Pulmonary Complications of HIV Infection Study Group. N. Engl. J. Med. 1995; 28; 333 (13): 845–851.
4. Twigg H.L., Soliman D.M., Day R.B. et al. Lymphocytic alveolitis, bronchoalveolar lavage viral load, and outcome in human immunodeficiency virusinfection. Am. J. Respir. Crit. Care Med. 1999; 159 (5, Pt 1): 1439–1444.
5. Jones J.L., Hanson D.L., Dworkin M.S. et al. Surveillance for AIDS-defining opportunistic illnesses, 1992–1997. Morb. Mortal. Wkly. Rep. CDC Surveill. Summ. 1999; 16; 48 (2): 1–22.
6. Serraino D., Puro V., Boumis E. et al. Epidemiological aspects of major opportunistic infections of the respiratory tract in persons with AIDS: Europe, 1993–2000. AIDS. 2003 26; 17 (14): 2109–2116.
7. Sullivan J.H., Moore R.D., Keruly J.C. et al. Effect of antiretroviral therapy on the incidence of bacterial pneumonial in patients with advanced HIV infection. Am. J. Respir. Crit. Care Med. 2000; 162 (1): 64–67.
8. Crothers K., Huang L., Goulet J.L. et al. HIV infection and risk for incident pulmonary diseases in the combination antiretroviral therapy era. Am. J. Respir. Crit. Care Med. 2011; 183 (3): 388–395. DOI: 10.1164/rccm.201006-0836OC.
9. Bordon J., Kapoor R., Martinez C. et al. CD4+-cell counts and HIV-RNA levels do not predict outcomes of community-acquired pneumonia in hospitalized HIV-infected patients. Int. J. Infect. Dis. 2011; 15 (12): e822–e827. DOI: 10.1016/j.ijid.2011.05.021.
10. Chew K.W., Yen I.H., Li J.Z. et al. Predictors of pneumonia severity in HIV-infected adults admitted to an Urban public hospital. AIDS Patient Care STDS. 2011; 13 25 (5): 273–277. DOI: 10.1089/apc.2010.0365.
11. Segal L.N., Methé B.A., Nolan A. et al. HIV-1 and bacterial pneumonia in the era of antiretroviral therapy. Proc. Am. Thorac. Soc. 2011; 8 (3): 282–287. DOI: 10.1513/pats.201006-044WR.
12. WHO Case Definitions of HIV for Surveillance and Revised Clinical Staging and Immunological Classification of HIV-Related Disease in Adults and Children. Geneva: World Health Organisation; 2007. URL: http://www.who.int/hiv/pub/guidelines/HIVstaging.pdf (дата обращения: 06.08.2016).
13. CDC. Revised Surveillance Case Definition for HIV Infection. United States, 2014. Morb. Mortal. Wkly. Rep. Recomm. Rep. 2014; 63 (RR-03): 1–10.
14. Приказ Минздравсоцразвития РФ от 17.03.06 № 166 «Об утверждении инструкции по заполнению годовой формы федерального государственного и статистического наблюдения № 61 «Сведения о контингентах больных ВИЧ-инфекцией». М.; 2006. URL: http://www.webapteka.ru/phdocs/doc11200.html (дата обращения: 06.08.2016).
15. Сведения о результатах тестирования представителей различных контингентов на антитела к ВИЧ в субъектах Российской Федерации на 2013–2014 гг. ВИЧ-инфекция. Информационный бюллетень № 40. М.; 2015. URL: http://hivrussia.ru/files/bul_40.pdf (дата обращения: 06.08.2016).
16. Wallace J.M., Rao A.V., Glassroth J. et al. Respiratory illness in persons with human immunodeficiency virus infection. The Pulmonary Complications of HIV Infection Study Group. Am. Rev. Respir. Dis. 1993; 148 (6, Pt 1): 1523–1529.
17. Gordin F.M., Roediger M.P., Girard P.M. et al. Pneumonia in HIV-infected persons: increased risk with cigarette smoking and treatment interruption. Am. J. Respir. Crit. Care Med. 2008; 178 (6): 630–636. DOI: 10.1164/rccm.200804-617OC.
18. Grau I., Pallares R., Tubau F. et al. Epidemiologic changes in bacteremic pneumococcal disease in patients with human immunodeficiency virus in the era of highly active antiretroviral therapy. Arch. Intern. Med. 2005; 165 (13): 1533–1540.
19. Jones J.L., Hanson D.L., Dworkin M.S. et al. Surveillance for AIDS-defining opportunistic illnesses, 1992–1997. Morb. Mortal. Wkly. Rep. CDC Surveill. Summ. 1999; 48 (2): 1–22.
20. Sullivan J.H., Moore R.D., Keruly J.C. et al. Effect of antiretroviral therapy on the incidence of bacterial pneumonia in patients with advanced HIV infection. Am. J. Respir. Crit. Care Med. 2000; 162 (1): 64–67.
21. Serraino D., Puro V., Boumis E. et al. Epidemiological aspects of major opportunistic infections of the respiratory tract in persons with AIDS: Europe, 1993–2000. AIDS. 2003; 17 (14): 2109–2116.
22. Bénard A., Mercié P., Alioum A. et al. Bacterial pneumonia among HIV-infected patients: decreased risk after tobacco smoking cessation. ANRS CO3 Aquitaine Cohort, 2000–2007. PLoS One. 2010; 5 (1): e8896. DOI: 10.1371/journal.pone.0008896.
23. Madeddu G., Fiori L.M., Mura S.M. Bacterial community-acquired pneumonia in HIV-infected patients. Curr. Opin. Pulm. Med. 2010; 16 (3): 201–207. DOI: 10.1097/MCP.0b013e3283375825.
24. Manno D., Puoti M., Signorini L. et al. Risk factors and clinical characteristics associated with hospitalization for community-acquired bacterial pneumonia in HIV-positive patients according to the presence of liver cirrhosis. Infection. 2009; 37 (4): 334–339. DOI: 10.1007/s15010-009-8140-5.
25. Burack J.H., Hahn J.A., Saint-Maurice D. et al. Microbiology of community-acquired bacterial pneumonia in persons with and at risk for human immunodeficiency virus type 1 infection. Implications for rational empiric antibiotic therapy. Arch. Intern. Med. 1994; 154 (22): 2589–2596.
26. Miller R.F., Foley N.M., Kessel D. et al. Community acquired lobar pneumonia in patients with HIV infection and AIDS. Thorax. 1994; 49 (4): 367–368.
27. Mundy L.M., Auwaerter P.G., Oldach D. et al. Community-acquired pneumonia: impact of immune status. Am. J. Respir. Crit. Care Med. 1995; 152 (4, Pt 1): 1309–1315.
28. Afessa B., Green B. Bacterial pneumonia in hospitalized patients with HIV infection: the Pulmonary Complications, ICU Support, and Prognostic Factors of Hospitalized Patients with HIV (PIP) Study. Chest. 2000; 117 (4): 1017–1022.
29. Park D.R., Sherbin V.L., Goodman M.S. et al. The etiology of community-acquired pneumonia at an urban public hospital: influence of human immunodeficiency virus infection and initial severity of illness. J. Infect. Dis. 2001; 184 (3): 268–277.
30. Rimland D., Navin T.R., Lennox J.L. et al. Prospective study of etiologic agents of community-acquired pneumonia in patients with HIV infection. AIDS. 2002; 16 (1): 85–95.
31. Tarp B., Jensen J.S., Ostergaard L. et al. Search for agents causing atypical pneumonia in HIV-positive patients by inhibitor-controlled PCR assays. Eur. Respir. J. 1999; 13 (1): 175–179.
33. Osmond D.H., Chin D.P., Glassroth J. et al. Impact of bacterial pneumonia and Pneumocystis carinii pneumonia on human immunodeficiency virus disease progression. Pulmonary Complications of HIV Study Group. Clin. Infect. Dis. 1999; 29 (3): 536–543.
34. Kohli R., Lo Y., Homel P. et al. Bacterial pneumonia, HIV therapy, and disease progression among HIV-infected women in the HIV epidemiologic research (HER) study. Clin. Infect. Dis. 2006; 43 (1): 90–98.
35. Dworkin M.S., Ward J.W., Hanson D.L. et al. Pneumococcal disease among human immunodeficiency virus-infected persons: incidence, risk factors, and impact of vaccination. Clin. Infect. Dis. 2001; 32: 794–800.
36. Nuorti J.P., Butler J.C., Gelling L. et al. Epidemiologic relation between HIV and invasive pneumococcal disease in San Francisco County, California. Ann. Intern. Med. 2000; 132: 182–190.
37. Jones N., Huebner R., Khoosal M. et al. The impact of HIV on Streptococcus pneumoniae bacteraemia in a South African population. AIDS. 1998; 12 (16): 2177–2184.
38. Hibbs J.R., Douglas J.M. Jr, Judson F.N. et al. Prevalence of human immunodeficiency virus infection, mortality rate, and serogroup distribution among patients with pneumococcal bacteremia at Denver General Hospital, 1984–1994. Clin. Infect. Dis. 1997; 25 (2): 195–199.
39. Redd S.C., Rutherford G.W., Sande M.A. et al. The role of human immunodeficiency virus infection in pneumococcal bacteremia in San Francisco residents. J. Infect. Dis. 1990; 162 (5): 1012–1017.
40. Barry P.M., Zetola N., Keruly J.C. et al. Invasive pneumococcal disease in a cohort of HIV-infected adults: incidence and risk factors, 1990–2003. AIDS. 2006; 20 (3): 437–444 DOI: 10.1097/01.aids.0000206507.54901.84.
41. Heffernan R.T., Barrett N.L., Gallagher K.M. et al. Declining incidence of invasive Streptococcus pneumoniae infections among persons with AIDS in an era of highly active antiretroviral therapy, 1995–2000. J. Infect. Dis. 2005; 191 (12): 2038–2204.
42. Curran A., Falcó V., Crespo M. et al. Bacterial pneumonia in HIV-infected patients: use of the pneumonia severity index and impact of currentmanagement on incidence, aetiology and outcome. HIV Med. 2008; 9 (8): 609–615. DOI: 10.1111/j.1468-1293.2008.00603.x.
43. Cordero E., Pachon J., Rivero A. et al. Community-acquired bacterial pneumonia in human immunodeficiency virus infected patients: validation of severity criteria. The Grupo Andaluz para el Estudio de las Enfermedades Infecciosas. Am. J. Respir. Crit. Care Med. 2000; 162 (6): 2063–2068.
44. Пархоменко Ю.Г., Зюзя Ю.Р., Флигиль Д.М. Дифференциальная диагностика деструктивных поражений легких при ВИЧ-ассоциированных инфекциях. Архив патологии. 2011; 1: 9–12.
45. Horo K., Koné A., Koffi M.O. et al. Comparative diagnosis of bacterial pneumonia and pulmonary tuberculosis in HIV positive patients. Rev. Mal. Respir. 2016; 33 (1): 47–55. DOI: 10.1016/j.rmr.2015.01.004.
46. Cilloniz C., Torres A., Polverino E. et al.Community-acquired lung respiratory infections in HIV-infected patients: microbial aetiology and outcome. Eur. Respir. J. 2014; 43 (6): 1698–1708. DOI: 10.1183/09031936.00155813.
47. Selwyn P.A., Pumerantz A.S., Durante A. et al. Clinical predictors of Pneumocystis carinii pneumonia, bacterialpneumonia and tuberculosis in HIV-infected patients. AIDS. 1998; 12 (8): 885–893.
48. Сайт Федеральной службы государственной статистики. URL: http://www.gks.ru/wps/wcm/connect/rosstat_main/rosstat/ru/statistics/population/healthcare/# (дата обращения 08.08.16).
49. Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in HIV-infected adults and adolescents: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. Chapter «Bacterial Respiratory Disease». 2014; 97–109. Available at https://aidsinfo.nih.gov/guidelines/html/4/adult-and-adolescent-oi-prevention-and-treatment-guidelines/327/bacterial-respiratory (дата обращения 08.08.2016).
50. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Российское респираторное общество (РРО) Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ). Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых. Пульмонология. 2014; 4: 13–48.
51. Гаращенко Т.И., Геппе Н.А., Гомберг М.А. и др. Роль и место современных макролидов в лечении бактериальных инфекций. Клиническая микробиология и антимикробная химиотерапия. 2014; 16 (1); 78–84.
52. Porwal C., Kaushik A., Makkar N. et al. Incidence and risk factors for extensively drug-resistant tuberculosis in Delhi region. PLoS One. 2013; 8 (2): e55299. DOI: 10.1371/journal.pone.0055299.
53. Chen T.C., Lu P.L., Lin C.Y. et al Fluoroquinolones are associated with delayed treatment and resistance in tuberculosis: a systematic review and meta-analysis. Int. J. Infect. Dis. 2011; 15 (3): e211–e216.
54. Devasia R.A., Blackman A., Gebretsadik T. et al. Fluoroquinolone resistance in Mycobacterium tuberculosis: the effect of duration and timing of fluoroquinoloneexposure. Am. J. Respir. Crit. Care Med. 2009; 180 (4): 365–370. DOI: 10.1164/rccm.200901-0146OC.
55. These guidelines were developed in compliance with the process for evidence gathering, assessment and formulation of recommendations, as outlined in the WHO Handbook for Guideline Development. 2014. WHO Treatment guidelines for drug-resistant tuberculosis – 2016 update. March; Available at http://www.who.int/kms/handbook_2nd_ed.pdf
56. García Vázquez E., Mensa J., Martínez J.A. et al. Lower mortality among patients with community-acquired pneumonia treated with a macrolide plus a beta-lactam agent versus a beta-lactam agent alone. Eur. J. Clin. Microbiol. Infect. Dis. 2005; 24 (3): 190–195.
57. Nie W., Li B., Xiu Q. β-Lactam/macrolide dual therapy versus β-lactam monotherapy for the treatment of community-acquired pneumonia in adults: a systematic review and meta-analysis. J. Antimicrob. Chemother. 2014; 69 (6): 1441–1446. DOI: 10.1093/jac/dku033.
58. Martin-Loeches I., Lisboa T., Rodriguez A. et al. Combination antibiotic therapy with macrolides improves survival in intubated patients with community-acquired pneumonia. Intens. Care Med. 2010; 36 (4): 612–620. DOI: 10.1007/s00134-009-1730-y.
59. Restrepo M.I., Mortensen E.M., Waterer G.W. et al. Impact of macrolide therapy on mortality for patients with severe sepsis due to pneumonia. Eur. Respir. J. 2009; 33 (1): 153–159. DOI: 10.1183/09031936.00054108.
60. Lodise T.P., Kwa A., Cosler L. et al. Comparison of beta-lactam and macrolide combination therapy versus fluoroquinolone monotherapy inhospitalized Veterans Affairs patients withcommunity-acquiredpneumonia. Antimicrob. Agents Chemother. 2007; 51 (11): 3977–3982.
61. Clinical Guidelines Portal. Guidelines for the Prevention and Treatment of Opportunistic Infections in HIV-Infected Adults and Adolescents Bacterial Respiratory Disease. Available at: https://aidsinfo.nih.gov/guidelines/html/4/adult-and-adolescent-oi-prevention-and-treatment-guidelines/327/bacterial-respiratory
62. Чучалин А.Г., Биличенко Т.Н., Осипова Г.Л. и др. Вакцинопрофилактика болезней органов дыхания в рамках первичной медико-санитарной помощи населению. Клинические рекомендации. Пульмонология: прил. 2015; 25 (2): 1–20. http://www.pulmonology.ru/download/Prilogenie_2015_final.pdf (дата обращения 08.08.2016).
63. Фельдблюм И.В., Николенко В.В., Воробьева Н.Н. и др. Реактогенность, безопасность, иммуногенность и профилактическая эффективность полисахаридной пневмококковой вакцины при иммунизации ВИЧ-инфицированных пациентов. Журнал микробиологии, эпидемиологии и иммунобиологии. 2013; 3: 52–60.
64. Gebo K.A., Moore R.D., Keruly J.C. et al. Risk factors for pneumococcal disease in human immunodeficiency virus-infected patients. J. Infect. Dis. 1996; 173 (4): 857–862.
65. Guerrero M., Kruger S., Saitoh A. et al. Pneumonia in HIV-infected patients: a case-control survey of factors involved in risk and prevention. AIDS. 1999; 13 (14): 1971–1975.
66. Breiman R.F., Keller D.W, Phelan M.A. et al. Evaluation of effectiveness of the 23-valent pneumococcal capsular polysaccharide vaccine for HIV-infected patients. Arch. Int. Med. 2000; 160 (17): 2633–2638.
67. Recommended Adult Immunization Schedule. United States, October 2007–September 2008. Morb. Mortal. Wkly. Rep. 2007; 56: Q1–Q4.
68. Hung C.C., Chen M.Y., Hsieh S.M. et al. Clinical experience of the 23-valent capsular polysaccharide pneumococcal vaccination in HIV-1-infected patients receiving highly active antiretroviral therapy: a prospective observational study. Vaccine. 2004; 22 (15–16): 2006–2012.
69. Peñaranda M., Falco V., Payeras A. et al. Effectiveness of polysaccharide pneumococcal vaccine in HIV-infected patients: a case-control study. Clin. Infect. Dis. 2007; 45 (7): e82–e87.
70. Fiore A.E., Uyeki T.M., Broder K. et al. Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2010. Morb. Mortal. Wkly. Rep. Recomm. Rep. 2010; 59 (RR-8): 1–62.
71. Sibanda E.L., Weller Ian V.D., Hakim J.G. et al. Does trimethoprim-sulfamethoxazole prophylaxis for HIV induce bacterial resistance to other antibiotic classes? Results of a systematic review. Clin. Infect. Dis. 2011; 52 (9): 1184–1194. DOI: 10.1093/cid/cir067.
72. Hirschtick R.E., Glassroth J., Jordan M.C. et al. Bacterial pneumonia in persons infected with the human immunodeficiency virus. Pulmonary Complications of HIV Infection Study Group. N. Engl. J. Med. 1995; 333 (13): 845–851.
73. Eigenmann C., Flepp M., Bernasconi E. et al. Low incidence of community-acquired pneumonia among Human Immunodeficiency Virus-infected patients after interruption of Pneumocystis carinii pneumonia prophylaxis. Clin. Infect. Dis. 2003; 36: 917–921.