Чем опасно поступление ксенобиотиков разобщителей
Что такое ксенобиотики?
Это вещества, которые организм не может использовать ни для производства энергии, ни для построения каких-либо тканей, но они вполне могут навредить человеку, особенно если у него аллергия.
Ксенобиотики разделяют на 3 группы:
К сожалению, разрешенные в пищевой промышленности, пищевые добавки —красители, консерванты, стабилизатора и др. тоже относятся к ксенобиотикам.
Эти вещества с достаточно высокой молекулярной массой, сами могут обладать свойствами аллергенов и, кроме того, они резко повышают агрессивность «обычных» аллергенов (пищевых, пыльцевых, бытовых).
В зависимости от особенностей генома люди по разному реагируют на ксенобиотики. Существуют гены, которые несут ответственность за синтез белков, инактивирующих ксенобиотики, поступающие в организм. Эти белки находятся в основном в ЖКТ, дыхательных путях.
Другими словами, генетически запрограммированная система обезвреживания ксенобиотиков делает уникальным каждого человека в отношении его устойчивости или чувствительности к повреждающим внешним факторам (пищевые добавки, лекарства и др.).
Отсюда и разнообразие реакций организма на распространенные, разрешенные к употреблению в пищу вещества.
Исходя из всего вышесказанного общими правилами для людей, склонных к аллергическим и псевдоаллергическим реакциям являются:
Надеюсь вопросов не осталось по поводу того, что когда вы приходите на прием вашему ребенку или вам назначают гипоаллергенную диету, исключая самые любимые продукты (пицу, мороженое, шоколад и др.)
Что такое ксенобиотики и чем они опасны?
Ксена, ксенобиотики и все-все-все
Многим из нас с детства знаком сериал о непобедимой воительнице, принцессе Ксене (Зене), которая сражается с силами зла. А знаете ли вы, что «Ксена» в переводе с греческого языка означает «чужая»?
Помимо воинствующей принцессы такое же имя носит семейство вредных, чужеродных организму веществ.
Знакомьтесь — ксенобиотики!
Ксенобиотики — это антибиотики, пестициды, гербициды, синтетические красители, моющие вещества, гормоны и другие химические соединения. Они содержатся в грунте, воде, продуктах, воздухе. Эти чуждые для нашего организма вещества, попадая в организм, подрывают иммунитет и становятся причиной отравлений и аллергических реакций. К большому сожалению, полностью отгородиться от их вредного влияния сегодня попросту нереально.
Ксенобиотики вызывают нарушение работы многих органов, и, как следствие, становятся причиной болезней органов пищеварения, дыхания, сердечно-сосудистой системы, почек. При длительном влиянии на человека ксенобиотики становятся причиной злокачественных опухолей.
Матушка-природа предусмотрела механизмы защиты от чужаков. Они уничтожаются клетками иммунной системы, печени, существуют даже клеточные барьеры для различных токсических веществ.
А человечество, придумавшее эти ксенобиотики, придумало и кишечные сорбенты (Энтеросгель). Благодаря энтеросорбентам «вредные» молекулы поглощаются и выводятся из организма, обеспечивая полноценную работу печени, предохраняя клетки от вредных факторов воздействия.
Для того, чтобы защита была крепкой, организму нужны помощники — питательные вещества. Кто же это может быть?
Витамины
Витамины защищают иммунные клетки от повреждений.
Основные источники витаминов: овощи, фрукты, злаковые, морская капуста, зелёный чай.
Минералы
За иммунитет отвечают микроэлементы: селен, магний и цинк.
Эти минералы содержатся в злаковых, бобовых, в морепродуктах, в печени, яйцах.
Холестерин и фосфолипиды
Эти вещества — «кирпичики» для клеточных мембран, в частности — клеток печени. Достаточное поступление этих фосфолипидов с пищей обеспечивает «стойкость» печёночных клеток к «чужакам». Жирные кислоты, холин, «хороший» холестерин содержатся в морской рыбе, орехах, желтках, семенах льна.
Белки
Работа печени напрямую связана с тем, что мы ежедневно едим. При недостаточном употреблении белковой пищи активность работы печени снижается.
Где организму взять необходимые белки?
В орехах, зелени, бобовых, яйцах, мясе домашней птицы, в речной и морской рыбе, нежирном сыре, молоке.
Клетчатка
Начиная борьбу с ксенобиотиками, нельзя забывать и о пользе пищевых волокон. Они, как и Энтеросгель, удерживают на своей поверхности большое количество токсинов и канцерогенов.
Пищевыми волокнами (клетчаткой) богаты фруктовые и овощные пюре, мармелад, овсяные и пшеничные отруби, морская капуста.
Фитонциды
Всем известна польза фитонцидов. О них всегда много говорят в период борьбы с гриппом и другими вирусными инфекциями. Больше всего фитонцидов в луке и чесноке. Богаты фитонцидами:
Морковь, хрен, томат, болгарский перец, яблоки «Антоновка», цитрусовые.
Ягоды: черника, ежевика, кизил, калина;
Вредные продукты: список
Немалая часть ксенобиотиков попадает в организм «благодаря» нашим кулинарным пристрастиям. Для того чтобы не подвергать себя неоправданному риску, давайте откажемся от вредной пищи!
Итак, в «чёрном» списке:
сосиски, колбасы, копчёности;
маргарин, майонез, уксус;
продукты, содержащие большое количество глутамата натрия и соли;
кондитерские изделия и сладкие газированные напитки;
продукты, содержащие консерванты и красители.
Значит ли это, что их стоит исключить из рациона? Здоровье ваше, так что «думайте сами, решайте сами!»
К сожалению, продуктов из «расстрельного» списка избежать удаётся не всегда — именно для таких случаев существует энтеросорбент №1 — Энтеросгель! Этот препарат, созданный по заказу Министерства Обороны СССР, помогает эффективно и безопасно для здоровья бороться с отравлениями, аллергией, похмельем, вредными пищевыми добавками и даже выводит радионуклиды.
Основные пути поступления ксенобиотиков в организм
| Сайт: | Образовательный портал МБФ (ВолгГМУ) |
| Курс: | Химико-токсикологические исследования в работе клинической лаборатории |
| Книга: | Основные пути поступления ксенобиотиков в организм |
Описание
Оглавление
1. Общее представление
Подавляющее большинство веществ может проникать в организм через один или несколько тканевых барьеров: кожные покровы, дыхательные пути, желудочно-кишечный тракт (ЖКТ). В зависимости от того, какой из барьеров преодолевает вещество, говорят о резорбции через слизистые оболочки, чрезкожном, пероральном или ингаляционном пути поступления ксенобиотика в организм. Важное значение может иметь взаимосвязь различных способов поступления. Так, токсические соединения, поступившие в организм через ЖКТ, могут выводиться из него через легкие и тем самым оказывать на них повреждающее действие. Возможно вовлечение ксенобиотиков в «порочный круг», основой которого является ретенция, т.е. их задержка из-за тесной физиологической связи ЖКТ и печени.
Пути поступления и распределения ксенобиотиков в организме человека
2. Чрезкожное поступление.
Площадь кожных покровов взрослого человека составляет в среднем 1,6 м, пятилетнего ребенка — 0,8 м2. Кожа — не просто пассивный барьер, отделяющий организм от окружающей среды. В эпидермальном слое осуществляется метаболизм некоторых ксенобиотиков, хотя общая активность процессов не превышает 2 — 6% от метаболической активности печени. Проникновение веществ через кожу осуществляется тремя путями: через эпидермис, через сальные и потовые железы, через волосяные фолликулы. Для хорошо проникающих через кожу низкомолекулярных и липофильных соединений основным является трансэпидермальный путь. На процесс резорбции в наибольшей степени влияют физико-химические свойства ксенобиотиков, и прежде всего их липофильность.
3. Резорбция через слизистые оболочки.
Резорбция через слизистые оболочки. Слизистые оболочки лишены рогового слоя и жировой пленки на поверхности. Их функция состоит в осуществлении обмена веществами между организмом и внешней средой. Эти отличия от кожи объясняют, почему многие вещества достаточно легко проникают через слизистые оболочки. Резорбция веществ через слизистые определяется главным образом следующими факторами:
• агрегатное состояние вещества (газ, аэрозоль, взвесь, раствор);
• доза и концентрация ксенобиотика;
• вид слизистой оболочки, ее толщина;
• интенсивность кровоснабжения анатомической структуры.
4. Пероральное поступление.
5. Ингаляционное поступление.
Биотрансформация ксенобиотиков и загрязняющих окружающую среду веществ»
Классификация ксенобиотиков. Пути поступления ксенобиотиков в организм человека. Влияние пищевых продуктов на всасывание ксенобиотиков. Характеристика метаболизма ксенобиотиков. Связывание, транспорт и выведение ксенобиотиков. Индукция защитных систем.
| Рубрика | Производство и технологии |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 14.04.2020 |
| Размер файла | 1,5 M |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Размещено на http://www.allbest.ru/
Федеральное государственное бюджетное образовательное учреждение высшего образования
«ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ» (ПензГТУ)
Кафедра «Биотехнологии и техносферная безопасность»
Дисциплина «Методологические основы исследований в биотехнологии»
на тему: «Биотрансформация ксенобиотиков и загрязняющих окружающую среду веществ»
ПензГТУ 3.19.04.01.002 ПЗ
Выполнил: студент группы 19БТ1м
Проверил: доцент каф. БТБ, к. б. н.
Работа защищена с оценкой:
на курсовую работу
по дисциплине «Методологические основы исследований в биотехнологии»
Студенту Епифановой Юлии Абдулхаковне Группа 19БТ1м
Тема работы: Биотрансформация ксенобиотиков и загрязняющих окружающую среду веществ
1. Ксенобиотики. Общая характеристика;
2. Биологическая активность ксенобиотиков;
3. Биотрансформация ксенобиотиков.
Руководитель Кузьмин А. А.
Студент Епифанова Ю. А.
Пояснительная записка курсовой работы содержит 27 стр., 6 рисунков, 9 библиографических источников.
КСЕНОБИОТИКИ, БИОТРАНСФОРМАЦИЯ, ХИМИЧЕСКИЕ СОЕДИНЕНИЯ, ДНК, ТОКСИЧНОСТЬ, БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ, МИКРОСОМАЛЬНАЯ СИСТЕМА МЕТАБОЛИЗМА.
Цель курсовой работы: изучить основные характеристики ксенобиотиков, а также их биотрансформацию, рассмотреть их классификацию и пути поступления в организм, проанализировать биологическую активность ксенобиотиков.
Стремительные темпы развития промышленного производства, химизация народного хозяйства ведут к появлению во внешней среде большого количества разнообразных химических соединений, постоянно загрязняющих биосферу и пагубно влияющих на живую природу.
В силу различных причин многие химические вещества, поступающие в организм и ранее не встречающиеся в нем, получили название чужеродных или ксенобиотиков. К таким веществам относятся синтетические и природные лекарственные препараты, пестициды, промышленные яды, отходы производств, пищевые добавки, косметические средства и прочие.
Актуальность проблем, рассматриваемых в ксенобиологии все возрастает. Это обусловлено тем, что ежегодно на Земле синтезируются десятки тысяч новых соединений. Ряд из них вовлекаются в круговорот веществ в природе. Чем шире масштабы производства химических соединений, тем больше влияние они оказывают на биологические процессы в почве, водоемах и на суше, тем сильнее проявляются побочные и отдаленные последствия их действия на живые системы.
Воздействие ксенобиотиков на живой мир, и на человека в частности происходит, в самых различных комбинациях этих соединений не только друг с другом, но и с фактором окружающей среды. Поэтому многие из ксенобиотиков, вошедших в сегодняшнюю практику могут являться носителями опасного биологического действия.
1 КСЕНОБИОТИКИ. ОБЩАЯ ХАРАКТЕРИСТИКА
1. Изменять метаболизм в клетках или тканях. В результате нарушаются естественные процессы в организме, проявляется определенная симптоматика.
2. Воздействовать на клеточную ДНК, изменять генетическую информацию. В результате происходит злокачественная трансформация.
3. Подражать действию естественных соединений, к примеру, гормонов. Это обуславливает нарушение нормального роста, развития тканей, органов, иммунной, нервной систем.
4. Изменять активность защиты организма. В этом случае негативное воздействие проявляется в иммунной модуляции, выражающейся в развитии гиперчувствительности, увеличении количества В- или Т-лимфоцитов, стимулировании аутоиммунных процессов.
1. Нарушения репродуктивной функции;
2. Злокачественные образования в половой системе мужчин;
4. Раковые опухоли молочной железы;
5. Угнетение иммунитета;
6. Гипертрофия щитовидки;
7. Расстройство психомоторного развития в детском возрасте.
Воздействие ксенобиотиков может привести к снижению жизнеспособности, плодовитости и вызвать гибель живых организмов, популяций или сообществ. К их числу относятся:
· продукты хозяйственной деятельности человека (промышленность, сельское хозяйство, транспорт);
· вещества бытовой химии (моющие средства, вещества для борьбы с паразитами, косметические средства);
· многие лекарственные препараты.
1.1 Классификация ксенобиотиков
Классификация ксенобиотиков в зависимости от источника происхождения и практического применения:
1. Промышленные ксенобиотики, к которым относятся органические растворители; вещества, применяемые в качестве топлива (метан, пропан, бутан); красители (анилин и его производные; фреоны); химические реагенты, полупродукты органического синтеза и др.;
2. Химические удобрения и средства защиты растений, в том числе пестициды, направленные на уничтожение вредных насекомых, сорных растений, грибов и т. д.;
3. Лекарственные средства и полупродукты фармацевтической промышленности;
4. Бытовые химикаты, используемые в качестве инсектицидов, красителей, лаков, парфюмерно-косметических средств, пищевых добавок, антиоксидантов;
5. Растительные и животные яды;
6. Боевые отравляющие вещества.
Основные причины, вызывающие канцерогенез (мутагенез), под действием ксенобиотиков:
· активирование ферментов, изменение ДНК и нуклеофильных групп;
· ограниченная способность клеток удалять химически модифицированные участки ДНК и восстанавливать ее структуру;
· способность химических веществ активировать ферменты от вида клетки и стадии ее развития (фазы пролиферации), а также от вида организма;
· многоступенчатость процесса канцерогенеза и обуславливающие факторы, которые частично зависят от «микроокружения» раковой клетки;
· способность мутагенных химических соединений выступать в качестве промоторов появления опухолей; мутации лишь в определенных условиях приводят к образованию опухолей;
Таблица 1. Токсикологическая классификация ксенобиотиков
Общий характер токсического воздействия
Характерные представители токсических веществ
Нервно-паралитическое действие (бронхоспазм, удушье, судороги и параличи)
Фосфорорганические инсектициды (хлорофос, карбофос и пр.), никотин, анабазин, БОВ («Ви-Икс», зарин)
Дихлорэтан, гексахлоран, БОВ (иприт, люизит), уксусная эссенция, мышьяк и его соединения, ртуть (сулема)
Общетоксическое действие (гипоксические судороги, кома, отек мозга, параличи)
Синильная кислота и ее производные, угарный газ, алкоголь и его суррогаты, БОВ (хлорциан)
Удушающее действие (токсический отек легких
Окислы азота, БОВ (фосген, дифосген)
Слезоточивое и раздражающее действие (раздражение наружных слизистых оболочек)
Хлорпикрин, БОВ («Си-Эс», адамсит и пр.), пары крепких кислот и щелочей
Таблица 2. Классификация ксенобиотиков по избирательности действия
Характер «избирательной токсичности
Характерные представители токсических веществ
Сердечные гликозиды (дигиталис, дигоксин, лантозид и пр.); трициклические антидепрессанты (имипрамин, амитриптилин);растительные яды (аконит, чемерица заманиха,хинин и пр.); животные яды (тетродоксин); соли бария, калия
Психофармакологические средства (наркотики, транквилизаторы, снотворные); фосфорорганические соединения; угарный газ; производные изониазида (тубазид, фтивазид); алкоголь и его суррогаты
Нефротоксическое действие- токсическая нефропатия
Соединения тяжелых металлов; этиленгликоль; щавелевая кислота
Анилин и его производные4 нитриты; мышьяковистый водород
Крепкие кислоты и щелочи; соединения тяжелых металлов и мышьяка
Ключевой особенностью этих веществ является их способность оказывать продолжительное влияние. При этом их концентрации могут быть незначительными. К примеру, серьезные изменения в детском организме могут обуславливаться минимальным содержанием гормоноподобных соединений во внутриутробный период. Большинство ксенобиотиков обладают липофильностью (гидрофобностью).
1.2 Пути поступления ксенобиотиков в организм человека
Пути поступления ксенобиотиков в организм могут быть различными (рис. 2): через легкие, кожу и пищеварительный тракт.
Проникновение веществ через кожу осуществляется через эпидермис, сальные и потовые железы и через волосяные фолликулы. Через кожу хорошо проникают низкомолекулярные и липофильные соединения. Скорость и возможность проникновения ксенобиотиков через кожу зависят от состояния кожного покрова: повреждение рогового слоя и жировой смазки кожи приводит к увеличению всасывания.
Всасывание многих веществ происходит через слизистую оболочку полости рта путем простой диффузии и оттуда, минуя печеночный барьер, в кровеносную систему. Жирорастворимые соединения достаточно легко проникают через слизистую оболочку желудка в кровь. На протяжении желудочно-кишечного тракта существующие градиенты pHопределяют скорость всасывания токсических веществ. На их всасывание также влияет кровоснабжение стенки желудка и кишечника, моторика желудочно-кишечного тракта. Из пустого желудка вещества всасываются лучше, чем из наполненного. Если ксенобиотик поступает в желудок с пищей, то возможно взаимодействие с ее компонентами: растворение в жирах и воде, абсорбция белками и т.д., что уменьшает их контакт со слизистой.
1.3 Влияние пищевых продуктов на всасывание ксенобиотиков
Пищевые продукты, которые влияют на всасывание ксенобиотиков:
· молоко и молочные продукты на 20-80% снижают всасывание тетрациклиновых антибиотиков;
· молоко увеличивает скорость всасывания нестероидных противовоспалительных средств (бутадион, вольтарен, индометацин и других), препаратов гормонов коры надпочечников (преднизолон, дексаметазон и других);
· алкогольные напитки, раздражая слизистую желудка, стимулируют секрецию соляной кислоты, задерживают эвакуацию содержимого желудка, что может облегчать всасывание ксенобиотиков и повышать их токсичность.
Для уменьшения негативного влияния токсических веществ на слизистую желудка утром на завтрак полезно употреблять овсяную или рисовую крупу, которая при отваривании образует большое количество слизистого отвара. Кроме этого слизистый отвар образуют корень лопуха, ятрышник и другие диетические легкие каши, являясь эффективным средством защиты слизистой желудка от раздражающего действия токсических веществ.
· состояние иммунной системы;
· генетически обусловленная активность ферментов;
· наличие соматических заболеваний и другие.
2 БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КСЕНОБИОТИКОВ
Биологической активностью ксенобиотика называют его способность изменять функциональные возможности либо компонентов организма (in vitro или in vivo), либо живого организма в целом, либо сообщества организмов.
Разнообразие видов биологической активности определяется факторами:
· множеством биологических объектов, их состояний и протекающих в них реакций. Поскольку любой живой организм индивидуален, можно говорить об индивидуальной реакции на данный ксенобиотик;
· способом попадания в организм (доза, физическая форма вещества, временной режим введения, место введения и т. д.);
· наличием или отсутствием дополнительных воздействий, которые предшествуют, сопутствуют или следуют за введением химического соединения. Такими воздействиями могут быть другие вещества или их комбинации, другие искусственные или естественные факторы (физическиэлектромагнитные, гравитационные поля, температура, давление и т. д.; биологические, обусловленные влиянием, например, других организмов). Одновременное действие нескольких ксенобиотиков может изменить биологические эффекты каждого из них;
· способом, временем наблюдения, принципом подбора биообъекта, анализом информации и т.д.
Цели определения биологической активности:
· выявление соединений, обладающих полезными для человеческого организма свойствами, например, для профилактики и лечения болезней, расширения физиологических и интеллектуальных возможностей человека;
· обнаружение вредных для человеческого организма биологических активностей у испытуемых ксенобиотиков. Особую опасность представляют такие простые виды биологической активности химических соединений, как мутагенная, канцерогенная, эмбриотоксическая и т. п.;
· нахождение ксенобиотиков, влияющих на продуктивность и биологическое равновесие естественных и искусственных экосистем. Такого рода вещества очень нужны сельскому хозяйству, микробиологической промышленности, лесному, рыбному хозяйству;
· установление таких биологических активностей у испытуемых чужеродных соединений, которые могут вызвать неконтролируемое опасное или недостаточно прогнозируемое нарушение биологического равновесия природных экосистем. Например, способность соединений резко увеличивать вероятность гибридизации вирусов гриппа или какой-либо другой группы вирусов или микроорганизмов;
3 БИОТРАНСФОРМАЦИЯ КСЕНОБИОТИКОВ
В XXІ веке происходят всевозрастающее загрязнение ксенобиотиками внешней среды и увеличивающееся их поступление в организм человека. Это серьезно угрожает здоровью и даже жизни всех живых существ, включая человека, так как повреждает клетки и вызывает мутации, ведущие к злокачественным процессам или наследственным заболеваниям.
Конечно, в первую очередь надо заботиться об экологии. Но если загрязнение все же происходит, то мы не беззащитны: в каждой клетке происходят метаболизм, связывание и выведение ксенобиотиков, что в большинстве случаев приводит к снижению их токсичности. Это позволяет выживать даже на сильно загрязненных территориях, хотя, к сожалению, не исключает риска заболеваний.
3.1 Общая характеристика метаболизма ксенобиотиков
В метаболизме ксенобиотиков участвуют около 30 ферментов. В нем различают две фазы:
1) модификация, создающая или освобождающая функциональные группы;
Первая фаза метаболизма. В этой фазе наиболее важной является локализованная в основном в мембранах эндоплазматической сети (ЭПС) система цитохрома Р-450, называемая также микросомальной системой метаболизма или монооксигеназной системой (рис. 3).
Однако этой системе присущи и серьезные ограничения и даже недостатки:
1) слабость или отсутствие во многих жизненно важных органах (сердце, головной мозг);
2) меньшая защита организма при других путях проникновения (слизистые, раны, инъекции);
3) токсификация некоторых веществ.
Вторая фаза метаболизма. Основные функции этой фазы те же, что и первой: увеличение гидрофильности и снижение токсичности ксенобиотиков. Наиболее важные ферменты второй фазы относятся к классу трансфераз.
Чем опасно поступление ксенобиотиков разобщителей
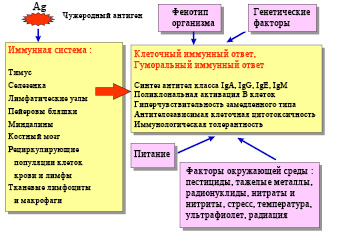
В иммунной системе млекопитающих различают три основные группы органов: 1) центральные (костный мозг и тимус); 2) периферические (селезенка, лимфатические узлы и Пейеровы бляшки); 3) лимфоидная ткань, ассоциированная со слизистыми оболочками. Эволюционно раньше других появляется иммунная система желудочно-кишечного тракта, призванная предотвращать проникновение микроорганизмов и аллергенов пищи в слизистую кишечника [6].
Выделяют клеточный и гуморальный типы иммунного ответа, а также неспецифи-ческую реакцию организма, опосредованную системами мононуклеарных фагоцитов, комплемента и т.д. Все типы иммунного ответа – это звенья единого механизма поддержания гомеостаза организма, осуществляемого иммунной системой. Сила иммунного ответа определяется генами главного комплекса гистосовместимости (Major Hystocompatibility Complex – MHC) и модулируется многими экстракорпоральными факторами (рис. 1).
В-лимфоциты имеют костно-мозговое происхождение, созревают и дифференцируются в ростовых зонах лимфатических узлов. Cозревание и селекция основной массы Т-лимфоцитов происходит в тимусе из бластных предшественников костномозгового происхождения и сопровождается последовательной экспрессией на поверхности клетки гликопротеинов, обозначаемых согласно общепринятой номенклатуре как CD-антигены: CD2, CD3, CD4, CD5, CD8, CD25, CD44 и т.д., начиная от CD2+CD3-CD4-CD8- проТ-клеток через стадию двойных негативных тимоцитов CD3+CD4-CD8- и двойных позитивных тимоцитов CD3+CD4+CD8+ к клеткам зрелого фенотипа – CD2+CD3+CD4+ или CD2+CD3+CD8+. Cелекция в тимусе происходит на стадии CD4+CD8+. Клетки, имеющие рецепторы к молекулам MHC I класса, дифференцируются в CD8+ лимфоциты, а несущие рецепторы к молекулам MHC II класса становятся CD4+ лимфоцитами [103].
Позитивная селекция происходит при блокировании программы гибели клетки, а клональная делеция – при ее активации. Аутореактивные лимфоциты выходят в апоптоз и фагоцитируются макрофагами [101].
Рис. 1. Факторы, определяющие развитие иммунного ответа
От 1 до 5% зрелых СD4+- или СD8+-тимоцитов попадают в кровь и далее в селезенку, регионарные лимфатические узлы и ткани [46]. Приблизительно 30-40% периферических иммунокомпетентных Т- и В-лимфоцитов обновляются каждые три дня; в течение 10 дней происходит обмен подавляющего большинства В-лимфоцитов [37].
Значение экспрессии поверхностных антигенов лимфоцитов в активации и дифференцировке клеток
Рецептор Т-лимфоцита представляет собой комплекс молекул, включающий TCR/CD3 комплекс и гликопротеин CD4 (или CD8), выполняющий функцию ко-рецептора и распознающий молекулы MHC II класса (или молекулы MHC I класса для CD8). Поверхностный антиген CD4 фенотипически характеризует популяцию хелперных клеток, координирующих иммунный ответ на Т-зависимые антигены. CD8 антиген характеризует лимфоциты, преимущественно выполняющие цитотоксические или супрессорные функции [101].
Иммунологическое распознавание предполагает взаимодействие процессированного антигенного пептида (Ag) в комплексе с двумя молекулами МНС с активным центром TCR/CD3-комплекса. При этом фосфорилируются рецептор-ассоциированные протеинтирозинкиназы и далее сигнал передается по каскаду вторичных мессенджеров, включающих, в частности, фосфатидилинозит-4,5-бифосфат, фосфолипазу Сγ1 и диацилглицерин – специфический активатор протеинкиназы С, что приводит к мобилизации внутриклеточного [Ca2+]i. Далее через систему митоген-активированных протеинкиназ сигнал передается на ядерные факторы транскрипции и далее к протоонкогенам c-fos, c-myc, c-jun. Активируются так называемые «ранние гены», в том числе ген интерлейкина IL-2. Прямым следствием стимуляции лимфоцита является синтез IL-2, являющегося регуляторным цитокином, необходимым на всех стадиях иммунного ответа и потенцирующим образование ряда других цитокинов, например фактора некроза опухоли альфа (TNF-α) и гамма-интерферона (IFN-γ) [63].
Значение миграции и молекул адгезии в поддержании иммунного статуса in situ
При развитии иммунного ответа специфические предшественники клеток-эффекторов пролиферируют в особом микроокружении лимфоидной ткани, затем они дифференцируются в эффекторные лимфоциты и мигрируют из лимфоидных органов в кровь и ткани. Миграция зависит от распределения Ag в организме и локальной активации лимфоцитов молекулами МНС, наличия факторов миграции и т. д. Взаимодействие всех типов клеток-эффекторов приводит к выведению чужеродного антигена из организма [100].
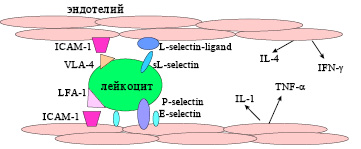
Молекулы адгезии представляют собой трансмембранные белки, участвующие в межклеточном распознавании, прикрепление иммунных и других клеток к эндотелию или экстраклеточному матриксу. Связывание молекул адгезии их лигандами инициирует дополнительные сигналы, необходимые для активации иммунных клеток и развития полноценного иммунного ответа.
Молекулы адгезии распределены между тремя семействами: суперсемейство иммуноглобулинов Ig, семейство интегринов и семейство селектинов [105]. Селектины P, E и L играют роль в адгезии лейкоцитов к активированному эндотелию и их продвижению через сосудистый барьер в лимфоидную ткань или область воспаления.
К молекулам адгезии суперсемейства Ig относятся ICAM-1, ICAM-2, ICAM-3 (Inter Cellular Adhesion Molecule), VCAM-1 (Vascular Cell Adhesion Molecule), CD31 (PECAM-1) и MAdCAM-1, которые связывают интегрины на лейкоцитах и обусловливают их проникновение в стенку сосуда и далее в окружающие ткани. Семейство интегринов служит рецепторами для ICAMs и VCAMs. Интегрины – это гетеродимерные белки, α и β цепи которых отвечают за адгезию лейкоцитов к эндотелию сосудов и межклеточные контакты. Схема действия молекул адгезии представлена на рис. 2.
Другие белки, функционально относящиеся к молекулам адгезии, участвуют в усилении ассоциации Т-лимфоцитов с Ag-презентирующей клеткой или клеткой мишенью, а также принимают участие в активации лимфоцитов. Такие молекулы адгезии как CD44 отвечают за движение лимфоцитов при их возвращении из лимфоидной системы обратно в циркуляцию. Некоторые формы CD44 важны для метастазирования.
Клетки эндотелия через Р- и Е-селектины (P-selectin, E-selectin) получают предварительный сигнал при касании лейкоцита, экспрессируют лиганд для L-селектина (L-selectin ligand), который взаимодействует с растворимой формой рецептора (sL-selectin). Лейкоцит прикрепляется к эндотелию, получает дополнительные сигналы от взаимодействия интегринов (LFA-1, ICAM-1), что способствует реструктуризации цитоскелета и проникновению клеток через сосудистую стенку в окружающие ткани. Клетки эндотелия также секретируют цитокины, например, IL-1, IL-4, TNF-α, IFN-γ, играющие роль факторов дифференцировки и развития клеток иммунной системы.
Рис. 2. Влияние молекул адгезии на продвижение клеток из сосудистого русла в ткани.
В тимусе позитивная и негативная селекция лимфоцитов зависит не только от взаимодействия TCR и MHC, но и от межклеточного распознавания через молекулу LFA-1. На покоящихся лимфоцитах LFA-1 не связывает ее лиганд – ICAM-1. При активации Т-клет-ки через TCR/CD3 комплекс повышается авидность LFA-1 и ICAM-1, что дает Т-лимфоци-там дополнительный акцессорный сигнал через ICAM-1. В незрелых тимоцитах одно-временное распознавание рецепторов CD3 и LFA-1 повышает мобилизацию кальция, а также экспрессию рецептора Bcl-2 – протектора апоптоза [103].
Повышение экспрессии молекул адгезии, в результате появления в тканях чужеродного антигена, приводит к повышению синтеза макрофага IL-12, который, в свою очередь, способствует дифференцировке Т-клеток в Т-h1 и синтеза ими INF-γ. Повышение синтеза макрофагами IL-12 и IL-6 значительно усиливает пролиферацию Т-лимфоцитов и заселение ими нелимфоидных тканей [31].
Апоптоз как регуляторный механизм иммунитета
Пик первичного иммунного ответа приходится на 3-5 день и затем эффекторные Т-лимфоциты выходят в апоптоз [102]. При этом повышается число рецепторов TNF-α, TNF-β, Fas-R и других, связывание которых специфическими лигандами приводит к программированной гибели клеток – апоптозу [73]. Апоптоз является активным генно-регулируемым процессом, морфологически характеризуемым конденсацией хроматина, реорганизацией цитоскелета, потерей контакта с экстраклеточным матриксом, фрагментацией ДНК и цитоплазмы, фагоцитозом изолированных клеточных компартментов без контакта их содержимого с внешней средой, что отличает апоптоз от некроза или других типов распада клеток [94].
Апоптоз непосредственно связан с регуляцией гомеостаза в организме, является механизмом негативной селекции тимоцитов, поддерживает периферическую иммунологическую толерантность, способствует выведению из организма клонов клеток-эффекторов при завершении иммунного ответа [91].
С точки зрения биохимических процессов, происходящих в лимфоцитах при апоптозе, его условно можно разделить на несколько видов: активационно-индуцированный, глюкокортикоид-индуцированный, Fas-зависимый, TNF- индуцированный, bcl/bcx-зависимый, гранзим- и перфорин-зависимый, каспазо-зависимый и т. д. [76].
Процессы созревания и дифференцировки лимфоцитов в тимусе регулируются несколькими типами апоптоза, что зависит от рецептора, через который проводится сигнал для активации программы гибели клетки [30].
Образованные в результате фрагментации цитоплазмы так называемые апоптозные тельца фагоцитируются макрофагами. В тимусе F4/80+ макрофаги имеют малый диаметр и располагаются в корковой зоне рядом с тимоцитами, выходящими в апоптоз, так как обладают высокой скоростью поглощения апоптозных телец [96, 101].
Наиболее важным представляется рассмотрение активационно-индуцированного и Fas- зависимого апоптоза, так как изучаемые в данной работе токсические вещества запускают именно эти типы апоптоза. Распознавание и выведение нефункциональных или аутореактивных лимфоцитов осуществляется макрофагами [91]. Уже на ранних стадиях апоптоза нарушается асимметрия фосфолипидов плазматической мембраны и на поверхности клетки появляется фосфатидилсерин, что распознается макрофагами через специфический рецептор, как сигнал для фагоцитоза [103].
Активационно-индуцированная гибель клеток является одним из регуляторных механизмов иммунной системы. Основной задачей этого типа апоптоза является выведение из организма зрелых периферических Т-лимфоцитов, которые были активированы через TCR/CD3 комплекс или ко-рецепторы CD4 или CD8, но в отсутствие специфического антигена не могут стать эффекторами [82]. Активация незрелых тимоцитов или трансформированных Т-лимфоцитов через TCR/CD3 комплекс также ведет к апоптозу.
Активационно-индуцированный апоптоз может быть при распознавании рецептором CD4+ Т-лимфоцита растворимого комплекса, состоящего из антигенного пептида и молекулы MHC II класса, который в норме должен быть представлен на мембране антиген-презентирующей клетки, что сопровождается дополнительными сигналами от других мембранных рецепторов [93].
Нарушение активации факторов транскрипции, снижение тирозинкиназной активности, ослабление контакта с экстраклеточным матриксом [82] так или иначе влияют на процессы созревания и дифференцировки лимфоцитов, что отражается на количестве клеток, несущих CD3, CD4, CD8, CD25 и другие антигены, а также приводит к изменению плотности и аффинности рецепторов.
Fas-зависимый апоптоз в лимфоцитах является регуляторным механизмом, препятствующим накоплению эффекторных клеток и нерегулируемой продукции цитокинов. Удаление эффекторных CD4+- и CD8+-лимфоцитов после реализации иммунного ответа осуществляется Fas-зависимым путем, который инициируется при связывании лигандом рецептора CD95/Fas/APO-1, реализуется через Ras-сигнальный путь, в котором одной из обязательных ступеней является транзиторный синтез активных форм кислорода [49].
В периферических Т-лимфоцитах Fas-зависимый апоптоз является одним из двух основных механизмов эффекторной функции цитотоксических лимфоцитов при киллинге клеток-мишеней [52]. Повышение экспрессии CD95 /Fas/APO-1 рецептора на мембране нестимулированного CD4+ лимфоцита повышает вероятность его выхода в апоптоз [74].
Иммунная система как мишень комбинированного воздействия факторов внешней среды
Иммунная система играет критическую роль в поддержании гомеостаза организма, однако при определенных условиях сама может оказаться мишенью для различных токсических веществ из окружающей среды, включая пестициды, тяжелые металлы, нитраты, нитриты и т.д., которые по воздействию на иммунную систему могут рассматриваться как иммунодепрессанты, иммуностимуляторы, Т-зависимые антигены, Т-независимые антигены, гаптены или митогены.
Иммунодепрессивные состояния являются основой для развития оппортунистических инфекций и опухолей, тогда как иммуностимуляция повышает риск развития аутоиммунных заболеваний и аллергических реакций. Иммунотоксическое действие вредных веществ на человека изучают при скрининге биологических жидкостей или при исследовании биопсийного материала.
Биологическая активность токсических веществ обычно изучается на различных видах животных, используемые при этом высокие дозы не соответствуют реальным дозам, получаемым человеком, и, кроме того, многие эффекты являются видоспецифическими [9]. Однако модельные системы на животных позволяют определить клетки или органы мишени действия токсикантов. При этом «первично-иммунотоксическими» считаются вещества, приводящие к изменению иммунологических параметров в обычных дозах, тогда как подобный эффект для веществ в сверхвысоких дозах считается «непрямым, или вторичным иммунотоксическим» [104].
Альтернативное использование моделей, основанных на культивировании клеток или клеточных линий в присутствии токсических веществ, могут отражать пути метаболизма веществ в органах-мишенях. Однако также возможно видоспецифическое различие: малатион, например, в 5 раз повышал образование микроядер в клетках крысы, но был неэффективен в тех же дозах в отношении лимфоцитов человека [102].
Влияние пестицидов на иммунитет
Пестициды это органические и неорганические вещества различных классов, используемые для борьбы с вредителями сельского хозяйства, переносчиками опасных заболеваний человека, а также регуляторы роста растений и дефолианты. В зависимости от мишени воздействия пестициды делятся на инсектициды, гербициды, зооциды, фунгициды и т.д. [24]. По токсичности пестициды делятся на сильнодействующие, высокотоксичные, среднетоксичные и малотоксичные. Подобное разделение лежит в основе классификации Международного агентства по изучению рака [57]. Имеется также классификация пестицидов, одобренная Институтом гигиены им. Эрисмана, по их канцерогенности, включающая чрезвычайно опасные, опасные, умеренно опасные и мало опасные пестициды [5].
По химическому составу пестициды можно разделить на
1) хлорорганические (р,р’-ДДТ и его метаболиты: р,р’- ДДЕ, p,p’-ДДД, и др.),
2) фосфорорганические (хлорпирифос, фентион, малатион или карбофос, темефос, диметоат, метилпаратион, фолидол и т. д.),
3) циклодиеновые (диелдрин),
4) пиретроиды (бифентрин, перметрин),
5) карбаматы (иетонил, карбамил, альдикарб, ZZ-афокс),
6) полихлорированные дибензофураны,
7) полихлорированные бифенилы,
8) полихлорированные дибензо-р-диоксины (фуран),
9) метаболиты нафталина,
10) триазины (атразин),
и др., а также тяжелые металлы и микробные пестициды (например, Bacillus thuringiensis и Bacillus sphaericus).
В настоящее время одну четверть всего объема пестицидов занимают пиретроиды, обладающие низкой токсичностью для птиц и млекопитающих [60].
Способы экспозиции пестицидов на человека можно разделить на производственные и бытовые. Человек может заразиться пестицидами при их транспортировке и хранении, а также пылью с одежды или с водой [61]. У работающих с пестицидами людей существенно повышен процент заболеваемости астмой, контактным и аллергическим дерматитами, а также фотодерматитами. Все перечисленные заболевания имеют в патогенезе те или иные нарушения иммунной системы. У людей, постоянно контактирующих с водой, при очень низких концентрациях в ней пестицидов наблюдается эритематозный дерматит [40, 42, 101, 102].
Бытовая экспозиция к пестицидам может быть при контакте с поверхностью зараженных фруктов и овощей, при употреблении воды и пищевых продуктов, содержащих пестициды, а также при вдыхании воздуха в загрязненных районах [29, 95, 100]. Пестициды имеют свойство аккумулироваться в органах, тканях и биологических жидкостях человека и других млекопитающих в зависимости от конечных мишеней их действия [8, 71]. Фосфорорганические соединения и карбаматы, например, обладают нейротоксическими свойствами, ингибируют ацетилхолинэстеразу, снижают уровень ацетилхолина. При неонатальном развитии хлорпирифос вызывает снижение синтеза ДНК во всех отделах мозга [103]. Большинство дитиокарбаматов ингибируют также сывороточную допамин-β-гидроксилазу и транспорт допамина [102]. Линдан и эндосульфан повышают порог захвата медиатора в синаптической щели [44]. Контакт с пестицидами повышает риск развития опухолей мозга [51].
Контактная гиперчувствительность и аутоиммунная патология при экспонировании к пестицидам особенно часто наблюдаются у больных с пониженным питанием, детей и лиц пожилого возраста [105]. Пестициды хлордан и хлорпирифос могут усиливать имеющиеся иммунологические нарушения или хронические заболевания, протекающие на фоне иммунодефицитного состояния [103].
У лиц обоего пола, работающих с жидкими пестицидами, выявлено повышение сывороточного IgG и числа лейкоцитов, снижена адгезия нейтрофилов, снижено общее число Т-лимфоцитов, и также процент Т-хелперов и Т-супрессоров [65]. Длительный контакт людей с пестицидами, содержащими пентахлорфенол в дозе более 10 мкл/л снижает пролиферативный потенциал лимфоцитов в ответ на митогены, а также повышается уровень моноцитов в периферической крови, уровень IL-8 в сыворотке; соотношение Т-хелперов и супрессоров CD4/CD8 при этом снижается [26]. Экспозиция крыс к диметоату и метилпаратиону на протяжении трех поколений вызывала снижение массы тела и органов, снижение клеточности костного мозга, а также снижение числа плазматических клеток в селезенке, синтезирующих IgM; супрессировалось клеточное звено иммунного ответа, что отражалось на развитии ГЗТ [58].
Метилдитиокарбамат натрия снижает вес тимуса мышей и число CD4+CD8+ двойных негативных тимоцитов, снижает общий уровень лимфоцитов в периферической крови и активность натуральных киллеров. При этом повышается процентное содержание нейтрофилов в крови [62]. Гептахлор при однократном введении в дозе более 23 мг на кг приводил к некрозу лимфоцитов тимуса и селезенки, триадимефон снижал вес селезенки [17].
Как уже говорилось ранее, иммунная система желудочно-кишечного тракта играет существенную роль в общем гомеостазе организма. Атразин, диазинон, эндосульфан обладают митогенной активностью в отношении эпителия кишечника [45]. Интересно, что некоторые пестициды вступают во взаимодействие с микрофлорой кишечника. При этом фермент кишечной палочки параоксоназа расщепляет паратион и параоксон и приводит к детоксикации пестицидов [101]. Бактериальные фосфодиэстеразы гидролизуют фосфо-3-эфир-содержащие фосфорорганические пестициды [23,27].
In vitro, малатион обладает генотоксичностью и способностью ингибировать пролиферацию лимфоцитов крысы [102]. Подобные тесты на лимфоцитах людей, экспонированных к малатиону, выявили существенные межиндивидуальные различия, однако установили специфическое мутагенное действие малатиона на Т-лимфоциты человека [106].
Следует обратить внимание на влияние пестицидов на мононуклеарные клетки периферической крови. Существует весьма распространенный способ тестирования мутагенной активности пестицидов по частоте хромосомной аберрации, обмену сестринских хроматид и образованию микроядер в лимфоцитах. Митогенная активность определялась по уровню синтеза ДНК, митотической активности, проценту диплоидных клеток. Генотоксичность определяется по SOS-хроматесту и тесту Эймса. Слабой генотоксичностью обладают каптал и капафон [103], а также алахлор, фенпропатрин, перметрин, трифлюрамин [101]. Большинство хлорорганических пестицидов обладают слабым генотоксическим действием [72]. Существенно, что различные смеси этих веществ не обладают аддитивным эффектом в плане повреждения ДНК [18, 81], Гексахлорбензин рассматривается как слабый генотоксичный канцероген [21]. Частота аберрации хромосом в лимфоцитах периферической крови людей, экспонированных к пестицидам, повышается более чем в 3 раза при повышении интенсивности контактов с пестицидами и снижается по мере их ослабления [22, 70, 88]. ДДТ и бромпропилат дозо-зависимо влияет на митоз (s-митоз) [69] Комбинированное воздействие малатиона и γ-излучения на культивируемые лимфоциты человека в G0 фазе клеточного цикла приводит к усилению фрагментации хромосом и хроматид [3].
Существенным моментом в этих исследованиях является то, что лимфоциты представлены как коротко-живущими клетками, так и долго-живущими, имеющими фенотип клеток памяти [37]. Однократное воздействие пестицидов приводит к изменению иммунного статуса организма на некоторый непродолжительный период времени. Экспонирование организма в течение этого периода к чужеродным антигенам приведет, вероятно, к нарушению иммунного ответа. С появлением новой генерации лимфоцитов способность отвечать на антигены восстанавливается. Однако хромосомные нарушения могут сохраняться в долгоживущих популяциях лимфоцитов, представленных в основном клетками памяти. Это может привести к нарушениям при вторичном иммунном ответе.
При хроническом воздействии пестицидов на организм, повышении частоты мутаций и митогенной активации клеток повышается вероятность развития лимфопролиферативных заболеваний, в том числе не-Ходжкинской лимфомы, лимфомы Ходжкина, хронического лимфолейкоза и множественной миеломы [11, 103]. Было показано, что инсектициды и фунгициды достоверно чаще по сравнению с контролем повышают частоту разрывов хромосом. При этом активируются онкогены, гены апоптоза и супрессии опухолей. [41].
Фосфорорганические соединения, тиофосфаты и дитиофосфаты могут выступать в качестве гаптенов: при конъюгации с белком при участии диоксафосфоринан-метоксиацетиловой кислоты были высокоиммуногенными и давали существенные титры специфических антител [102].
Опосредованные изменения иммунного ответа при попадании в организм пестицидов могут быть вследствие синтеза арахидоновой кислоты и повышенной продукции эйкозаноидов, что показано для ДДТ и полихлорированных бифенилов [48]. Действие пестицидов может опосредовано изменить иммунный ответ, в связи с их способностью активировать протеинкиназу С [14], ингибировать протеин-фосфатазы А2 и 1 [34], служить лигандом для Р-гликопротеина [15] и ингибировать синтез белка [18], что может влиять на сигнальные пути в иммунных клетках.
Соли тяжелых металлов как иммуномодуляторы
В связи с использованием в предыдущие годы солей тяжелых металлов в качестве пестицидов и их способностью к аккумуляции в тканях и органах, а также загрязнением ими окружающей среды [22] были проведены исследования о характере влияния их на показатели клеточного и гуморального иммунного ответа у людей и животных.
Для свинца показана дозо-зависимая стимуляция гуморального иммунного ответа с повышением числа В-лимфоцитов и продукцией неспецифических Ig [101]. При этом снижается резистентность к бактериальной и вирусной инфекции за счет повышения продукции аутоантител [53].
Хроническое отравление свинцом также приводит к изменению Т-клеточного иммунного ответа и индукции гиперчувствительности замедленного типа (ГЗТ) на фоне повышенного образования Т-хелперов второго порядка и синтеза соответствующих цитокинов [53]. У мышей хлорный свинец повышал образование IL-4 клонами Th2 in vitro и приводил к снижению продукции IFN-γ клонами Th1. При этом были повышены уровни сывороточного IgE и IL-4 [53]. При введении хлорного свинца или хлорной ртути у мышей наблюдалась олигоклональная активация CD4+ клеток селезенки. Недифференцированные тимоциты не отвечали митогенной стимуляцией. Как и в предыдущей работе, было показано переключение образования Th2 вместо Th1 под действием свинца [54]. При одновременном введении антигена и свинца отмечалась поликлональная активация В-клеток с продукцией Ig класса E, повышение синтеза IgG1и снижение синтеза IgG2a. Существенно, что свинец вызывал переключение образования Т-хелперов второго порядка даже в отсутствие антигенной стимуляции, хотя на более низком уровне. Подобные нарушения регуляции приводят к аутоиммунным заболеваниям и снижению показателей клеточного иммунитета [54].
Механизм действия свинца предположительно связан с активацией [Ca2+]i / кальмодулин-зависимой протеинкиназы 2-го типа, в связи, с чем требуется обязательное присутствие Ca2+ для реализации действия свинца [109]. Свинец также приводит к сниже-нию уровня АТФазы, ацетилхолинэстеразы и моноаминооксидазы [97].
Следует обратить внимание на то, что нарушение функционального состояния именно Т-хелперов первого порядка характерно для тяжелых металлов. Таким свойством обладает также железо [87].
Свинец, медь и другие тяжелые металлы имеют свойство аккумулироваться в тканях животных морских и речных пищевых цепей. При постоянном употреблении в пищу таких продуктов тяжелые металлы попадают в организм человека и вызывают хроническую интоксикацию, сопровождающуюся изменением реактивности организма [102]. Однако кратковременный контакт с тяжелыми металлами не приводит к существенным нарушениям [106]. В следовых количествах такие элементы как медь, кобальт, молибден, ванадий и др. обладают определенными протективными свойствами [56].
Важным моментом является то, что с возрастом происходит накопление тяжелых металлов в тканях и сыворотке людей [104], что приводит к активации металлопротеинов, в частности медь-содержащий аминооксидазы [35], а также повышению риска развития рака. Ассоциация с повышенным риском развития опухолей у человека показана при накоплении кадмия [10]. Медь и ее соли повышают риск развития неходжкинской лимфомы [38]. Ртуть повышает частоту обмена сестринских хроматид [75] и повреждает мембраны эритроцитов [12].
Канцерогенный эффект тяжелых металлов прямо связан с их способностью выступать в роли эндогенных окислителей ДНК. Существует целый пласт взаимосвязанных проблем, касающихся метиллирования ДНК, образования реактивных метаболитов кислорода и их взаимодействия с реактивными метаболитами азота.
Действие нитратов и нитритов на клетки иммунной системы
Нитраты и нитриты являются составной частью пищи и пищевых добавок. Основной источник нитратов – это овощи, кроме того, эндогенный синтез нитратов составляет около 1 мг на кг веса в день и может быть существенно повышен при некоторых воспалительных заболеваниях. Источником нитритов являются мясные продукты. При этом нитраты овощей превращаются в нитриты.
Эндогенный синтез нитрозоаминов может быть при одновременном присутствии в пище донаторов аминных групп и нитрозообразующих агентов (нитрит или окись азота).
Окись азота (NO) играет ключевую роль в неспецифической резистентности организма и образуется фагоцитами в ответ на бактериальные и клеточные антигены. Активированные нейтрофилы и макрофаги продуцируют как интермедианты кислорода, так и азота [39]. При этом донаторы NO-групп, в частности, экзогенные нитраты, нитриты, N-нитрозоамины и индукторы эндогенного синтеза нитрозоаминов, являются ингибиторами цитотоксической функции макрофагов [80]. NO также рассматривается как вторичный мессенджер в передаче сигналов в клетке, особенно связанных с индукцией апоптоза. NO-синтаза активируется в ответ на бактериальные стимулы в макрофагах и рассматривается как важный фермент в реализации бактериостатической функции. NO-синтаза ингибируется IL-13 через активацию фосфатидилинозитол-3-киназы (PI-3K). Ингибиция этой киназы приводит к активации синтеза NO в клетке [77, 103].
Эндогенно-образованные нитриты, например, пероксинитрит, являются индукторами апоптоза в клетке. Накопление N-нитрозоаминов и ПАУ приводит к изменению ферментной системы цитохромов Р450, b5, NADPH-цитохром с редуктазы и др. [106], что приводит к развитию окислительного стресса и повреждению тиол-содержащих протеинов, играющих роль во многих клеточных процессах [102].
Известный генотоксический эффект нитрозоаминов связан с метиллированием или окислением ДНК. Предполагается также, что активные метаболиты азота связываются с ядерным фактором транскрипции TN-kB и способны регулировать апоптоз через взаимодействие с сигнальными путями TNF [85]. Вероятно, следует различать сигнальные пути с метаболитами азота как вторичными мессенджерами в макрофагах и лимфоцитах. В дифференцированных и высокоспециализированных клетках генерация реактивных метабо-литов азота выполняет скорее функцию переключения или ингибирования сигнальных путей, связанных с дифференцировкой и активацией клетки, тогда как в макрофагах метаболиты азота выполняют скорее киллерную функцию. Из этого следует, что влияние экзогенных нитросоединений будет оказывать тканеспецифическое действие на клетки. Цитокины, продуцируемые Т-хелперами как первого, так и второго порядка предотвращают образование нитратов и нитритов макрофагами [90].
Интересными представляются данные по утилизации атома азота медь-содержащей нитритредуктазой в некоторых бактериях, когда нитрит связывает сначала синглетный кислород с высвобождением NО, затем высвобождается атом кислорода и азот связывается с медью [92]. Для ферментной системы человека это не показано, однако, такой механизм взаимодействия нитритов с медь-содержащими ферментами может иметь существенное значение при образовании реактивных метаболитов кислорода при введении в организм нитрата и меди.
Механизмы токсического действия ксенобиотиков
Пестициды являются субстратом для ферментов, метаболизирующих ксенобиотики, таких как цитохромы системы Р450, флавинсодержащие монооксигеназы, а также могут выступать как активаторы или ингибиторы этих ферментов [47]. Индукция цитохрома Р450 – это общеклеточный защитный механизм детоксикации ксенобиотиков. Пестициды повышают активность гена Р450 2В10 и 1А и 3А4 связывающую активность ядерного фактора 1 и ядерных рецептор-подобных факторов [20, 33, 55, 99]. Сочетанное введение полихлорированных бифенилов и арохлора, а также железа, приводит к резкой активации цитохрома 1А1 и окислительному стрессу на фоне падения глютатион-пероскидазной активности [79]. Однако повышение активности этой системы может привести и к образованию еще более токсичных метаболитов [86,104]. Так, цитохром Р2Е1 способен образовывать интермедианты, являющиеся промоторами для цитотоксической или канцерогенной активности ксенобиотиков. Пестициды активируют этот фермент системы цитохрома Р450, что повышает риск токсичности их метаболитов [84, 100, 103].
Пестициды различных классов приводят к образованию липидных гидроперекисей и реактивных кислородных радикалов, которые вызывают окислительное повреждение ДНК и ее фрагментации [13,25, 105]. Повреждение ДНК является одним из механизмов запуска апоптоза [19]. Комбинированное воздействие пестицидов, солей кадмия и свинца, а также нитритов приводит к повышению процессов перекисного окисления липидов (ПОЛ) в тканях, активации каталаз, пероксидаз, оксиредуктаз. Ацефат, метамидофос, малеиновый гидразин и никотин ингибируют супероксиддесмутазу (СОД) эритроцитов [32]. Повреждение антиоксидантной системы сопровождается дальнейшим накоплением продуктов ПОЛ, что является наиболее существенным патогенетическим фактором действия пестицидов [32].
Одним из методов определения окислительного повреждения ДНК может быть измерение уровня 8-ОН-2-дезоксигуанозина, положительную реакцию на который дают фосфорорганические пестициды хлорпирифос и фентион, а также алахлор, ендрин, хлордан. Пентахлорфенол и его метаболиты повышают как уровень 8-ОН-2-дезоксигуанозина, так и обрыв ДНК, что может быть в результате действия радикалов кислорода [64, 78].
Таким образом, повышение активности оксидазоредуцирующих ферментов (например, с помощью селена) является патогномоничным в предупреждении эффекта комбинированного действия этих веществ.
Селен – это необходимый элемент питания человека, включение его в диету является одним из требований противораковой защиты. Протективная роль селена, в иммунном ответе, связана с селенопротеинами, которые в клетках млекопитающих играют роль в антиоксидантной защите. В Т-лимфоцитах тиоредоксинредуктаза представляет собой фермент, включающий селен в С-концевой регион и играющий роль в антиоксидантной системе наряду с такими известными системами как глютатион-пероксидаза.
Цитозольная форма селен-зависимой глютатионпероксидазы детоксицирует как водород, так и липидные гидроперекиси и является основным компонентом антиоксидантной защиты лимфоцитов. Посредством изменения уровня редуцированного глютатиона, селен может регулировать антиоксидантный потенциал Т-лимфоцитов человека.
Фосфорорганические пестициды снижают уровень селена в крови [59]. Повышение уровня свинца приводит к снижению концентрации селена в сыворотке крови [106]. Свинец в дозе 20 мг на кг массы при введении в течение 8 недель вызывает резкое падение активности гексокиназы, АТРазы, моноаминооксидазы и ацетилхолинэстеразы в структурах мозга крыс. Добавление селена восстанавливает активность ферментов [97].