Чем опасна стимуляция овуляции при поликистозе
Поликистоз яичников: как вернуть овуляцию и можно ли забеременеть с этим диагнозом
Существует два способа лечения синдрома поликистозных яичников (СПКЯ) – оперативный и консервативный.
Оперативная методика лечения в гинекологии
Если при поликистозе у женщины присутствует избыточный вес, важно изменить пищевые привычки и внести корректировки в режим дня. Ключевой аспект – правильное сбалансированное питание, включающее выверенную норму белков, жиров, углеводов и клетчатки. Рекомендуются активные занятия спортом.
Уменьшение потребления жирной пищи и быстрых углеводов в совокупности с увеличением физических нагрузок – обязательные условия терапии.
Консервативный способ лечения у эндокринолога
При СПКЯ снижается чувствительность тканей к инсулину, что характерно сахарному диабету II типа. Для повышения восприимчивости клеток к инсулину, назначается метформин (МФ).
Препарат нормализует углеводный обмен, уменьшает выработку мужских половых гомонов, стабилизирует функции яичников. С учетом индивидуальных особенностей организма, возможны любые методы контрацепции.
Задача консервативного лечения СПКЯ – восстановить овуляторный менструальный цикл, исключив причины бесплодия у женщин.
Как нормализовать менструальный цикл?
Для предотвращения прогрессирования заболевания применяются комбинированные оральные контрацептивы (КОК). В составе препаратов содержатся антиандрогены. Они снижают выработку мужских половых гормонов, на фоне этого появляется овуляция и возникает вероятность беременности.
Если курс КОК пройдет, а овуляторная функция не нормализовалась, для стимуляции овуляции назначаются гормональные препараты с постепенным увеличением дозировки. Дополнительно могут применяться препараты с антиандрогенным эффектом (ципротеронацетат, спиронолактон).
Пациентки отмечают уменьшение жирности кожи и угревой сыпи, увеличивается интенсивность роста волос. В качестве дополнения к лекарственной терапии гирсутизма рекомендуется использовать косметологические методы удаления нежелательных волос, например, фотоэпиляцию.
Протекание беременности у женщин с СПКЯ
Пациентки с СПКЯ входят в группу риска по течению беременности с неблагоприятными факторами. Отказ от курения, смена режима труда и отдыха, переход на правильное питание – главные аспекты планирования беременности.
При наступлении беременности естественным путем, риск выкидыша минимальный и не зависит от степени ожирения. После индукции овуляции риск невынашивания плода повышается и сопоставим с иными формами лечения бесплодия.
На фоне СПКЯ у беременных существует вероятность развития гестационного диабета и гипертонии, что в последствии может негативно сказаться на здоровье новорожденного. Чтобы исключить эти факторы, рекомендуется наблюдение у акушера-гинеколога и эндокринолога.
Что делать, если спустя 3-6 месяцев лечения овуляции нет?
Если гормональная терапия не оказала желаемый эффект, требуется оперативное хирургическое вмешательство, в частности лапароскопия:
После лапароскопии 50% пациентам необходима индукция овуляции. Если в течение 12 недель овуляция отсутствует, назначается кломифенцитрат. Прошло еще 6 месяцев, а результата нет? Рекомендуется применение гонадотропинов.
Показания к применению вспомогательных репродуктивных технологий (ВРТ)
В процессе лечебного цикла у 35% женщин наступает клиническая беременность, что практически идентично числу пациенток без СПКЯ.
Важно!
У вас СПКЯ? Наблюдаться необходимо у двух лечащих врачей – акушер-гинеколога и эндокринолога.
Стимуляция овуляции при поликистозе яичников – успешный метод забеременеть
Стимуляция овуляции при поликистозе яичников – успешный метод забеременеть
Расстройства женского здоровья могут привести к патологическим изменениям в структуре яичников, нарушению их деятельности, которые известны под медицинским термином поликистоз яичников. Одним из последствий такого состояния становится женское бесплодие, для его устранения с успехом вам нужно обратится в медицинский центр и пройти курс лечения с применением стимуляции овуляции при поликистозе яичников в.
Что обозначает синдром поликистозных яичников
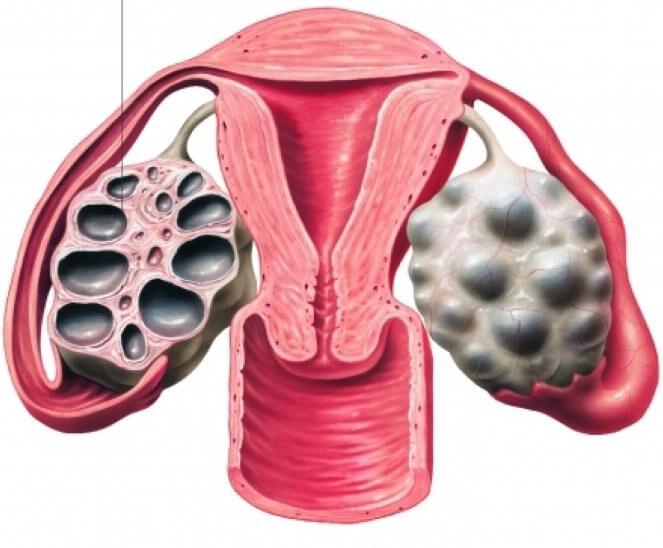
При некоторых нарушениях в организме утолщаются стенки яичника, в итоге созревшая яйцеклетка – фолликул, не может из него выйти, попасть в полость матки для оплодотворения. Оставаясь в яичнике и наполняясь жидкостью, яйцеклетка со временем превращается в маленькую кисту.
Поскольку этот процесс повторяется многократно, образуется множество таких кист, а явление, с этим связанное, называется синдром поликистоза яичников. В итоге происходит нарушение созревания яйцеклеток и процесса овуляции – самая частая причина бесплодия, которую можно успешно лечить и устранять.
От чего бывает поликистоз яичников
При поликистозе яичников происходит изменения в менструальном цикле. Если наблюдаются изменения в виде болезненных ощущений, отсутствия, несвоевременности, скудном или, наоборот, обильном количестве выделений, следует проводить диагностику. На ее основе назначается соответствующее результативное лечение.
Устранение бесплодия
Стимуляция овуляции при поликистозе яичников считается эффективным методом для возможности планировать беременность. При этом назначается лечение гормональными препаратами в форме уколов или таблеток, которые следует принимать в строго определенные дни по отношению к началу менструального цикла. Лекарства помогают правильному созреванию яйцеклетки в строго определенный период. В день овуляции, когда яйцеклетка освобождается от фолликула, можно забеременеть.
Прежде, чем начинать лечение, следует проверить другие возможные причины бесплодия в виде не проходимости маточных труб, а так же пройти спермограмму.
Процесс стимуляции овуляции состоит из нескольких этапов:
Такая стимуляция овуляции при поликистозе яичников может сразу привести к желаемому результату. В противном случае продолжается стимуляция с повышением дозы лекарств. Если не происходит зачатие, используется лечение препаратами другой группы.
Во время стимуляции увеличивается уровень гормонов в организме, и это может способствовать тому, что лопнет сразу несколько фолликулов и выйдет несколько яйцеклеток. Беременность может стать многоплодной, и возникает вероятность появления двойни или тройни.
Если данный метод лечения бесплодия не помог, отчаиваться не стоит. Необходимо использовать оздоровление организма с помощью правильного питания, приведения в норму веса тела, увеличение физических нагрузок для укрепления общего физического состояния и повышения иммунитета. В случае неэффективности консервативного курса, существуют другие способы, такие как – лапароскопия, разные виды хирургического вмешательства.
Синдром поликистозных яичников или мультифолликулярные яичники
Врачи на УЗИ нередко видят достаточно типичную картину, которую называют мультифолликулярными яичниками. Для некоторых пациенток мультифолликулярные яичники — синоним поликистоза, при котором также много фолликулов. Между тем, это совершенно разные понятия.
Для начала опишем УЗИ-картину яичников при поликистозе:
Однако описанная картина иногда бывает лишь ошибочно похожа на поликистозные яичники. Например, весьма похожая картина может быть в 1 фазе цикла (на 5-7 день) вследствие чисто физиологических изменений, которые естественно протекают в половой системе женщины. Кроме того, подобные изменения бывают у женщин на фоне длительного приема оральных контрацептивов, в рамках гипогонадотропной аменореи и, наконец, у девушек в периоде полового созревания.
Таким образом, мультифолликулярные яичники — лишь ультразвуковой симптом менструального цикла в рамках нормы. Однако, учитывая, что картина может быть нечеткой, что есть определенные варианты течения поликистоза яичников, при выявлении картины мультифолликулярных яичников необходимо провести дифференциальную диагностику. Для этого исследуют содержание в крови ЛГ и ФСГ, тестостерона, инсулина. При мультифолликулярных яичниках уровень этих гормонов находится в пределах нормы. А при поликистозе яичников соотношение ЛГ/ФСГ больше 2,5-3, увеличен уровень общего и свободного тестостерона, а также инсулина. Кроме того, о наличии поликистозных яичников свидетельствует также и клиническая картина заболевания.
То же относится и к девушкам периода полового созревания, у которых состояние называют также «формирующийся синдром поликистозных яичников». У них специфическую ультразвуковую картину сопровождают специфические гормональные и внешние изменения.
Таким образом, мультифолликулярные яичники — диагноз не заболевания, а определенного состояния, которое само по себе не является причиной бесплодия, нарушений менструального цикла и т.д. Но проводить дифференциальный диагноз с более тяжелыми состояниями все-таки необходимо.
Для дифференциальной диагностики мультифолликулярных и поликистозных яичников можно использовать следующие признаки:
Часто мультифолликулярные яичники принимают за поликистозные яичники, однако мультифолликулярные яичники следует рассматривать как вариант нормы, а поликистоз яичников — заболевание.
Женские половые органы – яичники, маточные трубы, матка, подвержены изменениям в зависимости от фазы менструального цикла. В начале менструального цикла в яичниках начинают созревать 5-7 фолликулов, но дозревает только один из них. При картине мультифолликулярных яичников одновременно дозревают более 7 фолликулов. Мультифолликулярные яичники часто встречаются в начале полового созревания, когда только устанавливается менструальная функция, у женщин длительно принимающих пероральные контрацептивы, а также на 5-7 день нормального менструального цикла. Иногда синдром мультифолликулярныхяичников может сопровождаться нарушениями менструального цикла, чаще всего это связано с недостаточностью лютеинизирующего гормона, что может быть вызвано резкой потерей веса, или наоборот его набором. При этом может наблюдаться аменорея или олигоменорея. Нарушения менструального цикла, сопровождающие мультифолликулярные яичники, может свидетельствовать о начальной стадии поликистоза яичников.
Часто, только лишь по данным УЗИ, бывает сложно отдифференцировать синдром мультифолликулярный яичников от синдрома поликистозных яичников. В таких случаях, необходимо динамическое наблюдение у гинеколога и определение гормонального фона. Однако, есть ряд УЗИ-признаков, отличающих мультифолликулярные яичники от поликистозных. Главным отличительным признаком является размер яичника, при синдроме мультифолликулярных яичников он нормальный, при поликистозных яичниках увеличен. Количество фолликулов при синдроме мультифолликулярных яичников 8-10, диаметр фолликулов 4-8 мм, приполикистозе более 10, диаметр фолликулов более 10 мм. Мультифолликулярные яичники не сопровождаются гормональными нарушениями, в отличии от поликистозных яичников.
Причины СПКЯ
СПКЯ – часто распространенное гормональное расстройство среди женщин репродуктивного возраста, приводящее к стойкому бесплодию. Несмотря на актуальнось проблемы, точные причины возникновения СПКЯ до сих пор неизвестны.
Помимо гормональных причин, к предрасполагающим факторам, ведущим к развитию СПКЯ, относят:
Симптомы СПКЯ
Молочные железы развиты правильно, у каждой третьей женщины имеет место фиброзно-кистозная мастопатия, развивающаяся на фоне хронической ановуляции и гиперэстрогении.
Практически все пациенки с СПКЯ имеют повышенную массу тела. При этом излишки жира откладываются, как правило,на животе (“центральный” тип ожирения). Поскольку уровень инсулина при СПКЯ повышен, довольно часто заболевание сочетается с сахарным диабетом 2 типа. СПКЯ способствует раннему развитию сосудистых заболеваний, таких какгипертоническая болезнь и атеросклероз.
Поскольку симптомов заболевания много, СПКЯ легко можно перепутать с любым дисгормональным нарушением. В молодом возрасте жирную кожу, угри и прыщи принимают за естественные возрастные особенности, а повышенная волосатость и проблемы с лишним весом зачастую воспринимаются как генетические особенности. Поэтому если менструальный цикл не нарушен и женщина еще не пробовала беременеть, то к гинекологу такие пациентки обращаются редко. Важно знать,что любые подобные проявления не являются нормой и при обнаружении у себя подобных симптомов следует очно проконсультироваться у гинеколога-эндокринолога.
Диагностика СПКЯ
Структурные изменения яичников при СПКЯ характеризуются:
Диагностика СПКЯ включает:
После пробы с дексаметазоном содержание андрогенов незначительно снижается, примерно на 25% (за счет надпочечниковой фракции).
Проба с АКТГ отрицательная, что исключает надпочечниковую гиперандрогению, характерную для адреногенитального синдрома. Отмечено также повышение уровня инсулина и снижение ПССГ в крови.
В клинической практике простым и доступным методом определения нарушения толерантности глюкозы к инсулину является сахарная кривая. Определяется сахар крови сначала натощак, затем — в течение 2 ч после приема 75 г глюкозы. Если через 2 ч уровень сахара крови не приходит к исходным цифрам, это свидетельствует о нарушенной толерантности к глюкозе, т. е. об инсулинрезистентности, что требует соответствующего лечения.
Критериями для постановки диагноза СПКЯ являются:
Лечение СПКЯ
Лечение СПКЯ определяется с учетом выраженности симптомов и желанием женщины забеременеть. Обычно начинают с консервативных методов лечения, при неэффективности показано хирургическое лечение.
Если у женщины имеется ожирение, то лечение следует начать с коррекции массы тела. В противном случае консервативное лечение у таких пациенток не всегда дает желаемый результат.
При наличии ожирения проводятся:
Консервативное лечение СПКЯ
При нарушенном углеводном обмене лечение бесплодия начинают с назначения гипогликемических препаратов из группы бигуанидов (Метформин). Препараты корректируют уровень глюкозы в крови, курс лечения составляет 3-6 месяцев, дозы подбирают индивидуально.
Для стимуляции овуляции применяют гормональный препарат-антиэстроген Кломифен-цитрат, который стимулирует выход яйцеклетки из яичника. Препарат применяют на 5-10 день менструального цикла. В среднем, после применения Кломифена овуляция восстанавливается у 60 % пациенток, беременность наступает у 35 %.
При отсутствии эффекта от Кломифена, для стимуляции овуляции применяют гонадотропные гормоны, такие как Пергонал, Хумегон. Стимуляция гормонами должна проводится под строгим контролем гинеколога. Эффективность лечения оценивают при помощи УЗИ и показателей базальной температуры тела. Если женщина не планирует беременность, для лечения СПКЯ назначают комбинированные оральные контрацеативы (КОК) с антиандрогенными свойствами для восстановления менструального цикла.Такими свойствами обладают КОКи Ярина, Диане-35, Жанин, Джес. При недостаточном антиандрогенном эффекте КОКов, возможно совместное применение препаратов с антиандрогенами (Андрокур) с 5 по 15-й день цикла. Лечение проводят с динамическим контролем показателей гормонов в крови. Курс лечения составляет в среднем от 6 месяцев до года.
Высоким антиандрогенным свойством обладает калийсберегающий диуретик Верошпирон, который также используют при поликистозе яичников. Препарат снижает синтез андрогенов и блокирует их действие на организм. Препарат назначают минимум на 6 месяцев.
Стимуляция овуляции при СПКЯ
Кломифен относится к нестероидным синтетическим эстрогенам. Механизм его действия основан на блокаде рецепторов эстрадиола. После отмены кломифена по механизму обратной связи происходит усиление секреции ГнРГ, что нормализует выброс ЛГ и ФСГ и, соответственно, рост и созревание фолликулов в яичнике. Таким образом, кломифен не стимулирует яичники непосредственно, а оказывает воздействие через гипоталамо-гипофизарную систему. Стимуляция овуляции кломифеном начинается с 5-го по 9-й день менструального цикла, по 50 мг в день. При таком режиме повышение уровня гонадртропинов, индуцированное кломифеном, происходит в то время, когда уже завершился выбор доминантного фолликула. Более раннее назначение кломифена может стимулировать развитие множества фолликулов и увеличивает риск многоплодной беременности. При отсутствии овуляции по данным УЗИ и базальной температуры дозу кломифена можно увеличивать в каждом последующем цикле на 50 мг, достигая 200 мг в день. Однако многие клиницисты полагают, что если нет эффекта при назначении 100-150 мг кломифена, то дальнейшее увеличение дозы нецелесообразно. При отсутствии овуляции при максимальной дозе в течение 3 месяцев пациентку можно считать резистентной к кломифену.
Критериями эффективности стимуляции овуляции служат:
При наличии этих показателей рекомендуется введение овуляторной дозы 7500-10000 МЕ человеческого хорионического гонадотропина — чХГ (профази, хорагон, прегнил), после чего овуляция отмечается через 36-48 ч. При лечении кломифеном следует учитывать, что он обладает антиэстрогенными свойствами, уменьшает количество цервикальной слизи («сухая шейка»), что препятствует пенетрации сперматозоидов и тормозит пролиферацию эндометрия и приводит к нарушению имплантации в случае оплодотворения яйцеклетки. С целью устранения этих нежелательных эффектов препарата рекомендуется после окончания приема кломифена принимать натуральные эстрогены в дозе 1-2 мг. или их синтетические аналоги (микрофоллин) с 10-го по 14-й день цикла для повышения проницаемости шеечной слизи и пролиферации эндометрия.
При недостаточности лютеиновой фазы рекомендуется назначить гестагены во вторую фазу цикла с 16-го по 25-й день. При этом предпочтительнее препараты прогестерона (дюфастон, утрожестан).
Частота индукции овуляции при лечении кломифеном составляет примерно 60-65%, наступление беременности — в 32-35% случаев, частота многоплодной беременности, в основном двойней, составляет 5-6%, риск внематочной беременности и самопроизвольных выкидышей не выше, чем в популяции. При отсутствии беременности на фоне овуляторных циклов требуется исключение перитонеальных факторов бесплодия при лапароскопии.
При резистентности к кломифену назначают гонадотропные препараты — прямые стимулятороы овуляции. Используется человеческий менопаузальный гонадотропин (чМГ), приготовленный из мочи женщин постменопаузального возраста. Препараты чМГ содержат ЛГ и ФСГ, по 75 МЕ (пергонал, меногон, менопур и др.). При назначении гонадотропинов пациентка должна быть информирована о риске многоплодной беременности, возможном развитии синдрома гиперстимуляции яичников, а также о высокой стоимости лечения. Лечение должно проводится только после исключения патологии матки и труб, а также мужского фактора бесплодия. В процессе лечения обязательным является трансвагинальный УЗ-мониторинг фолликулогенеза и состояния эндометрия. Овуляция инициируется путем однократного введения чХГ в дозе 7500-10000 МЕ, когда имеется хотя бы один фолликул диаметром 17 мм. При выявлении более 2 фолликулов диаметром более 16 мм. или 4 фолликулов диаметром более 14 мм. введение чХГ нежелательно из-за риска наступления многоплодной беременности.
При стимуляции овуляции гонадотропинами частота наступления беременности повышается до 60%, риск многоплодной беременности составляет 10-25%, внематочной — 2,5-6%, самопроизвольные выкидыши в циклах, закончившихся беременностью, достигают 12-30%, синдром гиперстимуляции яичников наблюдается в 5-6% случаев.
Хирургическое лечение СПКЯ
Несмотря на достаточно высокий эффект при стимуляции овуляции и наступлении беременности, большинство врачей отмечают рецидив клинической симптоматики СПКЯ примерно через 5 лет. Поэтому послебеременности и родов необходима профилактика рецидива СПКЯ, что важно, учитывая риск развития гиперпластических процессов эндометрия. С этой целью наиболее целесообразно назначение КОК, предпочтительнее монофазных (марвелон, фемоден, диане, мерсилон и др.). При плохой переносимости КОК, что бывает при избыточной массе тела, можно рекомендовать гестагены во вторую фазу цикла: дюфастон в дозе 20 мг. с 16-го по 25-й день цикла.
Женщинам, не планирующим беременность, после первого этапа стимуляции овуляции кломифеном, направленного на выявление резервных возможностей репродуктивной системы, также рекомендуется назначение КОК или гестагенов для регуляции цикла, уменьшения гирсутизма и профилактики гиперпластических процессов.
Физиотерапия и фитнесс для лечения СПКЯ
Физиотерапевтические процедуры также показаны при СПКЯ. Применяют гальванофорез лидазы для активации ферментативной системы яичников. Электроды устанавливают в надлобковой области. Курс лечения-15 дней ежедневно.
Лечение поликистоза яичников длительное, требующее тщательного наблюдения у гинеколога-эндокринолога. Всем женщинам с СПКЯ рекомендуется, по возможности, как можно раньше беременеть и рожать, поскольку симптомы заболевания, увы, с возрастом довольно часто прогрессируют.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
Сегодня мы поговорим о самых волнующих аспектах программы ЭКО и, опираясь на научные исследования последних лет, ответим на возможные вопросы.
Чем опасна стимуляция овуляции?: современные особенности проведения протоколов стимуляции суперовуляции.
В былые годы возрождения и начала использования контролируемой суперовуляции при осуществлении программ ЭКО репродуктологи использовали высокие дозы гонадотропинов при проведении стимуляции, стремились получить как можно больше ооцитов, так как считалось, что это увеличивает шансы оплодотворения и получения эмбрионов. Как стремились получить больше клеток, так же старались и перенести «побольше» эмбрионов…….
Сейчас подходы категорически поменялись. В настоящее время доказано, что использование высоких доз гонадотропинов при проведении контролируемой супервовуляции не увеличивает шансы оплодотворения, приводит к быстрому истощению яичников, имеет большее количество побочных эффектов. Ответ яичников на стимуляцию после проведения пункции оценивается следующим образом: 0 ооцитов – нет ответа, 1-2 ооцита – бедный ответ, 3-6 ооцитов – удовлетворительный ответ, более 7 ооцитов – хороший ответ.
Доказано, что уровень ответа яичников не влияет на качество эмбрионов при наличии зрелых ооцитов. Однако при удовлетворительном и хорошем ответе можно криоконсервировать большее количество эмбрионов, не заставляя женщину проходить процедуру стимуляции овуляции несколько раз.
При бедном ответе в настоящее время используется схема «накопления» эмбрионов: проводится несколько стимуляций овуляции минимальными дозами гонадотропинов и из каждой такой программы получается 1-2 эмбриона, после чего «самые лучшие» эмбрионы криоконсервируются и только потом проводится подготовка эндометрия к переносу эмбрионов. Такая схема выгодна своим щадящим воздействием на яичники женщины, также она способствует получению максимально зрелых яйцеклеток и используется преимущественно у женщин с крайне низким овариальным резервом (уровень АМГ Итак, использование принципов «backtonature» («назад к природе») в Университетской группе клиник Я здорова позволяет избежать ненужных осложнений, минимизировать гормональную нагрузку и сохранить овариальный резерв.
Синдром гиперстимуляции яичников, что это и как этого избежать?

Синдром гиперстимуляции яичников характеризуется довольно широким спектром клинических проявлений: от незначительных изменений лабораторных показателей до довольно серьезных состояний, требующих госпитализации.
Основными причинами его возникновения являются высокие дозы гормональных препаратов, которые используют для стимуляции овуляции, так и с высоким уровнем активности гормона эстрадиола, который вырабатывается в растущих фолликулах, высоким уровенем гормона ХГЧ. Основной группой риска для формирования этого синдрома являются девушки с диагнозом «Синдром поликистозных яичников», так как у этой группы высокий фолликулярный резерв и большое количество фолликулов «вступает в рост» во время проведения индукции.
Синдром гиперстимуляции яичников в настоящее время является хорошо изученным синдромом, по этой причине репродуктологи всего мира стараются проводить стимуляцию яичников с использованием минимальной гормональной нагрузки, преследуя основную цель: получить максимальное количество зрелых и качественных ооцитов, избежать синдрома гиперстимуляции яичников. Все пациентки, которые готовятся к программе ЭКО проходят тщательное обследование (согласно приказу 107н РФ), врачом-репродуктологом оцениваются все возможные риски, принимаются профилактические меры при наличии факторов риска возникновения СГЯ.
Женщинам с высоким риском возникновения синдрома рекомендуется проведение протокола ЭКО с последующей криоконсервацией эмбрионов и переноса эмбрионов в другом цикле.
Итак, современные знания об особенностях стимуляции пациенток с высоким риском гиперстимуляции позволяют минимизировать случаи гиперстимуляции яичников посредством использования минимальных протоколов и переносом эмбриона в нестимулированном цикле.
Онкологические риски и ЭКО: миф или реальность?
Действительно ли проведение программы увеличивает риски возникновения различных онкологических заболеваний: рака груди, яичников, матки, колоректального рака, меланомы и др. или это необоснованные страхи? Ученые вплотную занимаются изучением этого вопроса уже десятки лет, в результате их стараний было установлено отсутствие закономерности между проведением ВРТ и возникновением онкологических заболеваний.
Приведем результаты международных исследований в этой области:
Таким образом, гормональные препараты, которые используются в ВРТ, не провоцируют развитие онкологических заболеваний. Однако, у недообследованных женщин, с наличием предраковых заболеваний, собственный повышенный фон эндогенных гормонов может активировать уже имеющийся процесс.
Будет ли «нормальным» мой ребенок?
Одна из самых больших проблем, с которыми сталкивается любая беременная женщина, будет ли ее ребенок “нормальным” или нет? Когда дело доходит до ЭКО, опасения возрастают из-за введения “неестественной” составляющей в уравнение, которая может увеличить вероятность аномального потомства.
Было опубликовано несколько работ, которые демонстрировали повышенный риск развития пороков у детей после ЭКО: синдром Дауна (трисомия 21), синдромом Эдварда (трисомия 18) и синдром Тернера (моносомия Х0).
Таким образом, поздний репродуктивный возраст пациентки увеличивает риск возникновения хромосомных аномалий, как при спонтанном зачатии, так и после ЭКО.
Влияет ли «заморозка» эмбрионов на здоровье будущего ребенка?
Первая «удачная» беременность с переносом криоконсервиврованных эмбрионов была получена в 1983 году. Следовательно, этот метод далеко не нов, активно развивается, и его технологии усовершенствуются в течение последних 30 лет.

Доказано, что сам процесс хранения эмбрионов в замороженном виде не влияет на дальнейшее их развитие, однако повреждение эмбрионов может произойти на этапе «заморозки» и «разморозки». В настоящее время более эффективным способом «заморозки» является метод витрификации, т.е. быстрой «заморозки», при проведении которого процент выживаемости эмбрионов гораздо выше (более 98%), чем после медленной заморозки (около 50%), которая была популярна раньше.
Количество прогрессирующих беременностей после криоконсервации эмбрионов сопоставимо с количеством прогрессирующих беременностей при переносе свежих эмбрионов (в среднем, 41.6% и 44.3%, соответственно) и зависит от ряда факторов, главными из которых являются: качество, толщина и сохранение рецептивных свойств эндометрия, отсутствие деформации полости матки, качество эмбриона, соматическое здоровье женщины.
Несмотря на доводы, которые приводят врачи в пользу криоконсервации эмбрионов, большинство женщин продолжают крайне настороженно относиться к этому процессу. В результате обширного научного исследования в Швеции было выяснено: дети, рожденные после «криопереноса» реже имеют низкую массу тела при рождении и чаще рождаются в срок по сравнению с детьми, рожденными после «свежего переноса».
Итак, в современных условиях «криоконсервация» абсолютно безопасна и эффективна в аспекте дальнейшего развития беременности.
Хэтчинг? Что это такое и нужен ли он?

Установлен ряд возможных показаний к проведению данной манипуляции в программах ЭКО: возраст женщины более 38 лет, несколько предшествующих неудачных попыток ЭКО, утолщенная оболочка эмбриона и другие ее аномалии, перенос эмбрионов после криоконсервации.
Было проведено исследование, в котором сравнивали следующие показатели: частоту наступления беременности, частоту имплантации и количество рожденных детей в группе женщин с криопереносом и использующих метод вспомогательного хэтчинга и в группе женщин со свежим переносом без него. Реузльтаты: 74%, 52%, 65% соответственно против 17%, 10%, 13% показывают, что вспомогательный хэтчинг не влияет на частоту наступления беременности для женщин моложе 38 лет при свежем переносе эмбрионов, в то время как эффективность метода при криопереносе доказана.
Таким образом, большинство страхов перед проведением программы ЭКО являются необоснованными и, скорее, представляют собой некую совокупность стереотипов, навязанных обществом. Однако не стоит забывать о том, что программа ЭКО должна проводиться высококвалифицированным врачом-репродуктологом в тесном симбиозе с эмбриологом, которые имеют многолетний опыт работы в этой области, в специализированной клинике, включающей в себя все возможности обеспечения «эмбриологического этапа», обследования и подготовки пациентки к проведению программы.
Список используемой литературы.
1. Cryopreservation of Embryos and Fetuses as a Future Option for Family Planning Purposes, April 2015
2. Medical and ethical basis for embryo cryopreservation, Spanish, 2014 г.
3. Department of Obstetrics and Gynaecology, University of Gothenburg, Gothenburg, Sweden. 2013 г.
4. Valojerdi MR, Eftekhari-Yazdi P, Karimian L, Ashtiani SK (2008) Effect of laser zona pellucida opening on clinical outcome of assisted reproduction technology in patients with advanced female age, recurrent implantation failure, or frozen-thawed embryos. Fertil Steril 90: 84-91.
5.Assisted Hatching for In Vitro Fertilization-Embryo Transfer: An Update Shahryar K Kavoussi* Austin Fertility & Reproductive Medicine/Westlake IVF, 300 Beardsley Lane, Bldg B, Suite 200, Austin, Texas, USA. 2014.
6. International journal of gynecology and Obstetrics: the official organ of the International Federation of gynecology and obstetrics. Reproductive potential of mature oocytes after conventional ovarian hyperstimulation for in vitro fertilization. Zhang JJ, Yang M, Merhi Z, Ireland, 2016.
7. PLoS One. Prediction of Ovarian Hyperstimulation Syndrome in Patients Treated with Corifollitropin alfa or rFSH in a GnRH Antagonist Protocol. Griesinger G1, Verweij PJ, Gates D, Devroey P, Gordon K, Stegmann BJ, Tarlatzis BC, 2016.
8. Breast Cancer Research. Association of infertility and fertility treatment with mammographic density in a large screening-based cohort of women: a cross-sectional study. Lundberg FE, Johansson AL, Rodriguez-Wallberg K, Brand JS, Czene K, Hall P, Iliadou AN, 2013.
9. Clinical gastroenterology and hepatology: the official clinical practice journal of the American gastroenterological association, 2015.
10. Journal of Canser Research and Clinical Oncology. The risk of female malignancies after fertility treatments: a cohort study with 25-year follow-up. Kessous R, Davidson E, Meirovitz M, Sergienko R, Sheiner E, 2016.
11. Breast Cancer Research. Breast cancer incidence after hormonal treatments for infertility: systematic review and meta-analysis of population-based studies. Gennari A, Costa M, Puntoni M, Paleari L, De Censi A, Sormani MP, Provinciali N, Bruzzi P, 2015.
12. Human Reproductology. Risk of severe ovarian hyperstimulation syndrome in GnRH antagonist versus GnRH agonist protocol: RCT including 1050 first IVF/ICSI cycles. Toftager M, Bogstad J, Bryndorf T, Løssl K, Roskær J, Holland T, Prætorius L, Zedeler A, Nilas L, Pinborg A. Oxford, England, 2016.
13. Human Reproductology. Melanoma risk after ovarian stimulation for in vitro fertilization. Spaan M, van den Belt-Dusebout AW, Schaapveld M, Mooij TM, Burger CW, van Leeuwen FE; OMEGA-project group. Oxford, England, 2015.
14. Journal of Clinical medicine Research. Is It Possible to Prevent Ovarian Hyperstimulation Syndrome by Gonadotropin-Releasing Hormone Agonist Triggering and Modified Luteal Support in Patients With Polycystic Ovarian Morphology? Gurbuz AS, Deveer R, Kucuk M, Ozcimen N, Incesu D, Koseoglu S, 2016.