Чем опасна генно инженерная терапия
Чем опасна генно инженерная терапия
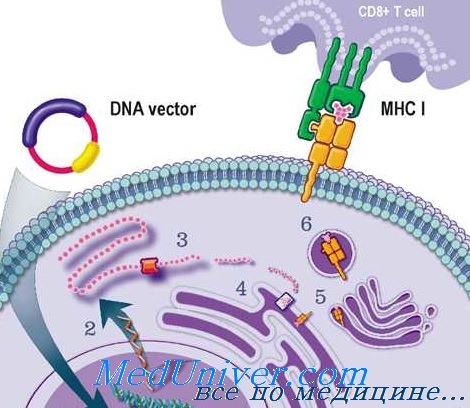
Генотерапия для лечения болезни человека имеет как уже продемонстрированные, так и теоретические риски трех общих типов.
Неблагоприятный ответ на вектор или комбинацию вектор/болезнь в генной терапии
Главная озабоченность — то, что пациент может неблагоприятно отреагировать на вектор или передаваемый ген. Такие проблемы в основном предполагают на основе животных моделей и предварительных исследований у человека. По крайней мере один пациент погиб из-за неблагоприятного иммунного ответа на введенный аденовирусный вектор.
Дополнительные соображения в этом случае — иммунный ответ у больного проявился вследствие катаболической реакции. Поскольку его генетическое заболевание — дефект цикла мочевины, способность переносить катаболизм белка была резко снижена.
Общий вывод из этого примера состоит в том, что при выборе подходящего вектора необходимо учитывать патофизиологические характеристики специфического заболевания; пациент, устойчивый к катаболизму, вероятно, смог бы перенести иммунную реакцию на введение аденовируса.
Инсерционный мутагенез, приводящий к злокачественным новообразованиям в генной терапии
Вторая причина для беспокойства — инсерционный мутагенез, т.е. вероятность того, что переданный ген, внедряясь в ДНК пациента, активизирует протоонкогены или нарушает гены — супрессоры опухолевого роста, возможно, вызывая злокачественное новообразование.
Текущее поколение вирусных векторов с меньшей вероятностью вызывает экспрессию онкогенов, так как они изменены для минимизации способности их промоторов активизировать экспрессию смежных генов хозяина. Инактивация генов-супрессоров, вероятно, будет встречаться редко, поэтому риск такого события оценивают как приемлемый при болезнях без другой терапевтической альтернативы.
Неожиданный механизм онкогенеза при генотерапии был обнаружен случайно при выявлении лимфопроли-феративных заболеваний у некоторых пациентов после генотерапии Х-сцепленного комбинированного иммунодефицита, обсуждаемого далее. Оказалось, что у этих больных перенос гена содействовал развитию злокачественного заболевания.
Следовательно, необходимо максимально предусматривать биологическое влияние передаваемого гена, когда он экспрессируется в необычном хромосомном положении за пределами своего нормального биологического контекста.
Инсерционная инактивация важного гена в генной терапии
Третий фактор риска — инактивация гена, существенного для жизнеспособности клетки — в основном не будет иметь значимого эффекта, поскольку ожидают, что такие летальные мутации будут редкими и повредят лишь единичные клетки.
Хотя векторы в основном включаются в транскрибируемые гены, а ретровирусы преимущественно в их 5′-конец, шанс, что один и тот же ген будет нарушен более чем в нескольких клетках, чрезвычайно низок, так как отдельные типы клеток экспрессируют около 10 000 генов.
Единственное исключение из этого правила относится к половым клеткам; инсерция в важный ген в половой клетке может вызвать патогенную доминантную мутацию у потомства пациента. Тем не менее, вероятно, такие события будут редкими, а риск приемлемым, поэтому на этом основании трудно оправдать отказ от тщательно спланированной и проверенной попытки генотерапии у пациентов, для которых нет других способов лечения.
Кроме того, проблема модификации половых клеток при лечении болезни не ограничивается генотерапией. Например, широко используемая при лечении злокачественных болезней химиотерапия мутагенна, но этот риск принимают из-за терапевтических преимуществ.
Этические проблемы генной терапии
Как и любое новое лечение, предложения по пересадке генов следует подвергать строгому изучению полномочными органами и этическими комитетами больниц. Тем не менее фактически все правительственные и религиозные учреждения, изучавшие предложения по применению генотерапии у человека для лечения генетической патологии, согласны, что эта терапевтическая возможность должна быть использована. Соматическая генотерапия, в отличие от передачи генов в половые клетки, поднимает всего несколько этических вопросов, не учитываемых при введении других новых видов лечения (например, новых противораковых препаратов).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Безопасность генно-инженерных биологических препаратов в зависимости от клинико-фармакологических свойств и химической структуры
Изучение профиля безопасности генноинженерных биологических препаратов (ГИБП) в зависимости от клинико-фармакологических характеристик и химической структуры на основании спонтанных сообщений о нежелательных реакциях (НР).
Материалы и методы
Проводили анализ спонтанных сообщений о НР, полученных Федеральной службой по надзору в сфере здравоохранения, поступивших за период 01.01.2009–08.05.2018.
При применении ГИБП было зарегистрировано 1 217 сообщений о НР. Применение ГИБП, представляющих собой растворимый рецептор или пегилированный Fab-фрагмент, ассоциировалось с более низким риском развития НР по сравнению с моноклональными антителами классической структуры. Ингибиторы фактора некроза опухоли α обладали более благоприятным профилем безопасности по сравнению с ингибиторами ИЛ-6. Риск развития НР уменьшался при увеличении доли человеческого компонента в структуре моноклонального антитела.
Рекомендуется учитывать указанные закономерности при выборе ГИБП для клинического применения с учетом риска развития НР.
Свнедрением в клиническую практику генно-инженерных биологических препаратов (ГИБП) связывают большие надежды в различных областях медицины [1,4]. Например, в ревматологии ГИБП применяют для лечения ревматоидного артрита при неэффективности синтетических базисных противовоспалительных препаратов, а также системной красной волчанки, системных васкулитов и других заболеваний [2,3]. Количество зарегистрированных ГИБП постоянно увеличивается, однако опыт их практического применения остается ограниченным [5,6], что имеет особое значение с точки зрения безопасности лечения. По классификации Всемирной организации здравоохранения (ВОЗ) нежелательные реакции (НР), возникающие при применении ГИБП, чаше всего относят к типу В (иммуноаллергические реакции), С (развитие новых заболеваний) и D (отсроченные канцерогенные и тератогенные эффекты) [7,8]. Результаты предрегистрационных клинических исследований не позволяют в полной мере изучить профиль безопасности лекарственных средств [9], поэтому важное значение для оценки безопасности ГИБП имеет постмаркетинговый фармаконадзор [8].
ГИБП представляют собой достаточно неоднородную группу лекарственных средств [10] и отличаются по строению молекулы (моноклональные антитела классической структуры, растворимый рецептор, пегилированный Fab-фрагмент), фармакодинамике, степени гуманизации (человеческие, гуманизированные, химерные) 12.
Целью настоящего исследования было изучение профиля безопасности ГИБП в зависимости от их клинико-фармакологических характеристик и химической структуры на основании спонтанных сообщений о НР.
Материал и методы
В ретроспективном фармакоэпидемиологическом исследовании анализировали безопасность применения адалимумаба (ADA), голимумаба (GOL), инфликсимаба (IFX), тоцилизумаба (TOC), цертолизумаба пэгол (CZP), этанерцепта (ETN) на основании спонтанных сообщений о нежелательных лекарственных реакциях. Использовали данные Центра мониторинга эффективного, безопасного и рационального использования лекарственных средств ФГБУ “Информа ционно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Росздрав надзора за период 01.01.2009 – 08.05.2018 гг. Сведения о реализации указанных ЛС, необходимые для расчета экспозиции, получены из базы данных IMS Health.
Валидность спонтанных сообщений определяли по критериям, рекомендованным Правилами надлежащей практики фармаконадзора Евразийского экономического союза [14]: идентифицируемый репортер, идентифицируемый пациент, по крайней мере один подозреваемый препарат, по крайней мере одна подозреваемая НР. При отсутствии хотя бы одного из указанных критериев спонтанные сообщения считали невалидными. Из анализа исключали также дублирующиеся спонтанные сообщения. Причинноследственную связь оценивали направители спонтанных сообщений, сотрудники Росздравнадзора и наши эксперты с использованием классификации ВОЗ (WHO-UMC). В анализ включали спонтанные сообщения, для которых причинно-следственная связь хотя бы одной из указанных сторон была оценена как “возможная», “вероятная» или “определенная».
НР кодировали с использованием Медицинского словаря для нормативно-правовой деятельности (Medical Dictionary for Regulatory Activities – MedDRA), версии 21.1 [15]. Расчет экспозиции проводили по методике установленной суточной дозы, рекомендованной ВОЗ, по формуле [16]: Р=m/(DDD×365), где Р – количество пациенто-лет, m – масса действующего вещества во всех реализованных упаковках препарата, DDD (Defined Daily Dose). DDD – это установленная суточная доза, принятая ВОЗ в качестве основы международной методологии для проведения статистических исследований в области потребления лекарственных средств. Она представляет собой среднюю поддерживающую суточную дозу ЛС для взрослого человека массой тела 70 кг. Показатель может применяться для оценки потребления ЛС и позволяет сравнивать потребление ЛС одной группы между собой, являясь некоторой нормирующей единицей для проведения такого сравнения. Для определения частоты НР использовали классификацию ВОЗ: очень частые (возникающие более чем у 10% пациентов); частые (1–10%); менее частые (0,1–1%); редкие (0,01–0,1%); очень редкие (менее 0,01%) [15].
По строению МАБ были распределены на 3 группы: классические моноклональные антитела (ADA, GOL, IFX,TOC), растворимый рецептор (ETN) и пегилированный Fab-фрагмент (CZP), по фармакодинамическим свойствам – на 2 группы: ингибиторы фактора некроза опухоли α (ФНОα) (ADA, GOL, IFX, CZP, ETN) и ингибиторы интерлейкина-6 (ИЛ-6) (TOC), по степени гуманизации – на 3 группы: химерные (IFX), гуманизированные (TOC, CZP), человеческие (ADA, GOL). Для каждого свойства была выбрана референтная подгруппа: для структурного строения – моноклональные антитела классической структуры; для фармакодинамических свойств – ингибиторы ФНОα; для степени гуманизации – человеческие моноклональные антитела. Было проведено сравнение частоты НР со стороны 10 лидирующих системно-органных классов (SOC) референтной группы с частотой НР тех же SOC иных групп для каждой клинико-фармакологической характеристики.
Результаты
Всего за анализируемый период времени Росздрав над зором было зарегистрировано 1 510 первичных и повторных спонтанных сообщений, содержащих информацию о НР при применении изучаемых ГИБП. После исключения невалидных и дублирующихся сообщений, а также совмещения данных, содержащихся в первичных и повторных сообщениях, была получена информация о 1 217 НР.
Для каждой группы ГИБП был произведен расчет экспозиции и частоты возникновения НР. Среди групп ГИБП, сформированных на основании структурного строения, наибольшая частота спонтанных сообщений зафиксирована при применении моноклональных антител классической структуры, наименьшая – растворимого рецептора, в то время как пегилированный Fab-фрагмент занимал промежуточное положение (табл. 1). Частота спонтанных сообщений при применении ингибитора ИЛ-6 в 3 раза превосходила таковую при лечении ингибиторами ФНОα. Тем не менее, в обеих группах они относились к одной категории “частые». Среди групп, сформированных по признаку гуманизации, самая высокая частота спонтанных сообщений зафиксирована для гуманизированных моноклональных антител, самая низкая – для химерных, человеческие моноклональные антитела занимали промежуточное положение.
| Группы препаратов | Количество СС | Экспозиция, пациенто-лет | Частота СС, 1 : 100 000 (%) | Градация по ВОЗ |
|---|---|---|---|---|
| Структура | ||||
| Классические моноклональные антитела | 1 152 | 60 772 | 1 896 (1,90) | Часто |
| Растворимый рецептор | 36 | 9 465 | 380 (0,38) | Менее часто |
| Пегилированный Fab | 29 | 2 078 | 1 396 (1,40) | Часто |
| Фармакодинамические свойства | ||||
| Ингибиторы ФНОα | 1 026 | 68 268 | 1 503 (1,50) | Часто |
| Ингибитор ИЛ-6 | 191 | 4 227 | 4 519 (4,52) | Часто |
| Степень гуманизации антител | ||||
| Человеческие | 279 | 14 620 | 1 908 (1,91) | Часто |
| Гуманизированные | 220 | 6 305 | 3 489 (3,49) | Часто |
| Химерные | 682 | 41 925 | 1 626 (1,62) | Часто |
Для большинства сравниваемых SOC частота нежелательных реакций при применении моноклональных антител классической структуры была выше, чем растворимого рецептора и пегилированного Fab-фрагмента (табл. 2, 3). Исключением были “Нарушения со стороны органа зрения», которые чаще встречались при применении растворимого рецептора, и “Нарушения со стороны крови и лимфатической системы», частота которых была выше в группе пегилированного Fabфрагмента. Частота нежелательных реакций, относящихся к “Нарушениям со стороны сердца», “Общим расстройствам и нарушениям в месте введения» и “Новообразованиям доброкачественным, злокачественным и неопределенным», не различалась при применении моноклональных антител классической структуры и пегилированного Fab-фрагмента.