Чем опасен повышенный гемоглобин у мужчин после 50
Гемоглобин у пожилых
Кровь играет одну из самых важных ролей в человеческом организме. И даже небольшие изменения в ее химическом составе сказываются на общем самочувствии человека и функционировании его органов и систем. Пожилому человеку необходимо тщательно следить за уровнем гемоглобина, который может как падать, так и повышаться.
Норма белка в крови
Показатели крови должны соответствовать общепринятым нормам. Норма гемоглобина на протяжении жизни может быть разной. Так, в литре крови мужчины содержится 130-160 г гемоглобина, для женщин этот показатель равен 120-155 г. И когда норма оказывается пониженной или повышенной, это сказывается на самочувствии как в молодом, так и в пожилом возрасте. И в зависимости от результатов анализа, данный показать нужно понижать или повышать.
Причины, почему падает гемоглобин, могут быть самыми разными. Это может произойти в том случае, если:
Симптоматика
Практически у 50% пожилых людей возрастом за 60 лет показатель данного белка в крови составляет менее 110 г/л, что свидетельствует о наличии такого заболевания, как анемия. При этом мужчина страдает ею чаще, чем женщина. Среди наиболее распространенных причин, почему показатель начинает падать ниже нормы, стоит выделить наличие постоянных инфекций, опухолей, а также различных заболеваний сердечно-сосудистой, эндокринной или аутоиммунной систем. Его снижение может спровоцировать неправильный режим питания и хронические недуги, сопровождающиеся кровотечениями (язвы, колиты, злокачественные и доброкачественные опухоли и т.д.). И довольно часто причиной является дефицит витамина В12 и фолиевой кислоты.
Низкий гемоглобин у пожилых мужчин и женщин дает о себе знать сухостью кожи, быстрой утомляемостью, слабостью и головокружениями. Распространенными симптомами низкого уровня этого показателя в крови является появление отдышки и сильного сердцебиения.
Также при низком уровне данного белка в крови у человека преклонного возраста присутствуют следующие симптомы:
Симптоматика анемии становится более выраженной при существенном снижения уровня белка. Если пониженный гемоглобин — 60 г/л, человек может падать в обмороки и страдать от спутанности сознания, поэтому его уровень нужно срочно повышать.
Как повысить низкий уровень
Наиболее часто пожилые люди страдают железодефицитной анемией, которую можно определить по цветовому показателю крови, а также соотношению различных элементов. Задаваясь вопросом, как поднять гемоглобин, необходимо лечить не последствия недуга, а устранять факторы, которые его вызвали.
Чтобы повысить уровень белка, больному с низким гемоглобином в крови назначается прием железосодержащих препаратов. Важно, чтобы в них содержалось достаточное количество двухвалентного железа, а также присутствовали компоненты, улучшающиеся всасывание его ионов. Зачастую, такие лекарства принимаются дважды в сутки во время еды. При этом назначать себе лекарства самостоятельно ни в коем случае не стоит, так как содержание препарата может спровоцировать возникновение побочных эффектов. У старых людей могут возникнуть нарушения в работе органов пищеварительного тракта, воспаление сосудистых стенок вен, гипотония и аллергическая реакция. Еще одним довольно распространенным побочным эффектом являются боли за грудиной. Поэтому препараты для повышения гемоглобина должны выписываться исключительно специалистом, который учтет все индивидуальные особенности организма.
Также избавиться от малокровия можно, придерживаясь правильного и сбалансированного питания. Продукты, повышающие гемоглобин в крови у пожилых — это:
Такое питание при пониженном гемоглобине способно поднять его уровень, и помочь навсегда избавиться от проявлений анемии на ранней стадии развития заболевания.
Как снизить высокий уровень
Не менее серьезной проблемой для мужчины и женщины пожилого возраста является повышенный гемоглобин. Причин, почему имеет место повышение уровня белка, может быть много. Так, пожилой человек, который злоупотребляет курением, проживает в загазованной местности или бесконтрольно принимает мочегонные препараты может иметь повышенный уровень белка.
Несмотря на то, что повышение содержания белка в крови никак не проявляет себя внешне, понижать его нужно обязательно. Для пожилого человека лучшим вариантом станет подбор лечебного питания, подходящего под его возраст и индивидуальные особенности организма. Стоит употреблять бобовые и кисломолочные продукты питания, а также ту пищу, в которой содержится фолиевая кислота. Чтобы показатель начал уменьшаться, стоит ограничить употребление таких продуктов как красное мясо, печень, овощи и фрукты красного цвета.
Если вы или ваши родственники обнаружили у себя вышеописанные симптомы, обращайтесь за помощью к специалистам. Ведь своевременное выявление проблемы — гарантия того, что лечение будет успешным, и в кратчайшее время вы сможете вернуться к нормальному образу жизни и прекрасно себя чувствовать.
Анализ крови на гемоглобин

Функции гемоглобина
Эритроциты важны тем, что благодаря им осуществляется «дыхание» клеток и тканей организма. Но они служат только своеобразным транспортом, который помогает переносить жизненно важный кислород, на деле же основную дыхательную функцию выполняет белок – гемоглобин, которым насыщенны красные кровяные тельца. Именно он придает им такую окраску и взаимодействует с кислородом, прикрепляя его к себе и доставляя к тканям, а после – забирая углекислый газ из клеток. Также он играет немалую роль в поддержании кислотно – щелочного баланса в организме. Примечательно, что сразу после своего создания эритроциты еще не насыщены гемоглобином, это происходит уже после их попадания в кровь. В норме зрелый эритроцит содержит порядка 400 млн молекул гемоглобина.
Так как именно на гемоглобине лежит одна из наиболее ответственных функций – дыхательная, его показатели очень важны, в случае отклонений начинается гипоксия – кислородное голодание, которое очень негативно отражается на организме в целом. При этом необходимо помнить, что выход его показателей за пределы нормы не является самостоятельным заболеванием, но при этом служит его следствием, это всегда побуждает к более глубокому исследованию состояния здоровья для выявления настоящей причины подобного отклонения и предотвращения возможных последствий.
Отдельные исследования гемоглобина не проводятся, его количество изучается в рамках общего (клинического) анализа крови, где в комплексе с гемоглобином анализируются другие составляющие крови – эритроциты, лейкоциты и тромбоциты.
Норма гемоглобина в крови
Нельзя сказать, что показатели гемоглобина индивидуальны и каждому человеку свойственны свои границы нормы. Но при этом они зависят от возраста, пола и определенных физиологических состояний. Например, у беременных женщин в норме уровень гемоглобина находятся несколько ниже, чем у всех остальных, так как их организм работает за двоих. В среднем у здорового человека гемоглобин должен варьироваться от 110 до 160 г/л.
Так у беременной женщины нормой считается 110 г/л, та же норма и у новорожденного ребенка. Уровень данного белка младенец берет от своей матери, так как самостоятельно вырабатываться в организме он начинает только после 6-ти месячного возраста. У взрослых женщин гемоглобин может варьироваться от 120 до 140 г/л (зачастую это зависит от питания и образа жизни).
Для взрослых мужчин нормой считается более высокий уровень, нежели у женщин. Этот показатель должен находиться в промежутке от 130 до 160 г/л. Стоит также отметить возможное понижение уровня гемоглобина у пожилых людей и у лиц страдающих алкоголизмом. Подобное явление носит физиологический характер и не будет отклонением от нормы, оно лишь свидетельствует о нехватке витаминов группы В.
Показания к назначению анализа на уровень гемоглобина
Общий анализ крови проводится на регулярной основе каждым человеком, следящим за своим здоровьем, для мониторинга состояния организма и преждевременного выявления скрытых болезней, которые еще никак не начали себя проявлять. При этом важно начать их своевременное лечение. Обычно подобный анализ сдается раз в год, гораздо чаще в профилактических целях кровь сдается беременными женщинами для предотвращения кислородного голодания плода (гипоксии) и резкого ухудшения самочувствия будущей роженицы.
В качестве базового исследования забор крови для общего анализа осуществляется при госпитализации и перед операционным вмешательством, чтобы выяснить состояние организма и не допустить каких-либо осложнений. Не менее важно проведение анализа в процессе лечения для мониторинга эффективности выбранной медикаментозной стратегии.
Также поводом для направления на анализ для более детального изучения уровня гемоглобина служат жалобы пациента: повышенная сонливость, быстрая утомляемость, нехватка сил, бледность кожных покровов. Все это может говорить не только о пониженном уровне белка, но и о наличии серьезного заболевания: разного рода анемии, заболевание кроветворной системы и даже наличие раковых опухолей.
Подготовка к анализу
Исследование гемоглобина входит в общий (клинический) анализ крови, забор крови для которого осуществляется либо из вены, либо из пальца. Причем у детей предпочтителен вариант забора именно капиллярной крови. Далее материал загружается в анализатор для подсчета количества клеток и оценки характеристик эритроцитов, лейкоцитов (в том числе и составление лейкоцитарного плана) и тромбоцитов. Конечно, наиболее точным способом исследования считается ручной подсчет, но поскольку этот процесс очень долгий и трудоемкий, сейчас его уже практически не используют, лишь в тех случаях, когда требуется максимальная точность анализа.
Подготовка к общему анализу подразумевает стандартные шаги для предотвращения искажения результатов:
В случае если экстренно необходимо сдать общий анализ крови (непредвиденная госпитализация), то забор крови делается без какой-либо подготовки. Также нет никаких ограничений на обычную питьевую воду.
Расшифровка результатов анализа (повышенные лейкоциты)
Несмотря на то, что уровень гемоглобина зависит от многих факторов (возраст, приём пищи, пол, физиологическое состояние), есть определенные рамки нормы содержания, которые уже были приведены выше.
Отклонение уровня гемоглобина от нормы, не вызванное каким-либо заболеванием называется физиологическим и, зачастую, либо не требует вообще никакого лечения, либо все корректируется диетой, железосодержащими препаратами или изменением образа жизни. Так физиологическое повышение гемоглобина может быть у людей, потребляющих недостаточное количество воды. Сокращается производство плазмы, вырабатывается больше эритроцитов, повышается вязкость крови. Безусловно, это состояние нельзя назвать вариантов нормы, оно опасно для здоровья, но его легко скорректировать потреблением больше количества чистой питьевой воды.
Повышенный гемоглобин наблюдается у курящих людей. Их организм испытывает серьезное кислородное голодание, так как возникают прочные соединения гемоглобина и угарного газа. Все решит отказ от вредной привычки. Влияет также и место проживания, например, у людей живущих в высокогорье, где воздух разряжен и в нем сравнительно небольшое содержание кислорода или же у пилотов и стюардесс наблюдается повышенный уровень гемоглобина, который не является отклонением и не требует каких-либо методов лечения.
Высокий гемоглобин может возникнуть у профессиональных спортсменов, это также является вариантом нормы. Повышенным уровнем белка для женщин и детей является показатель выше 150 г/л, а для мужчин выше 180 г/л.
Пониженным считается уровень гемоглобина, который меньше нормы на 20 г/л. Физиологическое понижение гемоглобина может быть вызвано неправильным питанием: человек употребляет в пищу мало мяса, молочных и железосодержащих продуктов. В данном случае все корректируется соответствующей диетой и витаминами, но важно не запускать ситуацию и придерживаться всех предписаний врача, потому что при дальнейшем снижении гемоглобина можно заработать анемию.
О чем говорят отклонения от нормы
Помимо физиологических и вполне естественных причин повышения гемоглобина в крови, конечно, есть и патологические, вызванные серьезными заболеваниями. Поэтому по каждому отклонению от нормы требуется консультация специалиста, анализ имеющихся симптомов и, возможно, расширенное исследование организма.
К патологическим причинам повышения уровня гемоглобина относят:
В целом вся опасность повышения уровня гемоглобина заключается в увеличении вязкости крови, что может привести к таким явлениям, как инсульт, инфаркт миокарда и тромбообразование. Все это серьезные патологии сердечно-сосудистой системы, которые не просто опасны, они могут привести к летальному исходу.
Как уже говорилось выше, причиной пониженного гемоглобина может выступать неправильный рацион с низким содержанием железа, но также есть и более опасные причины пониженного гемоглобина, которые требуют медикаментозного вмешательства. Одной из таких патологических причин являются глистные инвазии. Паразиты поглощают важные для организма микроэлементы и питательные вещества, в результате чего человек начинается испытывать их дефицит.
Также пониженный гемоглобин может свидетельствовать о наличии скрытого кровотечения и большой кровопотери из-за этого. Подобное явление требует срочного медицинского вмешательства, так как оно серьезно угрожает жизни пациента.
Из-за пониженного уровня гемоглобина появляется усиленное кровообращение, которое все также чревато проблемами с сердечно-сосудистой системой и может привести к развитию кардиомиопатии и сердечной недостаточности.
Анализ крови на гемоглобин в МедАрт
Лаборатория медицинского центра МедАрт оснащена автоматическим гематологическим анализатором DxH 500 Beckman Coulter, произведенным в США. Данное оборудование отличается повышенной точностью при проведении исследований. Медицинский персонал нашего центра высоко квалифицирован и хорошо подготовлен к работе. Результат общего анализа крови будет достоверен на 100% и не вызовет у вас никаких сомнений.
У нас вы сможете сдать общий (клинический) анализ крови, не тратя много времени и сил на получение направления, а потом и выяснение результатов анализа. Мы гарантируем быструю и качественную гематологическую диагностику. Результаты вы сможете получить уже через день, а в экстренных ситуациях, по показаниям уже через 1 час.
Комфортная и спокойная обстановка поможет вам расслабиться, в этом случае результаты анализа не будут искажены из-за стресса или нервозности.
Чем опасен повышенный гемоглобин у мужчин после 50
Вряд ли можно найти человека, который хотя бы раз в жизни не делал клинический (или общий) анализ крови. Это один из самых часто применяемых анализов для диагностики различных заболеваний, такое исследование, выполненное профессионально, может многое сказать врачу о состоянии здоровья пациента.
Чаще всего люди, самостоятельно получая результаты клинического анализа крови в лаборатории или слушая их интерпретацию от врача, не понимают, что означает тот или иной показатель, и как они связаны с их состоянием. Безусловно, пациент не должен «подменять» собой врача и пытаться на основании полученных результатов ставить себе диагноз и т.п. Целью данной статьи является ознакомление широкого круга читателей с основными показателями общего анализа крови, чтобы терминология, которую используют врачи при общении с пациентами, не была «тайной за семью печатями», и врач и пациент лучше понимали бы друг друга.
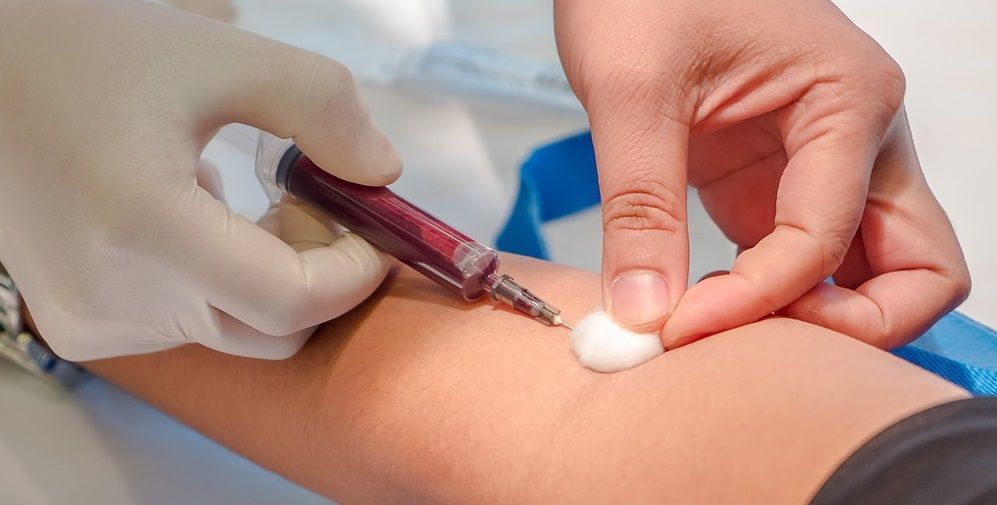
Для взятия анализа используется одноразовый стерильный инструментарий. Лаборант, производящий забор крови, обязан работать либо в одноразовых перчатках, либо в резиновых перчатках, которые обеззараживаются дезинфицирующими растворами после каждого забора крови, и которые он меняет по мере необходимости.
Традиционно кровь берут из четвертого пальца левой руки, который тщательно протирают ватой со спиртом, после чего делают укол специальной иглой в мякоть пальца на глубину 2-3 мм. Первую каплю крови снимают ватой, смоченной эфиром. Вначале набирают кровь для определения гемоглобина и СОЭ, затем – для определения числа эритроцитов и лейкоцитов, после чего с помощью стекол делают мазки крови и изучают строение клеток под микроскопом.
Общий анализ крови помогает врачу любой специальности. На основании результатов анализа крови (гемограммы) врач может компетентно оценить состояние организма, поставить предварительный диагноз и своевременно назначить соответствующее лечение.
Значительное повышение содержания эритроцитов может говорить об эритремии (одно из заболеваний крови). Кроме того, повышение числа эритроцитов (эритоцитоз, полицитемия) наблюдается при острых отравлениях, когда из-за сильной рвоты и поноса наблюдается большой дефицит жидкости в организме; при ацидозах (из-за нарушения обмена веществ при обострении некоторых заболеваний); при потере жидкости по разным причинам (жара, болезнь, большая физическая нагрузка); при длительных сердечно-сосудистых или легочных заболеваниях, когда организм недостаточно снабжается кислородом и увеличивает количество эритроцитов в попытке все-таки доставить кислород к тканям; или при нахождении человека в высокогорье, когда ему перестает хватать кислорода.
Скорость оседания эритроцитов (СОЭ) определяет, как быстро оседают эритроциты в пробирке, отделяясь от плазмы крови. У женщин норма СОЭ немного выше, чем у мужчин, при беременности СОЭ повышается. В норме величина СОЭ у мужчин не превышает 10 мм/час, а у женщин — 15 мм/час. Показатель СОЭ может меняться в зависимости от различных факторов, в том числе вследствие различных болезней.
Повышение СОЭ в анализе крови является одним из показателей, который заставляет врача предположить у пациента наличие острого или хронического воспалительного процесса (пневмония, остеомиелит, туберкулез, сифилис), а также повышение СОЭ характерно для отравления, инфаркта миокарда, травм, переломов костей, анемии, заболеваний почек, рака. Наблюдается оно и после проведенных операций, и вследствие приема некоторых лекарственных препаратов. Снижение СОЭ происходит при голодании, при снижении мышечной массы, при приеме кортикостероидов.
Низкий гемоглобин (анемия) может быть результатом большой кровопотери, понижение гемоглобина происходит при нехватке железа, необходимого материала для строительства гемоглобина. Также пониженный гемоглобин (анемия) является следствием заболеваний крови и многих хронических заболеваний, с ними не связанных.
Уровень гемоглобина выше нормы может быть показателем многих заболеваний крови, при этом общий анализ крови также покажет увеличение эритроцитов. Повышенный гемоглобин характерен для людей с врожденными пороками сердца, легочно-сердечной недостаточностью. Повышение гемоглобина может быть вызвано физиологическими причинами – у летчиков после полетов, альпинистов, после значительной физической нагрузки уровень гемоглобина выше нормы.
Лейкоциты – это защитники нашего организма от чужеродных компонентов. В крови взрослого человека лейкоцитов содержится в среднем 4-9х10 9/л. Лейкоциты борются с вирусами и бактериями и очищают кровь от отмирающих клеток. Различают несколько видов лейкоцитов (моноциты, лимфоциты и др.). Подсчитать содержание этих форм лейкоцитов в крови позволяет лейкоцитарная формула.
Если в анализе крови находят лейкоциты в повышенном количестве, то это может означать наличие вирусных, грибковых или бактериальных инфекций (воспаление легких, ангина, сепсис, менингит, аппендицит, абсцесс, полиартрит, пиелонефрит, перитонит), а также быть признаком отравления организма (подагра). Перенесенные ожоги и травмы, кровотечения, послеоперационное состояние организма, инфаркт миокарда, легких, почек или селезенки, острые и хронические анемии, злокачественные опухоли все эти «неприятности» сопровождаются повышением количества лейкоцитов крови.
У женщин некоторое повышение лейкоцитов в крови наблюдается также в период перед менструацией, во второй половине беременности и при родах.
Понижение числа лейкоцитов, которое может показать анализ крови, может быть свидетельством вирусных и бактериальных инфекций (грипп, брюшной тиф, вирусный гепатит, сепсис, корь, малярия, краснуха, эпидемический паротит, СПИД), ревматоидного артрита, почечной недостаточности, лучевой болезни, некоторых форм лейкоза, заболеваний костного мозга, анафилактического шока, истощения, анемии. Снижение количества лейкоцитов ожжет наблюдаться также на фоне приема некоторых лекарственных препаратов (анальгетиков, противовоспалительных средств).
Снижение числа тромбоцитов наблюдается у женщин во время менструации и при нормально протекающей беременности, а увеличение происходит после физической нагрузки. Также количество тромбоцитов в крови имеет сезонные и суточные колебания. Обычно контроль тромбоцитов назначают при приеме некоторых лекарств, когда у человека беспричинно лопаются капилляры, часты носовые кровотечения, или при обследовании по поводу различных заболеваний.
Увеличение числа тромбоцитов в крови (т.н. тромбоцитоз) происходит при:
— воспалительных процессах (острый ревматизм, туберкулез, язвенный колит);
— острой кровопотере;
— гемолитической анемии (когда эритроциты разрушаются);
— состояний после удаления селезенки;
— отмечается при лечении кортикостероидами;
— некоторых более редких заболеваниях.
Понижение числа тромбоцитов (тромбоцитопения) наблюдается при целом ряде наследственных заболеваний, но гораздо чаще появляется при заболеваниях приобретенных. Снижается число тромбоцитов при:
— тяжелой железодефицитной анемии;
— некоторых бактериальных и вирусных инфекциях;
— заболеваниях печени;
— заболеваниях щитовидной железы;
— применении ряда лекарственных препаратов (винбластин, левомицетин, сульфаниламиды и др.);
— системной красной волчанке.
Объем эритроцитов по сравнению с плазмой увеличивается при:
— обезвоживании (дегидратации), что бывает при токсикозах, поносах, рвоте;
— врожденных пороках сердца, сопровождающиеся недостаточным поступлением кислорода к тканям;
— нахождении человека в условиях высокогорья;
— недостаточности коры надпочечников.
Объем эритроцитов по отношению к плазме уменьшается при разжижении крови (гидремии) или при анемии.
Гидремия может быть физиологической, если человек сразу выпил много жидкости. После значительной кровопотери возникает компенсаторная гидремия, когда восстанавливается объем крови. Патологическая гидремия развивается при нарушении водно-солевого обмена и возникает при гломерулонефрите, острой и хронической почечной недостаточности, при сердечной недостаточности в период схождения отеков.
Формула крови. Исследование лейкоцитарной формулы имеет важное диагностическое значение, показывая характерные изменения при ряде болезней. Но эти данные всегда должны оцениваться вместе с другими показателями системы крови и общего состояния больного.
При различных заболеваниях смотрят совокупность следующих признаков: общее число лейкоцитов; наличие ядерного сдвига нейтрофилов (так называемый «сдвиг по формуле влево», то есть появление в крови юных, не созревших форм нейтрофилов); процентное соотношение отдельных лейкоцитов; наличие или отсутствие дегенеративных изменений в клетках.
Синдром перегрузки железом при хронических заболеваниях печени: фокус на неалкогольную жировую болезнь печени
Статья посвящена вопросам терапии синдрома перегрузки железом (СПЖ) при хронических заболеваниях печени (ХЗП). Рассмотрены роль железа и его метаболизм в организме человека, механизмы и диагностика СПЖ у пациента с ХЗП, особенности клинических проявлений
The article is dedicated to the issues of therapy of iron overload syndrome (IOS) in chronic hepatic diseases (CHD). Role of iron and its metabolism in human organism were considered, as well as the mechanisms and diagnostics of IOS in a patient with CHD, features of clinical manifestations of iron metabolism disorders and methods of IOS treatment.
На сегодняшний день синдром перегрузки железом (СПЖ) при хронических заболеваниях печени (ХЗП) недостаточно полно освещен в литературе и малоизвестен практикующему врачу. При этом СПЖ у данной категории больных часто является более тяжелым нарушением, нежели дефицит железа, и может приводить к необратимым последствиям [2, 5, 16].
В последние годы регистрируется высокая распространенность первичного СПЖ — наследственного гемохроматоза (НГ) в популяции (до 1:250 среди жителей Северной Европы, манифестные формы — 2:1000), а также обнаружены новые мутации в генах, регулирующих обмен железа [8, 18, 23]. Тогда как далеко не все клиницисты осведомлены, что вторичный СПЖ, возникающий при развитии ХЗП, в том числе при такой частой на сегодняшний день патологии, как неалкогольная жировая болезнь печени (НЖБП), наблюдается почти у каждого третьего пациента (в 20–30% случаев). Нередко при этом, по данным некоторых авторов, у 36,7% больных ХЗП обнаруживаются мутантные гены в гетерозиготном состоянии (C282/N, H63D/N), которые сами по себе не приводят к развитию НГ, однако при возникновении патологии печени способствуют манифестации СПЖ [18, 28].
Результаты исследований свидетельствуют, что раннее обнаружение и лечение СПЖ у пациентов с ХЗП позволяет предотвратить прогрессирование заболевания печени до цирротической стадии и значительно уменьшает риск гепатоцеллюлярной карциномы (ГЦК) [2, 4, 26, 31].
В этой связи необходимы новые подходы к диагностике, оценке клинической картины, лечению данного состояния и практическому специалисту актуально получение ответов на следующие вопросы:
Роль железа и его метаболизм в организме человека
В литературе последних лет появились новые данные о метаболизме железа (Fe) в организме человека, в связи с открытием белков-регуляторов, участвующих в обмене этого микроэлемента [1, 17, 20].
Известно, что железо является важнейшим элементом, участвующим в метаболизме организмов, живущих в среде, богатой кислородом. Обладая выраженными окислительно-восстановительными свойствами, оно необходимо для транспорта кислорода гемоглобином, синтеза дезоксирибонуклеиновой кислоты (ДНК), работы митохондриальных ферментов. Как металл с переменной валентностью, железо в составе негемовых энзимов (каталазы, пероксидазы, цитохрома) нейтрализует активные формы кислорода. Однако увеличение пула Fe III может являться катализатором образования свободных радикалов и инициатором оксидативного стресса. С целью компенсации, в организме предусмотрены естественные антиоксиданты — хелаторы Fe III, к которым относятся мочевая кислота (МК), церулоплазмин, супероксиддисмутаза, ферритин, трансферрин.
У человека в норме содержится около 3–4 г железа (40–50 мг Fe/кг). Суточная потребность в этом элементе в пище составляет около 10 мг для мужчин и 20 мг для женщин детородного возраста. При этом всасывается лишь 1–2 мг и почти столько же теряется со слущиваемым эпителием желудочно-кишечного тракта, эпидермисом, потом и мочой. Основная масса необходимого железа ежедневно поступает в циркуляцию из клеток ретикулоэндотелиальной системы (РЭС) (селезенка, печень, костный мозг).
Всасывание железа осуществляется эпителиальными клетками двенадцатиперстной кишки и начальных отделов тощей кишки и находится под строгим контролем белков-регуляторов обмена железа.
Известно, что гемовое железо (Fe II), находящееся в составе гемоглобина и миоглобина (в мясных продуктах), усваивается человеком на 20–30% независимо от желудочной секреции и состава пищи. Гемовое железо легко эндоцитируется энтероцитом после сливания с транспортером гемового железа (НСР1). Негемовое железо (Fe III), содержащееся в растительной пище, усваивается человеком на 1–7% и во многом зависит от сопутствующих пищевых факторов (табл. 1).
Всасывание негемового железа — сложный энергозависимый транспортный процесс. Оно происходит после восстановления Fe III до Fe II при помощи соляной кислоты желудочного сока и дуоденального цитохрома — ферроредуктазы (Dcyt b). Затем Fe II переносится в энтероцит специальным транспортером двухвалентных ионов (ДMT1).
Часть железа, которая не используется клеткой, депонируется в виде ферритина и гемосидерина в печени, селезенке, костном мозге, мышечной ткани. Ферритин — внутриклеточный комплекс, содержащий белок-апоферритин, связывающий до 4 тысяч атомов железа. Существует 5 изоформ ферритина: щелочные изоформы печени и селезенки отвечают за депонирование железа, а кислые изоформы миокарда, плаценты, опухолевых клеток являются посредниками в процессах синтеза и участвуют в регуляции Т-клеточного иммунного ответа. Поэтому ферритин является еще и белком острого воспаления и опухолевого роста. Гемосидерин — нерастворимая часть ферритина, форма депонирования избыточного железа.
Поступление железа (Fe II) в кровь из энтероцита, а также из клеток печени, макрофагов селезенки, костного мозга осуществляется единственным белком-переносчиком — ферропортином. В 2001 г. был открыт важнейший регулятор обмена железа и функции ферропортина — гепсидин. Этот белок, состоящий из 25 аминокислот, синтезируется печенью, а также, по некоторым данным, клетками жировой ткани при ожирении [24].
Ранее он был известен как белок острой фазы, обладающий антибактериальными свойствами, благодаря способности уменьшать поступление железа к микроорганизмам, блокировать их размножение, разрушать бактериальные мембраны. Основными стимуляторами синтеза гепсидина при воспалении являются провоспалительные цитокины — ИЛ-6 и ФНО-а. На сегодняшний день известно, что именно гепсидин, уровень которого повышается при воспалении, а также опухолевом процессе, играет основную роль в развитии анемии хронического воспаления [35]. Гепсидин регулирует сывороточную концентрацию железа, путем «выключения» работы ферропортина (в этом случае железо накапливается в энтероцитах, макрофагах, гепатоцитах). При повышении железа в крови — увеличивается синтез гепсидина. В результате блокируются процессы всасывания (угнетается работа ДMT1), рециркуляции и высвобождения железа из депо.
Транспорт железа от энтероцитов и органов-депо к костному мозгу и другим тканям осуществляет трансферрин, синтезируемый печенью. Этот белок способен переносить только Fe III. Поэтому на поверхности мембран клеток происходит окисление Fe II в Fe III при помощи ферментов-ферроксидаз — гефестина и церулоплазмина. Трансферрин является отрицательным белком острой фазы.
Железо (Fе III), связанное с трансферрином, поступает внутрь клетки посредством специальных трансферриновых рецепторов 1-го и 2-го типа (TfR). Под действием внутриклеточных ферроредуктаз Fe III вновь восстанавливается в Fe II. Синтез трансферриновых рецепторов в клетке зависит от ее потребностей в железе и строго регулируется системой внутриклеточных белков (IRP1, IRP2, IRE). Образование комплекса трансферрина с TfR и их эндоцитоз внутрь клетки контролируется белком HFE, при мутации гена которого развивается НГ.
Механизмы развития СПЖ
По имеющимся на сегодняшний день данным, организм человека не имеет средств контроля за экскрецией железа. Интестинальная абсорбция — основной этап, который тщательно регулируется. Поэтому любые ситуации, связанные с избыточным поступлением железа в кровь (при парентеральном введении препаратов железа, переливании крови, гемолизе) или всасыванием (наследственные и приобретенные механизмы), могут приводить к СПЖ.
Таким образом, развитие СПЖ обуславливается как наследственными причинами, так и приобретенными факторами (табл. 2).
Среди основных этиологических факторов можно выделить «триаду»:
1) гемолиз эритроцитов (сидероахрестические анемии, талассемия, недостаточность глюкозо-6-фосфатдегидрогеназы, микросфероцитоз, дефицит витамина В12);
2) избыточное экзогенное поступление железа (диета, многократные гемотрансфузии, длительное бесконтрольное применение парентеральных препаратов железа, хронический гемодиализ);
3) заболевания печени (хронический вирусный гепатит С, реже В, алкогольная болезнь печени, НЖБП, кожная порфирия).
При СПЖ железо оказывает негативное влияние на организм. Перенасыщение трансферрина железом сопровождается включением дополнительного транcпорта железа, связанного с альбумином. Данный комплекс легко проникает в клетки, не предназначенные для депонирования железа (миокард, гонады, поджелудочная железа и др.), и вызывает токсические эффекты. При избыточном накоплении железа в органах-депо, а также тканях, не являющихся таковыми, происходит усиление образования коллагена и прямое повреждение ДНК. При переходе Fe III в Fe II образуются токсичные свободные радикалы, активирующие процессы перекисного окисления. При выраженном СПЖ в организме работа собственных антиоксидантных систем защиты становится неэффективной.
Тем не менее патогенез СПЖ у больных с ХЗП остается не до конца ясным. Возможными механизмами могут являться:
Признаки СПЖ
СПЖ выявляется при оценке совокупности признаков:
1. Клинические признаки
В зависимости от причины СПЖ весьма вариабельны. Могут наблюдаться проявления стеатоза или цирроза печени, меланодермия, гипогонадизм, дисфункция надпочечников, гипотиреоз, артропатия, сахарный диабет 2-го типа, гиперурикемия [5, 13, 18, 29].
2. Лабораторные маркеры СПЖ
Показатели клинического анализа крови при СПЖ не являются специфичными, гемоглобин, эритроциты, цветовой показатель могут быть даже снижены (например, при гемолитической анемии, талассемии). При НГ, а также СПЖ, связанном с ХЗП, нередко обнаруживается повышение уровня гемоглобина.
Согласно мнению специалистов, лабораторными маркерами СПЖ являются [26]:
Рекомендации Европейского общества по изучению заболеваний печени (European association for the study of the liver, EASL) по лабораторной диагностике СПЖ, 2010 [26]:
Как правило, при воспалении повышение ферритина сочетается с нормальными показателями НТЖ. В ряде случаев требуется учитывать, что повышение НТЖ может быть «ложным» при печеночно-клеточной недостаточности и снижении синтеза трансферрина, а также при синдроме мальабсорбции белков. Однако, по мнению специалистов, НТЖ — самый информативный показатель статуса железа и может использоваться для скрининга патогенетически значимых нарушений обмена железом у больных с ХЗП [18].
3. Генетическое тестирование
Применяется для исключения первичного СПЖ. На сегодняшний день доступными методами диагностики НГ являются:
Рекомендации EASL по генетическому тестированию, 2010 [26]:
4. Морфологическое исследование
Для подтверждения СПЖ в случаях, когда его маркеры сомнительны, а также в целях дифференциальной диагностики заболеваний печени показано проведение биопсии печени с окраской берлинской лазурью на железо (гемосидерин) по Перлсу и определением количественного содержания железа в препарате (печеночный индекс железа (ПИЖ) — Fе в печени/возраст). При НГ данный показатель более 1,9.
Рекомендации EASL по проведению гепатобиопсии при СПЖ, 2010 [26]:
5. МРТ печени и сердца в режиме Т2
Может использоваться как метод дополнительного измерения содержания железа в печени, а также миокарде, как альтернатива биопсии [11].
6. Десфераловая проба
Проводится в сомнительных случаях СПЖ и при необходимости проведения дифференциального диагноза между первичным и вторичным СПЖ. После внутримышечго введения 0,5 г Десферала производится последующий анализ суточной экскреции железа. В норме этот показатель составляет менее 1 мг/сут (менее 18 мкмоль/л), при СПЖ — 18–27 мкмоль/л, при НГ — более 27 мкмоль/л [4, 11].
Механизмы развития и клинические проявления СПЖ при НЖБП
На сегодняшний день установлено, что СПЖ обнаруживается примерно у 1/3 больных НЖБП: у 30% пациентов с жировым гепатозом (ЖГ), у 34% больных с неалкогольным стеатогепатитом (НАСГ) [4, 6, 15].
Впервые СПЖ у пациентов с НЖБП был описан в 1997 г. R. Moirand и Y. Deugnier, которые предложили термин «дисметаболический синдром перегрузки железом» (ДСПЖ, Dysmetabolic iron overload syndrome (DIOS)) [25]. В 1999 г. M. Mendler и соавт. доказали наличие СПЖ у пациентов с ИР и метаболическим синдромом (Insulin resistance hepatic iron overload syndrom (IR-HIO)) [32]. Был описан «железный фенотип» синдрома ИР. В 2008 г. A. Riva и соавт. предложили критерии синдрома DIOS/IR-HIO [34].
Важно знать, что СПЖ у данной категории пациентов является фактором риска, предрасполагающим к развитию и прогрессированию ИР, СД и сердечно-сосудистых заболеваний. Так, установлено, что высокий ферритин более 400 мкг/л у мужчин и более 300 мкг/л у женщин с ожирением является маркером ИР [34]. Гиперферритинемия, при исключении воспалительного процесса, требует тщательного контроля за уровнем гликемии у больных НЖБП, так как увеличивает риск СД в 4,6 раза [16]. Повышенный уровень ферритина может быть также предиктором стеатоза печени и предшествовать его развитию, что свидетельствует о том, что причиной гиперферритинемии является не НЖБП, а гиперферритинемия, связанная с ожирением и ИР, что приводит к НЖБП [14, 15].
В основе развития СПЖ при НЖБП лежит ИР, гипергликемия и висцеральное ожирение.
При ИР и гиперинсулинемии происходит повышенная транслокация трансферриновых рецепторов на мембранах гепатоцитов, энтероцитов, приводящая к увеличению поступления железа в клетку и стимулированию синтеза ферритина [27]. В свою очередь, при перегрузке железом гепатоцитов нарушается поглощение и деградация инсулина печенью, что усугубляет гиперинсулинемию. Избыток железа (Fe III), катализируя образование свободных радикалов, нарушает процесс проведения инсулинового сигнала и соединение инсулина с инсулиновым рецептором. Стимулируется синтез глюкозы в печени. При стойкой гипергликемии возникает гликирование трансферрина, приводящее к нарушению связывания Fe III и его транспорта к органам-потребителям.
Абдоминальная жировая ткань, обладающая собственной гормональной активностью, при липолизе выделяет провоспалительные цитокины (ФНО, ИЛ-6, ИЛ-8, ИЛ-10), что приводит к инфильтрации жировой ткани макрофагами, которые активно накапливают железо. Это индуцирует окислительный стресс и воспалительную реакцию. Таким образом, формируется порочный круг. Повышенная продукция вышеперечисленных цитокинов стимулирует синтез гепсидина, причем не только в гепатоцитах, но и в клетках жировой ткани [24]. Гепсидин блокирует работу ферропортина, в результате чего тормозятся процессы абсорбции пищевого железа, высвобождения железа из клеток, соответственно, стимулируется синтез ферритина. При этом, в результате повышенного синтеза гепсидина, у некоторых пациентов, чаще подростков и фертильных женщин, а также лиц с морбидным ожирением (индекс массы тела более 40), может даже развиваться анемия хронического воспаления, с недостаточностью железа, вследствие уменьшения его всасывания в тонкой кишке и перераспределения в клетки РЭС, а не на нужды синтеза гемоглобина [6, 7, 14].
Этот «железодефицитный» фенотип ожирения характеризуется как признаками относительного железодефицита, так и ДСПЖ. В данном случае оценка такого параметра крови, как количество растворимых трансферриновых рецепторов, может помочь в диагностике истинного дефицита железа, так как не зависит от активности воспалительного процесса, влияющего на содержание ферритина. Дополнительным предиктором наличия «функционального» дефицита железа служит также уровень С-реактивного белка.
Преимущественное накопление железа в гепатоцитах и клетках Купфера в перисинусоидальном пространстве запускает процессы проапоптоза, некроза, коллагенообразования и является триггерным механизмом прогрессирования ЖГ в НАСГ, с последующим развитием ФП, ЦП и ГЦК.
Дополнительным фактором, усугубляющим СПЖ у пациентов с НЖБП, по мнению некоторых авторов, может быть нарушение экскреции МК почками (например, при диабетической нефропатии) [5]. МК, являясь естественным хелатором негемового железа (Fe III), в условиях гиперферремии усиленно продуцируется в ксантинооксидазной реакции. Первоначально повышение уровня МК в крови и/или ее экскреции с мочой свидетельствует о включении компенсаторной реакции организма, Так, при НТЖ ниже 30%, повышение МК и ее экскреции способствует адекватному выведению с мочой избытка железа и поддержанию его физиологического уровня. При НТЖ 30–45% наблюдается более выраженное повышение МК, при недостаточно эффективной экскреции. При НТЖ более 45% уровень урикемии не соответствует механизму антиоксидантной защиты [5].
Критерии постановки диагноза ДСПЖ:
1) наличие двух и более компонентов метаболического синдрома (ожирение, дислипидемия, артериальная гипертензия, гипергликемия или нарушение толерантности к глюкозе);
2) гиперферритинемия при нормальном или незначительно повышенном НТЖ;
3) наличие стеатоза печени;
4) легкое или умеренное повышение содержания железа в печени (по данным МРТ или гепатобиопсии, ПИЖ менее 1,9 (рис. 1)).
Дополнительными маркерами СПЖ при НЖБП могут служить также повышение уровня гепсидина (определение данного показателя в настоящее время малодоступно), МК в крови и/или ее суточной экскреции с мочой.
Лечение СПЖ при ХЗП
Согласно мнению большинства специалистов, показаниями для лечения СПЖ у больных ХЗП являются:
1) клинически манифестный НГ;
2) повышение ферритина более 200 мкг/л у женщин и более 300 мкг/л у мужчин и женщин в постменопаузе или более 500 мкг/л у мужчин моложе 40 лет и у женщин до наступления менопаузы (при исключении острого воспаления, опухолевого процесса, алкогольного эксцесса);
3) НТЖ более 45%;
4) при НЖБП целесообразно рассматривать дополнительное показание: НТЖ 30–45% в сочетании с гиперурикемией и/или повышенной суточной экскрецией мочевой кислоты и гипергликемией [5].
Способы лечения СПЖ при ХЗП включают: этиотропную терапию, строгий отказ от алкоголя, соблюдение диеты с ограничением содержания железа до 8–10 мг/сут, лечебные кровопускания (флеботомии), с эксфузией до 300–400 мл крови 1 раз в неделю, до достижения целевого уровня ферритина ≤ 50 мкг/л и НТЖ ≤ 30%, использование антиоксидантов.
Согласно клиническим рекомендациям Европейских обществ по изучению заболеваний печени, ожирения и диабета (EASL, Европейского общества изучения диабета (European association for the study of diabetes, EASD), Европейского общества изучения ожирения (European Association for the Study of Obesity, EASO)), проведение флеботомии с целью уменьшения запасов железа почти до уровня железодефицита улучшает статус больных НЖБП по шкале NAS без прогрессирования фиброза, однако необходимы дополнительные данные. Как свидетельствуют специалисты, флеботомии при НЖБП уменьшают ИР, выраженность воспалительных изменений в печени, замедляют темпы прогрессирования фиброза печени и риски развития ГЦК [12].
При противопоказаниях к флеботомии (прежде всего, в случае НГ с повышением уровня ферритина более 1000 мкг/л, сочетающимся с анемией средней и тяжелой степени, выраженной гипотонией, гипоальбуминемией, СН) используются хелаторы железа (деферазирокс (Эксиджад), менее предпочтителен дефероксамин (Десферал)). Однако высокая стоимость препаратов и возможные побочные эффекты (диспептические расстройства, нарушение функции почек, печени, зрения, слуха и др.) ограничивают их применение.
В терапию СПЖ всем больным целесообразно включать антиоксиданты. Для этого могут применяться препараты янтарной кислоты, урсодезоксихолевая кислота (Урдокса), глицирризиновая кислота, липоевая кислота, адеметионин [5, 9].
Так, например, установлено, что антиоксидантный эффект янтарной кислоты связан с повышением активности глутатионпероксидазы и каталазы, важнейших ферментов, участвующих в разрушении активных форм кислорода, перекисей. Препарат также способствует увеличению уровня восстановленного глутатиона и подавлению активности ксантиноксидазы, что приводит к снижению продукции высокоактивных форм кислорода [9].
Глицирризиновая кислота как антиоксидант способна ингибировать образование супероксидного радикала и перекиси водорода [10].
Антиоксидантное действие урсодезоксихолевой кислоты связано с изменением метаболизма простагландинов и жирных кислот, а также снижением оксидативной активации клеток Купфера гидрофобными желчными кислотами. Несомненным достоинством данного препарата у пациентов с ХЗП и СПЖ является опосредованное антифибротическое действие, обусловленное снижением содержания активаторов фиброгенеза и угнетением активности звездчатых клеток [22, 30]. В исследовании J. Holoman и соавт. [38] продемонстрировано, что на фоне применения УДХК снижалась сывороточная концентрация N-терминального пептида коллагена III типа и матриксных металлопротеиназ и одновременно повышался уровень их тканевых ингибиторов, что клинически выражается в замедлении развития фиброза.
ФГБОУ ВО СПбГМУ им. И. П. Павлова МЗ РФ, Санкт-Петербург
Синдром перегрузки железом при хронических заболеваниях печени: фокус на неалкогольную жировую болезнь печени/ С. Н. Мехтиев, О. А. Мехтиева
Для цитирования: Лечащий врач №12/2017; Номера страниц в выпуске: 60-67
Теги: гемохроматоз, метаболизм, наследственность, метаболизм железа




.gif)
.gif)