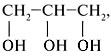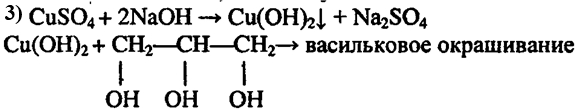Чем объясняется способность глицерина растворять гидроксиды некоторых металлов
Глицерин как представитель многоатомных спиртов. Лабораторная работа № 13. Растворение глицерина в воде и взаимодействие с гидроксидом меди (II).
Список вопросов теста
Вопрос 1
Посмотрите видеоурок » Глицерин как представитель многоатомных спиртов»
Запишите в тетрадь, определение многоатомных спиртов, получение, гомологический ряд, общую фориулу, физические и химичекие свойства и рименение.
Ответье на вопрос?
Выберите структурные формулы многоатомных спиртов:
Варианты ответов
Вопрос 2
По названиям веществ составьте их структурные формулы:
Варианты ответов
Вопрос 3
Посмотрите опыт: физические свойства глицерина.
Ответье на вопросы:
Варианты ответов
Вопрос 4
Что образуется при взаимодейстия глицерина с натрием.
Варианты ответов
Вопрос 5
Ответье на вопросы:
Варианты ответов
Вопрос 6
Взаимодействия глицерина с сильными окислителями.
Ответье на вопросы.
Варианты ответов
Вопрос 7
Выполните лабораторную работу 13. Растворение глицерина в воде и взаимодействие с гидроксидом меди (II).
Запишите цель работы: исследовать свойства глицерина, изучить качественную реакцию на него.
Запишите какое химическое оборудование вам понадобится.
Варианты ответов
Вопрос 8
Выполните лабораторную работу 13. Растворение глицерина в воде и взаимодействие с гидроксидом меди (II).
Запишите цель работы: исследовать свойства глицерина, изучить качественную реакцию на него.
Запишите какое химические химические реактивы вы используете в данном опыте.
Варианты ответов
Вопрос 9
Запишите в последовательность проведения опыта;
Варианты ответов
Вопрос 10
Варианты ответов
Вопрос 11
Ответьте на вопрос задания.
К 1 мл воды в пробирке прилейте равный объем глицерина и взболтайте смесь. Затем добавьте еще столько же глицерина. Что можно сказать о растворимости его в воде?
Варианты ответов
Вопрос 12
На лист фильтровальной бумаги нанесите 2-3 капли глицерина и отдельно несколько капель воды. Наблюдайте время от времени, какая жидкость быстрее испарится. Как объяснить результаты опыта?
Какая реакция характерна для глицерина и других многоатомных спиртов?
Многоатомные спирты. Двух- и трехатомные спирты получают теми же способами, что и одноатомные. В качестве исходных соединений могут быть использованы алкены, галогенопроизводные и другие соединения.
Общим методом синтеза гликолей является окисление алкенов перманганатом калия в нейтральной или щелочной среде.
Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. Однако в их химических свойствах есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют с щелочами, образуя соли. По аналогии с алкоголятами соли двухатомных спиртов называют гликолятами, а трехатомных — глицератами.
При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение синего цвета. Эта реакция используется для обнаружения многоатомных спиртов, имеющих гидроксильные группы при соседних атомах углерода —СН (ОН)— СН (ОН)— :
Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина (нитроглицерин) :
Лабораторные работы по органической Химии для студентов СПО
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Департамент образования Ивановской области
областное государственное бюджетное профессиональное образовательное учреждение
«Ивановский колледж легкой промышленности»
Председатель ПЦК Зам директора по УМР
______________ В.Ю. Малыванова _____________ Е.А.Тюпкина
«___» ________20___ г. «___» ________20___ г.
по выполнению лабораторных работ по органической
химии для студентов
по ППССЗ 15.02.01«МОНТАЖ И ТЕХНИЧЕСКАЯ ЭКСПЛУАТАЦИЯ ПРОМЫШЛЕННОГО ОБОРУДОВАНИЯ»
Разработаны: преподаватель химии
Сонина О.Н. Методические рекомендации по выполнению лабораторных работ по органической химии. Сонина О.Н. – ОГБПОУ «ИКЛП», Иваново, 2019 г. – 21 с.
Методические рекомендации по выполнению лабораторных работ по органической химии составлены в помощь студентам специальностей естественно-научного профиля ОГБПОУ «ИКЛП». Методические рекомендации разработаны в соответствии с рабочими программами ОУД «Химия», с учетом имеющихся реактивов, оборудования.
Прежде чем приступить к выполнению лабораторных работ, необходимо повторить соответствующие темы по конспектам лекций, познакомиться с содержанием лабораторных работ, правилами техники безопасности и правилами оказания первой помощи. При проведении опытов следует внимательно наблюдать за происходящими изменениями, результаты наблюдений заносить в лабораторный журнал, записи вести кратко, четко, а приборы зарисовывать.
Методические рекомендации по выполнению лабораторных работ предназначены для овладения студентами умениями и навыками самостоятельной работы по проведению химического эксперимента.
Перечень лабораторных работ соответствует рабочей программе по учебной дисциплине ОУД 09 «Химия».
Методические рекомендации выполняют функцию управления самостоятельной работой студента, поэтому каждое занятие имеет унифицированную структуру. Благодаря такой структуре занятий студент получает возможность овладеть дополнительными умениями, оформлять результаты эксперимента, составлять таблицы, анализировать и обобщать, делать заключения и выводы, что служит подготовительным этапом для выполнения более сложных исследовательских работ.
При выполнении лабораторных работ основным методом обучения является самостоятельная работа студента под управлением преподавателя.
Оценка преподавателем выполненной студентом работы осуществляется комплексно:
— по результатам выполнения;
— по устному сообщению;
— по оформлению работы.
Критерии оценок едины для выполнения всех лабораторных работ по дисциплине Химия:
Лабораторная работа выполнена в полном объеме с соблюдением необходимой последовательности. Обучающиеся работали полностью самостоятельно: показали необходимые для проведения лабораторно-практических работ теоретические знания, практические умения и навыки.
Работа оформлена аккуратно, в оптимальной для фиксации результатов форме.
Лабораторная работа выполнена студентами в полном объеме и самостоятельно. Допускается отклонение от необходимой последовательности выполнения, не влияющее на правильность конечного результата (перестановка пунктов типового плана, последовательность выполняемых заданий, ответы на вопросы). Работа показала знание основного теоретического материала и овладение умениями, необходимыми для самостоятельного выполнения работы.
Допускаются неточности и небрежность в оформлении результатов работы.
Практическая работа выполнена и оформлена с помощью преподавателя. На выполнение работы затрачено много времени (дана возможность оформить работу дома). Обучающийся показал знания теоретического материала, но испытывали затруднения при самостоятельной работе в лаборатории.
Выставляется в том случае, когда обучающийся оказался не подготовленными к выполнению этой работы. Полученные результаты не позволяют сделать правильных выводов и полностью расходятся с поставленной целью. Обнаружено плохое знание теоретического материала и отсутствие необходимых умений.
Правила оформления работы:
1. Лабораторные работы оформляются в лабораторных журналах- отдельных тетрадях для лабораторных работ.
2. Для каждой работы записывается отчет по следующей схеме:
— дата проведения лабораторной работы,
— уравнения реакций (если есть),
— схема лабораторной установки (если есть),
— оборудование и реактивы,
— наблюдения в виде таблицы, записанные связно сформулированными предложениями,
— вывод к опыту (что именно наблюдали и с чем это связано)
— ответы на контрольные вопросы.
Тематика лабораторных работ по органической химии
Изготовление моделей молекул органических веществ.
Ознакомление с коллекцией образцов нефти и продуктов ее переработки. Ознакомление с коллекцией каучуков и образцами изделий из резин.
Растворение глицерина в воде и взаимодействие с гидроксидом меди (II). Свойства уксусной кислоты, общие со свойствами минеральных кислот.
Доказательство непредельного характера жидкого жира. Взаимодействие глюкозы и сахарозы с гидроксидом меди (II). Качественная реакция на крахмал.
Растворение белков в воде. Обнаружение белков в молоке и в мясном бульоне. Денатурация раствора белка куриного яйца спиртом, растворами солей тяжелых металлов и при нагревании.
Список рекомендованной литературы
Решение задач по химии. / И.Г.Хомченко – М.: РИА «Новая волна», 2016 г, 256 с.
Химия: неорганическая химия. Органическая химия: учеб.для 9-10 кл. общеобразовательных учреждений/ Г.Е. Рудзитис, Ф.Г. Фельдман – М.: Просвещение, 2015 г. – 191 с.
Правила безопасности при выполнении лабораторных работ по химии
При работе с химическими веществами строго запрещено :
принимать пищу, употреблять напитки, пользоваться аэрозольными баллончиками и источниками открытого огня
пробовать на вкус, брать руками реактивы.
оставлять готовые рабочие и использованные растворы в неподписанных емкостях.
выливать в канализацию использованные реактивы, высыпать в раковину сухие вещества.
брать без разрешения преподавателя реактивы и лабораторную посуду.
Работа с небольшим количеством веществ снижает возможность несчастных случаев до минимума, но не исключает их полностью. Поэтому каждому работающему в химической лаборатории нужно знать и строго выполнять следующие правила техники безопасности:
1. Работая в химической лаборатории, необходимо соблюдать большую осторожность. Помнить, что неаккуратность, невнимательность, недостаточное знакомство с приборами и свойствами химических веществ могут повлечь за собой несчастный случай.
2. Приступать к выполнению задания можно только после разрешения преподавателя.
3. Химические реакции выполнять с такими количествами и концентрациями веществ, в такой посуде и приборах, как это указано в методическом пособии.
4. Производить опыты в чистой посуде.
6. Все опыты, сопровождающиеся выделением веществ (например, выпаривание, кипячение растворов кислот, а также растворов, содержащих галогены, аммиак, сероводород и т.д.), проводить в вытяжном шкафу.
7. Наливая или нагревая реактивы, не наклоняться над сосудом, так как возможно разбрызгивание и даже выброс жидкости. Нагревая пробирки, колбы, стаканы, не держать их отверстием к себе или в сторону находящихся рядом товарищей.
8. Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе.
9. При работе с газоотводной трубкой убирать горелку из-под пробирки с реакционной смесью можно лишь тогда, когда конец газоотводной трубки, опущенный в жидкость, удалён из неё. Если убрать горелку преждевременно, то жидкость засосёт в реакционную пробирку и может произойти разбрызгивание её.
10. Осторожно пользоваться газовыми горелками или спиртовками. Спиртовку не зажигать, наклоняя её к другой горящей спиртовке. Гасить спиртовку необходимо, накрывая её сверху колпачком.
11. В случае возникновения пожара в лаборатории немедленно позвонить в пожарную охрану по телефону 01 (по мобильному- 112).
12. Работа с реактивами разрешается только в халатах.
Лабораторная работа №1
Изготовление моделей молекул органических веществ
— обобщить и систематизировать знания учащихся о теории строения органических соединений;
— закрепить умение составлять структурные формулы углеводородов;
Оборудование и реактивы:
— набор шаростержневых моделей молекул, периодическая таблица, тетради.
Прочитайте теоретическую часть.
2. Составьте модели молекул:
2.1. ряда алканов: метана, этана, бутана, пентана, гексана, гептана, октана, нонана и декана;
2.2. циклоалканов: циклопропана, циклопетана
Зарисуйте модели молекул в тетради. Напишите структурные формулы этих веществ. Найдите их молекулярные массы.
3. Назовите вещества, следующего строения:
4. Составьте структурные формулы веществ:
4.1. бутен-2, напишите его изомер;
5. Выполните задания, оформив их в отчете. Ответьте на контрольные вопросы.
Суффиксы в названии углеводородов указывают на наличие кратной связи:
1. суффикс -ан → одинарная связь между атомами углерода (СС),
2. суффикс -ен → двойная связь между атомами углерода (С=С),
3. суффикс -ин тройная связь между атомами углерода (С ≡ С),
4. суффикс -диен две двойных связи между атомами углерода (С=СС=С).
Таблица 1. гомологический ряд алканов и радикалов алканового ряда
Формула и название алкана
Формула и название радикала
Формула и название алкана
Формула и название радикала
1. Выбрать самую длинную цепочку.
2. Пронумеровать, начиная с того края, к которому ближе радикал или кратная связь.
3. Указать радикал, если радикалов несколько указывают каждый. (Цифра перед названием).
4. Назвать радикал, начиная с меньшего радикала.
5. Назвать самую длинную цепочку.
6. Указать положение кратной связи. (Цифра после названия ).
И, наоборот, при составлении формул по названию надо:
1. Определить число атомов углерода в цепочке.
2. Определить положение кратной связи. (Цифра после названия).
3. Определить положение радикалов. (Цифра перед названием).
4. Записать формулы радикалов.
5. В последнюю очередь определить количество и расставить атомы водорода.
Пример. Составьте модель молекулы пропана.
Молекула пропана C 3 H 8 содержит три атома углерода и восемь атомов водорода. Атомы углерода соединены между собой. Суффикс – ан указывает на наличие одинарной связи между атомами углерода. Атомы углерода обычно изображают черными шариками, а атомы водорода – белыми, атомы хлора – зелеными.
В чем отличие между понятиями гомологии и изомерии?
Что такое функциональная группа?
Приведите примеры разных классов органических веществ, отличающихся функциональной группой.
Лабораторная работа №2
Ознакомление с коллекцией образцов нефти и продуктов ее переработки. Ознакомление с коллекцией каучуков и образцами изделий из резин.
— изучить физические свойства продуктов нефтепереработки, на основе коллекционного материала ознакомиться c продуктами нефтепереработки,
— на основе коллекционного материала ознакомиться c каучуками и образцами изделий из резины.
Оборудование и реактивы:
— штатив с пробирками, лабораторный термометр, спиртовки;
— к оллекции «Нефть и продукты ее переработки», «Каучуки и образцы изделий из резины»;
Изучив теоретическую часть, последовательно выполните опыты, занося результаты наблюдений в отчет по лабораторной работе (Табл. 2). Ответьте на контрольные вопросы.
Таблица 2. Результаты эксперимента
Название и описание эксперимента
Ректификация (перегонка) – разделение жидких смесей на фракции или отдельные компоненты на основании различия в их температурах кипения. Ректификацию осуществляют на специальных установках, называемых ректификационными колоннами. В процессе ректификации нефть разделяют на следующие фракции:
Ректификационные газы – смесь низкомолекулярных углеводородов (УВ), преимущественно пропана и бутана, с tкип до 40° С,
Остаток переработки нефти – мазут – содержит УВ с числом атомов углерода от 18 до 50.
Перегонкой при пониженном давлении из мазута получают соляровое масло (С 18 Н 28 – С 25 Н 52 ), смазочные масла (С 28 Н 58 – С 38 Н 78 ), вазелин и парафин – легкоплавкие смеси твердых УВ.
Твердый остаток перегонки мазута – гудрон и продукты его переработки – битум и асфальт используют для изготовления дорожных покрытий.
Полученные в результате ректификации нефти продукты подвергают химической переработке. Один из них – к рекинг – процесс переработки нефтепродуктов при повышенной температуре и давлении с целью получения УВ с меньшей молекулярной массой.
Термический крекинг – проводится при температуре Т=450-550 0 С и применяется для получения бензина, крекинг при температуре Т=750 0 С – для получения алкенов.
Риформинг – переработка нефтепродуктов с целью получения ароматических углеводородов.
Таблица 3 . Фракции перегонки нефти
Горючее для тракторов
Горючее для самолетов,
Газойль /соляровое масло/
Смазочные масла, дизельное топливо
Из мазута получают тяжелые смазочные масла, вазелин, парафин
Асфальт /дорожное покрытие/
Каучуки – эластичные материалы, из которых путем специальной обработки получают резину. Сырой каучук липок, непрочен, а при небольшом понижении температуры становится хрупким. Чтобы придать изготовленным из каучука изделиям необходимую прочность и эластичность, каучук подвергают вулканизации – вводят в него серу и нагревают. Вулканизированный каучук называется резиной.
Здесь n – степень полимеризации (для НК составляет 1000-3000 единиц)
Синтетические каучуки (СК) производят разного вида. СКБ – продукт совместной полимеризации бутадиена с другими непредельнми углеводородами. Формула СК на примере бутадиенового каучука :
Таблица 4. Основные типы резин и характеристики каучуков.
Предел прочности, МПа
Удлинение после разрыва,
Диапазон рабочих температур, °С
Бутадиеновый синтетический (СКБ)
Изопреновый синтетический (СКИ)
Бутадиен-метилстирольный (СКМС) и бутадиен-стирольный (СКС)
Таблица 5. Важнейшие виды каучуков и их применение.
Исходные вещества (мономеры)
Химическая формула полимера
Важнейшие свойства и применение
Характерна водо- и газонепроницаемость. По эластичности отстает от природного каучука. Для производства кабелей, обуви, принадлежностей быта
По износоустойчивости и эластичности превосходит природный каучук. В производстве шин
По эластичности и износоустойчивости сходен с природным каучуком. В производстве шин.
Хлоро преновый каучук
Устойчив к воздействиям высоких температур, бензинов и масел. В производстве кабелей, трубопроводов для перекачки бензинов, нефти
Характерна газонепроницаемость но недостаточная жароустойчивость. В производстве лент для транспортеров, автокамер
1. Взаимодействие нефтепродуктов с резинами и каучуком. В две пробирки налейте по 2—3 мл бензина. В одну из пробирок опусти кусочек резины, а в другую — такой же кусочек невулканизированного каучука. Закройте пробирки корковыми пробками и оставьте до следующего занятия. Через несколько дней можно будет убедиться, что каучук в бензине частично растворяется, а резина только набухает.
2. Испытание каучуков Поместите в пробирку несколько кусочков с каучука и закройте ее пробкой с газоотводной трубкой. Пробирку с каучуком нагрейте, и продукты разложения соберите в пробирку-приемник. Половину полученных жидких продуктов влейте в пробирку с 1-2 мл бромной воды. Оставшиеся жидкие продукты влейте в другую пробирку с раствором перманганата калия, слегка подкисленным серной кислотой. Опишите наблюдения в отчете.
Назовите природные источники углеводородов.
Что такое октановое число?
Что такое марки нефти, в чем их отличие?
К какому классу органических соединений относят каучуки?
Как доказать, что в продуктах термического разложения каучука содержатся непредельные углеводороды?
Лабораторная работа №3
Растворение глицерина в воде и взаимодействие с гидроксидом меди (II). Свойства уксусной кислоты, общие со свойствами минеральных кислот.
— изучить и экспериментально подтвердить зависимость свойств органических соединений от строения их молекулы.
Оборудование и реактивы:
— штатив с пробирками, пробка с длинной стеклянной трубкой-холодильником, химический стакан;
— глицерин, гидроксид натрия, раствор сульфат меди (II), уксусная кислота (70%), магний, цинк, фенолфталеин, этанол, серная кислота, хлорид натрия.
Изучив теоретическую часть, последовательно выполните опыты, занося результаты наблюдений в отчет по лабораторной работе (Табл. 6). Ответьте на контрольные вопросы.
Таблица 6. Результаты эксперимента
Название и описание эксперимента
Глицерин (пропантриол-1, 2, 3; 1, 2, 3-триоксипропан) СН 2 ОНСНОНСН 2 ОН — это трёхатомный спирт; сиропообразная бесцветная вязкая жидкость сладкого вкуса, без запаха. Глицерин может оставаться жидким при очень низких температурах. Чистый глицерин кипит при 290°С. Глицерин смешивается во всех отношениях с водой, этиловым или метиловым спиртом, анилином, ацетоном, нерастворим в жирах, бензине. При смешивании с водой происходит уменьшение объёма (контракция), достигающее наибольшего значения для смеси, содержащей 57% глицерина; одновременно повышается температура.
Глицерин гигроскопичен, он поглощает до 40% воды (по весу), растворяет многие органические и неорганические вещества: соли, едкие щёлочи, сахара, ароматические спирты и другие. Свойства глицерина определяются наличием в нём трёх гидроксильных групп.
Химические свойства глицерина. Глицерин является представителем трехатомных спиртов, для которых, как для гидроксилсодержащих соединений характерны те же реакции, что и для одноатомных спиртов.
Глицерин реагирует с активными металлами (калием, натрием и др.), замещающими водород во всех гидроксильных группах, вступают в реакции с галогеноводородами (HCl, HBr и др.), в реакции дегидратации, образуя различные эфиры.
Глицерин имеет и специфические свойства, отличающие его от одноатомных спиртов: он вступает в реакцию, не только со щелочными металлами, но и с некоторыми основаниями, в том числе нерастворимыми, например с гидроксидом меди (II):
Результатом реакции глицерина с гидроксидом меди (II) является глицерат меди (сложное комплексное соединение ярко-синего цвета). Эта реакция – качественная реакция на многоатомные спирты.
Применяют глицерин главным образом в производстве взрывчатых веществ, синтетических смол, как мягчитель в текстильной и кожевенной промышленности, в бумажной и пищевой промышленности, как компонент в парфюмерных, фармацевтических и косметических препаратах. Глицерин, применяемый в медицине бывает для наружного применения и для внутреннего.
Органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединенных с углеводородным радикалом, называют карбоновыми кислотами.
Таблица 7.Гомологический ряд карбоновых кислот.
Температура кипения, o С
Химические свойства карбоновых кислот обусловлены в первую очередь особенностями их строения.
Так, растворимые в воде кислоты способны диссоциировать на ионы:
Благодаря наличию в воде иона H + они имеют кислый вкус, способны менять окраску индикаторов и проводить электрический ток. В водном растворе эти кислоты – слабые электролиты.
Карбоновые кислоты обладают химическими свойствами, характерными для растворов неорганических кислот, т.е. взаимодействуют с металлами (1), их оксидами (2), гидроксидами (3) и слабыми солями (4):
R-COOH + KOH → R-COOK + H 2 O (3);
Специфическое свойство предельных, а также непредельных карбоновых кислот, проявляемое за счет функциональной группы,- взаимодействие со спиртами. Карбоновые кислоты взаимодействуют со спиртами при нагревании и в присутствии концентрированной серной кислоты. Например, если к уксусной кислоте прилить этиловый спирт и немного серной кислоты, то при нагревании появляется запах этилового эфира уксусной кислоты (этилацетата):
Специфическое свойство предельных карбоновых кислот, проявляемое за счет радикала, — реакция галогенирования (хлорирования).
1. Растворение глицерина в воде. Налейте в пробирку 1-2 мл глицерина, добавьте столько же воды и встряхните. Затем добавьте в 2-3 раза больше воды. Перемешайте содержимое. Какова растворимость глицерина в воде?
2. Взаимодействие глицерина с гидроксидом меди (II). В пробирку налейте 1 мл раствора гидрокисида натрия и добавьте немного раствора сульфата меди (II) до выпадения осадка. Запишите молекулярное и краткое ионно-молекулярное уравнения этой реакции. К образовавшемуся осадку добавьте немного глицерина и перемешайте смесь стеклянной палочкой. Что наблюдается?
3. Взаимодействие уксусной кислоты с некоторыми металлами. В две пробирки влейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, а во вторую – несколько гранул цинка. В первой пробирке происходит бурная реакция, а во второй – реакция протекает спокойно (иногда она начинается только при нагревании). Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
4. Взаимодействие уксусной кислоты с основаниями . Влейте в пробирку 1-1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавление уксусной кислоты происходит обесцвечивание. О чем это говорит? Подтвердите свой вывод уравнением реакции.
5. Взаимодействие уксусной кислоты со спиртами. В пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл этанола. Затем в пробирку осторожно добавьте 1 мл серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте. Жидкость налейте в сосуд с насыщенным раствором хлорида натрия
Назовите основные классы кислородсодержащих органических соединений, их функциональные группы.
Какая реакция характерна для глицерина и других многоатомных спиртов? Напишите уравнения соответствующих реакций.
Какие свойства уксусной кислоты сходны со свойствами минеральных кислот?
Вспомните понятие «скорость химической реакции». От чего она зависит?
Лабораторная работа №4
Доказательство непредельного характера жидкого жира. Взаимодействие глюкозы и сахарозы с гидроксидом меди (II). Качественная реакция на крахмал
— изучить свойства жидкого жира, глюкозы, сахарозы и крахмала.
Оборудование и реактивы:
— штативы, пробирки, пробиркодержатель, спиртовки;
— подсолнечное масло, твердый животный жир, бромная вода, растворы гидроксида натрия, сульфата меди (II), глюкозы, 5% спиртовая настойка йода, крахмал либо крахмальный клейстер.
Изучив теоретическую часть, последовательно выполните опыты, занося результаты наблюдений в отчет по лабораторной работе (Табл.8). Ответьте на контрольные вопросы.
Таблица 8. Результаты эксперимента
Название и описание эксперимента
Жиры – сложные эфиры высших карбоновых кислот и глицерина. Жиры и масла (жидкие жиры) – важные природные соединения. Все жиры и масла растительного происхождения почти целиком состоят из сложных эфиров глицерина (триглицеридов). В этих соединениях глицерин этерифицирован высшими карбоновыми кислотами. Жиры имеют общую формулу, приведенную справа. В ней R, R’, R” – углеводородные радикалы – предельные и непредельные органические кислоты.
Основные предельные кислоты, образующие жиры:
— пальмитиновая С15Н31СООН и стеариновая С17Н35СООН;
Основные непредельные кислоты:
Жиры, образованные предельными кислотами, — твердые вещества, а непредельными – жидкие. Все жиры очень плохо растворимы в воде.
Химические свойства жиров:
1) Среди реакций жиров особое место занимает гидролиз, который можно осуществить действием как кислот, так и оснований.
2) Для масел (жидких жиров) характерны реакции присоединения.
3) Гидрирование (реакция гидрирования (гидрогенизации) лежит в основе получения маргарина) или галогенирования.
4) Мерой ненасыщенности остатков кислот, которые входят в состав жиров, служит йодное число, выражаемое массой йода (в граммах), который может присоединиться по двойным связям к 100 г жира. Йодное число важно при оценке высыхающих масел.
5) Масла (жидкие жиры) подвергаются реакциям окисления и полимеризации.
Углеводы имеют общую формулу Cn(H2O)m, откуда и возникло название этих природных соединений. Углеводы делятся на: моносахариды (важнейшие представители – глюкоза и фруктоза); дисахариды (сахароза); полисахариды (важнейшие представители – крахмал и целлюлоза).
Глюкоза C6H12O6 – наиболее важный из всех моносахаридов, так как она является структурной единицей большинства пищевых ди- и полисахаридов. В процессе обмена веществ они расщепляются на отдельные молекулы моносахаридов, которые в ходе многостадийных химических реакций превращаются в другие вещества и в конечном итоге окисляются до углекислого газа и воды – используются как «топливо» для клеток. Глюкоза – необходимый компонент обмена углеводов. При снижении ее уровня в крови или высокой концентрации и невозможности использования, как это происходит при диабете, наступает сонливость, может наступить потеря сознания (гипогликемическая кома). Она содержится в плодах и ягодах и необходима для снабжения энергией и образования в печени гликогена (запасной углевод человека и животных).
Химические свойства глюкозы :
1) глюкоза – это вещество с двойственной химической природой;
2) как многоатомный спирт глюкоза образует сложные эфиры;
3) как альдегид она окисляется.
4) альдегидная группа глюкозы может быть восстановлена.
1. Спиртовое брожение идет под действием фермента дрожжей:
2. Под действием фермента молочнокислых бактерий происходит молочнокислое брожение глюкозы:
Сахароза С12Н22О11, образована молекулами глюкозы и фруктозы. Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли. Сахароза содержится в сахарном тростнике и сахарной свекле, а также в сладостях.
Химические свойства сахарозы:
1. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
2. Альдегидной группы в сахарозе нет: при нагревании с аммиачным раствором оксида серебра (I) она не дает «серебряного зеркала», при нагревании с гидроксидом меди (II) не образует красного оксида меди (I).
3. Сахароза, в отличие от глюкозы, не является альдегидом.
Рис. 2. Структурная формула крахмала.
1) крахмал нерастворим в холодной воде, в горячей он набухает и образует клейстер
2) при взаимодействии крахмала с йодом появляется ярко-синее окрашивание. Эта реакция является качественной на присутствие крахмала;
3) Как и для всех других полисахаридов, для крахмала характерна реакция гидролиза – взаимодействие с водой в присутствии катализаторов, которыми выступают кислоты. Крахмал может гидролизоваться частично образуя в качестве продуктов декстрины – (С6Н10О5)n –вещества с молекулярной массой значительно ниже, чем у крахмала. Гидролиз крахмала обычно протекает ступенчато. Сначала образуется растворимый крахмал, затем декстрины, мальтоза и глюкоза. Этот процесс естественный и протекает в процессе переваривания пищи в желудке.
1. Доказательство непредельного характера жидкого жира. В одну пробирку налейте 1-2 см3 подсолнечного масла, во вторую поместите кусочек твердого животного жира и нагрейте ее до расплавления жира. К содержимому каждой пробирки добавьте немного бромной воды и встряхните смеси. Отметьте, в какой из пробирок бромная вода обесцветилась. О чем это свидетельствует?
3. Качественная реакция на крахмал. В пробирку поместите небольшое количество порошка крахмала и прилейте 4мл воды все перемешайте стеклянной палочкой и нагрейте до кипения. Полученный крахмальный клейстер остудите, и добавьте 1 каплю раствора иода. Нанесите несколько капель спиртового раствора йода на кусочек хлеба и на срез клубня картофеля. Запишите все наблюдения.
1. Почему глюкоза проявляет свойства альдегидов и спиртов?
2. Почему сахароза не дает реакцию «серебряного зеркала»?
3. Как можно обнаружить крахмал в продуктах питания?
Лабораторная работа №5
Растворение белков в воде. Обнаружение белков в молоке и в мясном бульоне. Денатурация раствора белка куриного яйца спиртом, растворами солей тяжелых металлов и при нагревании.
— изучение свойств азотсодержащих органических соединений на примере белков, их нахождение в продуктах питания.
Оборудование и реактивы:
-штатив с пробирками, держатель, горелка, спички;
Изучив теоретическую часть, последовательно выполните опыты, занося результаты наблюдений в отчет по лабораторной работе (Табл. 9). Ответьте на контрольные вопросы.
Таблица 9. Результаты эксперимента
Название и описание эксперимента
Из-за огромного разнообразия белковых соединений и различной степени сложности их состава и разной структуры, для удобства существуют классификации, которые опираются на эти признаки. По своему составу они бывают следующими: простые; сложные, которые подразделяются в свою очередь на: соединение белка и углеводов; соединение белков и жиров; соединение белковых молекул и нуклеиновых кислот. По растворимости: водорастворимые; жирорастворимые.
Химические свойства белковых соединений:
Гидролиз. В результате его образуются простые белки и аминокислоты, потому что происходит разрушение первичной структуры. Он является основой процесса пищеварения.
Качественные реакции на определение белка. Их всего две, а третья нужна для того, чтобы обнаружить серу в данных соединениях:
— Биуретовая реакция. На белки воздействуют осадком гидроксида меди. В итоге происходит окрашивание в фиолетовый цвет.
— Ксантопротеиновая реакция. Воздействие осуществляется при помощи концентрированной азотной кислоты. В результате этой реакции получается белый осадок, который при нагревании становится желтым. А если добавить водный аммиачный раствор, то появляется оранжевый цвет.
— Определение серы в белках. Когда происходит горение белков, то начинает ощущаться запах «жженого рога». Это явление объясняется тем, что в них содержится сера.
1. Растворение белков в воде. К 2 каплям неразведенного яичного белка прибавляют 1 мл дистиллированной воды и перемешивают. При этом яичный альбумин растворяется, а яичный глобулин выпадает в виде небольшого осадка. Проверяют растворимость в воде и 5% растворе хлористого калия белка кератина, содержащегося в шерсти и волосах.
Результаты эксперимента можно оформить в виде таблицы 10.
Таблица 10. Результаты эксперимента по растворению белков
Обнаружение белков в молоке и мясном бульоне. В одну пробирку прилейте 4мл молока а, в другую пробирку 4мл мясного бульона и в каждую пробирку добавьте 4мл щелочи NaOH и 2мл раствора соли CuSO4. Появление характерного фиолетового окрашивания указывает на наличие белка. Запишите наблюдения.
3. Денатурация раствора белка куриного яйца солями тяжелых металлов. В 2 пробирки налейте по 1-2 мл раствора белка и медленно, при встряхивании, по каплям добавьте в одну пробирку насыщенный раствор медного купороса, а в другую – раствор ацетата (нитрата) свинца. Отметьте образование труднорастворимых солеобразных соединений белка.
4. Денатурация белка спиртом. К 1 мл 1% раствора белка добавляют 2 мл органического растворителя (96% этанола, хлороформа, ацетона или эфира) и перемешивают. Образование осадка можно усилить добавлением нескольких капель насыщенного раствора хлорида натрия. Данный опыт иллюстрирует применение белка как противоядия при отравлении тяжелыми металлами.
5. Денатурация белка при нагревании. В четыре пронумерованные пробирки приливают по 10 капель 1% раствора яичного белка.
а) первую пробирку нагревают до кипения. Раствор белка мутнеет, но так как частицы денатурированного белка несут заряд, они в осадок не выпадают. Это связано с тем, что яичный белок имеет кислые свойства (изоэлектрическая точка его равна рН 4,8) и в нейтральной среде заряжен отрицательно;
б) во вторую пробирку добавляют 1 каплю 1% раствора уксусной кислоты и нагревают до кипения. Выпадает осадок белка, так как раствор белка приближается к изоэлектрической точке и белок теряет заряд
в) в третью пробирку добавляют 1 каплю 10% раствора уксусной кислоты и нагревают до кипения. Осадка не образуется, так как в сильнокислой среде частицы белка приобретают положительный заряд (сохраняется один из факторов устойчивости белка в растворе);
г) в четвертую пробирку добавляют 1 каплю 10% раствора гидроокиси натрия и нагревают до кипения. Осадка не образуется, так как в щелочной среде отрицательный заряд частиц белка увеличивается
Какой состав имеет молекула белка?
Какова структура белковой молекулы?
Какие химические соединения в организме используются для синтеза белков?
Какие цветные реакции доказывают наличие белка?