Чем обусловлены кислотные свойства
Кислоты. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н + (или Н3О + ).
Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
При этом оксид кремния (IV) с водой не реагирует:
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
H2 0 + Cl2 0 → 2 H + Cl —
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н + и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
HCl → H + + Cl –
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O + + Cl –
Многоосновные кислоты диссоциируют cтупенчато.
HSO3 – ↔ H + + SO3 2–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
4H I — + 2 Cu +2 Cl2 → 4HCl + 2 Cu + I + I2 0
6. Кислоты взаимодействуют с солями.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Ag + NO3 — + H + Cl — → Ag + Cl — ↓ + H + NO3 —
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример : гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Al (OH) Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Fe + 2 H + Cl → Fe +2 Cl2 + H2 0
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
Азотная кислота HNO3 разлагается при нагревании или на свету:
Химические свойства кислот, их классификация и реакции
Общие свойства кислот. Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Многоосновные кислоты диссоциируют ступенчато.
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
От чего зависят кислотно-основные свойства
Содержание статьи
Что такое кислотно-основные свойства
Основные свойства проявляют металлы, их оксиды и гидроксиды. Кислотные свойства проявляются неметаллы, их соли, кислоты и ангидриды. Существуют также амфотерные элементы, способные проявлять как кислотные, так и основные свойства. Цинк, алюминий и хром являются одними из представителей амфотерных элементов. Щелочные и щелочно-земельные металлы проявляют типичные основные свойства, а сера, хлор и азот кислотные.
Так, при реакции оксидов с водой, в зависимости от свойств основного элемента, получается либо основание или гидроксид, либо кислота.
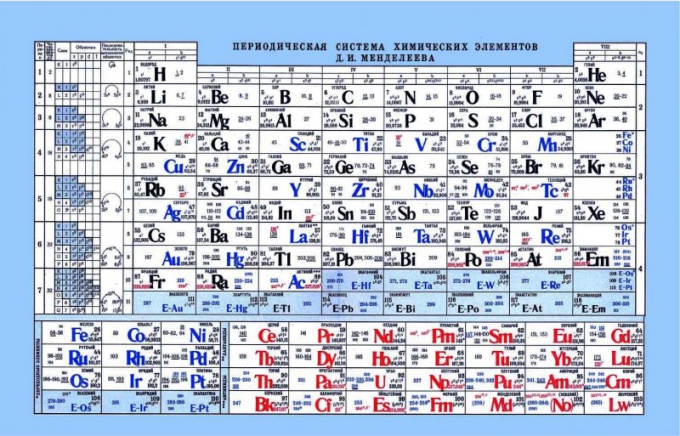
Периодическая таблица Менделеева, как показатель кислотно-основных свойств
Таблица Менделеева может помочь в определении кислотно-основных свойств элементов. Если посмотреть на таблицу Менделеева, то можно увидеть такую закономерность, что по горизонтали слева-направо усиливаются неметаллические или кислотные свойства. Соответственно ближе к левому краю находятся металлы, по центру амфотерные элементы, а справа неметаллы. Если посмотреть на электроны и их притяжение к ядру, то заметно, что в левой части элементы имеют слабый заряд ядра, а электроны находятся на s-уровне. В результате таким элементам проще отдать электрон, нежели элементам, находящимся в правой части. Неметаллы имеют достаточно высокий заряд ядра. Тем самым усложняется отдача свободных электронов. Таким элементам проще присоединить к себе электроны, проявляя кислотные свойства.
Три теории для определения свойств
Существуют три подхода, определяющих какие свойства имеет соединение: протонная теория Бренстеда-Лоури, апротонная электронная теория Льюиса, теория Аррениуса.
Согласно протонной теории кислотными свойствами обладают соединения, способные отдавать свои протоны. Такие соединения были названы донорами. А основные свойства проявляются способностью акцептировать или присоединять протон.
Апротонный подход подразумевает то, что акцептирование и донорство протонов для определения кислотно-основных свойств необязательно. Кислотные свойства по данной теории проявляются возможностью принять электронную пару, а основные, наоборот, отдать эту пару.
Кислота
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Содержание
Определение кислоты
Определения кислот и оснований претерпели значительную эволюцию по мере расширения теоретических представлений о природе химической связи и механизмах химических реакций.
В 1778 французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в молекуле атомов кислорода. Эта гипотеза быстро доказала свою несостоятельность, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу.
В 1839 немецкий химик Юстус Либих дал такое определение кислотам: кислота — это водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. Согласно его теории, сформулированной в 1887, кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H + ). Теория Аррениуса быстро показала свою ограниченность, она не могла объяснить многих экспериментальных фактов. В наше время она имеет главным образом историческое и педагогическое значение.
В настоящее время наиболее распространены три теории кислоты и оснований. Они не противоречат друг другу, а дополняют.
Следует также отметить, что многие вещества проявляют амфотерные свойства, то есть ведут себя как кислоты в реакциях с основаниями и как основания — в реакциях с более сильной кислотой.
Классификация кислот
Химические свойства кислот
(в данном случае образуется неустойчивая угольная кислота 
Некоторые распространённые кислоты
Неорганические (минеральные) кислоты
Кислоты, образованные серой
Органические кислоты
Интересные факты
Примечания
См. также
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Кислота» в других словарях:
кислота — сущ., кол во синонимов: 171 • абсцизин (2) • агарицин (1) • адипил (1) • … Словарь синонимов
КиСЛОТа — 1 капля Альбом ремиксов СЛОТ Дата выпуска 2008 Записан … Википедия
кислота — сущ., ж., употр. сравн. часто Морфология: (нет) чего? кислоты, чему? кислоте, (вижу) что? кислоту, чем? кислотой, о чём? о кислоте; мн. что? кислоты, (нет) чего? кислот, чему? кислотам, (вижу) что? кислоты, чем? кислотами, о чём? о кислотах 1.… … Толковый словарь Дмитриева
КИСЛОТА — КИСЛОТА, кислоты, мн. кислоты, жен. 1. только ед. отвлеч. сущ. к кислый, что нибудь кислое (разг.). Я попробовал, чувствую: кислота какая то. 2. Химическое соединение, обладающее кислым вкусом и окрашивающее синий лакмус в красный цвет (хим.).… … Толковый словарь Ушакова
кислота — КИСЛОТА, ы, мн. оты, от, жен. Химическое соединение, содержащее водород, дающее при реакции с основаниями (в 8 знач.) соли и окрашивающее лакмусовую бумагу в красный цвет. Азотная, уксусная к. | прил. кислотный, ая, ое. К. краситель. К. дождь (с… … Толковый словарь Ожегова
КИСЛОТА 1 — КИСЛОТА 1, Шы, мн. оты, от, ж. Химическое соединение, содержащее водород, дающее при реакции с основаниями (в 8 знач.) соли и окрашивающее лакмусовую бумагу в красный цвет. Азотная, уксусная к. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова … Толковый словарь Ожегова
КИСЛОТА 2 — см. кислый 1. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
кислота — КИСЛОТА, ы, ж Химическое соединение, обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. Кислота окрашивает лакмусовую бумагу в красный цвет … Толковый словарь русских существительных
КИСЛОТА — КИСЛОТА, химическое соединение, содержащее водород, который может быть замещен металлом или другим положительным ионом с образованием соли. Кислоты растворяются в воде с получением ионов водорода (Н+), то есть действуют как источник протонов;… … Научно-технический энциклопедический словарь
кислота́ — кислота, ы; мн. кислоты, кислот … Русское словесное ударение
Кислота — ж. 1. Химическое соединение, содержащее водород, способный замещаться металлом при образовании соли. 2. То, что своими свойствами цветом, запахом, едкостью и т.п. напоминает такое химическое соединение. Толковый словарь Ефремовой. Т. Ф. Ефремова … Современный толковый словарь русского языка Ефремовой